USP<787>: Tailored Guidance for Better Biologics

Understanding US<787> and its Impact on Pharmaceutical Quality with Tailored Guidance for Biologics
In the world of pharmaceuticals, quality is paramount. Ensuring the safety and efficacy of medications is not only a regulatory requirement but also a moral obligation to patients. To achieve this, regulatory bodies like the United States Pharmacopeia (USP) lay down guidelines and standards that pharmaceutical companies must adhere to. Two such standards, USP<787> and USP<788>, play a crucial role in maintaining the quality of pharmaceutical products, particularly in relation to particulate matter. Let’s delve into what these standards entail and how they compare.
What is USP<787>?
USP<787>, titled “Subvisible Particulate Matter in Therapeutic Protein Injections,” provides guidelines for assessing the presence of subvisible particulate matter in protein-based pharmaceutical products. These particulates, though not visible to the naked eye, can potentially impact product safety and efficacy. USP<787> outlines specific testing methods and acceptance criteria for detecting and quantifying these particulates, helping manufacturers ensure the quality of their protein injections.
Key Components of USP<787>:
- Testing Methods: USP<787> details various analytical techniques for detecting subvisible particulate matter, including light obscuration, microscopy, and flow imaging analysis. Each method has its advantages and limitations, allowing manufacturers to choose the most suitable approach based on their product characteristics.
- Critères d'acceptation :La norme définit des critères d'acceptation pour les particules en fonction de leur taille et de leur nature. Ces critères sont essentiels pour déterminer si un produit répond aux normes de qualité ou s'il nécessite une enquête plus approfondie et éventuellement des mesures correctives.
- Risk Assessment: USP<787> emphasizes the importance of risk assessment in evaluating the impact of particulate matter on product safety and efficacy. Manufacturers are encouraged to conduct thorough risk assessments to identify potential risks associated with particulate contamination and implement appropriate mitigation strategies.
Comparison with USP<788>:
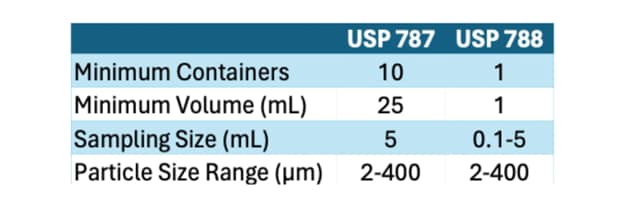
While USP<787> focuses specifically on protein-based pharmaceuticals, USP<788> addresses particulate matter in injections as a whole, encompassing both protein and non-protein formulations. The key differences between the two standards lie in their scope and application:
- Scope: USP<788> is broader in scope, covering all injectable products, including both small-molecule drugs and biologics, whereas USP<787> specifically targets therapeutic protein injections.
- Testing Methods: While both standards prescribe similar testing methods for particulate matter analysis, USP<787> may have additional considerations specific to protein formulations, such as protein aggregation and particle morphology.
- Acceptance Criteria: The acceptance criteria outlined in USP<788> are generally applicable to all injectable products, whereas USP<787> may have more tailored criteria considering the unique characteristics of protein-based formulations.
An important emphasis of USP<787> is that it acknowledges the limitations of light obscuration for protein-based particles and encourages additional methods like microscopy and image analysis for comprehensive characterization.
L'importance de la conformité
Adherence to standards like USP<787> and USP<788> is not just about regulatory compliance; it’s about ensuring patient safety and maintaining the reputation of pharmaceutical products. By following these guidelines, manufacturers can mitigate the risks associated with particulate contamination and uphold the quality of their products throughout the manufacturing process.
USP<787> plays a vital role in ensuring the quality and safety of therapeutic protein injections by providing comprehensive guidelines for detecting and assessing subvisible particulate matter. While similar in essence, USP<788> covers a broader spectrum of injectable products, highlighting the importance of understanding the specific requirements applicable to each product type. Ultimately, compliance with these standards is indispensable for pharmaceutical manufacturers committed to delivering safe and effective medications to patients worldwide.
How to Perform USP<787>
In the realm of pharmaceutical quality assurance, the ability to accurately detect and characterize subvisible particulate matter is paramount. One of the primary methods prescribed by USP<787> for this purpose is light microscopy. Let’s explore how light microscopy serves as a vital tool in the analysis of therapeutic protein injections and why its utilization is crucial for pharmaceutical manufacturers.
Principaux avantages de la microscopie optique
- Caractérisation des particules :La microscopie optique fournit des informations précieuses sur les caractéristiques des particules, telles que leur taille, leur forme et leur morphologie. Ces informations sont essentielles pour évaluer l'impact potentiel des particules sur la sécurité et l'efficacité des produits.
- Haute résolution: les microscopes optiques modernes offrent des capacités d'imagerie haute résolution, permettant un examen détaillé des particules individuelles. Ce niveau de détail est essentiel pour distinguer les différents types de particules et déterminer leur origine.
- Analyse en temps réel :contrairement à certaines autres techniques d'analyse, la microscopie optique facilite l'observation en temps réel des particules, ce qui permet une prise de décision immédiate pendant le processus d'analyse. Cette boucle de rétroaction rapide est inestimable pour garantir une détection efficace et précise des contaminants particulaires.
Défis et considérations
Bien que la microscopie optique soit un outil puissant pour l'analyse des particules, elle présente certaines limites et difficultés qui doivent être prises en compte :
- Préparation des échantillons :Une préparation adéquate des échantillons est essentielle pour obtenir des résultats fiables en microscopie optique. Il convient de veiller à ce que les échantillons soient correctement dispersés et montés afin de faciliter l'obtention d'images nettes.
- Compétences de l'opérateur : L'interprétationdes images microscopiques nécessite un certain niveau d'expertise et d'expérience. Il est nécessaire de faire appel à des opérateurs formés pour identifier et caractériser avec précision les particules, afin de minimiser le risque d'interprétation erronée.
- Étalonnage des instruments :Un étalonnage et un entretien réguliers des équipements de microscopie sont nécessaires pour garantir des mesures précises et des performances fiables dans le temps.
Microscopie optique automatisée moderne avec les systèmes Aura
Avec Aura PTx Système, tous ces défis et considérations sont résolus. Systèmes Aura are based on membrane/filter microscopy and are USP<787> compliant. Utilizing high-contrast imaging techniques, Background Membrane Imaging (BMI) and Fluorescence Membrane Imaging (FMM), drug manufacturers can detect, count, and size particulate matter with high confidence and reproducibility:
- Débit élevé :réduisez les risques liés à la préparation des échantillons en testant plusieurs échantillons. Les systèmes Aura prennent 1 minute par test.
- Entièrement automatisé avec prise en charge CFR Software: Éliminez les erreurs et les biais liés à l'opérateur. Les systèmes Aura sont entièrement automatisés et capturent les données sans nécessiter l'expertise d'un opérateur. De plus, le logiciel Particle Vue identifie, mesure et compte automatiquement les particules présentes dans un échantillon.
- Instrumentation robuste et fiable :les systèmes Aura sont des instruments fiables qui nécessitent peu d'entretien. Pour ceux qui ont besoin d'une assistance et d'un service plus importants, Waters propose divers programmes de service/maintenance et de qualification d'installation/qualification opérationnelle (IQ/OQ).
The Role of Light Microscopy in USP<787> Compliance
In accordance with USP<787> guidelines, pharmaceutical manufacturers rely on light microscopy as a key tool for assessing the presence of subvisible particulate matter in therapeutic protein injections. By leveraging the capabilities of light microscopy, manufacturers can effectively identify and quantify particulate contaminants, garantissant ainsi le respect des normes réglementaires et le maintien de la qualité de leurs produits.
In conclusion, light microscopy and Aura PTx Systems play a pivotal role in USP<787> analysis, offering pharmaceutical manufacturers a reliable means of detecting and characterizing subvisible particulate matter in therapeutic protein injections. Despite its challenges, the benefits of using light microscopy for particulate analysis far outweigh the drawbacks, making it an indispensable tool in the quest for pharmaceutical quality assurance.
Sujets populaires
ACQUITY QDa (17) bioanalyse (12) produits biologiques (17) biopharmacie (49) biopharmaceutique (58) biothérapeutiques (21) étude de cas (18) chromatographie (14) conformité (12) intégrité des données (23) analyse alimentaire (12) HPLC (15) LC-MS (26) chromatographie liquide (LC) (24) détection de masse (16) spectrométrie de masse (MS) (58) développement de méthodes (13) analyse des particules (19)