¿Es hora de reevaluar las normas de la Farmacopea de los Estados Unidos? Exploración de la compatibilidad de la administración de medicamentos pediátricos en el sitio Y.
Navegar por el complejo panorama de la atención médica pediátrica, especialmente cuando se trata de administrar medicamentos por vía intravenosa (IV) a niños, plantea una serie de dificultades únicas. La tarea se vuelve aún más abrumadora cuando se trata de pacientes en estado crítico que con frecuencia requieren grandes cantidades de medicamentos IV para mantener la homeostasis.
Para ponerlo en perspectiva, un bebé ingresado en una unidad de cuidados intensivos neonatales puede recibir una media de 8,5 medicamentos intravenosos durante una sola hospitalización, mientras que los niños ingresados en una unidad de cuidados intensivos pediátricos pueden recibir una cantidad impresionante de hasta 49 medicamentos intravenosos.1
Debido a los retos que plantean los pacientes pediátricos, los medicamentos suelen prepararse y administrarse en concentraciones diferentes a las de los pacientes adultos. Esto se debe en gran medida a que los bebés tienen mayores necesidades nutricionales. Sin embargo, este proceso no está exento de riesgos. Los medicamentos intravenosos incompatibles pueden producir partículas invisibles a simple vista. Estudios recientes han demostrado que los bebés sometidos a terapias intravenosas con múltiples fármacos pueden estar expuestos a hasta 85 000 de estas partículas subvisibles cada día.1
El impacto de estas partículas en pacientes pediátricos puede ser profundo, provocando complicaciones graves como disfunción pulmonar, paro cardiovascular y fallo multiorgánico. Además, estas partículas pueden afectar negativamente a las respuestas inmunitarias, lo que añade otro nivel de riesgo. El peligro de administrar involuntariamente estas partículas aumenta cuando se administran conjuntamente medicamentos que no han sido probados para determinar su compatibilidad física.1
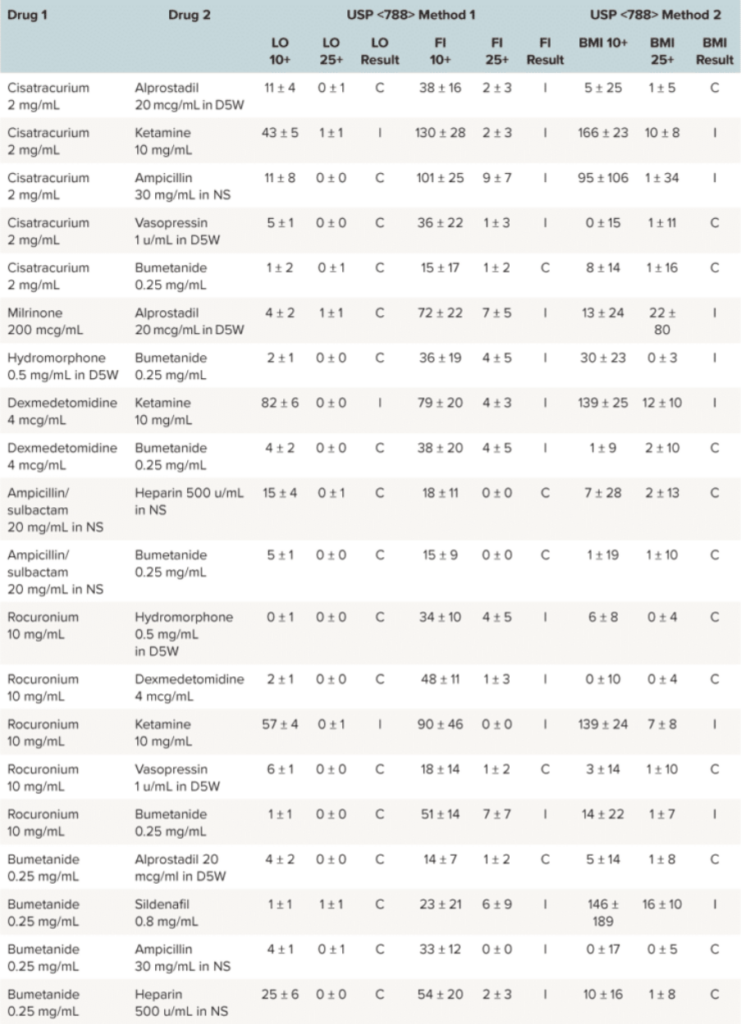
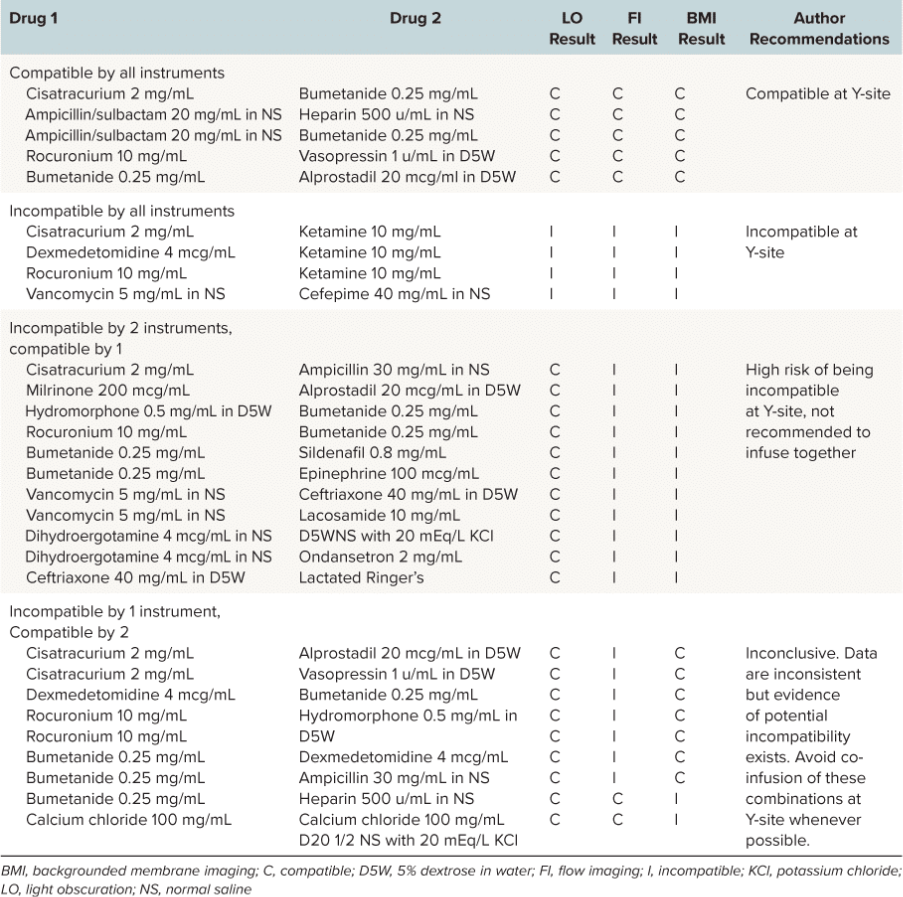
Por este motivo, los investigadores se propusieron evaluar la compatibilidad física intravenosa en el sitio Y de 29 combinaciones de medicamentos en concentraciones comúnmente utilizadas en pediatría, utilizando técnicas tanto convencionales como innovadoras.1 En un estudio publicado en Revista de Farmacología y Terapéutica Pediátrica, subvisible particle analysis se realizó utilizando Imágenes de membrana en segundo plano (BMI), una técnica de imagen de alto contraste en el Sistema AuraCon la capacidad de analizar 96 muestras en menos de dos horas, es una herramienta muy valiosa para el desarrollo de fármacos.
Comprensión de las partículas en suspensión en los productos inyectables
Los pacientes pediátricos suelen recibir múltiples medicamentos por vía intravenosa a través de una conexión en Y, debido a las dificultades para garantizar un acceso vascular fiable. Sin embargo, esto puede provocar interacciones entre los medicamentos y la posible formación de partículas. Esto coloca a los profesionales sanitarios en una situación difícil: arriesgarse a administrar conjuntamente medicamentos sin datos de compatibilidad o hacer frente a los retos asociados a un acceso vascular adicional.1
Dadas las lentas velocidades de infusión utilizadas en pacientes pediátricos, los medicamentos intravenosos pueden interactuar entre sí durante largos periodos de tiempo antes de entrar en el torrente sanguíneo. Incluso con un filtro en línea, puede producirse una mezcla considerable de medicamentos aguas abajo del filtro, lo que podría dar lugar a la formación de partículas si los medicamentos son físicamente incompatibles.1
Los métodos tradicionales para evaluar las partículas en los productos inyectables, tal y como se describen en la Farmacopea de los Estados Unidos (USP), incluyen pruebas de oscurecimiento de la luz (LO) y recuento de partículas al microscopio. Sin embargo, técnicas más recientes, como la imagen de flujo (FI) y el BMI, proporcionan una identificación más precisa de las partículas y una mejor caracterización de su morfología.1
Análisis de partículas subvisibles mediante BMI
Particles in high quantities or those with large diameters have the potential to be more devastating in small infants and children compared with adults, due to smaller pulmonary capillary size and relatively large fluid intake relative to their body weight. Because of the administration challenges specific to pediatric patients and the clinical risk associated with particle infusions, FI and BMI instrumental methodologies were used to assess USP <788> methods 1 and 2, despite a lack of precedent for either method in USP <788> guidelines. In this evaluation, these two methods demonstrated much higher accuracy for identifying particulates in solution when compared with LO.1
Applying USP <788> methods clinically to pediatric pharmacy practice brings to light clinical and analytical controversies. Are current LO and microscopy methods the most appropriate to use to test the compatibility of medication combinations? Additionally, are the current USP <788> particle count thresholds still applicable given the increased particle detection rates of instrumental methods now available? The USP chapter offers no explanation as to where the existing particle count thresholds originated, why method 1 has particle count limits that are essentially double that of method 2, or why large-volume parenterals are held to a different standard when compared with small-volume parenterals.1
No obstante, el equipo de investigadores consideró que los resultados de incompatibilidad obtenidos con cualquier método utilizado deberían impedir el uso clínico de una combinación de medicamentos en todos los pacientes, y en particular en recién nacidos y lactantes pequeños.1
Conclusión
El estudio reveló que las técnicas más novedosas, como el BMI, eran más precisas a la hora de identificar partículas, lo que plantea dudas sobre la aplicabilidad de las directrices actuales de la USP a la práctica farmacéutica pediátrica. Si bien estos hallazgos suponen un avance en la mejora de los resultados clínicos y la reducción de los requisitos de acceso intravenoso para los pacientes pediátricos, aún es necesario realizar más pruebas de compatibilidad química.1
Referencias
1. Ross, Emma L., et al. «Compatibilidad física de la administración pediátrica de medicamentos en el sitio Y: ¿una llamada a cuestionar las normas de la Farmacopea de los Estados Unidos?». The Journal of Pediatric Pharmacology and Therapeutics, vol. 28, n.º 1, 2023, pp. 84-92,https://doi.org/10.5863/1551-6776-28.1.84.
Temas populares
ACQUITY QDa (17) bioanálisis (12) productos biológicos (17) biofarmacéutica (49) biofarmacéutica (58) bioterapéuticos (21) estudio de caso (18) cromatografía (14) cumplimiento normativo (12) integridad de los datos (23) análisis de alimentos (12) HPLC (15) LC-MS (26) cromatografía líquida (LC) (24) detección de masas (16) espectrometría de masas (MS) (58) desarrollo de métodos (13) análisis de partículas (19)