ペットフードおよび植物性タンパク質中におけるアミノ酸分析用の新しいグラジエント溶出プログラムの開発
要約
AOAC 国際公定分析法 2018.06 では、乳児用調製乳、成人用栄養食品、乳製品中のアミノ酸の分析手順が指定されています。この手順は、6-アミノキノリル-N-ヒドロキシスクシンイミジルカルバメート(AQC)を使用したプレカラム誘導体化、および UV 検出機能を備えた逆相超高速液体クロマトグラフィー(UPLC™)に基づいています。ヒドロキシプロリンは通常、ミルク、成人用栄養食品、乳製品には含まれていないため、AOAC 分析法 2018.06 の対象外です。一方、ヒドロキシプロリンは、動物のタンパク質の中で最も存在量の多いタンパク質であるコラーゲンの必須構成成分であり、ペットフードによく含まれています。さらに、ヒドロキシプロリンは、植物性タンパク質の汚染や混入のマーカーとして頻繁に分析されています。そこで、AOAC 分析法 2018.06 をペットフードおよび植物性タンパク質に適用するため、AOAC 分析法で指定されたグラジエント溶出プログラムを改変・最適化して、ヒドロキシプロリンやその他のアミノ酸の保持と分離を改善しました。この分析法開発では、分析法のクオリティ・バイ・デザイン(aQbD)アプローチを使用し、ピークのアイデンティティー確認にアミノ酸の質量スペクトルも使用しました。最適化されたグラジエント溶出条件下ですべてのアミノ酸がベースライン分離され(分離度 2 以上)、併行精度と頑健性に優れていました。感度および直線性は、AOAC 分析法 2018.06 と同等でした。この新しいグラジエント溶出プログラムは、6 種類の一般的なペットフードと 4 種類の植物性タンパク質に正常に適用され、優れた結果が得られました。この改変 AOAC 分析法は、ペットフードと植物性タンパク質のアミノ酸分析に適用可能なソリューションになっています。
アプリケーションのメリット
- 最適化されたグラジエント溶出により、関連するアミノ酸のベースライン分離が得られ、AOAC 分析法をペットフードや植物性タンパク質に適応可能に
- ACQUITY™ Premier システムおよび AccQ Tag™ Ultra C18 カラムにより、ペットフードや植物性タンパク質中のアミノ酸の分析において優れた分離度を実現
はじめに
アミノ酸(AA)は、人および動物の生長と健康に必須の栄養素です。以前、バイナリーソルベントマネージャーと固定ループサンプルマネージャーを搭載した ACQUITY Premier システムを使用して、乳製品中の AA 分析における AOAC 分析法 2018.06 の実施について実証しました1。 しかし、この AOAC 分析法をペットフード中の AA の分析に適用すると、ターゲット AA のリストにギャップの存在が特定されました。ペットフード中の一般的な AA であるヒドロキシプロリン(HyPro)は、カラムであまりよく保持されないため、AOAC 分析法を使用した分析ができませんでした。HyPro は、靱帯、腱、軟骨、皮膚、骨などの組織中に最も豊富に存在するタンパク質であるコラーゲンの必須構成成分であり、ペットフードなどの動物由来飼料に含まれる一般的な AA です。HyPro は、タンパク質含量を高めることを目的として、加水分解した動物性食品を使用した食品混入のマーカーとしてしばしば分析されます。また、HyPro は動物由来のゼラチンおよびコラーゲンの指標的な AA であることから、ハラル食品やコーシャー食品の判断において重要な食品成分の存在を検出するために使用されています2,3。そのため、HyPro を他の AA とともに分離・分析できる分析法の開発が必要になります。
この試験では、AOAC 分析法 2018.06 のグラジエント溶出プログラムを改変して、他の AA とともに HyPro を分析できるように、新しいグラジエント溶出プログラムを開発しました。分析法開発の詳細と、開発した分析法の分析性能について説明します。開発したグラジエント溶出条件を使用して、代表的なペットフードと植物性タンパク質を分析し、その結果を考察しています。
実験方法
この試験では、AOAC 分析法 2018.06 で指定された分析手順に従いました。ただし、グラジエント溶出プログラムは変更しました。主な加水分解と誘導体化の手順を以下に簡単に記載します。
AA キャリブレーションスタンダード
AA 細胞培養標準試料キット(製品番号:186009300)には、調製済みストック溶液中に、以下のアミノ酸がそれぞれ 0.5 mM(0.25 mM のシスチン以外)含まれています:アラニン(Ala)、アルギニン(Arg)、アスパラギン酸(Asp)、シスチン(Cys)、グルタミン酸(Glu)、グリシン(Gly)、ヒスチジン(His)、イソロイシン(Ile)、ロイシン(Leu)、リシン(Lys)、メチオニン(Met)、フェニルアラニン(Phe)、プロリン(Pro)、セリン(Ser)、スレオニン(Thr)、チロシン(Tyr)、バリン(Val)、HyPro、タウリン(Tau)、アスパラギン(Asn)、グルタミン(Gln)、オルニチン(Orn)、ヒドロキシリジン(HyLys)、α-アミノ酪酸(AABA)、γ-アミノ酪酸(GABA)、トリプトファン(Trp)。0.05 mM AA 溶液は、0.5 mM AA ストック溶液を 0.1 M HCl で希釈して調製しました。ノルバリン(Nva)を内部標準試料(IS)として使用しました。10 mM Nva ストック溶液は、117.16 mg の Nva を 100 mL メスフラスコに量り取り、0.1 M HCl で標線まで希釈することによって調製しました。2.5 mM Nva 溶液は、10 mM Nva ストック溶液を 0.1 M HCl で希釈して調製しました。最終溶液(誘導体化後)0 ~ 19.2 µM(pmol/µL)の AA キャリブレーションスタンダードおよび 7.7 µM のノルバリン(Nva)は、表 1 に従って調製しました。
注:誘導体化試薬の容量比が変更されているため、これらの最終濃度は、AOAC 分析法 2018.06 とは異なります。
Cys は、この溶液中に含まれていましたが、キャリブレーションには使用しませんでした。Cys の検量線は、別途調製した Cys 標準溶液を用いて作成しました(後述)。Asn、Gln、AABA、GABA、Trp などのその他の AA を、主に分離度や干渉の確認に使用しました。
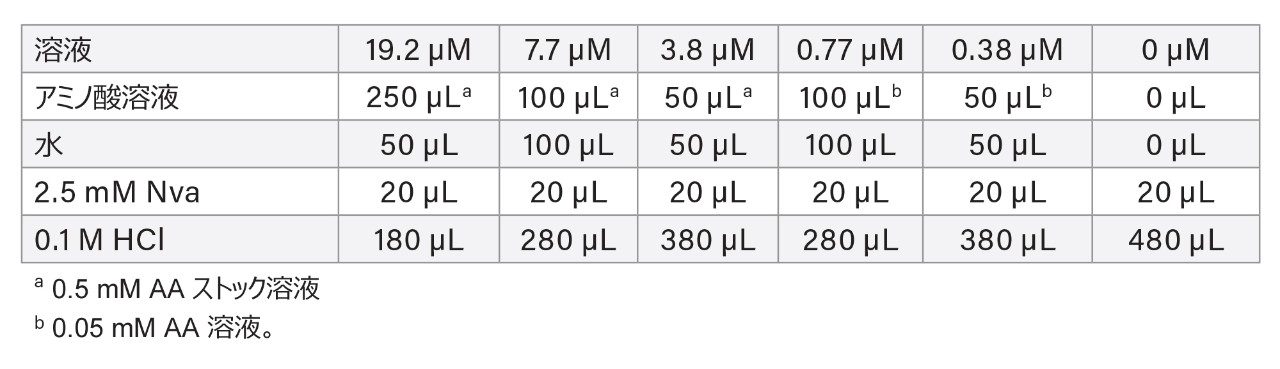
Cys のキャリブレーションスタンダード
Cys のストック溶液(10 mM)は、240 mg Cys(0.01 mg 単位で記録)を 100 mL のメスフラスコに量り取り、0.05 M NaOH で標線まで希釈することによって調製しました。Cys 溶液(1 mM)は、この Cys のストック溶液を 0.05 M NaOH で希釈することにより調製しました。10 mM Cys のストック溶液を最長 3 か月間 -20 ℃ で保存しました。1 mM Cys 溶液は、各分析ごとに新しく調製しました。
Cys のキャリブレーションスタンダードは、0、10、20、50、100、200 µL の 10 mM Cys ストック溶液を 10 mL バイアルに添加して調製し、水で 1100 µL にしてから、各バイアルに 600 µL の DDP(3,3'-ジチオジプロピオン酸)溶液(0.2 M NaOH 中 1% DDP)、600 µL の 0.2 M HCl、200 µL の 10 mM Nva ストック溶液、2500 µL のフェノール-HCl 溶液(12 M HCl 中 0.1% フェノール)を添加しました。
注:フェノール-HCl 溶液の添加作業は、必ず換気フード下で行ってください。
バイアルを窒素流で最低 5 秒間スパージして、酸素を置換しました。バイアルをスクリューキャップで閉じ、ボルテックスミキサーで混合しました。これらの Cys のキャリブレーションスタンダードを、後述の条件で加水分解しました。これらの標準溶液の誘導体化後の最終濃度はそれぞれ 0、0.38、0.77、1.9、3.8、7.7 µM でした。最終的な Nva(IS)の濃度は 3.8 µM でした。
注:シスチンおよびシステインは、DDP による酸加水分解で S-2-カルボキシエチルチオシステイン(XCys)に変換されています4。シスチンとシステインの合計量は、XCys の含有量から算出しました。
サンプル前処理
主要ブランドの 6 種類のペットフード製品と 4 種類の植物性タンパク質粉末製品をオンラインで購入しました。ペットフードには、乾いたドッグフード、湿ったドッグフード、乾いたキャットフード、乾いたネコ用おやつ、湿ったキャットフード、ニワトリの飼料が含まれていました。植物性タンパク質粉末製品には、エンドウタンパク質、玄米タンパク質、カボチャの種タンパク質、大豆タンパク質の粉末製品が含まれていました。ペットフードはまず、サンプル 5.0 g を水と混ぜて 80 g の混合物にし(重量を 0.01 g 単位で記録)、ブレンダーを用いて十分に均質化して調製しました。植物性タンパク質粉末はまず、粉末 1.0 g を水と混ぜて 40 g の混合物(重量を 0.01 g 単位で記録)にして調製しました。次に、均質化したサンプル-水混合物(ペットフードまたは植物性タンパク質)800 ±20 mg(重量を 0.01 g 単位で記録)を、スクリューキャップ付きの 10 mL ガラス容器に量り取りました。各容器に、600 µL の DDP 溶液(0.2 M NaOH 中 1% DDP)、600 µL の 0.2 M HCl、500 µL の 10 mM Nva ストック溶液、2500 µL のフェノール-HCl 溶液(12 M HCl 中 0.1% フェノール)を加えました。最終溶液(誘導体化後)の Nva(IS)の最終濃度は 7.7 µM でした。
酸加水分解(サンプルおよび Cys 標準試料のみ、AA 標準試料はなし)
サンプル溶液または Cys のキャリブレーション溶液が入っている容器を、110 ± 2 ℃ のオーブンに 24 ± 0.5 時間放置しました。
あるいは、マイクロ波加水分解装置(Discover Prep、CEM Corp、ノースカロライナ州)を使用してサンプルを加水分解しました。35 mL ホウケイ酸ガラス圧力容器(定格圧力最大 300 psi)(CEM 製品番号:909036)を、シリコンキャップ(CEM 製品番号:909350)とともに使用しました。Teflon コーティングしたマイクロ撹拌棒(CEM 製品番号:162810)を使用して混合しました。酸加水分解のステップは、最大出力設定 300 W のダイナミックコントロール、温度設定 160 ℃ で 20 分間、圧力限界の設定 300 psi、撹拌レベル設定「高」で、冷却中に窒素ガスを吹き付けて行いました。このマイクロ波補助加水分解は、AOAC 分析法 2018.06 には含まれていませんでしたが、これを代替の加水分解法として使用しました。
中和および希釈(サンプルおよび Cys 標準試料)
酸加水分解後、加水分解物を冷却しました。次に、0.2 mL の各加水分解物を 1.5 mL マイクロチューブに移し、続いて 0.2 mL の 6 M NaOH と 1.6 mL の 0.1 M HCl を添加しました。この混合物を、十分に混合してから、0.45 μm PVDF メンブレンフィルターでろ過して別の 1.5 mL マイクロチューブに入れました。
誘導体化(サンプル、Cys 標準試料、AA 標準試料)
AccQ Tag Ultra 誘導体化試薬は、AOAC 分析法 2018.06 の誘導体化手順または AccQ Tag Ultra 誘導体化キット(製品番号:186003836)の取扱説明書に従って調製しました5。次に、AA キャリブレーションスタンダード、中和したサンプル溶液、中和した Cys 標準試料を、100 µL の AccQ Tag Ultra ホウ酸バッファー(AccQ Tag Ultra 誘導体化キットの試薬 1)、10 µL のキャリブレーションスタンダード溶液、または中和したサンプル溶液、または中和した Cys 標準溶液、および 20 µL の再溶解した AccQ Tag Ultra 試薬を用いて誘導体化しました。
液体クロマトグラフィーの条件
|
システム: |
ACQUITY Premier システムは、バイナリーソルベントマネージャー、固定ループサンプルマネージャー、アクティブプレヒーター付きカラムヒーター(CH-A)、フォトダイオードアレイ(PDA)eλ 検出器で構成されていました。 |
|
UV/Vis の波長: |
260 nm |
|
検出器へのインレットチューブ: |
内径 0.004 mm、10.5 インチのチューブアセンブリー(製品番号:430001784) |
|
ソフトウェア: |
Empower™ 3 クロマトグラフィーデータシステム(CDS) |
|
カラム: |
ACQUITY UPLC BEH™ C18 カラム、1.7 µm、2.1 mm × 150 mm(製品番号:186002353)または AccQ∙Tag Ultra C18 カラム、1.7 µm、2.1 mm × 150 mm(製品番号:186009954) (注:AccQ Tag Ultra C18 カラムは、AA 分析用に特別にチェックされた ACQUITY UPLC BEH C18 カラム QC です)。 |
|
カラムインラインフィルター: |
ACQUITY カラムインラインフィルター 0.2 µm(製品番号:205000343) |
|
サンプリングレート: |
10 Hz |
|
カラム温度: |
50 ℃ |
|
サンプル温度: |
20 ℃ |
|
サンプルループサイズ: |
1 µL |
|
注入量: |
1 µL |
|
注入モード: |
6 倍オーバーフィルボリュームのニードルオーバーフィル付きパーシャルループ(PLNO) |
|
移動相 A: |
AccQ∙Tag Ultra 溶離液 A 濃縮液(製品番号:186003838)と水の 1:19(v/v)混合液 (注:50 mL のクラス A メスフラスコを使用して 50 mL の AccQ∙Tag Ultra 溶離液 A 濃縮液を移し、950 mL の水と混合します)。 |
|
移動相 B: |
AccQ Tag 溶離液 B(製品番号:186003839) |
|
弱ニードル洗浄溶媒: |
95:5(v/v)水:アセトニトリル |
|
強ニードル洗浄溶媒: |
5:95(v/v)水:アセトニトリル |
|
シール洗浄溶媒: |
50:50(v/v)水:アセトニトリル |
|
流量: |
0.4 mL/分 |
|
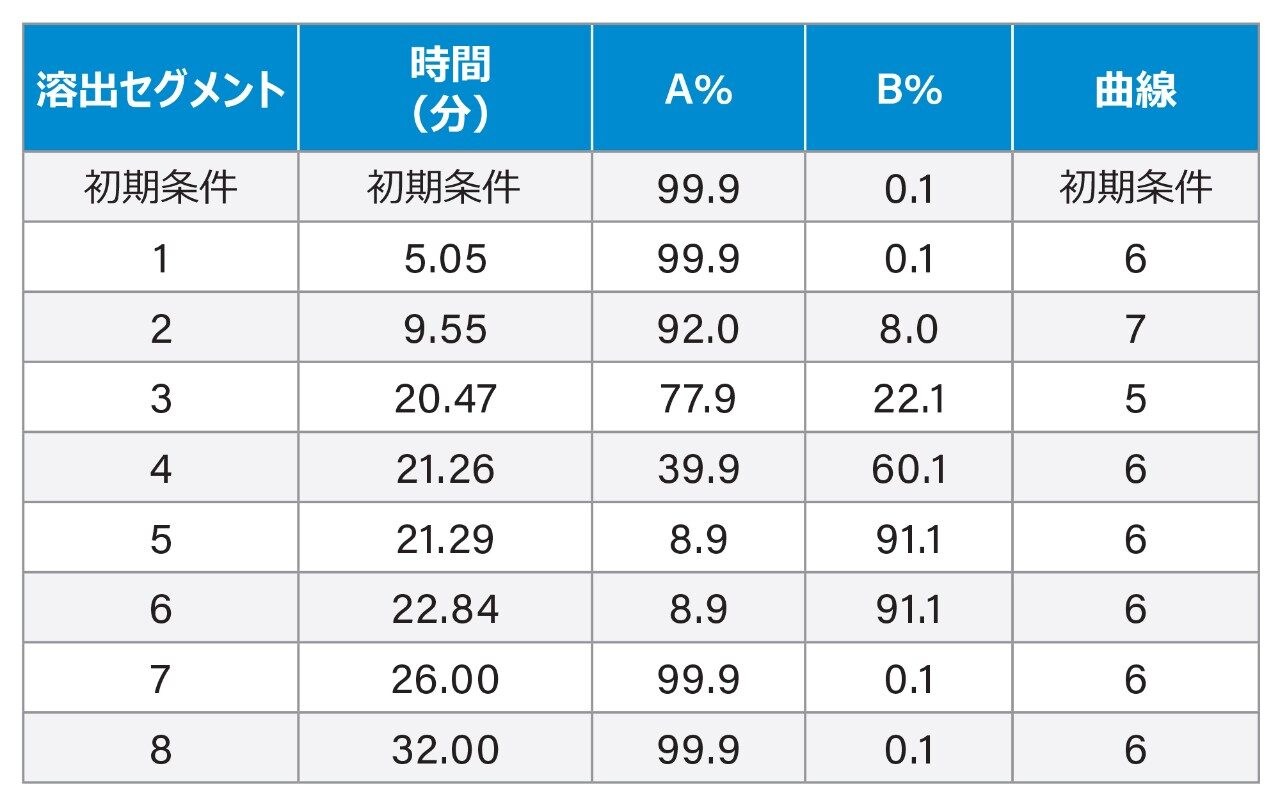
グラジエント溶出: |
(以下のグラジエントテーブルを参照) |
グラジエントテーブル
質量分析条件
|
MS システム: |
ACQUITY QDa™ 質量検出器(パフォーマンス) |
|
キャピラリー電圧: |
0.8 kV |
|
イオン極性: |
ポジティブ |
|
プローブ温度: |
600 ℃ |
|
サンプリングレート: |
10 ポイント/秒 |
|
ゲイン: |
1 |
|
MS スキャン: |
100 Da ~ 600 Da(コンティナム形式) |
|
コーン電圧: |
10 V |
キャリブレーション
AA の検量線は、各 AA キャリブレーションスタンダードの AA 濃度(単位 µM)に対してレスポンスをプロットすることにより作成しました。レスポンスは、ピーク面積の比(AA 分析種対 IS)に IS 濃度(通常は 7.7 µM)を乗算して算出しました。検量線(1 次多項式)は、プロットの検量線データポイントの直線回帰(原点を強制的に通過させる)によって取得しました。
定量限界
定量限界(LOQ)は、レスポンスの標準偏差と検量線の傾きに基づいて推定しました。LOQ は、0.39 µM(n=4、異なるカラム)における AA のレスポンスの標準偏差の 10 倍を、個々の AA の検量線の傾きで除算して算出しました。
AA プロファイルの計算
分析において測定された個々の AA 濃度(マイクロモル濃度(µM)で表す)にそれらの分子量を乗算して質量濃度(1 リットルあたりのマイクログラム数)に変換しました。これらの個々の質量濃度を合計して総 AA 質量濃度とし、個々の AA の相対濃度を、総 AA 濃度に対する質量の割合として算出しました。Trp はこの方法では測定されなかったため、その含量は計算上 AA の総含量に含めませんでした。
実験計画法を用いた分析法開発
グラジエント溶出のパラメーターを、実験計画法(DoE)ソフトウェア(Fusion QbD® ソフトウェア、S-Matrix Corp.、カリフォルニア州ユーレカ)を使用して最適化しました。グラジエント溶出プログラムの主要な変数である、初期アイソクラティックホールド時間(グラジエントテーブルのセグメント 1)および最初のグラジエント時間(グラジエントテーブルのセグメント 2)を検討して AA 分離に最適な条件を見つけました。この実験の目標は、3 つのクリティカルペア(クロマトグラムで早く溶出する領域の Ser/Arg、中間領域の Asp/MetSO2(メチオニンスルホン)、遅く溶出する領域の XCys/Met)の分離度を最大化することとしました。中心複合計画に基づく実験(またはサンプルキュー)を Fusion QbD ソフトウェアによって作成し、Empower CDS にエクスポートしました。サンプルキューの終了に続いて、クロマトグラフィーデータが Empower CDS で解析された後、Fusion QbD ソフトウェアによって結果が取り出され、モデリングおよび分析が行われました。許容できる性能範囲(分離度 2.0 以上)に基づいて、許容できる性能範囲内の 3 種類のクロマトグラフィー条件のセットを、関連するすべての AA の保持時間(RT)や分離度などの、一連のより広範な性能評価基準を用いてさらに評価しました。最適なクロマトグラフィー条件が決まった後、分離の頑健性も Fusion QbD ソフトウェアを使用して評価しました。カラム温度、流量、移動相 A の組成など、装置ユニット間、オペレーター間、ラボ間でのばらつきが大きい上位 3 つのクロマトグラフィー条件(または要因)を、完全実施要因計画を使用して、ターゲットのレベルを包含する 2 つのレベルで検討しました。分析法の頑健性を評価するため、これらの変化(ターゲットのレベルからの逸脱)が AA の分離に及ぼす影響を評価しました。
結果および考察
分析法開発
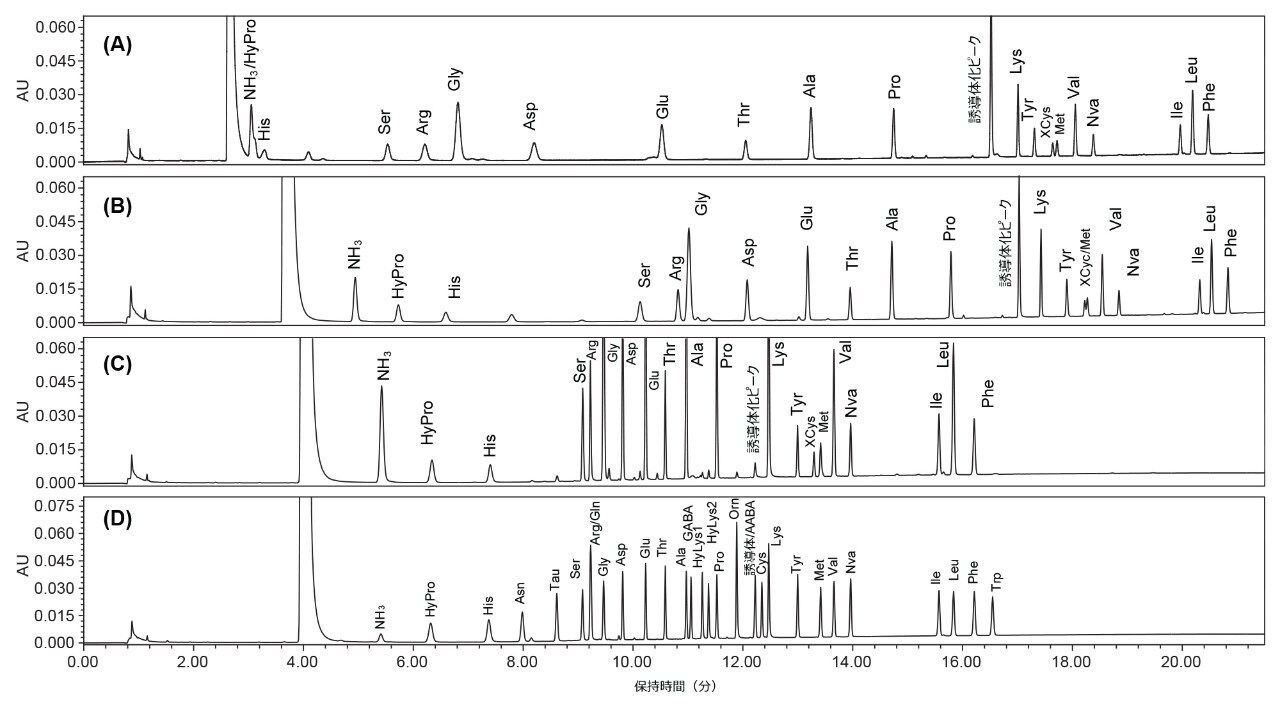
AOAC 分析法 2018.06 で指定されたグラジエント溶出プログラムでは HyPro はアンモニウム(NH3)と共溶出するため、この分析法をペットフードに直接適用することができませんでした(図 1A)。ウォーターズのアミノ酸分析ソリューションにより、タンパク質加水分解物、食品、飼料を分析するための分析法が得られます。この分析法を用いると、HyPro が保持されて NH3 のピークから分離されます6。しかし、ウォーターズの分析法(カラムサイズと流量に関して適応済み)を分析においてテストしたところ、XCys は Met のピークと部分的に共溶出することがわかりました(図 1B)。そのため、Xcys/Met と HyPro/NH3 の分離度を改善するために分析法開発を行いました。溶出セグメント 3 のグラジエント曲線 5(「実験方法」のグラジエントテーブルを参照)は、XCys と Met の分離の改善に有用であることがわかりました。その後、DoE アプローチを使用して、すべての AA について最良の分離が得られるように、グラジエント溶出パラメーターを微調整しました(「実験方法」の DoE の詳細を参照)。図 1C に、最終的に最適化されたグラジエント溶出条件下でのペットフード中の AA のクロマトグラムを示します。XCys と Met のベースライン分離が得られています。図 1D に、最終的に最適化されたグラジエント溶出条件下での AA 標準試料のクロマトグラムを示します。
分析法の特異性
図 1D から、Arg と共溶出した Gln を除いて、すべての AA のベースライン分離(分離度 2.0 以上)が得られていることがわかります。Gln は酸加水分解中に Glu に変換されるため、Gln と Arg の共溶出は懸念されませんでした。GABA および AABA はタンパク質を構成しないアミノ酸です。これらは、食品中のタンパク質含量には寄与せず、分析法の特異性評価試験に含めました。AABA は誘導体化されたピークと共溶出しましたが、どの AA にも干渉しませんでした。GABA は、GABA に最も近い AA である Ala からベースライン分離されました。これらの AA に加えて、システイン酸、MetSO2 も試験したところ(データは示していません)、他の AA からすべてベースライン分離されました。
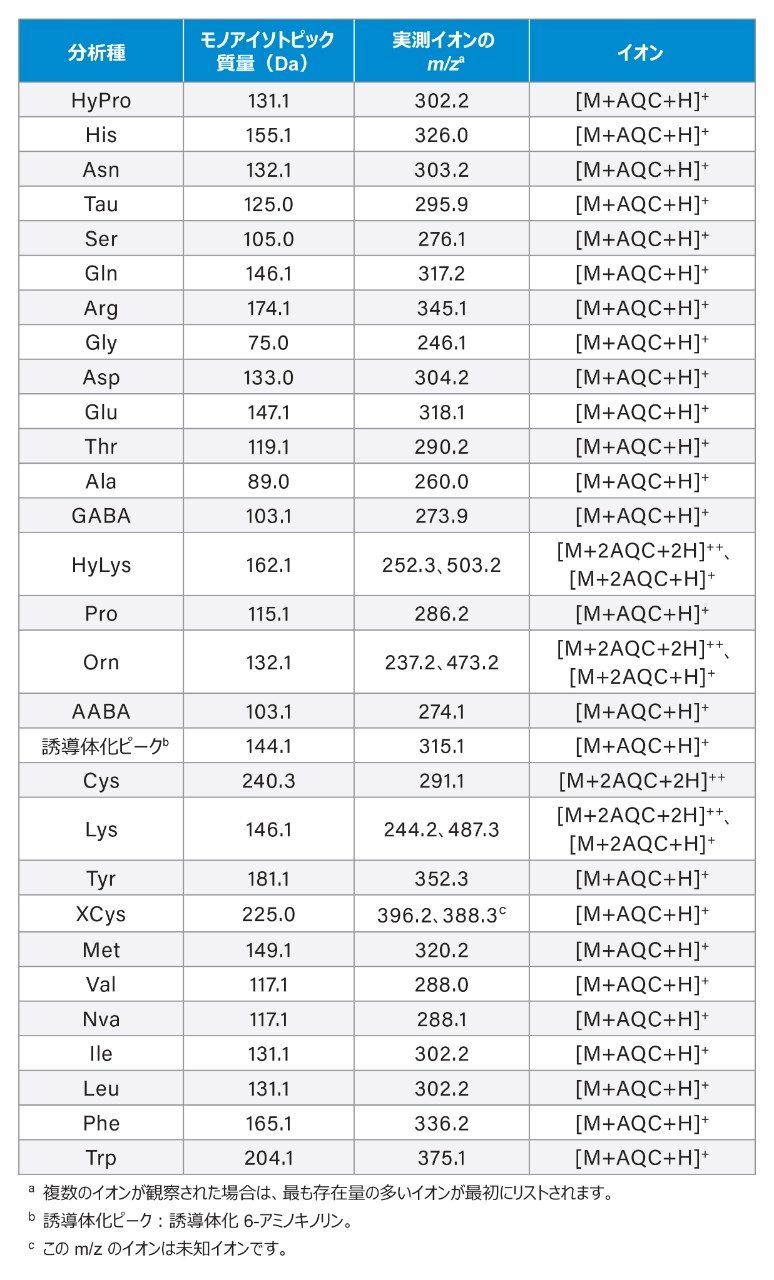
ピークのアイデンティティー
ピークのアイデンティティーは、溶出順序および ACQUITY QDa 質量検出器から取得した確認質量スペクトルに基づいて割り当てています。クロマトグラフィー条件は新たに最適化された分析法と大きく変わらないため、食品・飼料用のウォーターズ UPLC アミノ酸分析ソリューションに記載されている AA の溶出順序を参考にしました6。 正確なピークのアイデンティティーは、最終的に最適なクロマトグラフィー条件で得られた質量スペクトルによって確認しました。表 2 に、AA のモノアイソトピック質量、実測 m/z 比、正荷電イオンを示します。HyLys、Orn、Cys、Lys などの一部の AA は、2 分子の誘導体化試薬(AQC)と反応することがわかりました。これらの誘導体化 AA からは、二価イオンが MS で最も存在量の多いイオンとして形成され、一価イオンはこれより存在量の少ないイオンとなりました。Xcys では、ピーク強度がほぼ等しい 2 種類のイオン(m/z 396.2 と 388.3)が観測されました。m/z 388.3 のイオンの構造は不明のままでした。
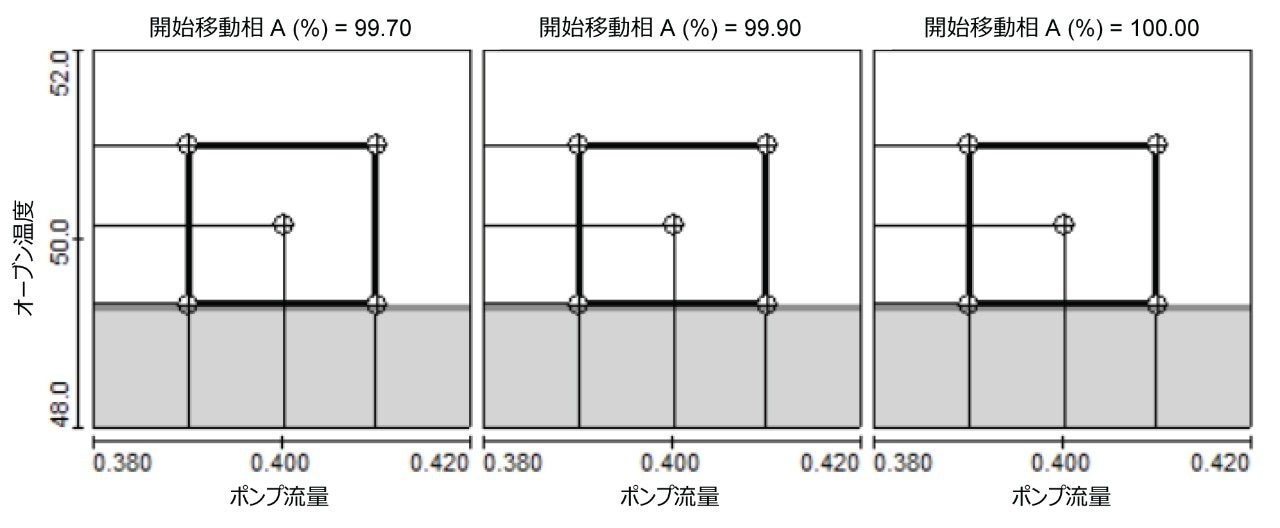
分析法の頑健性
最終条件下での AA の分離の頑健性を、DoE アプローチで評価しました。カラム温度、流量、移動相 A の組成など、装置ユニット間、オペレーター間、ラボ間でのばらつきが大きい 3 つの変数を、完全実施要因計画を使用して、ターゲットのレベルを包含する 2 つのレベルで検討しました。図 2 に、クリティカルペアの分離度が 2.0 超の安全動作領域を示します。安全動作領域は、カラム温度 49.3 ~ 51.0 ℃、流量 0.390 ~ 0.410 mL/分、開始移動相 A 99.7% ~ 100% でした(図 2)。これらの結果により、クロマトグラフィー条件の比較的軽微なばらつきにもかかわらず、分離の信頼性が高いことが実証されました。
分析性能
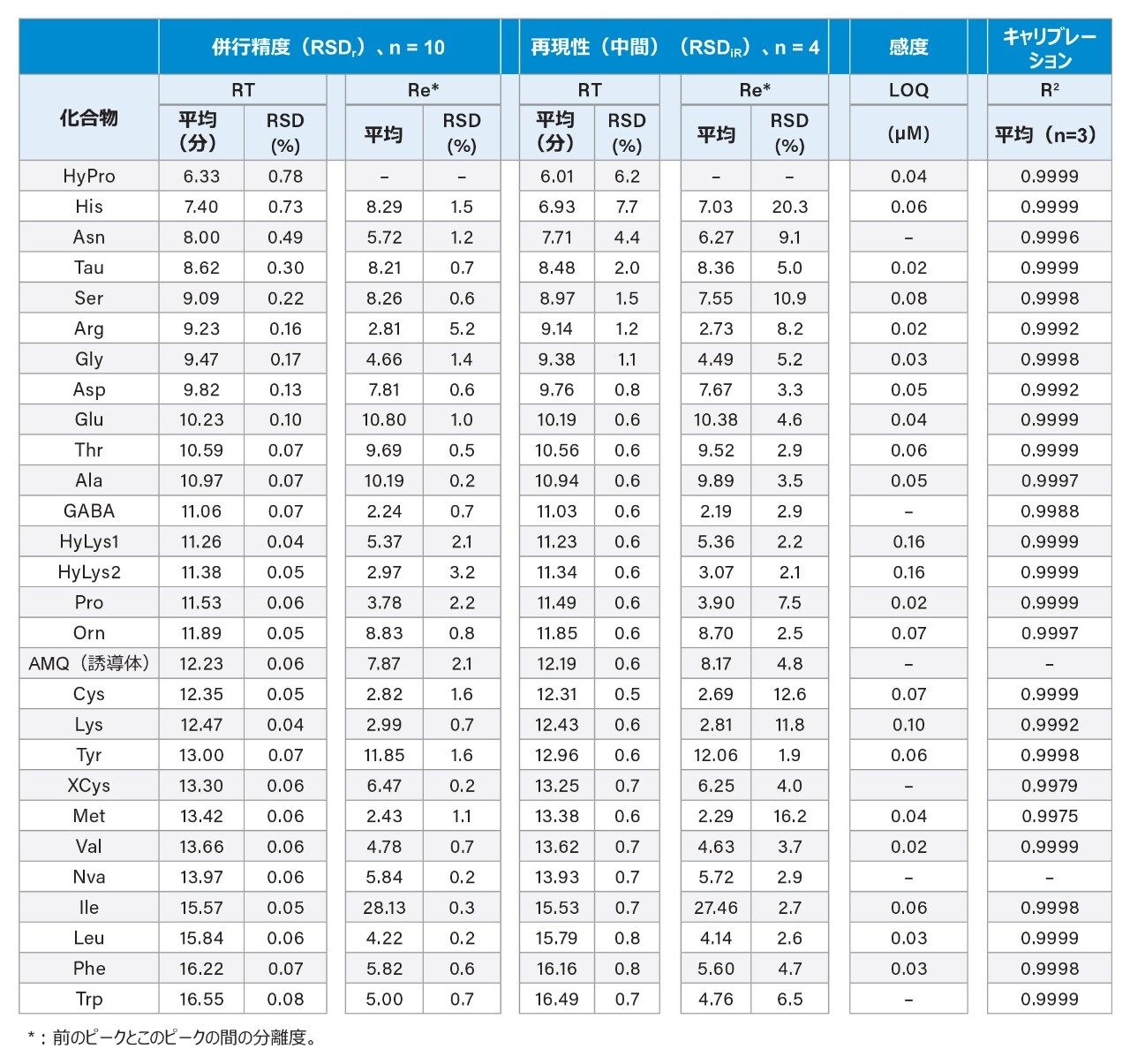
表 3 に、分離の RT および分離度における併行精度(相対標準偏差または RSDr)と中間再現性(RSDiR)を示します。併行精度の結果は、1 日内に 1 本のカラムで標準溶液を複数回注入(n=10)して得た結果で、中間再現性の結果は、数日間にわたって、異なるカラムに標準溶液を複数回注入して得た結果です。ACQUITY UPLC BEH C18 カラムおよび AccQ Tag Ultra C18 カラムの異なる製品バッチのカラムを使用しました。HyPro、His、Asn、Tau、Ser、Arg、Asp などの早く溶出する AA は、遅く溶出する AA よりも RT のばらつきが大きいことが分かりました。早く溶出する AA の RT の RSDr は 0.13% ~ 0.78% で、遅く溶出する AA の RT の RSDr は 0.1% 未満でした。早く溶出する AA の RT の RSDiR(中間再現性)は 0.8% ~ 7.7% で、遅く溶出する AA の RT の中間再現性の値は 0.8% 未満でした。単一のカラムおよび異なるカラムで得られた AA の分離度はそれぞれ 2.24 超(Ala/GABA)および 2.19 超(Ala/GABA)でした。これらの結果により、AA の分離におけるこの分析法の分離度と信頼性が高いことが実証されました。LOQ および決定係数(R2)も表 3 に示しています。LOQ は 0.02 ~ 0.10 µM で、すべての AA の R2 値が 0.9975 以上でした。このような LOQ および直線性の値は、以前の試験で観察された AOAC 分析法 2018.06 の値と同等でした1。
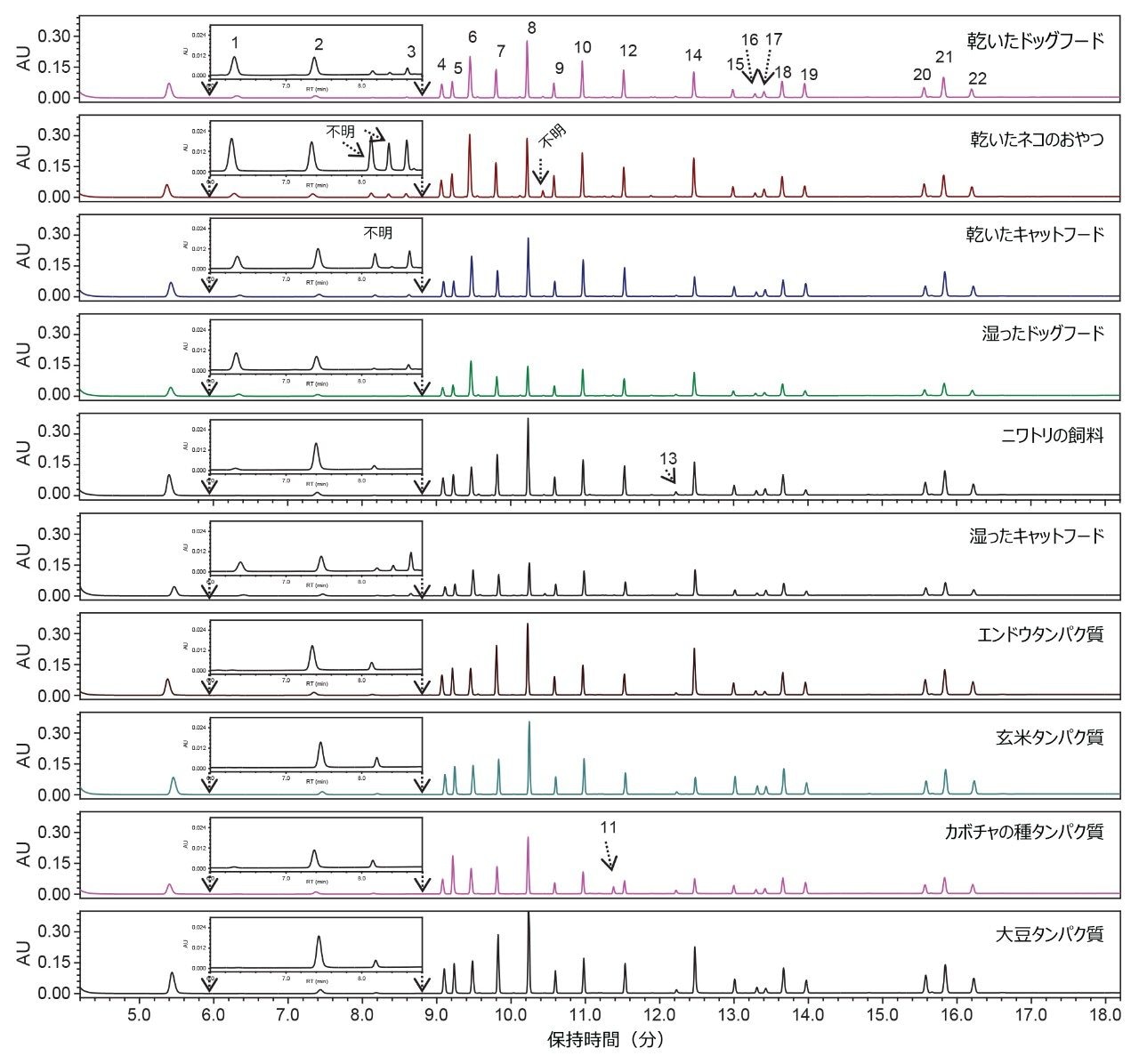
ペットフードおよび植物性タンパク質の分析
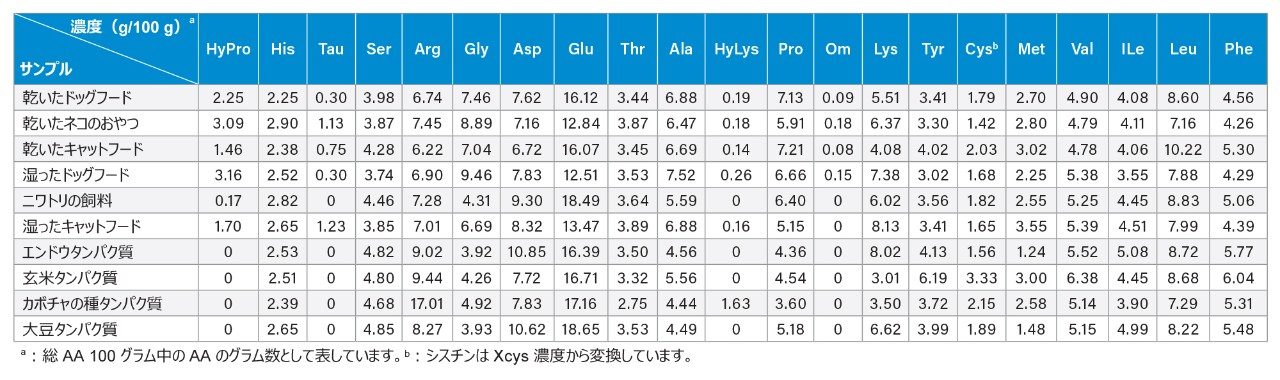
この試験で開発したグラジエント溶出条件を使用して、6 種類のペットフードと 4 種類の植物性タンパク質を分析しました。これらのサンプル中のすべての AA が、正常に分離され、ベースライン分離されています(分離度 2 以上 [図 3])。注入したサンプルを包含する標準試料の RT に基づいてピーク割り当てを行いました。乾いたネコ用おやつと乾いたキャットフードには、相対ピーク面積が総ピーク面積の約 1 ±0.5% の小さな未同定ピークがいくつか見られました(図 3)。これらの未知ピークのアイデンティティーについては、さらに調査する必要があります。総ピーク面積の 0.5% 未満のその他の小さなピークは分析しませんでした。これらのサンプルの AA プロファイルを表 4 に示します。表 4 から、HyPro、Tau、Hylys はペットフードでのみ検出され、Tau および Hylys はニワトリ飼料中には検出されず、HyLys はカボチャの種タンパク質中に検出されたことがわかります。HyPro および HyLys は、動物で最も存在量の多いタンパク質であるコラーゲンに一般に存在するアミノ酸であるため、ペットフード中にこれらが存在していたことは予想通りでした。一方、HyLys はカボチャの種タンパク質中に天然には存在しないため、これが検出されたことは予想外でした。このカボチャの種タンパク質中の HyLys の由来は不明のままであり、汚染が原因として考えられます。
結論
AOAC 分析法 2018.06 のグラジエント溶出プログラムを、ペットフードおよび植物性タンパク質中のアミノ酸の分析用に変更し、最適化しました。すべての AA について優れた分離度が得られ、RT の併行精度と中間再現性は良好でした。分析法の感度(LOQ)と直線性は、AOAC 分析法 2018.06 で得られた値と同等でした。変更後の分析法は、6 種類のペットフードと 4 種類の一般的な植物性タンパク質に正常に適用できました。変更後の AOAC 分析法は、ペットフードや植物性タンパク質中のアミノ酸の分析における、信頼性が高く実用的なソリューションとなります。
参考文献
- Yang, J., Liu, B., Rainville, P.D., and Harden, S. UPLC-UV Analysis of Amino Acids in Dairy Products – Implementing an International Standard on the ACQUITY Premier System.Application Note 720008632, Waters Corporation, Milford, MA, 2024.
- Dong, Y.-L., Yan, N., Li, X., Zhou, X.-M., Zhou, L., Zhang, H.-J., & Chen, X.-G. Rapid and Sensitive Determination of Hydroxyproline in Dairy Products Using Micellar Electrokinetic Chromatography With Laser-Induced Fluorescence Detection.Journal of Chromatography A 2012, 1233, 156–160.doi:10.1016/j.chroma.2012.02.030.
- Yuswan, M.H., Jalil, N.H.A., Mohamad, H., Keso, S., Mohamad, N.A., Yusoff, T.S.T.Md., Ismail, N.F., Manaf, Y.N.A., Hashim, A.M., Desa, M.N.M., Yusof, Y.A., & Mustafa, S. (2020) Food Chemistry 2020, 337,127762.doi:10.1016/j.foodchem.2020.127762.
- Cohen, S.A. and Michaud, D.P. (1993) Synthesis of a Fluorescent Derivatizing Reagent, 6-Aminoquinolyl-N-Hydroxysuccinimidyl Carbamate, and its Application for the Analysis of Hydrolysate Amino Acids Via High-Performance Liquid Chromatography.Analytical Biochemistry, 211, 279–287.
- AccQ Tag Ultra Derivatization Kit Care and Use Manual.Waters Corporation.715001331 Rev. A, 2024.
- UPLC Amino Acid Analysis Solution System Guide.Waters Corporation. 71500129702 Revision B, 2007.
720008700JA、2025 年 2 月