乳製品中のアミノ酸の UPLC™-UV 分析 - ACQUITY™ Premier システムでの国際標準試料の実施
要約
AOAC International 公定分析法 2018.06(AOAC 分析法 2018.06)に記載されている分析手順を使用して、バイナリーソルベントマネージャーおよび固定ループサンプルマネージャーを搭載した ACQUITY Premier システムで、乳製品中のアミノ酸の逆相超高速液体クロマトグラフィーを行いました。移動相 A の調製、注入モードとパラメーター、誘導体化のレシピ、インラインフィルターの使用などのクロマトグラフィー条件および手順を、より良好で信頼性の高い分離が得られるように改善または適応させています。これらの調整により、信頼性の高いアミノ酸の分離が可能になり、標準試料および特定の代表的な乳製品の両方について、優れた直線性、感度、精度、ピーク形状、ベースライン分離が得られました。このアプリケーションノートでは、バイナリーソルベントマネージャーと固定ループサンプルマネージャーを搭載した ACQUITY Premier システムで AOAC 分析法(2018.06)が正常に実施できたことについて説明します。
アプリケーションのメリット
- AOAC 分析法 2018.06 により、より迅速で完全な乳製品のアミノ酸分析が可能に
- バイナリーソルベントマネージャーと固定ループサンプルマネージャーを搭載した ACQUITY Premier システムは、AOAC 分析法 2018.06 によるアミノ酸の効率的な分離における信頼性の高いソリューションを提供
- AccQ∙Tag™ Ultra 誘導体化キットおよび AccQ∙Tag Ultra ケミストリーキットにより、AOAC 分析法 2018.06 の実施が簡素化
はじめに
アミノ酸(AA)は、人や動物の正常な成長と健康に必須の栄養分です。総アミノ酸およびアミノ酸プロファイルは、重要な栄養値です。また、AA プロファイルは、特定の食品に特徴的であり、不純物の検出に使用できます。AOAC 分析法 994.12 や AOAC 分析法 985.28 などの従来の AA 分析法の多くは、過ギ酸酸化の後に酸加水分解を行い、ニンヒドリンのポストカラム誘導体化を使用したイオン交換クロマトグラフィーによる分離に基づいています。しかし、過ギ酸酸化のステップには時間がかかります。チロシンもこの酸化ステップで破壊されるため、別途分析する必要があります。AOAC 分析法 2018.06 は、AA 分析のための迅速で完全なアプローチを提供します1。 この分析法では、サンプルを酸加水分解した後に、6-アミノキノリル-N-ヒドロキシスクシンイミジルカルバメート(AQC)を使用してプレカラム誘導体化し、次に紫外線/可視光(UV/Vis)検出を使用した逆相超高速液体クロマトグラフィー(RP-UPLC)による分離を行います。一晩かけて過ギ酸酸化するステップがなくなり、チロシンを他の AA と共に分析することができます。AOAC 分析法 2018.06 は、国際標準化機構(ISO)4214:20222、国際酪農連盟(IDF)254:20222、穀物協会(AACC)07-50.01 などの他の組織によって公定分析法として認められています3。
ウォーターズのアミノ酸分析ソリューション4,5では、AQC を用いたプレカラム誘導体化および RP-UPLC という点で類似のアプローチを用います。唯一の違いは、RP-UPLC において、AOAC 分析法 2018.06 では長いカラムを使用する点です。このため、AOAC 分析法 2018.06 では、多くのウォーターズのアミノ酸分析製品が使用されてきました。その中には、ACQUITY UPLC BEH™ C18(1.7 µm、2.1 × 150 mm、製品番号:186002353)、AccQ∙Tag™ Ultra 誘導体化キット(186003836)、AccQ∙Tag Ultra 溶離液 A 濃縮液(製品番号:186003838)、AccQ∙Tag Ultra 溶離液 B(製品番号:186003839)が含まれます。カラムおよび消耗品以外にも、ACQUITY UPLC システム、ACQUITY UPLC H-Class システム、ACQUITY UPLC I-Class システムを含む複数の Waters ACQUITY システムが、マルチラボ試験に参加したラボで正常に使用されてきており、この AOAC 分析法 2018.06 の承認につながる優れた結果が得られました6。AA の分離が LC 装置のハードウェアおよび設計の影響を受けやすいことを考慮し、AOAC 分析法 2018.06 の実施に向けて、バイナリーソルベントマネージャーと固定ループサンプルマネージャーで構成された ACQUITY Premier システムを評価しました。信頼性の高い効率的な AA の分離を実現するために、特にクロマトグラフィー条件に焦点を当てました。
実験方法
この試験では、AOAC 分析法 2018.06 に記載されている実験の詳細に従い、軽微な適応を加えました。ここでは、主な手順と条件を簡単に記載します。その他の詳細は、AOAC 分析法 2018.06 に記載されています。
AA キャリブレーションスタンダード
2.5 mM AA ストック溶液:AA ストック溶液(ウォーターズの製品番号:WAT088122)には、0.1 M HCl 中に、2.5 mM の以下の各アミノ酸(L-シスチンは 1.25 mM)が含まれています:L-アラニン(Ala)、L-アルギニン(Arg)、L-アスパラギン酸(Asp)、L-シスチン(Cys)、L-グルタミン酸(Glu)、L-グリシン(Gly)、L-ヒスチジン(His)、L-イソロイシン(Ile)、L-ロイシン(Leu)、L-リジン(Lys)、L-メチオニン(Met)、L-フェニルアラニン(Phe)、L-プロリン(Pro)、L-セリン(Ser)、L-スレオニン(Thr)、L-チロシン(Tyr)、L-バリン(Val)。0.5 mM AA 溶液および 0.05 mM AA 溶液は、AA ストック溶液を 0.1 M HCl で段階希釈して調製しました。0 ~ 19.2 µM(pmol/µL)の AA キャリブレーション標準溶液および 7.7 µM のノルバリン(Nva)(すべて誘導体化後の最終濃度)は、表 1 に従って調製しました。Nva を内部標準(I.S.)として使用しました。
注:シスチンは、この溶液中に存在しますが、定量には使用せず、別途調製しました。
あるいは、Waters 食品・飼料 AA 標準溶液(ウォーターズの製品番号:186009299)を AA キャリブレーションスタンダードとして使用することも可能です。これには、各 0.5 mM の 17 AA(AA ストック溶液と同じ AA)に加えて 0.5 mM の AA(タウリン(Tau)、α-アミノ酪酸(AABA)、メチオニンスルホン(MetSO2)、シスチン酸(Cya))が含まれていました。
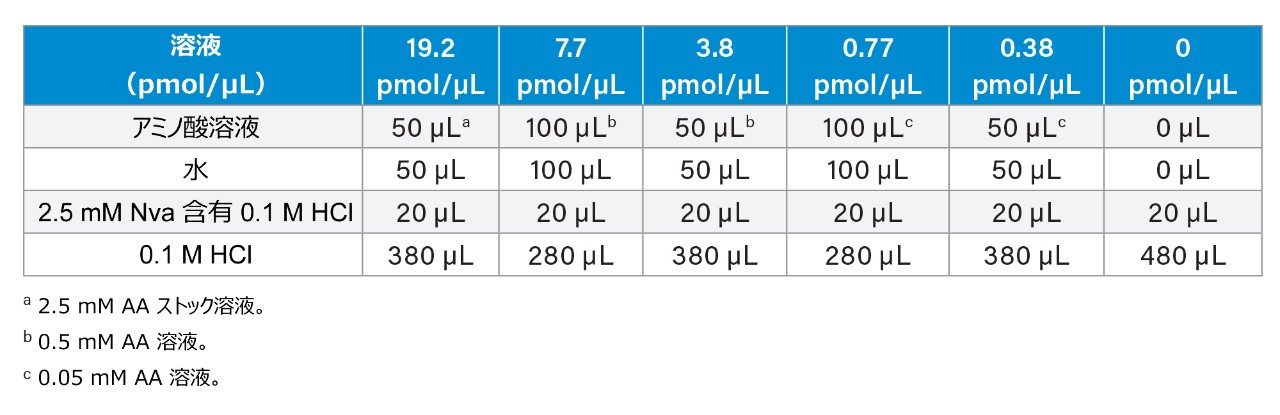
シスチンのキャリブレーションスタンダード
シスチンのストック溶液(10 mM)は、240 mg シスチン(0.01 mg 単位で記録)を 100 mL のメスフラスコに量り取り、0.05 M NaOH で標線まで希釈することによって調製しました。シスチン溶液(1 mM)は、シスチンのストック溶液を 0.05 M NaOH で希釈することにより調製しました。10 mM シスチンのストック溶液を最長 3 か月間 -20 ℃ で保存しました。1 mM シスチン溶液は、各分析ごとに新しく調製しました。
シスチンのキャリブレーションスタンダードは、0、10、20、50、100、200 µL の 10 mM シスチンストック溶液を 10 mL バイアルに加え、水で 1100 µL になるように調製しました。各バイアルに、600 µL の DDP(3,3'-ジチオジプロピオン酸)溶液(0.2 M NaOH 中に 1% DDP)、600 µL の 0.2 M HCl、200 µL の 10 mM Nva ストック溶液、2,500 µL のフェノール-HCl 溶液(12 M HCl 中に 0.1% フェノール)を加えました。これらの標準溶液の誘導体化後の最終濃度はそれぞれ 0、0.38、0.77、1.9、3.8、7.7 µM(pmol/µL)でした。バイアルを窒素流下で最低 5 秒間スパージして、酸素を置換しました。バイアルをスクリューキャップで閉じ、ボルテックスミキサーで混合しました。注:フェノール-HCl 溶液は、換気フード下で添加する必要があります。
サンプル前処理
乳児用調製乳および粉乳のサンプルは、まず 2.5 g の粉末を 40 g の水に添加して再溶解し、十分に混合しました。再溶解したサンプル 800 ± 20 mg を 10 mL のガラス容器またはスクリューキャップ付きバイアルに量り取りました。(サンプルの質量を 0.01 mg 単位まで記録しました。)各容器またはバイアルに、600 µL の DDP 溶液(0.2 M NaOH 中 1% DDP)、600 µL の 0.2 M HCl、500 µL の 10 mM Nva ストック溶液、2500 µL のフェノール-HCl 溶液(12 M HCl 中 0.1% フェノール)を加えました。
酸加水分解(サンプルおよびシスチン標準試料のみ、AA 標準試料はなし)
サンプル溶液またはシスチンキャリブレーション溶液が入っている容器またはバイアルを、110 ± 2 ℃ のオーブンに 24 ± 0.5 時間放置しました。
あるいは、マイクロ波加水分解装置(Discover Prep、CEM Corp、ノースカロライナ州)を使用してサンプルを加水分解しました。35 mL ホウケイ酸ガラス圧力容器(定格圧力最大 300 psi)(CEM 製品番号:909036)を、シリコンキャップ(CEM 製品番号:909350)とともに使用しました。Teflon コーティングしたマイクロ撹拌棒(CEM 製品番号:162810)を使用して混合しました。酸加水分解のステップは以下のパラメーターを使用して行いました:最大出力設定 300 W の Dynamic Control(ダイナミックコントロール)、温度 160 ℃ で 20 分間、圧力限界を 300 psi に設定、攪拌レベルを High(高)に設定、冷却中に窒素ガスを吹き付ける。
(サンプルおよびシスチン標準試料の)中和および希釈
酸加水分解後、加水分解物を冷却します。次に、0.2 mL の各加水分解生成物を 1.5 mL マイクロチューブに移し、続いて 0.2 mL の 6 M NaOH と 1.6 mL の 0.1 M HCl を添加しました。この混合液を十分に混合してから、0.45 μm PVDF メンブレンフィルターでろ過して別の 1.5 mL マイクロチューブに入れました。
(サンプル、シスチン標準試料、AA 標準試料の)誘導体化
AccQ∙Tag Ultra 誘導体化試薬の調製、キャリブレーションスタンダード、中和したサンプル溶液、中和した変換シスチン標準試料の誘導体化は、AOAC 分析法 2018.06 の誘導体化手順または AccQ∙Tag Ultra 誘導体化キット7(ウォーターズの製品番号:186003836)の取扱説明書に従って行いました。(注:取扱説明書の手順は、AOAC 分析法 2018.06 の誘導体化手順と同等です)。説明書にある元のレシピの代わりに、誘導体化レシピ(容積比)(100 µL AccQ∙Tag Ultra ホウ酸バッファー [AccQ∙Tag Ultra 誘導体化キットの試薬 1]、10 µL のキャリブレーション標準溶液(または、中和したサンプル溶液または中和した変換シスチン標準溶液)および 20 µL の再溶解した AccQ∙Tag Ultra 試薬)を使用しました。(注:この変更は、クロマトグラフィーのピーク形状の改善に役立ちました)。
UHPLC 分離条件
|
UHPLC システム: |
ACQUITY Premier システムは、バイナリーソルベントマネージャー、固定ループサンプルマネージャー、アクティブプレヒーター(CH-A)付きカラムヒーター、フォトダイオードアレイ(PDA)eLambda 検出器で構成されています |
|
UV/Vis の波長: |
260 nm |
|
検出器へのインレットチューブ: |
内径 0.004 インチ、10.5 インチのチューブアセンブリー(ウォーターズの製品番号:430001784) |
|
ソフトウェア: |
Empower™ 3 クロマトグラフィーデータシステム |
|
カラム: |
ACQUITY UPLC BEH C18 カラム、1.7 µm、2.1 × 150 mm(ウォーターズの製品番号:186002353) AccQ∙Tag Ultra C18 カラム、1.7 µm、2.1 mm × 150 mm(ウォーターズの製品番号:186009954) (注:AccQ∙Tag Ultra C18 カラムは、アミノ酸分析用に特別に製造された ACQUITY UPLC BEH C18 カラムです) |
|
カラムインラインフィルター: |
ACQUITY カラムインラインフィルター 0.2 µm(ウォーターズの製品番号:205000343) |
|
サンプリングレート: |
10 Hz |
|
カラム温度: |
50 ℃ |
|
サンプル温度: |
20 ℃ |
|
サンプルループサイズ: |
1 µL |
|
注入量: |
1 µL |
|
注入モード: |
6 倍オーバーフィルボリュームのニードルオーバーフィル付きパーシャルループ(PLNO) |
|
移動相 A: |
AccQ∙Tag Ultra 溶離液 A 濃縮液(ウォーターズの製品番号:186003838)と水の 1:6(v/v)混合液 (注:100 mL のクラス A メスフラスコを使用して 100 mL の AccQ∙Tag Ultra 溶離液 A 濃縮液を移し、600 mL の水と混合します。) |
|
移動相 B: |
AccQ∙Tag 溶離液 B(ウォーターズの製品番号:186003839) |
|
弱ニードル洗浄溶媒: |
95:5(v/v)水:アセトニトリル |
|
強ニードル洗浄溶媒: |
5:95(v/v)水:アセトニトリル |
|
シール洗浄溶媒: |
50:50(v/v)水:アセトニトリル |
|
流量: |
0.4 mL/分 |
|
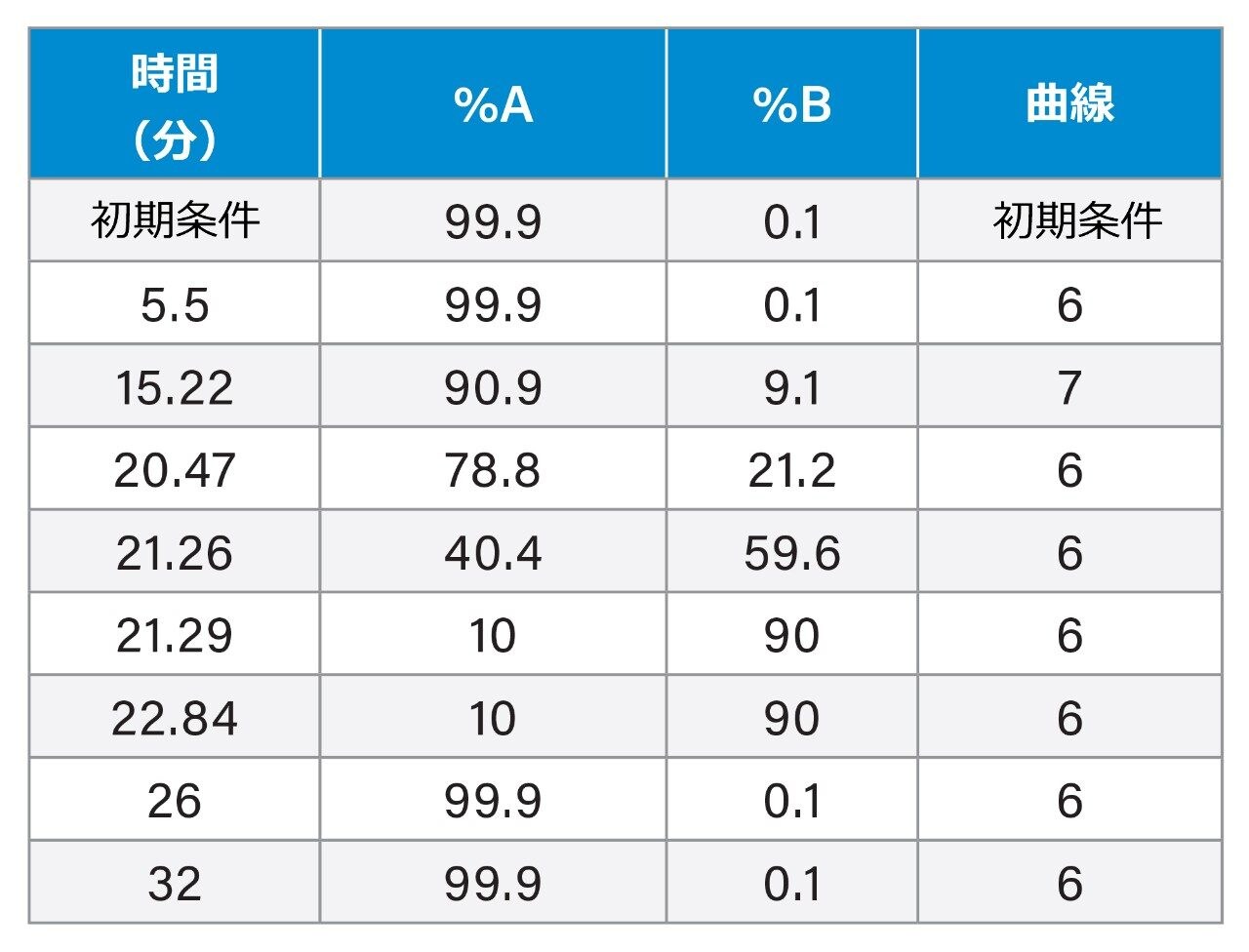
グラジエント溶出: |
(以下のグラジエントテーブルを参照) |
グラジエントテーブル
計算
計算の詳細については、AOAC 分析法 2018.06 を参照してください。
結果および考察
分析手順の概要
AOAC 分析法 2018.06 では、タンパク質をフェノールと DDP(3,3'-ジチオジプロピオン酸)の存在下、6 M HCl 中で加水分解しました。Nva を内部標準として添加しました。シスチンとシステインを、DDP によって S-2-カルボキシエチルチオシステイン(XCys)に変換しました8。 加水分解および中和の後、AA と XCys を AQC で誘導体化しました。誘導体化された AA および XCys を、260 nm の UV/Vis 検出を用いた RP-UPLC によって分離しました。酸加水分解では、Gln と Asn はそれぞれ Glu と Asp に変換されました。このため、Glu 値は Glu と Gln の値を合わせた値、Asp 値は Asp と Asn の値を合わせた値になりました。XCys 値はシステインとシスチンの値を合わせた値を表します。トリプトファンは酸加水分解によって分解したため、この分析法を含め酸加水分解に基づくメソッドでは分析できませんでした。
ACQUITY Premier システムでの AOAC 分析法 2018.06 の実施
バイナリーソルベントマネージャーと固定ループサンプルマネージャーで構成された ACQUITY Premier システムは、他の ACQUITY UPLC システムと比較した際に拡散容量、グラジエントディレイボリューム、システムデュエルボリュームが異なります。AOAC 分析法 2018.06 を実施する場合、信頼性の高い効率的な分離を得るには、クロマトグラフィーの条件と手順を調整する必要があります。クロマトグラフィーの条件と手順の主な調整には、移動相 A 調製手順の改善、6 倍オーバーフィルを行う PLNO 注入モードの使用、インラインフィルターの使用、誘導体化レシピのわずかな変更が含まれます。
移動相 A の調製
保持時間(RT)10 分未満の早く溶出する AA は、移動相 A の初期組成の影響を極めて受けやすいことがわかりました。新しく調製した移動相 A の別のバッチを使用すると、これらの化合物の RT の大きなシフトがしばしば見られました。RT の変化を低減するために、AccQ∙Tag Ultra 溶離液 A 濃縮液を移す際に、メスシリンダーの代わりにクラス A メスフラスコを使用して移動相 A を調製しました(「実験方法」セクションの「UHPLC 分離条件」を参照)。さらに、移動相 A 中の AccQ∙Tag Ultra 溶離液 A 濃縮液と水の容積比を 150:850 から 100:600(v/v)に変更しました。この容積比の調整により AA の RT がわずかに増加しました。そのため、移動相 A の小さなばらつきを原因とした、最初に溶出する AA(His)での His の前に溶出する誘導体化ピークからの分離の喪失が防げました。
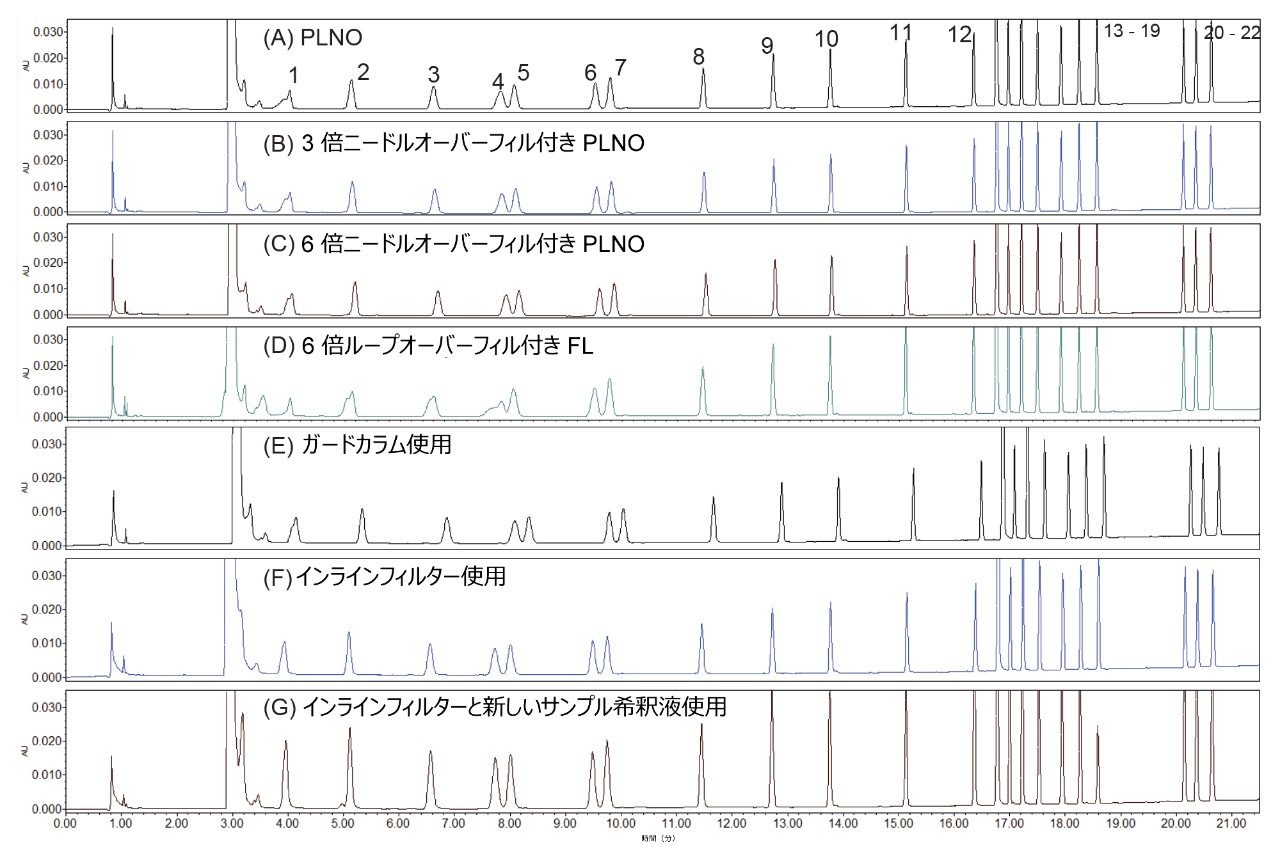
ピーク形状の改善
早く溶出する AA のピーク形状(図1)が歪んでいました。これはおそらく、強溶媒効果により、初期移動相と比較してサンプル希釈液中の有機含量が大幅に高くなったためです。ピーク形状を改善するために、さまざまなアプローチをテストしました。図1 に、さまざまな条件が AA のピーク形状に及ぼす影響を示します。これらの条件には、さまざまなニードルオーバーフィルの容積比のさまざまな注入モード、カラムインラインフィルターまたはガードカラムの使用、サンプル希釈液の有機含量低減による調整が含まれます。ニードルオーバーフィルの容積比 6 の PLNO 注入モード、インラインフィルターの使用、(誘導体化ステップのホウ酸バッファーの 70 µL から 100 µL への変更による)サンプル希釈液の有機含量の低減といった条件の組み合わせにより、最適なピーク形状が得られました。
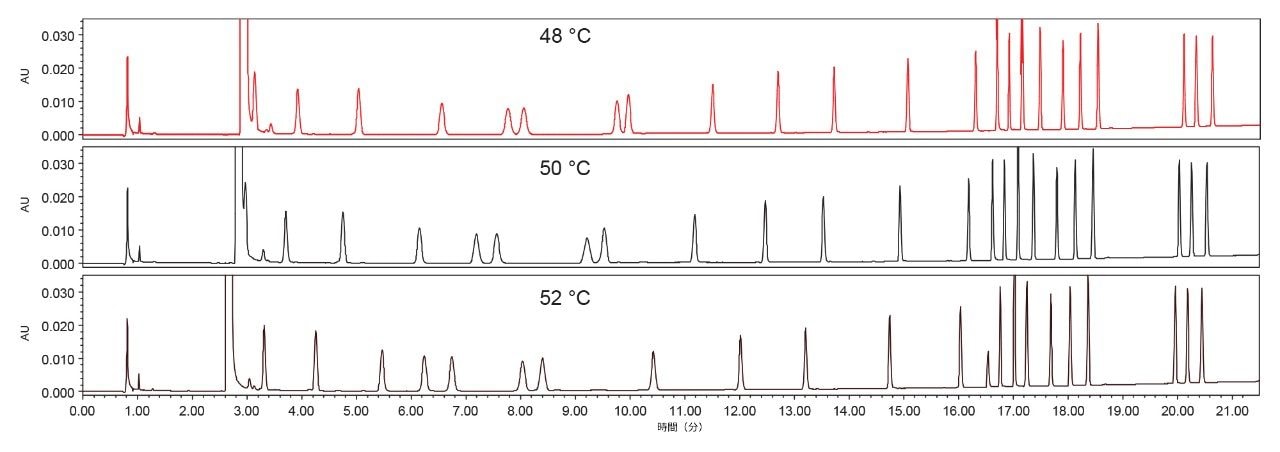
カラム温度
カラム温度も、最適な AA の分離を得る上で重要な要素であることがわかりました。図 2 に、カラム温度が RT および AA の選択性に及ぼす影響を示します。カラム温度のわずかな変動(± 2 ℃)でも、RT と AA の選択性が大きく変化しました。カラム温度 50 ℃ が、AA の十分な保持と良好な分離に最適な条件であることが確認されました。
感度および直線性
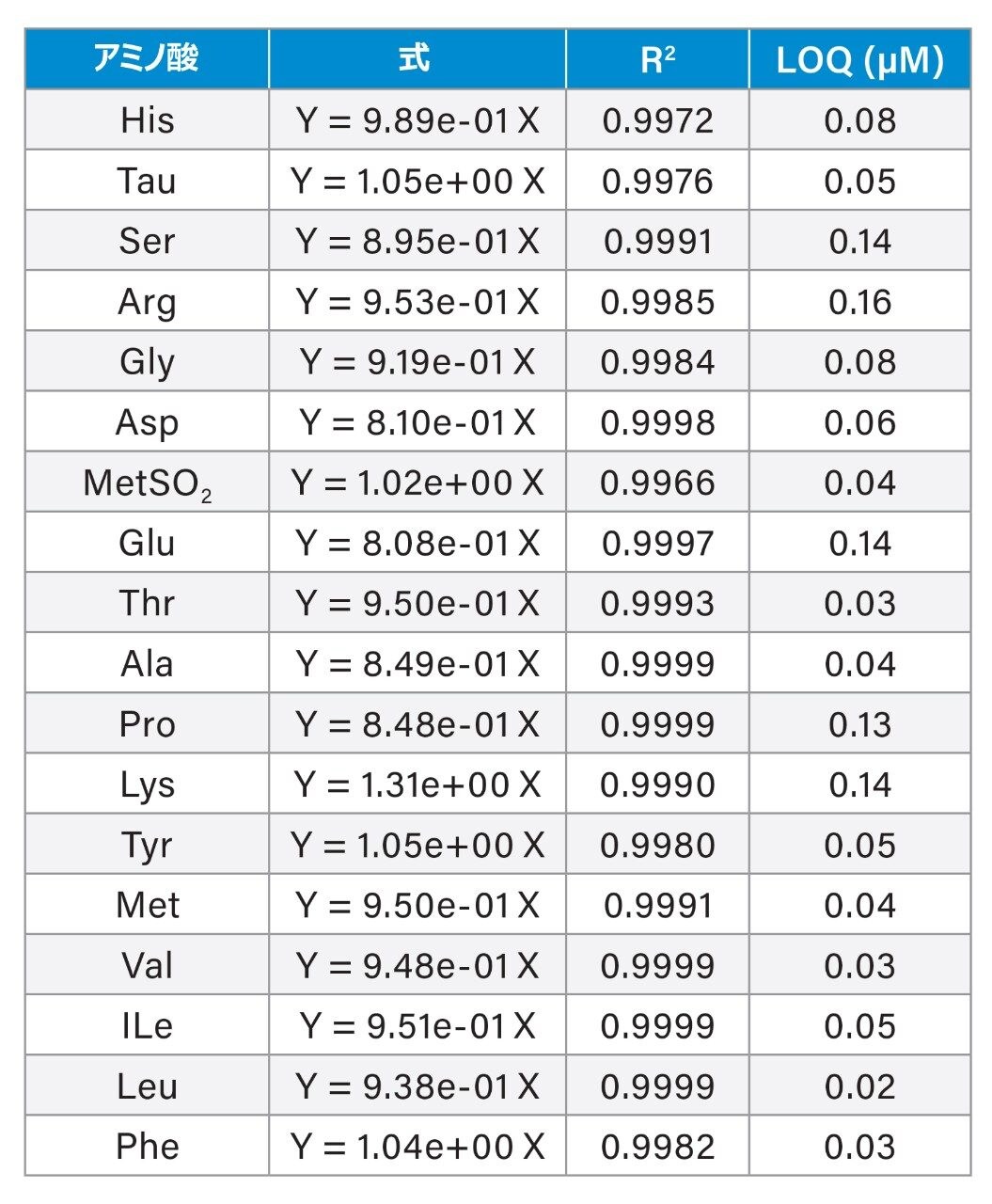
濃度 0 ~ 19.2 µM の AA 標準作業溶液を分析して、直線性を評価しました。重み付けなしの最小二乗回帰によって、データポイントを 0 を通る線に近似しています。表 2 に、各 AA の代表的なキャリブレーションの式、決定係数(R2)、定量限界(LOQ)の推定値を示します。すべての AA で 0.997 を超える R2 が得られました。LOQ は、レスポンスの標準偏差および業界のガイダンスに記載されているキャリブレーションの傾きアプローチを使用して推定しました9。AA のレスポンスは、ピーク面積比 AA/I.S.(Nva)× I.S. の濃度として計算しました。0.19 µM の AA 標準混合溶液を 5 回注入した結果を LOQ の推定に使用しました。LOQ の推定値は 0.02 ~ 0.16 µM でした(表 2 を参照)。
RP-UPLC の並行精度および室内再現精度
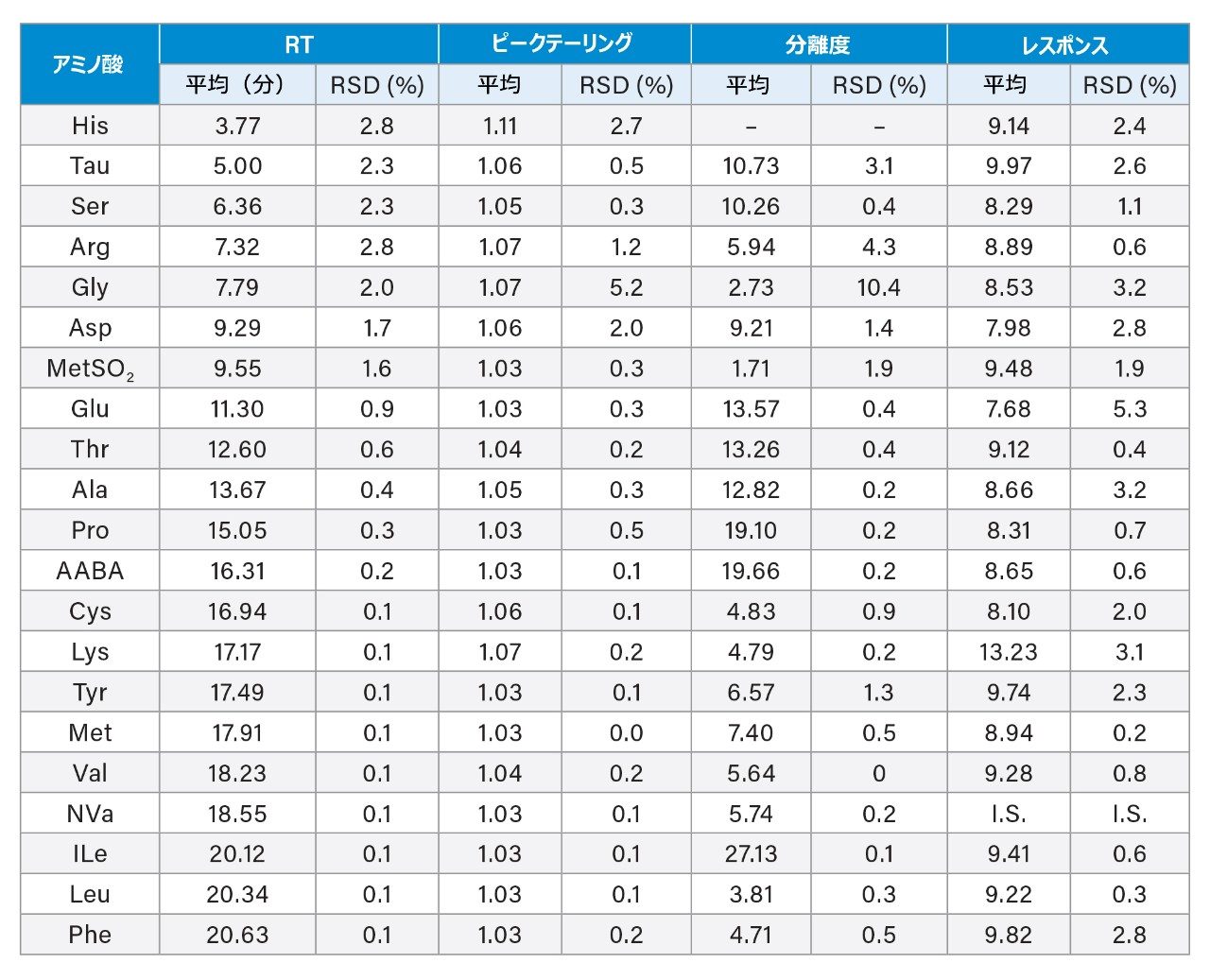
食品・飼料 AA 標準混合溶液(7.7 µM)の繰り返し注入(n=4、1 日内で測定)を使用して、RT の併行精度、ピークテーリング、分離度、レスポンスを評価しました。表 3 に、各 AA の RT、ピークテーリング、分離度、レスポンスの平均値と RSD 値を示します。RT では、RSD 値が、早く溶出する化合物では 3% 未満(RT <10 分)、その他の化合物では 1% 未満になりました。His(最初に溶出する AA でピークテーリングが 1.11)以外のすべての AA で、ピークテーリングが 1.07 未満でした。MetSO2(分離度が 1.71 で Asp と MetSO2 の間)以外の化合物では分離度が 2.0 を超えていました。MetSO2 は AOAC 2018.06 の AA のリストになく、乳製品サンプル中に検出されなかったことに注意してください。(Waters 食品・飼料 AA 標準混合液には含まれていました)。これらの AA のレスポンスの RSD は、Glu では 5.3%、残りの AA では 3.2% 未満でした。
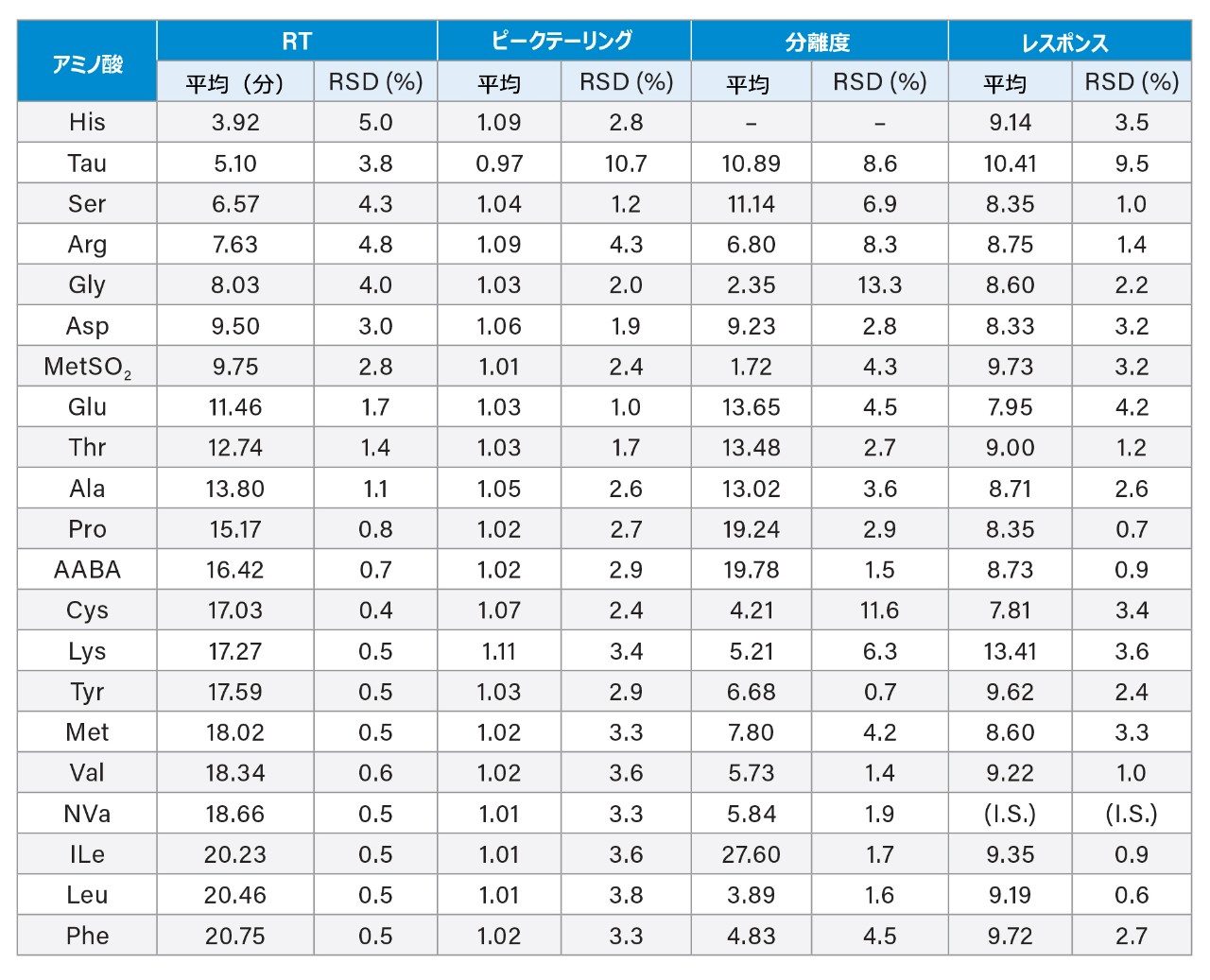
別途調製した食品・飼料 AA 標準混合溶液(7.7 µM)を使用し、異なるバッチの 3 本のカラムを使用して別々の 3 日に分析して室内再現精度も評価しました。表 4 に、結果のサマリーを示します。RT の RSD は、早く溶出する AA では 5.0% 未満(RT < 10 分)、残りの AA では 1.7% 未満でした。ピークテーリングは、すべての AA で 1.11 未満でした。分離度は MetSO2 以外のすべての化合物で 2.0 より高く、Asp と MetSO2 の対の分離度は 1.72 でした。これらの AA のレスポンスの RSD は、Tau では 9.5%、他の AA では 4.2% 未満でした。
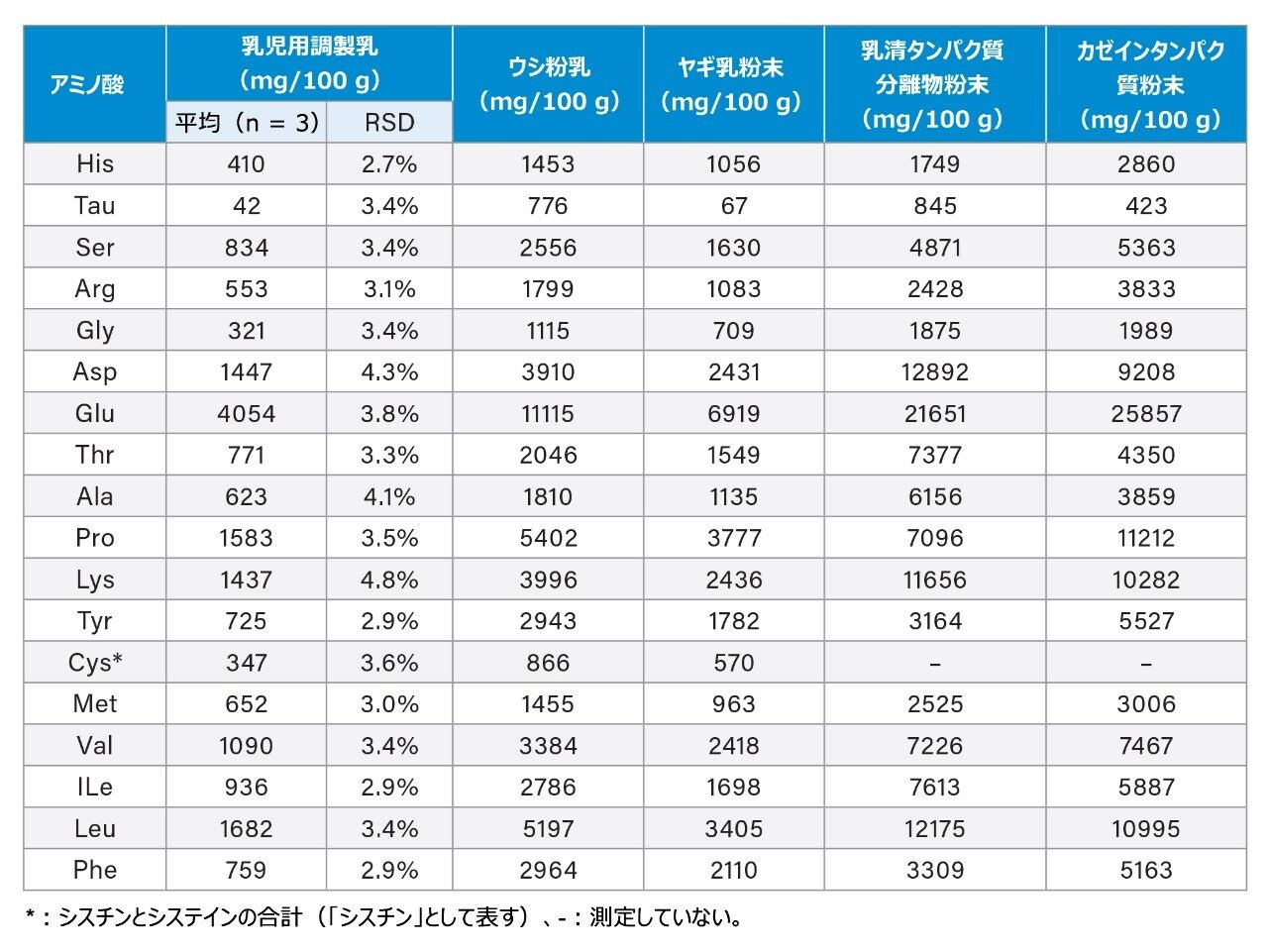
乳製品の分離
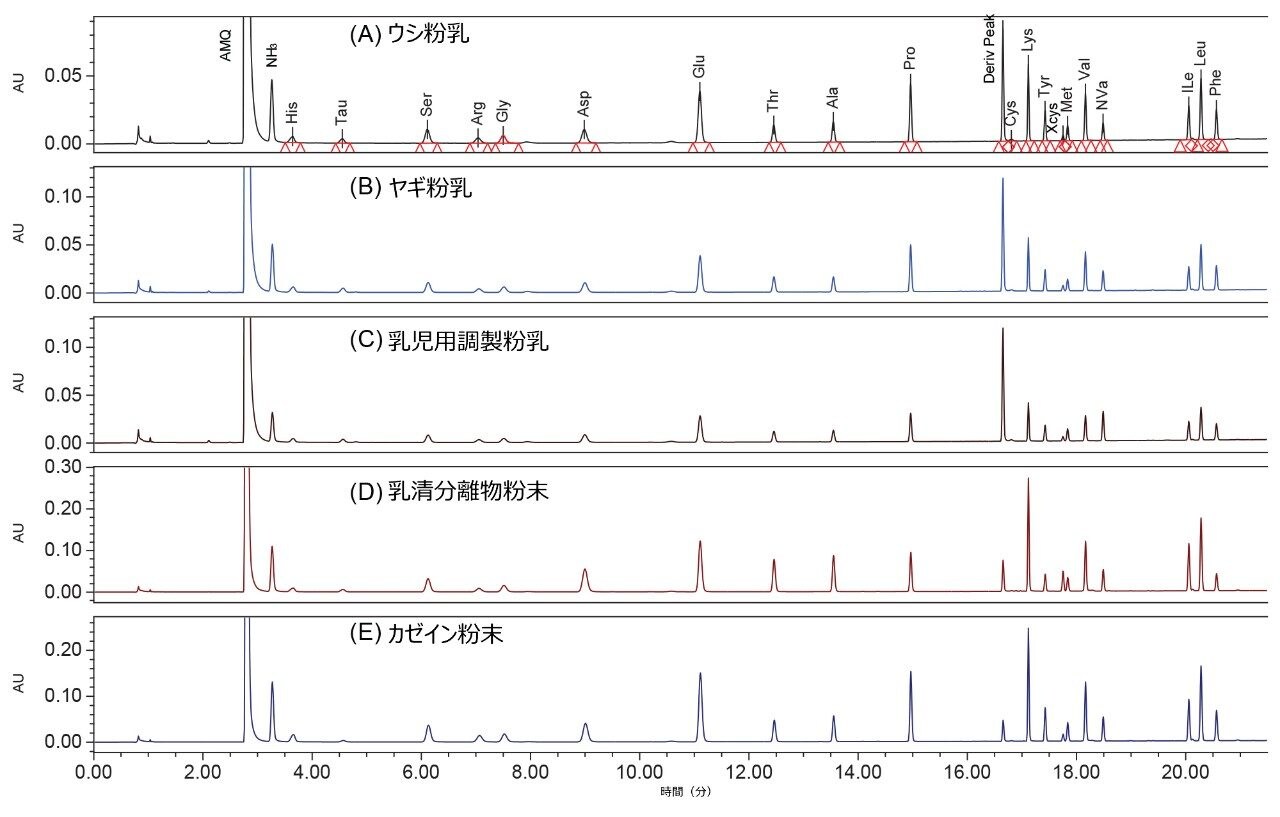
乳製品中の AA すべてが、正常にベースライン分離されました(図 3)。このような乳製品サンプルには、ウシ粉乳、ヤギ粉乳、乳児用調製粉乳、乳清タンパク質分離物、カゼイン粉末などがあります。表 5 に、これらの乳製品中の AA 含量測定値を示します。乳児用調製乳を 3 回繰り返しで分析したところ、AA の結果の RSD は 4.8% 未満でした。
結論
バイナリーソルベントマネージャーおよび固定ループサンプルマネージャーで構成された ACQUITY Premier システムで、AccQ∙Tag Ultra C18 カラム(1.7 µm、2.1 mm × 150 mm)を使用して、乳製品中の AA の測定が正常に実施できました。分析手順は AOAC 分析法 2018.06 に厳密に準拠させましたが、より一貫性のある AA の RT を得るために移動相 A 調製法の改善、クロマトグラフィー条件の最適化(注入モード/パラメーターおよびインラインフィルターの使用)、誘導体化のレシピ変更によるピーク形状の改善など、軽微な適応を加えました。AOAC 分析法に準拠した Waters AccQ∙Tag Ultra 消耗品(誘導体化キット、標準試料・ケミストリーキット、カラム)が、この分析の成功に大きく貢献しました。変更した AOAC 分析法条件下での ACQUITY Premier システムでの AA 分離において、優れた直線性、感度、併行精度(室内再現精度を含む)が得られることが実証されました。すべての AA について、優れたピーク形状と分離が得られました。乳児用調製乳、ウシ乳、ヤギ乳、乳清、カゼインタンパク質粉末などの一般的な乳製品サンプル中の AA 分析において、優れた分析性能が実証されました。バイナリーソルベントマネージャーおよび固定ループサンプルマネージャーを搭載した ACQUITY Premier システムおよび AccQ∙Tag Ultra ケミストリーキットは、乳製品中の AA 測定用の信頼できるソリューションとして使用できます。
参考文献
- Jaudzems, G.; Fuerer, C. Determination of total amino acids in infant formulas, adult nutritionals, dairy, and cereal matrixes by UHPLC–UV: Interlaboratory Validation Study, Final Action 2018.06. Journal of AOAC International 2022, 105 (6), 1625–1639.
- International Organization for Standardization.(2022).Milk and milk products – Determination of amino acids in infant and adult/paediatric nutritional formulas and dairy products (ISO Standard No.4214:2022).
- Cereals and Grains Association.(2022).Total Amino Acids by UHPLC-UV (AACC 07-50.01).
- UPLC Amino Acid Analysis Solution System Guide. Waters Corporation. 71500129702 Revision B, 2007.
- Amino Acid Analysis Application Notebook.Waters Corporation.720006130, 2018.
- For a list of Waters ACQUITY System used in the multi-lab testing, please refer to the supplemental Table 1 in reference 1.
- AccQ∙Tag Ultra Derivatization Kit Care and Use Manual.Waters Corporation.715001331 Rev. A, 2024.
- Cohen, S. Analysis of Sulfur Containing Amino Acids III.Alkylation of Cysteine.Waters Lab Highlights.LAH0379, 1988.
- ICH.(2005) Q2(R1) Validation of Analytical Procedures: Text and Methodology Guidance for Industry.(Accessed on June 2nd, 2023).
720008632JA、2024 年 12 月