核酸ポリメラーゼは、遺伝情報の複製と転写を触媒として促進する酵素であり、これらが非常に重要な創薬可能なターゲットであることは、驚くことではません。ウイルスのポリメラーゼとヒトのポリメラーゼとの構造的な相違は、有効な抗ウイルス治療への希望をもたらしています。このように、ウイルス DNA または RNA ポリメラーゼを、基質を模倣する阻害剤のターゲットとすることができます。SARS-CoV-2 の場合、RNA ポリメラーゼはゲノム複製を行います。新型コロナウイルス感染症に対する in vitro での有効性が有望な数多くの抗ウイルス薬が、患者に対して試験されています。これらの 1 つは新型コロナウイルス感染症の治療薬として、FDA によって承認されています。この分子は、ホスホロアミダートプロドラッグであるレムデシビル(GS-5734)であり、細胞内で活性型の三リン酸型に変換されます。これらの抗ウイルス薬やその他同様の薬が期待されることで、新薬創薬プロジェクトや臨床試験の爆発的増加につながっています。
場合によっては、光学検出または質量分析と組み合わせた液体クロマトグラフィーを使用して、生体内変化をモニターすることに関心が持たれます。ヌクレオチドアナログはこれまで、トリブチルアミンなどのイオン対試薬を使用して分離されてきました1。 これにより、親水性で酸性の分析種の保持が向上し、金属への問題のある吸着によるサンプルのロスが抑制されます。同時に、トリブチルアミンのような強力なイオン対試薬はイオン化を抑制し、他の LC-MS 手法に切り替えるのは大変になります。
このアプリケーションノートでは、ハイブリッドシリカ表面および酢酸アンモニウム移動相を使用するミックスモードクロマトグラフィーを利用して、in vitro 細胞アッセイまたは薬物動態分析および投薬試験に適用可能性のある分析法の出発点を考案します。
このアプリケーションの詳細、またはウォーターズがお客様の新型コロナウイルス感染症に対する取り組みをどのように支援できるかについては、COVID19Response@waters.com までお問い合わせください
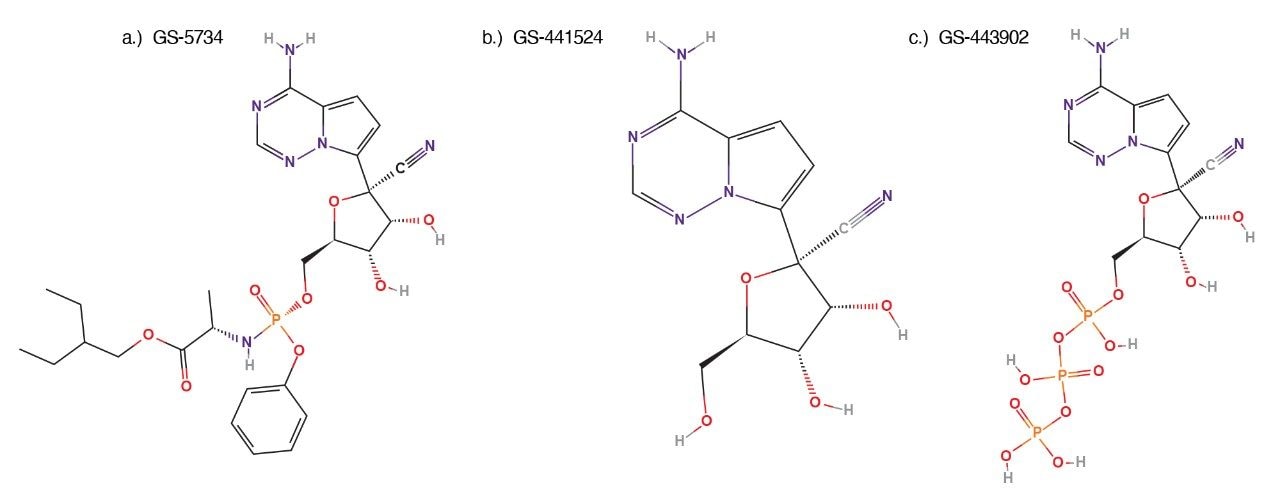
レムデシビル(GS-5734、図1A)は、コロナウイルスを含む複数のウイルスファミリーに属する RNA ウイルスに対して活性を示す、低分子抗ウイルス治験薬です。レムデシビルはヌクレオシド GS-441524 のプロドラッグです(図 1b)。これらはいずれも活性型のヌクレオシド三リン酸(GS-443902、図1c)に細胞内で代謝されます5。 レムデシビルは元々、エボラウイルス感染症治療用に開発されたものであり2、新型コロナウイルス感染症治療のための単独使用、または他の治療薬と組み合わせた使用に関して、リパーパシングに焦点を当てた広範な研究に注目が集まっています4。
これらの分子の分離で予想されていた 1 つの課題は、ヌクレオシド三リン酸の保持とピーク形状でした。イオン対試薬と HILIC モードクロマトグラフィーを使用して分離は達成されていますが、当社では、酢酸アンモニウムバッファーを用いたミックスモードクロマトグラフィーの使用を検討して、光学検出器または MS 検出器を用いてシンプルで迅速な分析法を達成することを選択しています。
ミックスモードクロマトグラフィー(MMC)により、固定相と分析種の間の複数種の相互作用を利用することで、分析種の分離が達成されます。移動相の pH、イオン強度、有機物含有量はすべて、分析種の保持と選択性に影響を及ぼす可能性がある要因です。Atlantis BEH C18 AX 固定相は、架橋エチレンハイブリッド粒子に基づくミックスモード逆相/陰イオン交換固定相です3。 架橋エチレンハイブリッド粒子を利用することで、広範な移動相 pH 値が使用でき、C18 基と陰イオン交換基の両方が存在すると、疎水性特性またはイオン特性のいずれかに基づいて分析種を分離できます。さらに、Atlantis BEH C18 AX 固定相は、初めて MaxPeak High Performance Surfaces カラムハードウェアを使用したクロマトグラフィー充塡剤であり、酸性分析種のステンレススチールとの相互作用を低減するように設計されています6。
以下の実験条件を使用し、Atlantis Premier BEH C18 AX カラムを使用して、レムデシビル(GS-5734)、その親ヌクレオサイド(GS-441524)、ヌクレオシド三リン酸(GS-443902)を分析しました。
|
LC システム: |
ACQUITY Premier クオータナリーシステム |
|
検出器 1: |
ACQUITY Premier PDA 検出器 |
|
検出器 2: |
ACQUITY QDa 質量検出器 |
|
カラム: |
Atlantis Premier BEH C18 AX 1.7 μm カラム(2.1 × 50 mm) |
|
カラム温度: |
50 ℃ |
|
サンプル温度: |
12 ℃ |
|
注入量: |
1 µL |
|
流速: |
0.5 mL/分 |
|
移動相 A: |
アセトニトリル 100% |
|
移動相 B: |
IonHance CX-MS 濃縮液 A、pH 5(1:5 希釈)、製品番号:186009280 |
|
移動相 C: |
100% 18 MΩ 水 |
|
移動相 D: |
IonHance 酢酸アンモニウム、pH 6.8 濃縮液(1:5 希釈)、製品番号:186009705 |
標準試料は複数の供給元から購入しました。レムデシビル(GS-5734、図1a)は Ambeed(Arlington Hts、IL 60004、米国)、レムデシビルヌクレオシド(GS-441524、図1b)は Biosynth-Carbosynth(Itasca、IL 60143、米国)、レムデシビルヌクレオシド三リン酸(GS-443902、図1c)は AOBIOUS, Inc(Gloucester, MA 01930、米国)から購入しました。
レムデシビルとレムデシビルヌクレオシド三リン酸の両方が含まれている標準試料は、濃度比 500:50 μg/mL および 50:500 μg/mL で調製しました。これらの比は、投与と代謝開始の異なる 2 つのタイムポイントを模倣するために、準備しました。単一成分標準試料のレムデシビルヌクレオシドは、濃度 10 μg/mL および 100 μg/mL で調製しました。
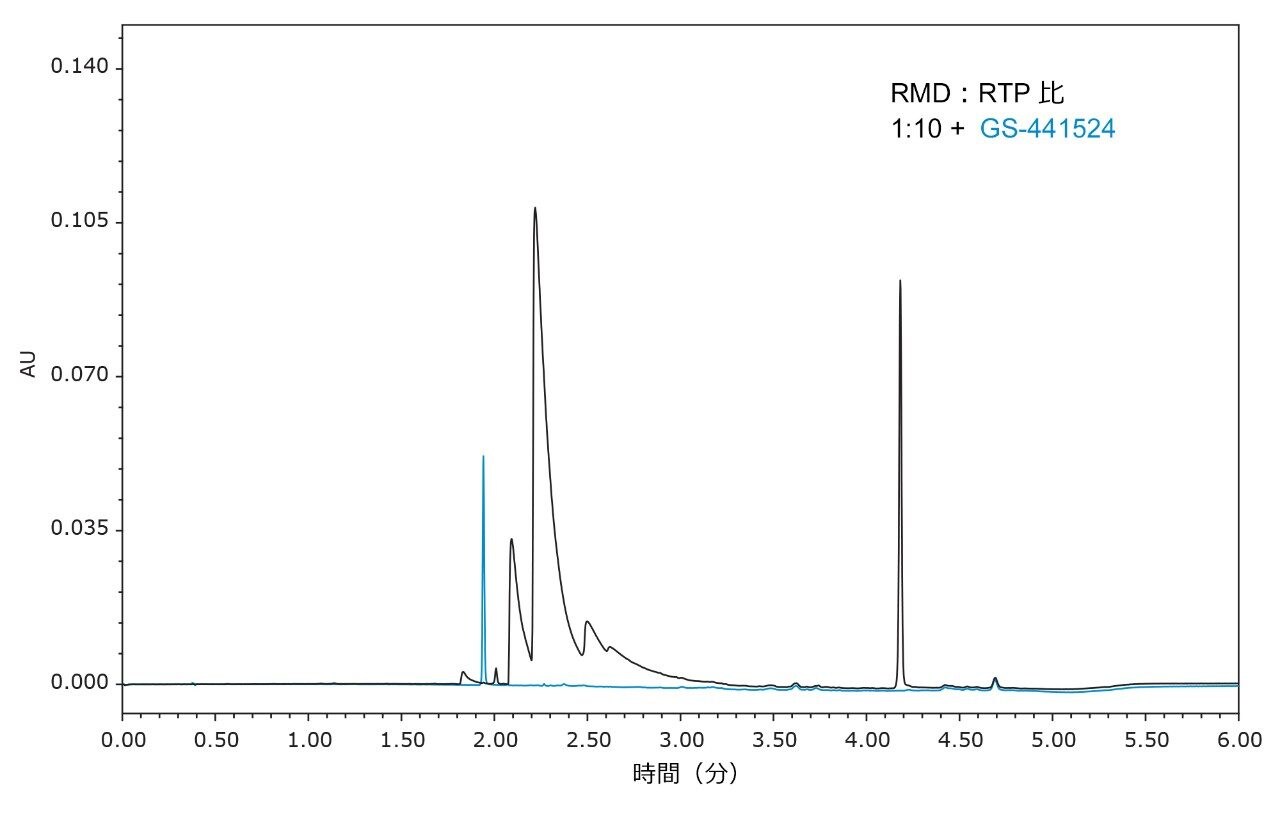
クロマトグラフィー移動相は、IonHance バッファー濃縮液(20% (v/v) アセトニトリルを含む)によって、クオータナリーポンプを使用してオンラインで調製しました。バッファー濃縮液は 1:5 希釈で調製し、IonHance CX-MS 濃縮液 A(pH 5)は 4% アセトニトリル中に最終濃度 100 mM、IonHance 酢酸アンモニウム(pH 6.8)濃縮液は 4% アセトニトリル中に 200 mM にしました。1:5 希釈液を 18 MΩ 水およびアセトニトリルと混合して、グラジエントを形成しました。最終的なグラジエントは、4 分で 0% アセトニトリル中 5 mM 酢酸アンモニウム pH 6.8 から 60% アセトニトリル中 20 mM 酢酸アンモニウム pH 6.8 までとし、直線グラジエント(曲線 6)を使用して 0.5 分で初期条件に戻しました。より長い 8 分間のグラジエントも実行し、良好な結果が得られました(図 2)。
レムデシビルの logP 値 2.01 は中等度であるため、このプロドラッグを溶出するには比較的高い割合のアセトニトリルが必要と予測されました。pH がヌクレオシド三リン酸の保持に重大な影響を及ぼすことも予測されました。
レムデシビルの保持係数は、一連の注入について算出されました。そこでは、アイソクラティック溶出条件、および 10 mM 酢酸アンモニウム中のアセトニトリル含有量が 40 ~ 60% になるように調製した移動相を使用しました。さらに、pH 値 4.8 および 6.8 の影響も評価しました。
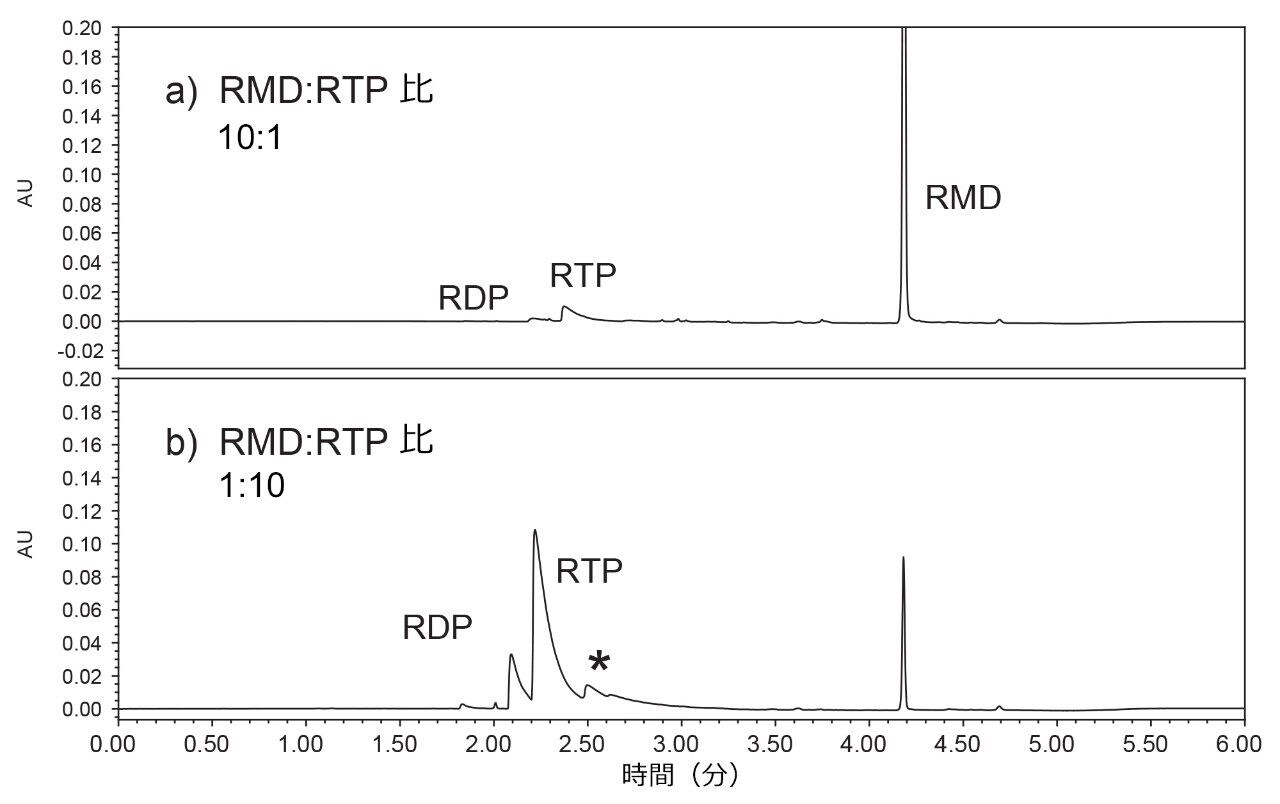
1 より大きく 10 より小さい保持係数を得るために、レムデシビルでは、水系移動相の pH に関係なく、40 ~ 60% のアセトニトリルを使用する必要がありました。より疎水性の高い分析種への適用を考慮して、より高い有機性のエンドポイントを使用しました。レムデシビルのための条件スクリーニングのように、レムデシビルヌクレオシド三リン酸の分析にも 2 つの pH 値を使用しました。ただし、ほとんどの分析を、pH 6.8 を優先的に使用して行いました。高い pH により、pH 4.8 の移動相よりもシャープなピークが得られましたが、二リン酸塩と三リン酸塩の間の分離がわずかに悪くなりました。必要に応じて、移動相の pH を調整して分離を微調整できます。
2 種類の標準試料の比較が図 2 に示されています。上のクロマトグラム(図2a)はレムデシビルヌクレオシド三リン酸の濃度の 10 倍のレムデシビルで構成されるサンプルから得られたものであり、下のクロマトグラム(図 2b)は逆の比率、つまりレムデシビル 1 に対してレムデシビルヌクレオシド三リン酸 10 のサンプルから得られたものです。レムデシビルのカラムにロードした質量は、図 2a では約 0.8 nmol、図 2b では 0.08 nmol であり、これらの値は以前に Gilead Sciences がバイオアナリシス試験に使用していた実験条件に相当します1。
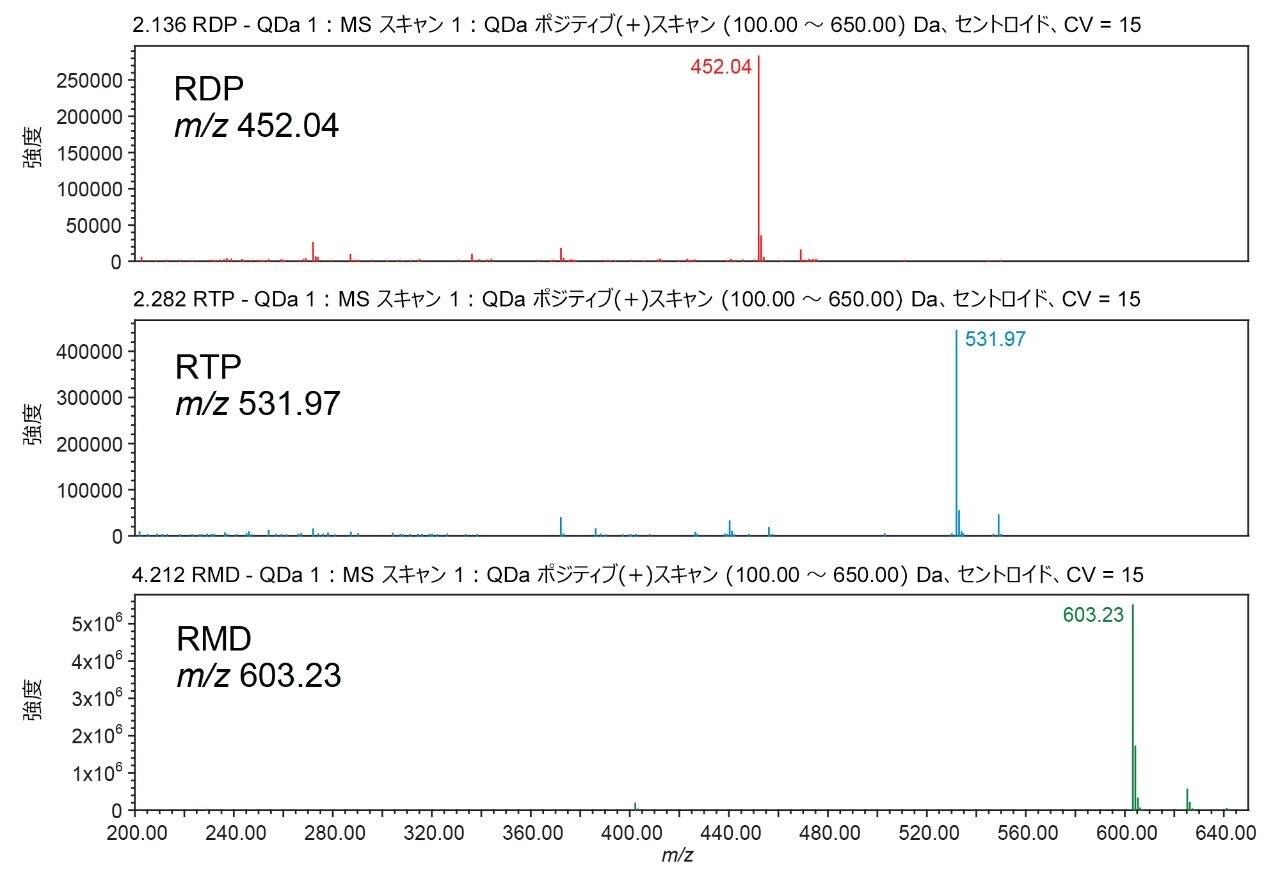
ACQUITY QDa 質量検出器を用いて各分析種の m/z 値を抽出し、ピーク同定を確認しました(図 3)。この最終グラジエントを使用して、レムデシビルヌクレオシド(GS-441524)も分析しました(図 4)。この分析種はグラジエントの初期に溶出し、ヌクレオシド三リン酸に干渉しない一方で、さらなるグラジエント最適化の出発点を提供できます。
Atlantis BEH C18 AX として知られているミックスモード固定相には独自の選択性があり、このため、複数の官能基がある分析種が含まれているサンプルを分析する分析法を考案する出発点と考えました。
このアプリケーションノートでは、pH に対して安定したハイブリッドシリカ表面を利用して、ミックスモードカラムを pH 6.8 で操作しました。この pH は、従来のシリカベースの逆相/ミックスモード固定相で使用すると、劣化を引き起こす可能性があります。Atlantis BEH C18 AX ミックスモード固定相には、C18 基と陰イオン交換基の両方があり、それぞれがクロマトグラフィー分離に寄与できます。pH 6.8 では、陰イオン交換部位はグラジエント内でレムデシビル三リン酸を溶出するように調整され、C18 基がレムデシビルの保持により大きな役割を果たしました。レムデシビル三リン酸の良好な保持、およびレムデシビルからの分離という第一の目標が、これらの条件を用いて達成されました。 オンカラムの注入量を減らすなど、分析法をさらに最適化して、レムデシビル三リン酸のピークの対称性が向上する可能性があります。
イオン対試薬を使用せずに調製した酢酸アンモニウム移動相を分離に使用することで、光学検出および MS 検出のオプションが使用できます。簡単に入手できる MS 認証バッファー濃縮液を使用することで、迅速で簡単な移動相調製が実現しました。
新しい創薬プロジェクトの登場に伴い、分析者は、この分析法を in vitro 細胞試験に適用することに目を向ける可能性があります。同様に、さらなる最適化により、この手法は、生体液から調製したポリメラーゼ阻害薬およびその代謝物の分析に魅力的であることが証明される可能性があります。
720007146JA、2021 年 2 月