开发一种分析宠物食品和植物蛋白所含氨基酸的全新梯度洗脱程序
摘要
AOAC国际官方方法2018.06规定了一种分析婴儿配方奶粉、成人营养品及乳制品中氨基酸的分析程序,该程序使用6-氨基喹啉-N-羟基琥珀酰亚胺基甲酸酯(AQC)进行柱前衍生化,并通过UV检测进行反相超高效液相色谱(UPLC™)分析。羟脯氨酸通常不存在于乳汁、成人营养品或乳制品中,因此不在AOAC方法2018.06的适用范围内。然而,羟脯氨酸是胶原蛋白(动物体内最丰富的蛋白质)的关键成分,常存在于宠物食品中。此外,羟脯氨酸也常被用作植物蛋白污染或掺假的分析标记物。为使AOAC方法2018.06能够适用于宠物食品和植物蛋白分析,我们改良和优化了AOAC方法中指定的梯度洗脱程序,以改善羟脯氨酸和其他氨基酸的保留及分离性能。方法开发中采用了“分析质量源于设计”(aQbD)策略,并利用氨基酸的质谱数据进一步鉴定色谱峰。在优化的梯度洗脱条件下,所有氨基酸均实现了基线分离(分离度≥2),且重复性和稳定性表现优异。方法的灵敏度与线性与原AOAC方法2018.06相当。这种新的梯度洗脱程序已成功应用于六种常见宠物食品和四种植物蛋白的分析,并取得了优异的结果。此改良版AOAC方法为宠物食品和植物蛋白的氨基酸分析提供了一种可行解决方案。
优势
- 优化的梯度洗脱程序实现了相关氨基酸的基线分离,使AOAC方法成功适用于宠物食品与植物蛋白分析
- ACQUITY™ Premier系统和AccQ Tag™ Ultra C18色谱柱可为宠物食品和植物蛋白中的氨基酸分析提供出色的分离度
简介
氨基酸(AA)是人类与动物生长及维持健康所必需的营养物质。此前,我们使用配备二元溶剂管理器和固定定量环样品管理器的ACQUITY Premier系统,成功应用AOAC方法2018.06分析了乳制品中的氨基酸1。 但当我们将该AOAC方法应用于宠物食品中的氨基酸分析时,发现目标氨基酸列表存在缺失。羟脯氨酸(HyPro)是宠物食品中的一种常见氨基酸,其在色谱柱上的保留时间过短,导致无法通过原AOAC方法分析。HyPro是胶原蛋白的关键成分,而胶原蛋白是韧带、肌腱、软骨、皮肤和骨骼等组织中最丰富的蛋白质。它也是动物源性饲料(包括宠物食品)中的常见氨基酸。HyPro常被用作潜在食品掺假的分析标志物(例如通过水解动物产品提高蛋白质含量),同时也是动物源性明胶和胶原蛋白的特征性氨基酸,可用于检测清真(halal)或犹太(kosher)食品中这些关键成分的存在2,3。因此,需要开发一种能够分离并分析羟脯氨酸及其他氨基酸的分析方法。
本研究通过改良AOAC方法2018.06中的梯度洗脱程序,开发了一种新的梯度洗脱程序,以同时分析羟脯氨酸与其他氨基酸。本文详细阐述了方法开发过程及所开发方法的分析性能,采用优化的梯度洗脱条件分析了代表性宠物食品和植物蛋白并进行了结果讨论。
实验
本研究参照AOAC方法2018.06指定的分析程序,但改良了梯度洗脱程序。以下简要介绍了关键的水解和衍生化步骤。
氨基酸校准标准品
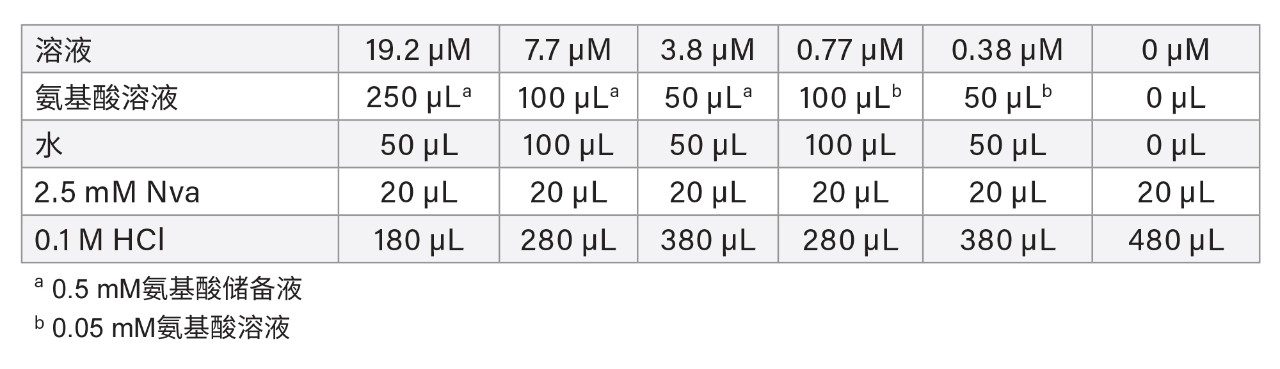
氨基酸细胞培养标准品试剂盒(P/N:186009300)的配制储备液中包含以下氨基酸(除胱氨酸浓度为0.25 mM外,其余均为0.5 mM):丙氨酸(Ala)、精氨酸(Arg)、天冬氨酸(Asp)、胱氨酸(Cys)、谷氨酸(Glu)、甘氨酸(Gly)、组氨酸(His)、异亮氨酸(Ile)、亮氨酸(Leu)、赖氨酸(Lys)、甲硫氨酸(Met)、苯丙氨酸(Phe)、脯氨酸(Pro)、丝氨酸(Ser)、苏氨酸(Thr)、酪氨酸(Tyr)、缬氨酸(Val)、HyPro、牛磺酸(Tau)、天冬酰胺(Asn)、谷氨酰胺(Gln)、鸟氨酸(Orn)、羟赖氨酸(HyLys)、α-氨基丁酸(AABA)、γ-氨基丁酸(GABA)和色氨酸(Trp)。用0.1 M HCl稀释0.5 mM氨基酸储备液,配制0.05 mM氨基酸溶液。使用正缬氨酸(Nva)作为内标(IS)。称取117.16 mg Nva放入100 mL容量瓶中,用0.1 M HCl定容,配制10 mM Nva储备液。用0.1 M HCl稀释10 mM Nva储备液,配制2.5 mM Nva溶液。根据表1配制0~19.2 µM (pmol/µL)氨基酸校准标准溶液和7.7 µM正缬氨酸(Nva)的最终溶液(衍生化后)。
注:由于衍生化试剂体积比例修改,本研究的最终浓度与AOAC方法2018.06中的最终浓度不同。
尽管该溶液中含有Cys,但未用于校准。其校准曲线由单独配制的Cys标准溶液建立(详见后文)。其他氨基酸(如Asn、Gln、AABA、GABA和Trp)主要用于分离度或干扰检查。
Cys校准标准品
称取240 mg Cys(精确至0.01 mg)放入100 mL容量瓶中,用0.05 M NaOH定容,制得Cys储备液(10 mM)。用0.05 M NaOH稀释Cys储备液,配制1 mM Cys溶液。10 mM Cys储备液可在–20 °C下保存至多3个月。每次分析中的1 mM Cys溶液需现配现用。
Cys校准标准品的配制方法如下:分别向10 mL样品瓶中加入0、10、20、50、100和200 µL的10 mM Cys储备液,加水至1100 µL,然后向每个样品瓶中加入600 µL DDP(3,3'-二硫代二丙酸)溶液(1% DDP溶于0.2 M NaOH)、600 µL 0.2 M HCl、200 µL 10 mM Nva储备液和2500 µL苯酚-盐酸溶液(0.1%苯酚溶于12 M HCl)。
注:苯酚–盐酸溶液必须在通风橱内添加。
用氮气流喷射样品瓶至少5秒以置换氧气。旋紧样品瓶的螺口盖,在涡旋混合器中混匀。这些Cys校准标准品在下述条件下水解。衍生化后这些标准溶液的最终浓度分别为0、0.38、0.77、1.9、3.8和7.7 µM。最终Nva (IS)浓度为3.8 µM。
注:胱氨酸和半胱氨酸在酸水解中被DDP转化为S-2-羧乙基硫代半胱氨酸(XCys)4。根据XCys含量计算胱氨酸和半胱氨酸之和。
样品前处理
线上购买了6种宠物食品和4种植物蛋白粉产品,均来自主要品牌。宠物食品包括干狗粮、湿狗粮、干猫粮、干猫零食、湿猫粮和鸡饲料产品。植物蛋白粉产品包括豌豆蛋白、糙米蛋白、南瓜籽蛋白和大豆蛋白粉产品。宠物食品的配制:取5.0 g样品与水混合,制成80 g混合物(质量精确到0.01 g),随后使用搅拌机充分均质化。植物蛋白粉的配制:取1.0 g粉末与水混合,制成40 g混合物(质量精确到0.01 g)。然后,称取800±20 mg均质化的样品-水混合物(宠物食品或植物蛋白)装入10 mL带螺旋盖的玻璃瓶容器(质量精确到0.01 mg)。向各容器中加入600 µL DDP溶液(1% DDP溶于0.2 M NaOH)、600 µL 0.2 M HCl、500 µL 10 mM Nva储备液和2500 µL苯酚–盐酸溶液(0.1%苯酚溶于12 M HCl)。最终溶液(衍生化后)中的最终Nva (IS)浓度为7.7 µM。
酸水解(仅适用于样品和Cys标准品,不适用于氨基酸标准品)
将装有样品溶液或Cys校准溶液的容器置于110 ± 2 °C的恒温箱中,加热24 ± 0.5 h。
或者,使用微波水解装置(Discover Prep,CEM Corp,北卡罗来纳州)水解样品。使用35 mL硼硅酸盐玻璃压力容器(额定压力高达300 psi)(CEM P/N: 909036)和硅胶盖(CEM P/N: 909350)。使用涂覆有Teflon涂层的微型搅拌棒(CEM P/N: 162810)进行搅拌。酸水解步骤参数如下:动态控制,最大功率设置为300 W;温度设定为160 °C,持续20 min;压力限值设置为300 psi;搅拌级别设置为“高”;冷却过程中吹入氮气。这种微波辅助水解不属于AOAC方法2018.06的范畴,但被用作替代水解方法。
中和与稀释(样品和Cys标准品)
酸水解完成后,等待水解产物冷却。然后,取每种水解产物0.2 mL,转移至1.5 mL微量离心管中,加入0.2 mL 6 M NaOH和1.6 mL 0.1 M HCl。将混合物充分混匀,然后使用0.45 µm PVDF膜式过滤器将混合液过滤到另一个1.5 mL微量离心管中。
衍生化(样品、Cys标准品和氨基酸标准品)
参照AOAC方法2018.06衍生化程序或AccQ Tag Ultra衍生化试剂盒(P/N:186003836)维护和使用手册中的步骤配制AccQ Tag Ultra衍生化试剂5。然后采用以下体积的试剂对氨基酸校准标准品、中和样品溶液和中和Cys标准品进行衍生化:100 µL AccQ Tag Ultra 硼酸盐缓冲液(AccQ Tag Ultra衍生化试剂盒中的试剂1)、10 µL校准标准溶液/中和样品溶液/中和Cys标准溶液,以及20 µL复溶的AccQ Tag Ultra试剂。
液相色谱条件
|
系统: |
ACQUITY Premier系统,包含一台二元溶剂管理器、一台固定定量环样品管理器、一个带主动预加热器的柱温箱(CH-A),以及一台光电二极管阵列(PDA) eλ检测器。 |
|
UV/Vis波长: |
260 nm |
|
连接检测器的入口管路: |
内径0.004 mm,长10.5英寸的管路组件(P/N:430001784) |
|
软件: |
Empower™ 3色谱数据软件(CDS) |
|
色谱柱: |
ACQUITY UPLC BEH™ C18色谱柱, 1.7 µm, 2.1 mm × 150 mm(P/N:186002353)或 AccQ Tag Ultra C18色谱柱, 1.7 µm, 2.1 mm × 150 mm(P/N:186009954) (注:AccQ Tag Ultra C18色谱柱是专门针对氨基酸分析进行了QC检查的ACQUITY UPLC BEH C18色谱柱)。 |
|
色谱柱在线过滤器: |
ACQUITY 0.2 µm色谱柱在线过滤器(P/N:205000343) |
|
采集速率: |
10 Hz |
|
柱温: |
50 °C |
|
样品温度: |
20 °C |
|
样品定量环大小: |
1 µL |
|
进样体积: |
1 µL |
|
进样模式: |
带针溢出的部分定量环(PLNO),6倍溢出体积 |
|
流动相A: |
AccQ∙Tag Ultra洗脱液A浓缩液(P/N:186003838)与水的1:19 (v/v)混合溶液 (注:使用50 mL A型容量瓶移取50 mL AccQ∙Tag Ultra洗脱液A浓缩液,并与950 mL水混合)。 |
|
流动相B: |
AccQ∙Tag洗脱液B(P/N:186003839) |
|
弱洗针液: |
95:5 (v/v)水:乙腈 |
|
强洗针液: |
5:95 (v/v)水:乙腈 |
|
密封清洗溶剂: |
50:50 (v/v)水:乙腈 |
|
流速: |
0.4 mL/min |
|
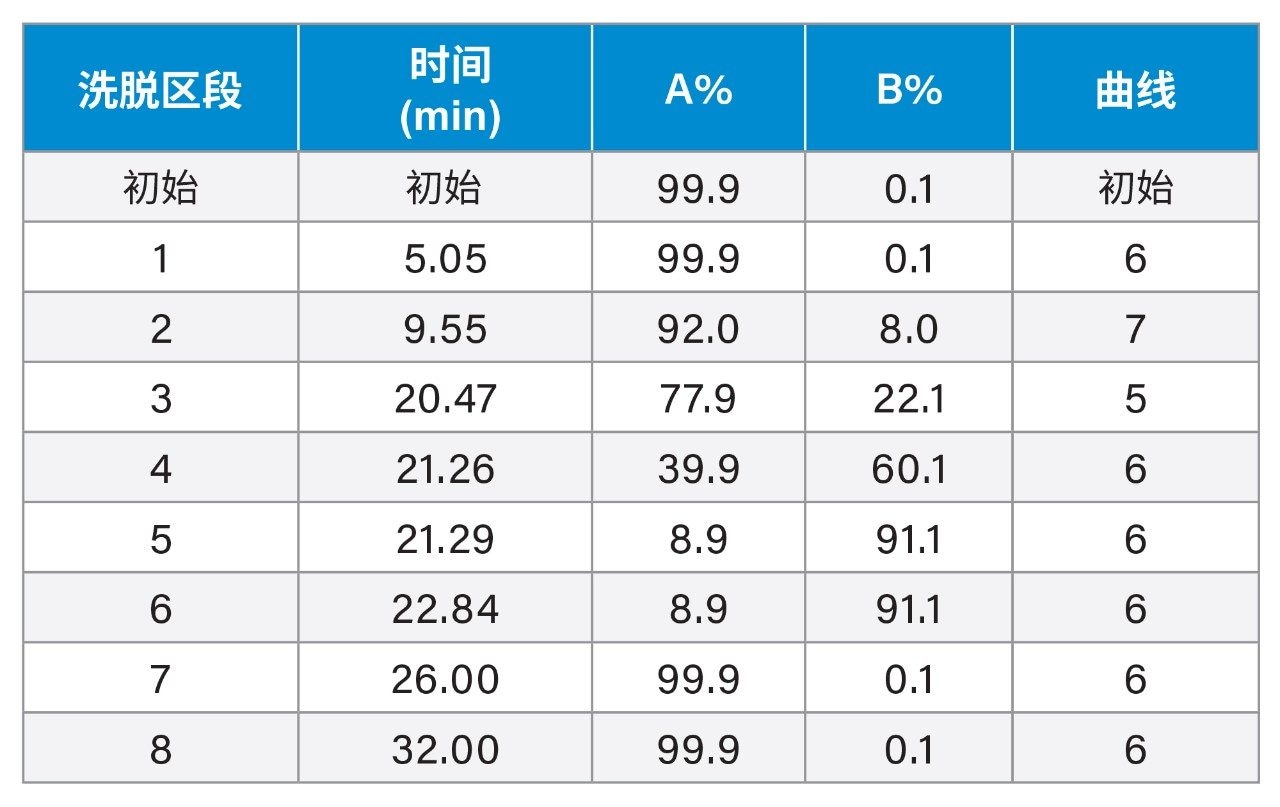
梯度洗脱: |
(请参阅下面的梯度表) |
梯度表
质谱条件
|
质谱系统: |
ACQUITY QDa™质谱检测器(Performance) |
|
毛细管电压: |
0.8 kV |
|
离子极性: |
正离子 |
|
探头温度: |
600 °C |
|
采集速率: |
10点/秒 |
|
增益: |
1 |
|
MS扫描: |
100 Da~600 Da(连续形式) |
|
锥孔电压: |
10 V |
校准
将每种氨基酸校准标准品的响应值及其浓度(用µM表示)作图,建立氨基酸的校准曲线。响应值通过峰面积比(氨基酸分析物与内标)乘以内标浓度(通常为7.7 µM)计算得出。校准曲线(一阶多项式)通过对图中校准数据点进行线性回归(强制通过原点)获得。
定量限
定量限(LOQ)基于响应值的标准偏差和校准曲线的斜率进行估算,其计算方法是将0.39 µM浓度下氨基酸响应值(n=4,不同色谱柱)的标准偏差乘以10,再除以每种氨基酸的校准曲线斜率。
氨基酸谱的计算
将分析中测得的各氨基酸浓度(以微摩尔(µM)表示)乘以其分子量,转换为质量浓度(μg/L)。然后将各质量浓度相加得到总氨基酸质量浓度,再以总氨基酸浓度的质量百分比形式计算各氨基酸的相对浓度。由于Trp未通过此方法测定,其含量在总氨基酸含量的计算中未予包含。
使用“实验设计”进行方法开发
使用实验设计(DoE)软件Fusion QbD®(S-Matrix Corp.,美国加利福尼亚州尤里卡)优化梯度洗脱参数。为了找到分离氨基酸的最佳条件,我们研究了梯度洗脱程序中的关键变量,即初始等度保持时间(梯度表中的区段1)和第一个梯度时间(梯度表中的区段2)。实验目标为尽可能提高三对关键分析物的分离度:色谱图先洗脱区的Ser/Arg、中间区的Asp/MetSO2(甲硫氨酸砜)以及后洗脱区的XCys/Met。采用Fusion QbD软件创建基于中心复合面设计的实验(或样品队列),然后导出至Empower CDS进行分析。在Empower CDS中运行完样品队列并处理好色谱数据后,使用Fusion QbD软件检索结果用于建模和分析。在可接受性能区域(分离度≥2.0)内,采用一组更广泛的性能评估标准,包括保留时间(RT)及所有相关AA的分离度,进一步评估了三组不同的色谱条件。确定理想色谱条件后,还使用Fusion QbD软件评估了分离的稳定性。针对仪器设备、操作人员及实验室间可能存在的差异,对前三大色谱条件(或因素)(例如柱温、流速及流动相A组成)通过全因子设计进行了两水平考察(围绕目标水平上下限)。本研究评估了这些变化(与目标水平的偏差)对氨基酸分离的影响,以评价方法的稳定性。
结果与讨论
方法开发
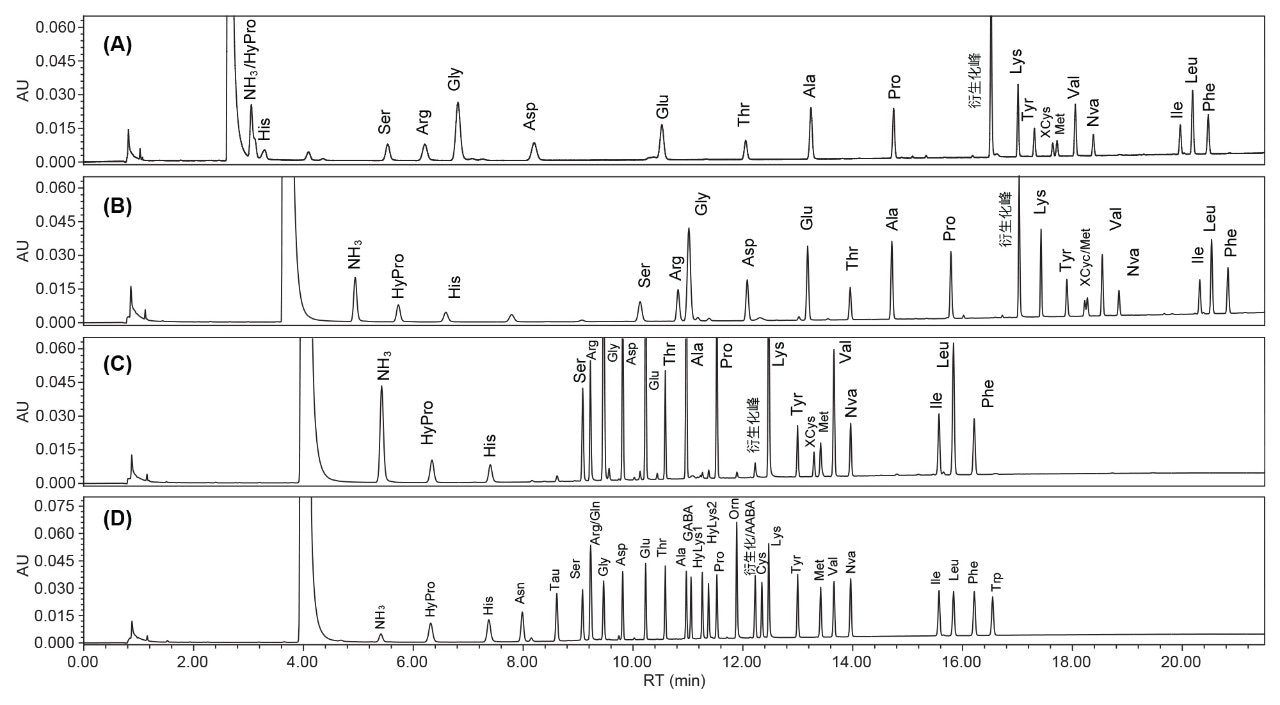
AOAC方法2018.06不能直接应用于宠物食品分析,因为在该方法指定的梯度洗脱程序下,HyPro会与铵盐(NH3)共洗脱(图1A)。沃特世的氨基酸分析解决方案提供了一种分析蛋白质水解产物、食品和饲料的方法,使HyPro得以保留并与NH3峰分离6。然而,在将该沃特世方法(已经过色谱柱尺寸和流速调整)用于实际分析时,发现XCys与Met峰存在部分共洗脱(图1B)。为此,研究开展了方法开发工作,以提高XCys/Met和HyPro/NH3的分离度。通过实验发现,洗脱区段3的梯度曲线5(见实验部分的梯度表)有助于提高XCys与Met的分离度。随后,使用DoE方法微调梯度洗脱参数,使所有氨基酸均获得理想分离效果(有关DoE的详细信息,请参阅实验部分)。图1C显示了在最终优化的梯度洗脱条件下,一种宠物食品中氨基酸的色谱图,XCys与Met实现了基线分离。图1D显示了在最终优化的梯度洗脱条件下获得的氨基酸标准品色谱图。
方法专属性
从图1D可以看出,除Gln与Arg共洗脱外,其余所有氨基酸均实现了基线分离(分离度≥2.0)。Gln与Arg共洗脱并非严重问题,因为Gln会在酸水解过程中转化为Glu。GABA和AABA均属于非蛋白氨基酸,对食品中的蛋白质含量没有影响,本研究用其评估方法专属性。AABA虽与衍生化峰共洗脱,但未对其他氨基酸产生干扰。GABA与其临近的Ala实现了基线分离。除这些氨基酸外,还测试了磺基丙氨酸和MetSO2(数据未显示),均与其他氨基酸实现了基线分离。
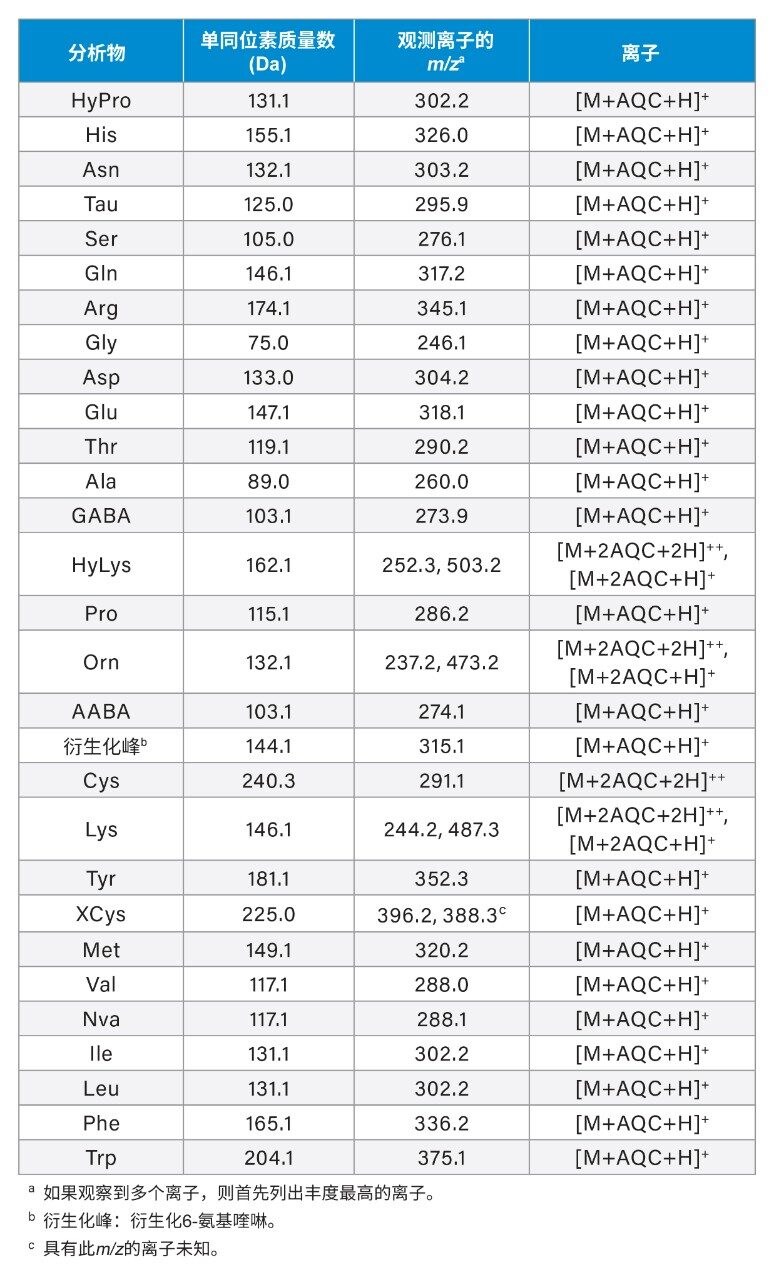
峰鉴定
根据洗脱顺序以及通过ACQUITY QDa质谱检测器获得的确认性质谱数据进行峰鉴定。采用沃特世UPLC氨基酸分析解决方案(针对食品和饲料)中提供的氨基酸洗脱顺序作为参考,因为其色谱条件与优化后的新方法无显著差异6。 通过在最终的理想色谱条件下获得的质谱数据验证了确切的峰鉴定结果。表2显示了单同位素质量数、实测m/z比以及氨基酸的正电荷离子。部分氨基酸(如HyLys、Orn、Cys和Lys)会与两分子衍生化试剂(AQC)发生反应,这些衍生化氨基酸形成的双电荷离子是MS中丰度最高的离子,单电荷离子的丰度较低。对于XCys,观察到两个峰强度相近的离子(m/z 396.2和388.3)。388.3 m/z离子的结构仍然未知。
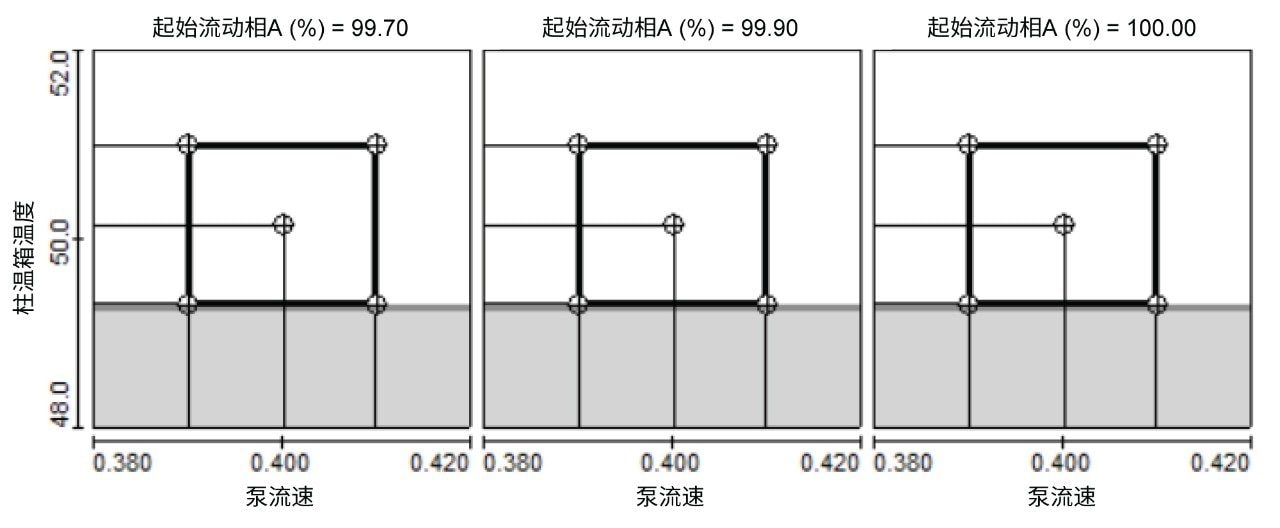
方法稳定性
使用DoE方法评估了最终条件下氨基酸分离的稳定性。针对仪器设备、操作人员及实验室间可能存在的差异,对三个变量(例如柱温、流速及流动相A组成)通过全因子设计进行了两水平考察(围绕目标水平上下限)。图2显示了关键分析物对分离度大于2.0的安全操作区域,其范围为柱温49.3~51.0°C、流速0.390~0.410 mL/min、起始流动相A占比99.7%~100%(图2)。结果表明,尽管色谱条件存在相对较小的变化,但分离过程具有高度可靠性。
分析性能
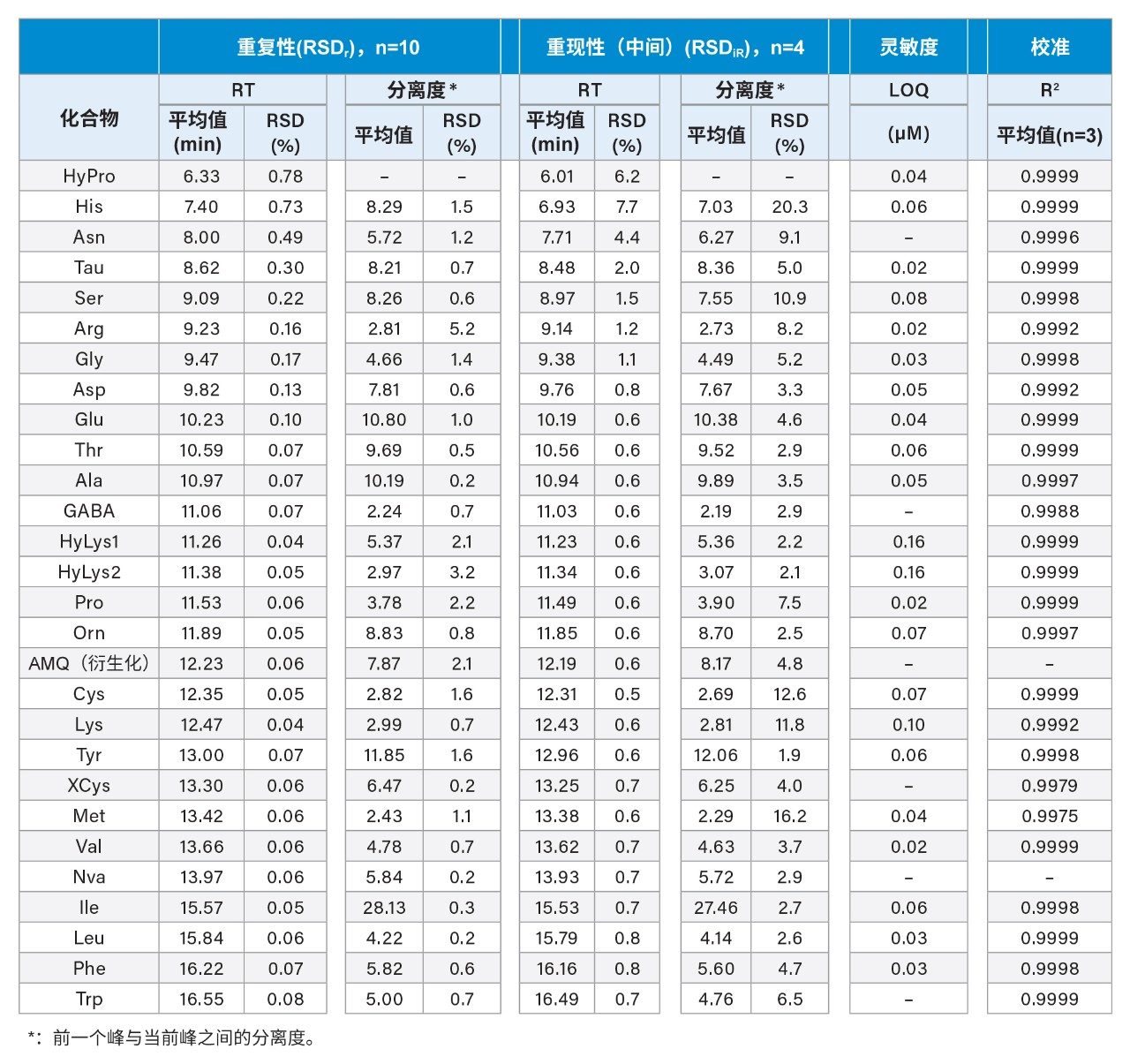
表3列出了保留时间和分离度的重复性(相对标准偏差或RSDr)和中间重现性(RSDiR)。重复性数据基于同一天使用同一色谱柱对标准溶液的多次进样(n=10);中间重现性数据则基于几日使用不同色谱柱对标准溶液的多次进样,使用不同批次的ACQUITY UPLC BEH C18色谱柱和AccQ Tag Ultra C18色谱柱。结果显示,先洗脱氨基酸(例如HyPro、His、Asn、Tau、Ser、Arg和Asp)与后洗脱氨基酸相比RT变化更大。先洗脱氨基酸的RT RSDr范围为0.13%~0.78%,而后洗脱氨基酸的RT RSDr均低于0.1%。先洗脱氨基酸的RT RSDiR(中间重现性)范围为0.8%~7.7%,而后洗脱氨基酸则低于0.8%。在同一色谱柱和不同色谱柱上获得的氨基酸分离度分别大于2.24 (Ala/GABA)和2.19 (Ala/GABA)。这些结果证明该方法在分离氨基酸方面具有高分离度和高可靠性。表3还列出了LOQ和确定系数(R2)。LOQ范围为0.02~0.10 µM,所有氨基酸的R2值均≥0.9975。这些LOQ及线性结果与前期研究中AOAC方法2018.06的性能相当1。
宠物食品与植物蛋白分析
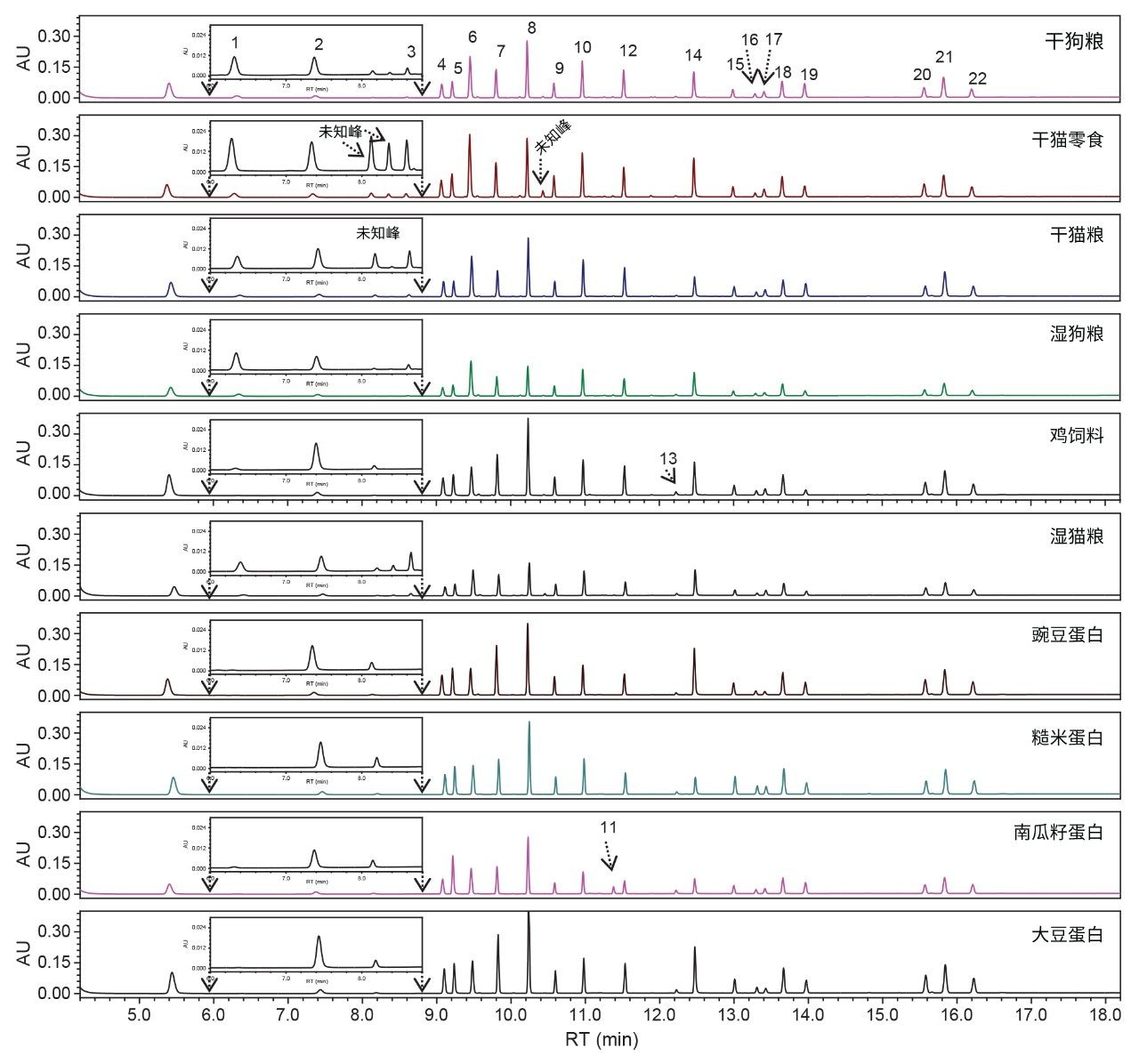
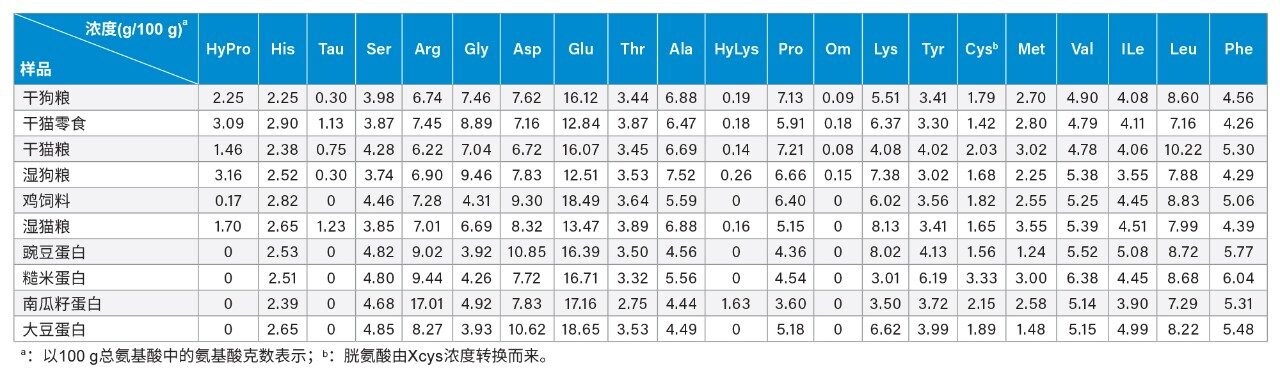
本研究使用所开发的梯度洗脱条件分析了六种宠物食品和四种植物蛋白。这些样品中的所有氨基酸均成功实现了基线分离,分离度≥2(图3)。基于在样品前后进样的标准品的RT进行了峰分配。在干猫零食和干猫粮中检测到少量未知峰(相对峰面积约为总峰面积的1±0.5%,图3),需进一步鉴定这些未知峰。其他相对峰面积小于总峰面积0.5%的次要峰未作分析。这些样品的氨基酸谱见表4。表4显示,HyPro、Tau和Hylys仅存在于宠物食品中,但在鸡饲料中未检出Tau和Hylys,在南瓜籽蛋白中检出了HyLys。由于HyPro和HyLys是胶原蛋白(动物体内最丰富的蛋白质)中的常见氨基酸,其存在于宠物食品中符合预期。但在南瓜籽蛋白中检出HyLys出乎意料,因其并非南瓜籽蛋白中天然存在的氨基酸。南瓜籽蛋白中HyLys的来源尚不明确,污染可能是潜在原因。
结论
本研究对AOAC方法2018.06的梯度洗脱程序进行了改良和优化,用于分析宠物食品和植物蛋白中的氨基酸。所有氨基酸均实现了出色的分离度,且保留时间的重复性和中间重现性良好。方法灵敏度(LOQ)和线性与AOAC方法2018.06相当。此版改良方法已成功应用于六种宠物食品和四种常见植物蛋白的分析。这种经过改良的AOAC方法为分析宠物食品和植物蛋白中的氨基酸提供了可靠且实用的解决方案。
参考资料
- Yang, J., Liu, B., Rainville, P.D., and Harden, S. UPLC-UV Analysis of Amino Acids in Dairy Products – Implementing an International Standard on the ACQUITY Premier System.Application Note 720008632, Waters Corporation, Milford, MA, 2024.
- Dong, Y.-L., Yan, N., Li, X., Zhou, X.-M., Zhou, L., Zhang, H.-J., & Chen, X.-G. Rapid and Sensitive Determination of Hydroxyproline in Dairy Products Using Micellar Electrokinetic Chromatography With Laser-Induced Fluorescence Detection.Journal of Chromatography A 2012, 1233, 156–160.doi:10.1016/j.chroma.2012.02.030.
- Yuswan, M.H., Jalil, N.H.A., Mohamad, H., Keso, S., Mohamad, N.A., Yusoff, T.S.T.Md., Ismail, N.F., Manaf, Y.N.A., Hashim, A.M., Desa, M.N.M., Yusof, Y.A., & Mustafa, S. (2020) Food Chemistry 2020, 337,127762.doi:10.1016/j.foodchem.2020.127762.
- Cohen, S.A. and Michaud, D.P. (1993) Synthesis of a Fluorescent Derivatizing Reagent, 6-Aminoquinolyl-N-Hydroxysuccinimidyl Carbamate, and its Application for the Analysis of Hydrolysate Amino Acids Via High-Performance Liquid Chromatography.Analytical Biochemistry, 211, 279–287.
- AccQ Tag Ultra Derivatization Kit Care and Use Manual.Waters Corporation.715001331 Rev. A, 2024.
- UPLC Amino Acid Analysis Solution System Guide.Waters Corporation. 71500129702 Revision B, 2007.
720008700ZH,2025年2月