迅速な重要品質特性モニタリングのための ACQUITY QDa 検出器を用いたモノクローナル抗体サブユニットのプロセスモニタリング
要約
この研究では、タンパク質ベースの医薬品のサブユニット分析における確実な質量測定に ACQUITY QDa 検出器を適用できることを実証します。サブユニットデータのルーチンモニタリングにより、製造工程のばらつきを適時に検出でき、バッチ間の一貫性のスクリーニングに使用することができます。
アプリケーションのメリット
- MassLynx ソフトウェアの MaxEnt デコンボリューションアルゴリズムを使用したサブユニット分析の補完的な質量データ
- サブユニットデータのルーチンモニタリングによる製造プロセスのばらつきの適時検出によるさらなるコスト削減
- バッチ間一貫性を迅速にスクリーニングするためのサブユニットグリコフォームのプロファイリング
はじめに
タンパク質ベースのバイオ医薬品は成長を続ける医薬品を代表する存在となっています。その製造は複雑なプロセスであることから、品質と安全性を確保するために、開発および製造プロセス全体で重要品質特性(CQA)をモニタリングするのにさまざまな検査が必要となります。一部の市販の組換えモノクローナル抗体(mAb)では、ガラクトシル化が細胞毒性に関連付けられているため、タンパク質のグリコシル化の試験が重要品質特性になっています1。分析法には、蛍光ベースおよび MS ベースの遊離・標識手法や、個々の糖鎖または糖ペプチドをモニターする「ボトムアップ」アプローチが含まれる場合があります。あるいは、モノクローナル抗体サブユニットの主要なグリコフォームを評価するために、「ミドルダウン」アプローチを適用することも可能です。ミドルダウン・アプローチは、製造環境で特に重要であり、グリコシル化パターンの変化を特定し、適時かつ費用対効果の高い方法でこれを報告し修正するために理想的と言えます。
ACQUITY QDa 検出器は費用対効果の高いツールとして確立されており、直交的な検出手法として使用した場合、既存の LC ワークフロー内でマススペクトルデータが得られます。本アプリケーションノートは ACQUITY QDa 検出器のサブユニット分析への適用性評価を対象にしています。IgG1 であるトラスツズマブは、ジチオスレイトール(DTT)を用いて部分還元し、約 25 kDa の軽鎖および約 50 kDa の重鎖の各フラグメントを生成することができます(図 1A)。MassLynx ソフトウェアを使用してデータを取り込むことにより、MaxEnt1 デコンボリューションアルゴリズムを介して複雑なスペクトルを解釈し、各サブユニットの分子量を決定しました。さらに IdeS 消化および還元によって、いずれも約 25 kDa の 3 つのフラグメントが生成されました(図 1B)。IdeS 消化は、抗体のヒンジ領域中の単一部位を特異的かつ効率的に切断するため、治療用モノクローナル抗体に広く使用される特性解析ツールになっています。この例では、主要なグリコフォームをモニタリングするための代替手段として使用しています。
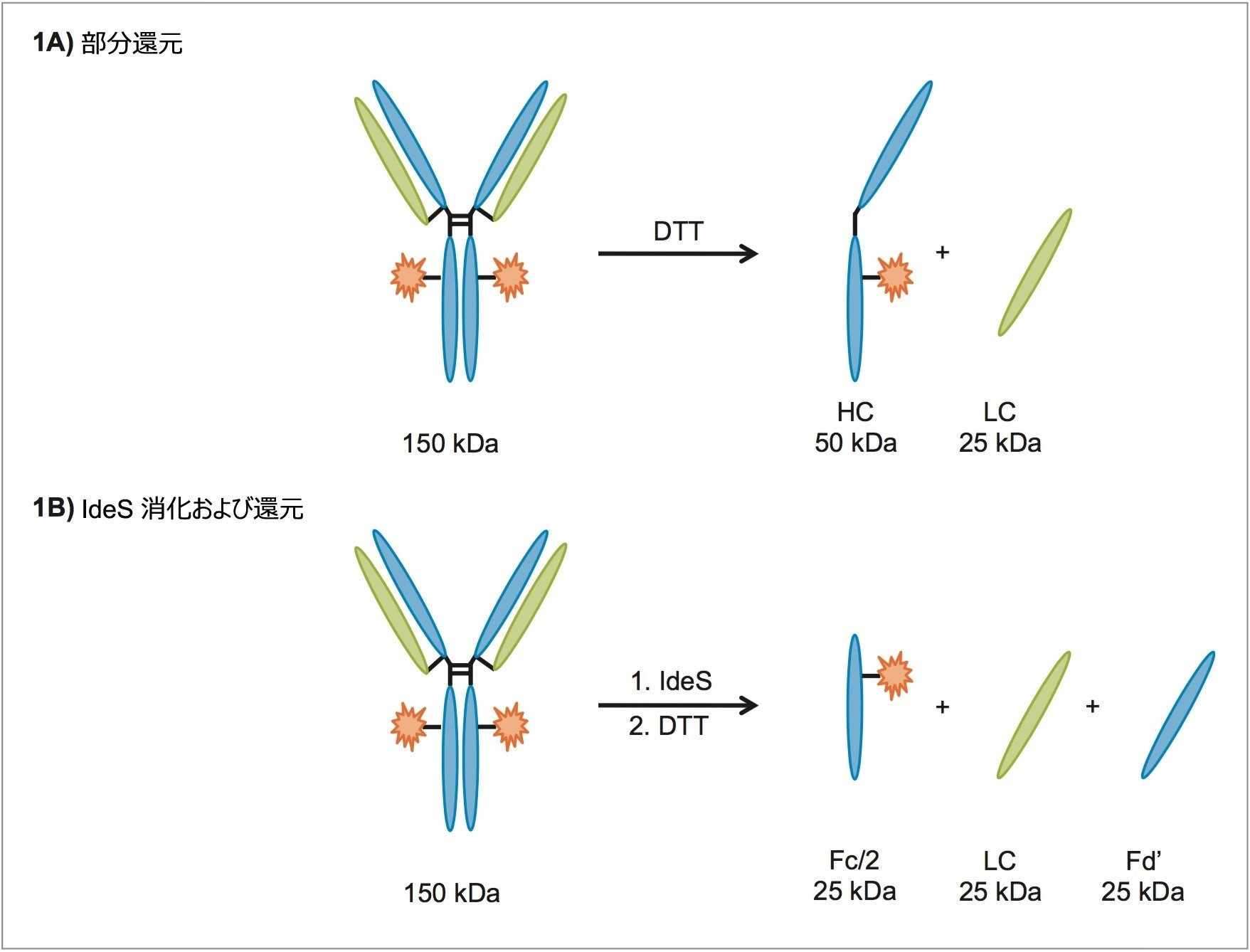
実験方法
LC 条件
|
LC システム: |
ACQUITY UPLC H-Class システム* |
|
吸収波長: |
214 nm |
|
サンプリングレート: |
5 Hz |
|
カラム: |
ACQUITY UPLC Protein BEH C4、1.7 μm、2.1 mm × 50 mm(製品番号:186004495) |
|
カラム温度: |
80 ℃ |
|
移動相 A: |
0.1%(v/v)ギ酸水溶液 |
|
移動相 B: |
0.1%(v/v)ギ酸含有アセトニトリル |
|
サンプル温度: |
10 ℃ |
|
注入量: |
3 µL |
ACQUITY Premier システムを用いることで、より良好な分離が得られます
グラジエント:
|
時間(分) |
流速(mL/分) |
%A |
%B |
%C |
%D |
|
初期条件 |
0.4 |
95 |
5 |
0 |
0 |
|
15 |
0.4 |
40 |
60 |
0 |
0 |
|
20 |
0.4 |
20 |
80 |
0 |
0 |
|
23 |
0.4 |
20 |
80 |
0 |
0 |
|
27 |
0.4 |
95 |
5 |
0 |
0 |
|
30 |
0.4 |
95 |
5 |
0 |
0 |
QDa 設定
|
サンプリングレート: |
5 Hz |
|
質量範囲: |
350 ~ 1250 Da |
|
イオン化モード: |
ESI+、コンティナム |
|
コーン電圧: |
15 V |
|
キャピラリー電圧: |
1.5 kV |
|
プローブ温度: |
600 ℃ |
データ管理
MaxEnt1 が含まれる MassLynx v. 4.1 ソフトウェア
トラスツズマブの部分的還元:
21 mg/mL トラスツズマブの 10 µL アリコートに 190 µL の 25 mM Tris-HCl(pH 7.5)を添加し、タンパク質濃度をほぼ 1 mg/mL にしました。濃縮 DTT をサンプルに添加し、最終 DTT 濃度が 1.0 mM の溶液としました。次にサンプルを 37 ℃ で 20 分間インキュベートしました。3% アセトニトリル、0.1% ギ酸水溶液を等量添加し、最終タンパク質濃度 0.5 mg/mL の溶液を調製しました。この調製は長期保存を想定したものではないため、サンプルを即座に注入しました。
トラスツズマブの IdeS 消化および還元:
25 mM Tris バッファー中の 1 mg/mL トラスツズマブサンプルを、IdeS プロテアーゼ(FabRICATOR。Genovis、マサチューセッツ州ケンブリッジ)と 37 ℃ で 30 分間インキュベートしました。濃縮 DTT を IdeS 消化サンプルに添加し、最終 DTT 濃度 1.0mM の溶液としました。得られたサンプルを 37 ℃ で 20 分間インキュベートしました。注入前に、サンプルと 3% アセトニトリル/0.1% ギ酸水溶液を等量含む溶液を調製し、推定最終タンパク質濃度を 0.5 mg/mL にしました。
結果および考察
トラスツズマブの軽鎖と重鎖のデータを得るために、前述したように抗体を部分的に還元しました。UV クロマトグラムを図 2A に示します。各フラグメントの質量を決定するために、MassLynx ソフトウェアの MaxEnt1 アルゴリズムを使用してデコンボリューションを行い、ゼロチャージ状態の質量を計算しました。ユニフォームガウスモデルを使用し、MaxEnt1 分解能を 0.5 Da/チャンネル、ピーク幅を 0.7 Da に設定しました。スペクトルは対象ピークの中央からベースラインまでを積算しました。データの重複処理を防ぐため、最大反復回数は 20 回としました。図 2B、2C には、軽鎖、重鎖のサブユニットのデコンボリューションスペクトルがそれぞれ示されています。軽鎖のデコンボリューションが荷電エンベロープを単一ピークに収束しているのに対し、重鎖のデコンボリューションでは 4 つの主要なグリコフォームを同定しました。
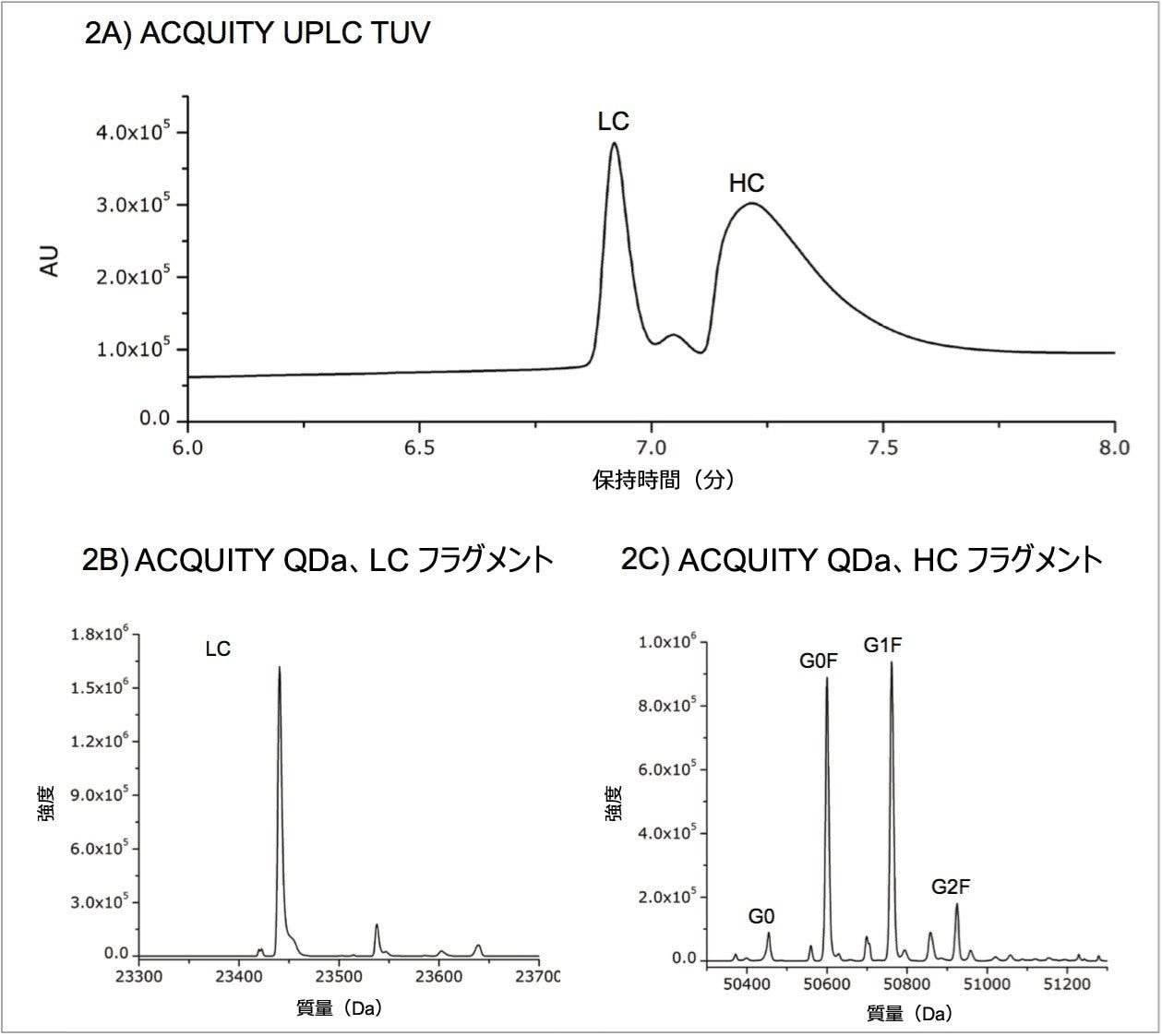
ACQUITY QDa 検出器の質量範囲は m/z 30 ~ 1250 であるため、軽鎖と重鎖ともにこの低チャージ状態はこの検出ウィンドウから外れます。図 3 では、軽鎖の ACQUITY QDa データに広範なスキャン範囲を持つ高分解能 MS のシミュレーション荷電エンベロープを重ね描きしています。この重ね描きから、ACQUITY QDa データは高分解能装置で測定可能な荷電エンベロープの一部分にしか対応していないことが分かります。このことが質量測定に及ぼす影響を評価するために、MaxEnt1 から計算された軽鎖と重鎖の結果を実測質量として表 1 に記載し、理論的な平均分子量と比較しました。
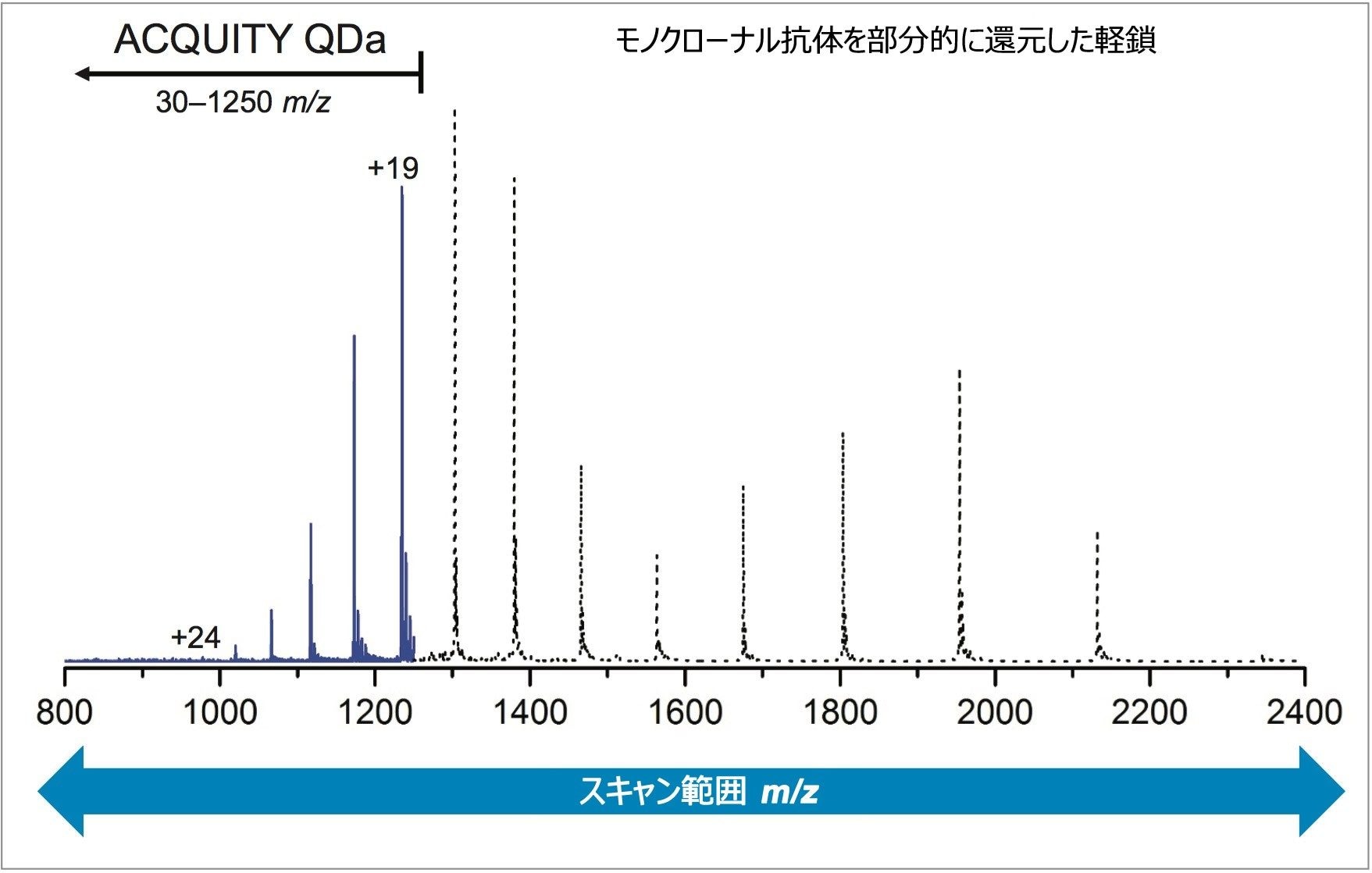
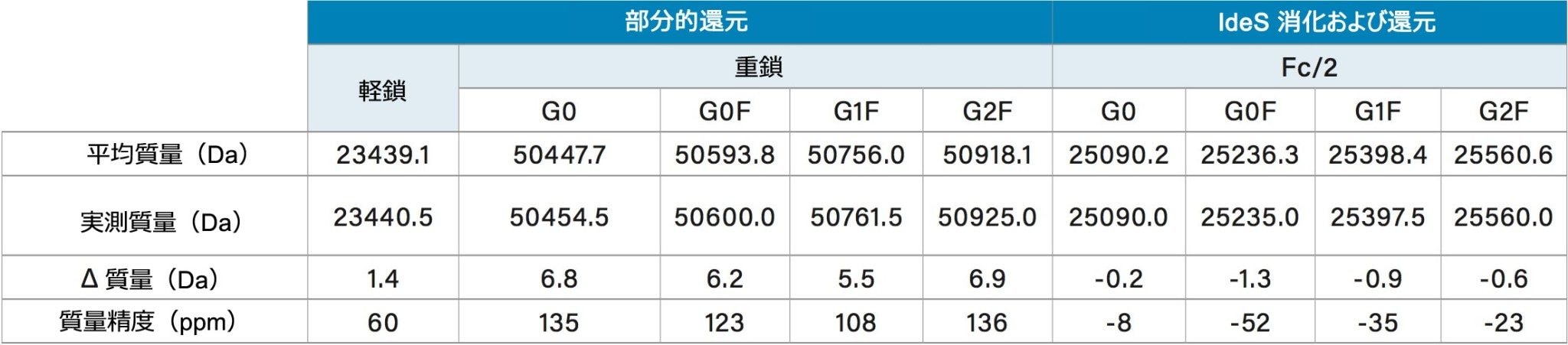
装置の質量誤差の影響は電荷状態に比例しており、高い電荷状態ほど誤差が大きくなります。例えば、+19 から +50 までの電荷状態を検討してみましょう。この範囲は、ACQUITY QDa 検出器によって取得した軽鎖および重鎖の両方で検出された荷電エンベロープを網羅しています。このような電荷状態の範囲での装置の質量誤差は ±3.8 Da から ±10 Da(±0.2 × 電荷状態)まででした。トラスツズマブの軽鎖(電荷状態が +19 ~ +24)を検討したところ、質量精度の予測値は 150 ppm ~ 200 ppm の範囲でした。報告された軽鎖の実測質量精度は 60 ppm であること(表 1)から、この値は装置の予測範囲内に問題なく収まっていることになります。同様に、重鎖の質量精度は 150 から 200 ppm までの範囲内に収まると考えられ、すべてのフラグメントが同様の基準を満たしています(表 1)。
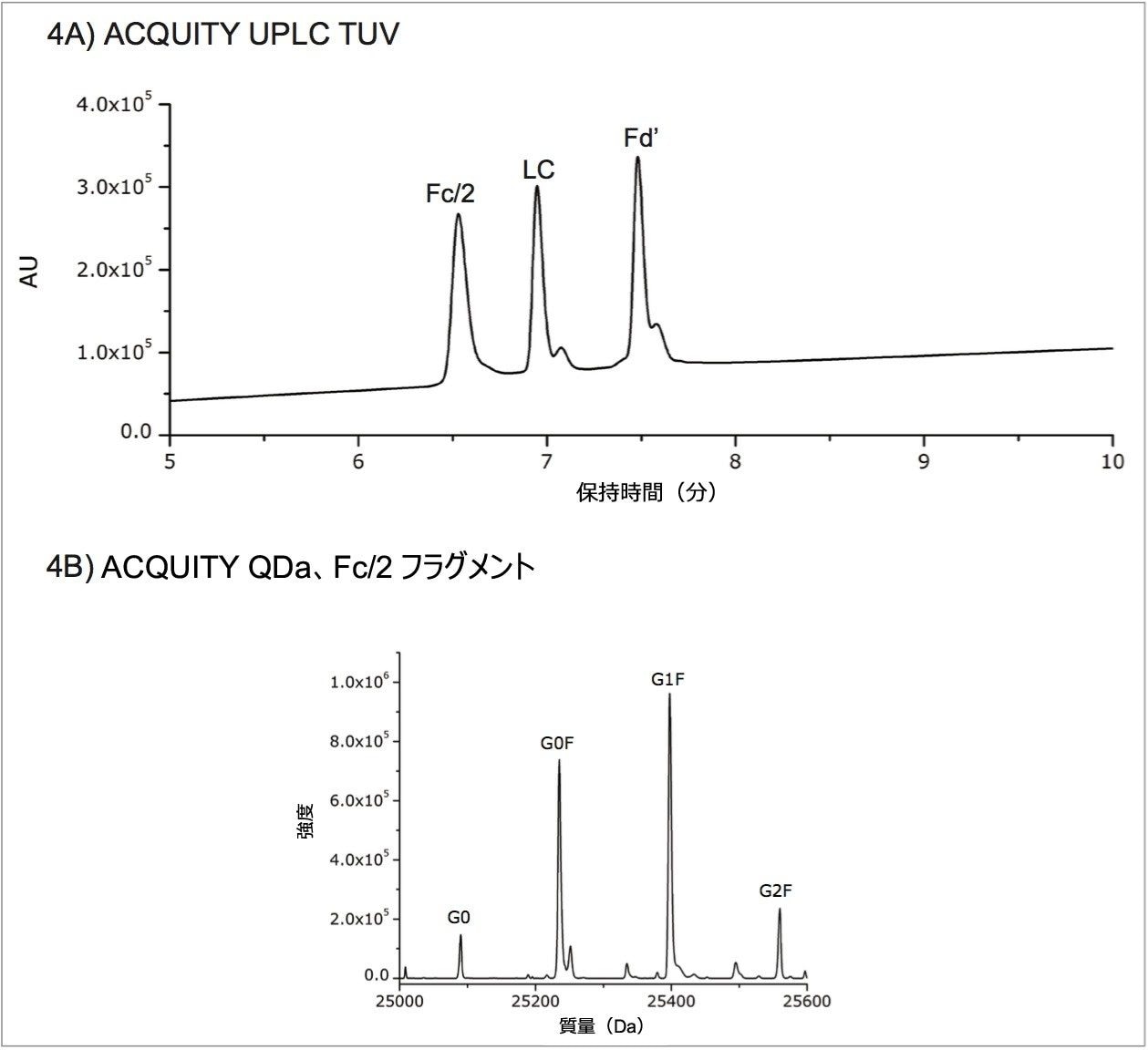
ACQUITY QDa 検出器のサブユニット分析への適用性をさらに評価するために、一般的に使われている IdeS 酵素を使用してサブユニットフラグメントを生成する第 2 の方法を試みました。IdeS 消化および還元を行うことで Fc/2、LC、Fd' からなる 3 つの約 25 kDa のフラグメントが生成しました。図 4A は、IdeS で消化・還元したトラスツズマブのクロマトグラムで、3 つのフラグメントがそれぞれ明確に分離されています。図 4B は、グリコシル化部位を含む Fc/2 フラグメントのデコンボリューション質量データで、重鎖データからこれまでに同定された 4 つの主要なグリコフォームが同様に示されています。表 1 は Fc/2 フラグメントのグリコフォームの質量精度を記載しており、これらも装置の予測質量精度範囲内に入っています。IdeS 消化および還元でも、部分還元と同じように、目的の製品の確認ができ、製造工程のばらつきをより容易に判定することができます。
結論
本実験により、ACQUITY QDa 検出器が、2 つの異なる方法でサブユニットレベルで信頼できる質量測定に使用可能であることが実証されました。トラスツズマブを部分的に還元し、装置で予測される質量精度限度内に十分に収まる分子量である軽鎖と重鎖の各フラグメントを取得しました。IdeS 消化および還元を用いて、抗体のより価数の低く分子量の小さなサブユニットフラグメントを取得しました。IdeS 消化および還元から得た約 50 kDa の重鎖フラグメントおよび約 25 kDa の Fc/2 フラグメント上の主要なグリコフォームをモニタリングすることにより、得られた結果を 2 つの方法間で比較しました。どちらの方法でも ACQUITY QDa 検出器を有効に利用することで、サブユニットデータの迅速かつ効果的な収集を実現しており、最終的に製品の一貫性と同一性を検証するスクリーニングプロトコル中で使用可能であることが示されました。
参考文献
- Raju T.S. and Jordan R.E. Galactosylation variations in marketed therapeutic antibodies. mAbs. 2012.4(3):385–391.
720005707JA、2024 年 3 月