Sartorius Ambr®15 マイクロバイオリアクターを用いたアップストリームプロセス開発の加速のための LC-MS によるアミノ酸および二重特異性抗体ホモダイマーのモニタリング
要約
このアプリケーションノートでは、間違ったペアリングをした二重特異性抗体(BsAb)ホモダイマーのモニタリングを特異的にターゲットとした、アップストリーム開発におけるアットラインプロセス分析テクノロジー(PAT)のための BioAccord™ LC-MS システムの使用について説明します。培地、温度のダウンシフト、供給戦略を含む一連の細胞培養条件を、実験計画法(DoE)のアプローチを用いて検討しました。実験は Sartorius Ambr®15 ハイスループットマイクロバイオリアクターシステムで進め、サンプルを異なる日に採取して、アミノ酸定量およびインタクト質量分析を行いました。waters_connect™ プラットホームにより、迅速で効率的なワークフローが実現し、サンプル分析が合理化されることで、プロセス開発が迅速になり、細胞培養に対する理解が深まりました。
アプリケーションのメリット
- ワンプラットホーム LC-MS システムでインタクト原薬とアミノ酸をモニターすることにより、ハイスループットのマイクロバイオリアクターシステムにおける二重特異性抗体細胞培養のアップストリームプロセス開発を簡素化および加速
- 専門知識の有無を問わず、誰でも簡単に操作できるように設計された BioAccord LC-MS システムを使用することで、LC-MS 取り込みおよびデータ解析が合理化され簡単に
- 実験計画法(DoE)およびデータの多変量回帰分析により、二重特異性抗体細胞培養における特定のアミノ酸とホモダイマー形成の間の相関が明らかに
はじめに
二重特異性抗体(BsAb)は、2 つの異なるターゲットまたはエピトープと同時に結合することで、生物学的効果をより精密に制御できるという点でモノクローナル抗体を上回っており、より優れた治療効果を発揮することができます。一方、望ましくないホモダイマー形成により、BsAb の製造が複雑になり、純度と収率が低下します。細胞培養上清中のホモダイマーの存在量を最小限に抑えることは、BsAb 発現の最大化およびコスト削減において非常に重要です。このアプリケーションノートでは、Sartorius Ambr®15 ハイスループットマイクロバイオリアクターシステムで行うホモダイマー存在量の最適化のための細胞培養条件の包括的な検討、および BioAccord LC-MS システムを使用して実現できる効率的なホモダイマーのモニタリングについて説明します。
実験方法
サンプル前処理
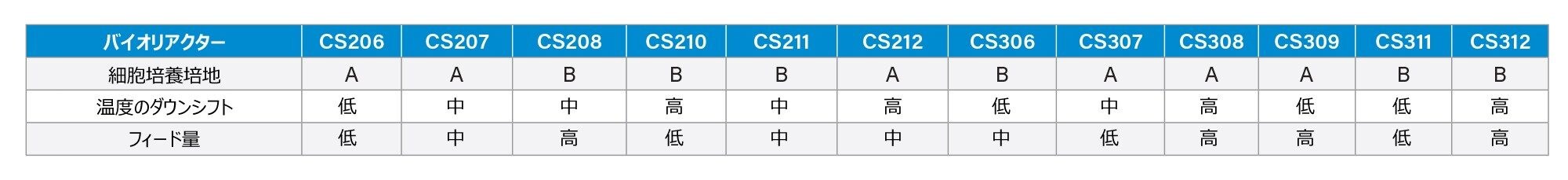
ホモダイマーのレベルを低減するために、培養培地、温度のダウンシフト、供給戦略に焦点を当てた DoE 実験を設計しました(表 1)。CHO-K1 を供給するバッチプロセスを、Ambr® 15 マイクロバイオリアクターシステムでの、14 日間にわたる、12 種類の培養条件を使用する実験に用いました。サンプルは、11、13、14 日目に採取してプロテイン A 精製処理し、PNGase F によって脱グリコシル化して、BioAccord LC-MS システムでインタクト質量を分析しました。以前に記載した分析法1を使用して 9 ~ 12 日目および 14 日目にアミノ酸サンプルを採取しました。分析前のサンプル前処理メソッドを若干改変しました1。簡単に説明すると、培養培地を遠心分離し、アセトニトリルで除タンパクしました。内部標準として 3-クロロ-L-チロシンを含む 0.1%ギ酸(FA)で上清を 1:2000 の比で希釈し、BioAccord システムで LC-MS 分析を行いました。
インタクトプロテイン分析の LC-MS 条件
|
LC-MS システム: |
ACQUITY™ Premier BSM を搭載した BioAccord LC-MS システム |
|
イオン化モード: |
フルスキャン |
|
質量範囲: |
高(m/z 400 ~ 7000) |
|
極性: |
ポジティブ |
|
キャピラリー電圧: |
1.5 kV |
|
コーン電圧: |
70 V |
|
脱溶媒温度: |
550 ℃ |
|
インテリジェントデータキャプチャ: |
オフ |
|
ロックマス補正モード: |
標準 |
|
LC-MS ソフトウェア: |
waters_connect 3.1 以降 |
アミノ酸定量のための LC-MS 条件
|
LC-MS システム: |
ACQUITY Premier BSM と組み合わせた BioAccord LC-MS システム |
|
カラム |
ACQUITY Premier HSS T3 カラム、1.8 μm、2.1 × 150 mm(製品番号:186009469) |
|
カラム温度: |
40 ℃ |
|
サンプル温度: |
8 ℃ |
|
注入量: |
1 µL |
|
流速: |
0.25 mL/分 |
|
移動相 A: |
0.1% ギ酸水溶液 |
|
移動相 B: |
90% ACN/10% IPA/0.1% FA |
|
イオン化モード: |
フラグメンテーションによるフルスキャン |
|
取り込み範囲: |
低分子(50 ~ 800 m/z) |
|
極性: |
ポジティブ |
|
キャピラリー電圧: |
1 kV |
|
コーン電圧: |
20 V |
|
フラグメンテーションコーン電圧: |
40-60 V |
|
スキャンレート: |
5 Hz |
|
脱溶媒温度: |
550 ℃ |
|
インテリジェントデータキャプチャ: |
オン |
|
ロックマス補正モード: |
標準 |
|
取り込み時間範囲: |
開始時間 = 0 分、終了時間 = 14 分 |
|
MS イベントテーブル: |
0 分で廃液に転流、0.8 分で MS に転流、14 分で廃液に転流 |
|
LC-MS ソフトウェア: |
3.1 以上 |
|
インフォマティクス: |
UNIFI™ - 細胞培養培地スクリーニングワークフローを使用した精密質量スクリーニング |
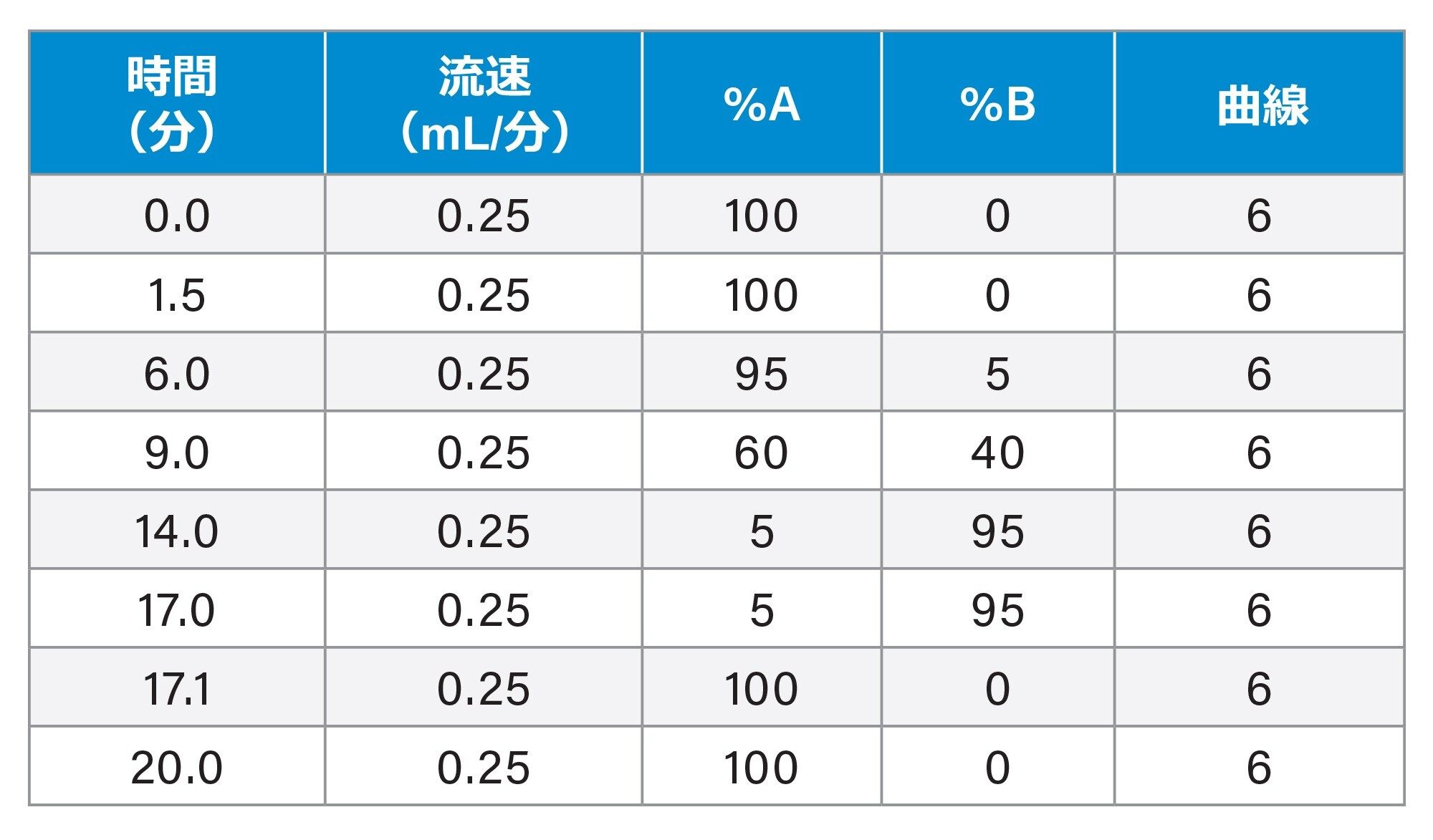
グラジエントテーブル
結果および考察
プロテイン A 精製後の BsAb ホモダイマー相対存在量の測定
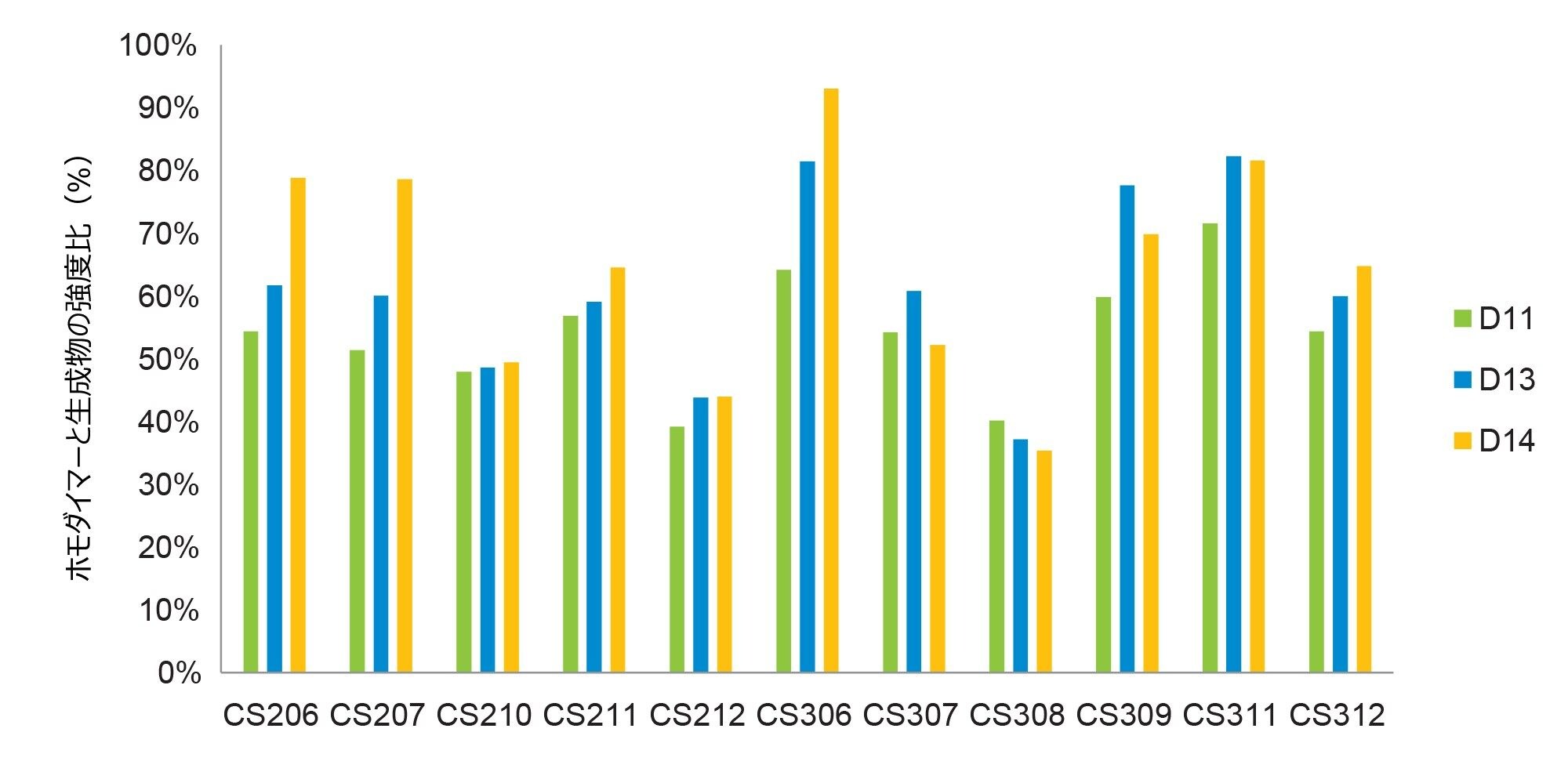
バイオ医薬品企業は通常、二重特異性抗体の特性解析に一連の分析法を使用しますが、初期のプロセス開発においてホモダイマーから生成物を区別するのにちょうど適した分析法はほとんどありません。一方、このプラットホーム LC-MS 分析法を使用すると、大がかりな分析法開発を行わずに、この 2 つを区別することができます。この試験では、インタクト質量分析のアプローチを利用して、さまざまな初期段階の細胞培養条件下におけるホモダイマーのレベルを評価しました。プロテイン A 精製後、ホモダイマーと生成物の両方を正常に確認できる BioAccord LC-MS システムを使用してサンプルを分析しました。ホモダイマー(148 kDa)と生成物(145 kDa)の間の分子量の差はわずか 3 kDa であるため、同様のイオン化効率により、これら 2 つの分子種の間で MS でのシグナル強度を正しく比較することができます。したがって、ホモダイマーと生成物の強度比を、ホモダイマー存在量の相対的定量法として用いることができます。図 1 は、さまざまな細胞培養条件下でのホモダイマーと生成物の強度比の経時的変化を示すヒストグラムで、すべて温度のダウンシフトが大きい CS210、CS212、CS308 ではホモダイマーのレベルが低いことが明らかになっています。
複数の細胞培養条件間でのアミノ酸存在量の変化のモニタリング
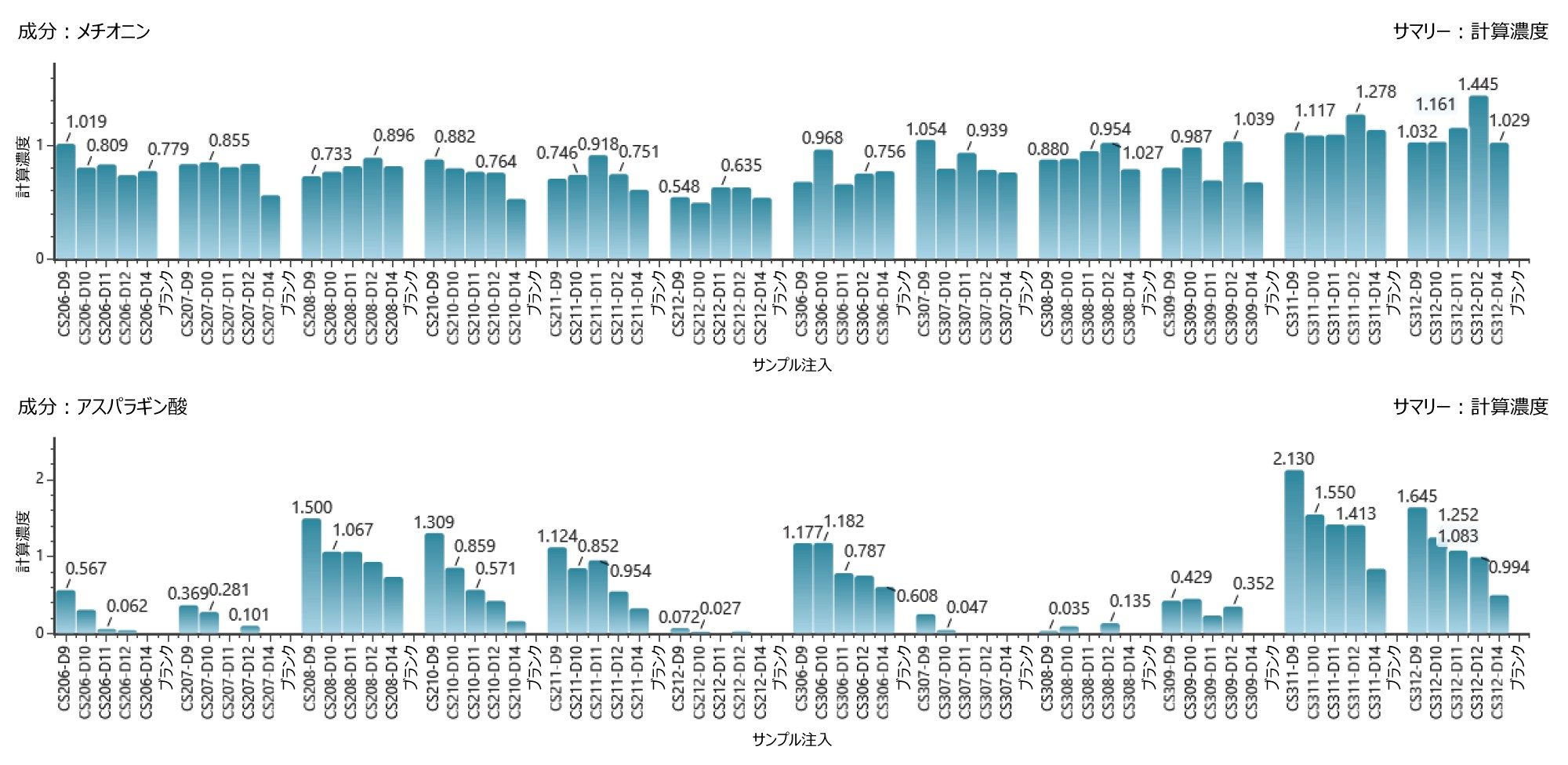
アミノ酸はタンパク質の構成要素および代謝中間体としての役割を果たしているため、バイオ医薬品の品質に大きく影響します。この点を考慮して、アミノ酸濃度のモニタリングに特に焦点を当てた細胞培養培地の最適化は、アップストリームプロセス開発の重要な側面となります。BioAccord LC-MS システムを使用し、以前の報告に詳述した方法で、20 種のアミノ酸を定量分析しました1。 図 2 は、DOE 試験における経時的なアミノ酸濃度の変動を示しています。さまざまな培養条件下において、メチオニンなどの一部のアミノ酸ではわずかな変動が見られ、アスパラギン酸などの他のアミノ酸ではより顕著な変化が見られることがわかります。
多変量回帰分析
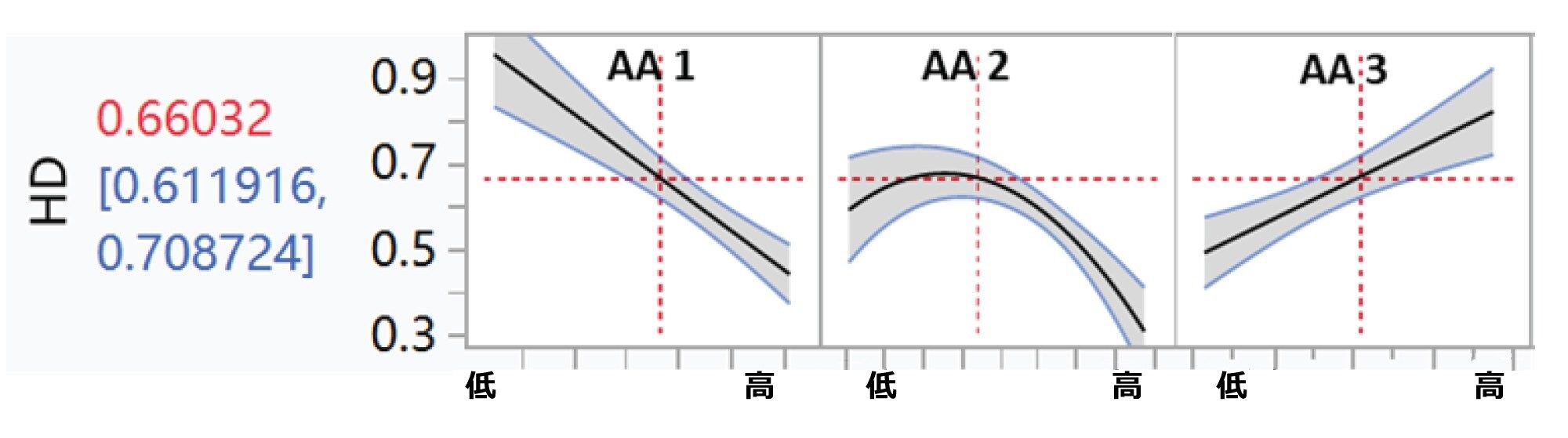
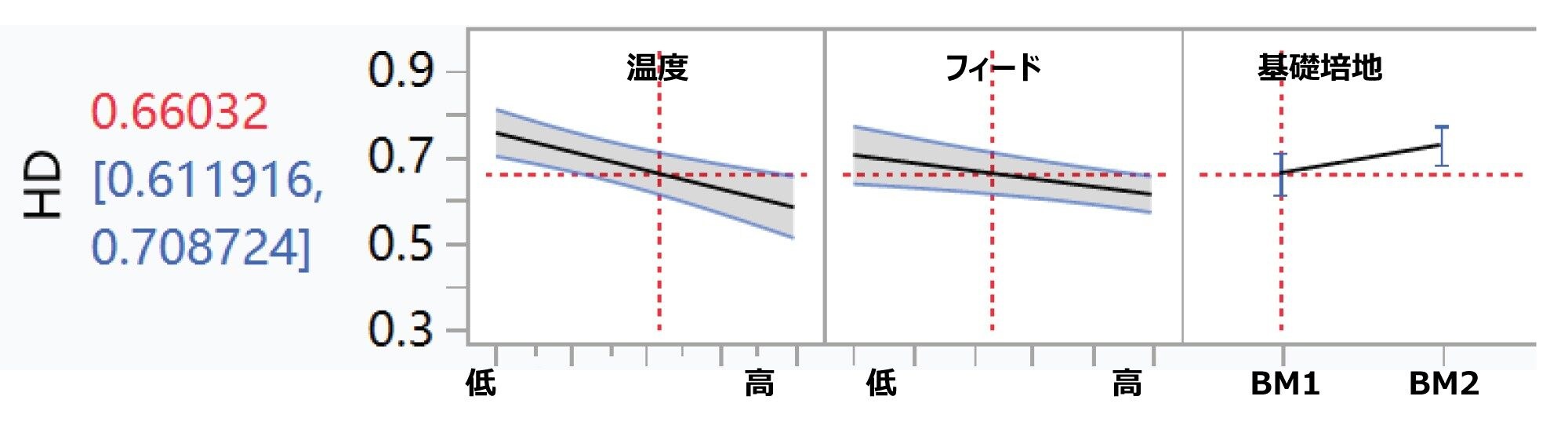
9 ~ 12 日目および 14 日目におけるすべてのアミノ酸濃度、培地の種類、温度のダウンシフト、供給戦略を、JMP によってさらに分析し、ホモダイマーの比率との相関を判定しました。ここで AA1 および AA2 と記載されているアミノ酸では、ホモダイマー存在量との負の相関が示されているのに対して、AA3 では正の相関が示されています(図 3)。さらに、温度のダウンシフトでは、弱い負の相関が見られます(図 4)。ホモダイマー存在量とその他の細胞培養条件の間には、有意な相関は見られませんでした(図 4)。
結論
ホモダイマーの存在量に焦点を当てた DoE 試験によるアップストリームの二重特異性抗体プロセスの最適化を、BioAccord LC-MS システムと組み合わせた Sartorius Ambr® 15 マイクロバイオリアクターシステムで行いました。BioAccord LC-MS システムを使用することで、14 日間にわたって 12 種類の培養条件を使用した、Ambr® 15 からの多数のサンプルについて、インタクト質量分析およびアミノ酸定量のハイスループット分析が可能になりました。多変量回帰分析により、3 種類のアミノ酸が、ホモダイマー存在量と強い相関を示し、温度のダウンシフトは弱い負の相関を示すことが明らかになりました。全体として、BioAccord LC-MS システムと Ambr® 15 バイオリアクターの間の相乗効果により、アップストリームプロセス開発の効率が大幅に向上しています。
参考文献
- YW Alelyunas, MD Wrona, YQ Yu.Quantification of Underivatized Amino Acids in Cell Culture Media Using the BioAccord™ LC-MS System, Waters Application Note, 720007766, October 2022.
720008343JA、2024 年 5 月