MauriceFlex™ システムおよび BioAccord™ LC-MS システムを用いた、イノベーター医薬品およびバイオシミラー医薬品のチャージバリアントの特性解析

要約
このアプリケーションノートでは、治療用モノクローナル抗体と研究グレードのバイオシミラーのチャージバリアントの詳細な比較分析を紹介します。イメージングキャピラリー等電点電気泳動(icIEF)ベースの電荷分離および分取を MauriceFlex システムで行ったところ、後続する分析用のフラクションを 1 回の実行で十分回収できました。後続の BioAccord システムを使用した LC-MS 分析が、追加のサンプル前処理なしで行え、特定の部位での軽鎖のフラグメンテーションや C 末端リジン残基の存在など、イノベーターとバイオシミラーの間の重要な違いが明らかになりました。MauriceFlex システムと BioAccord システムを使用することにより、バイオ医薬品の特性解析ワークフローが短時間で簡単に行えるようになります。
はじめに
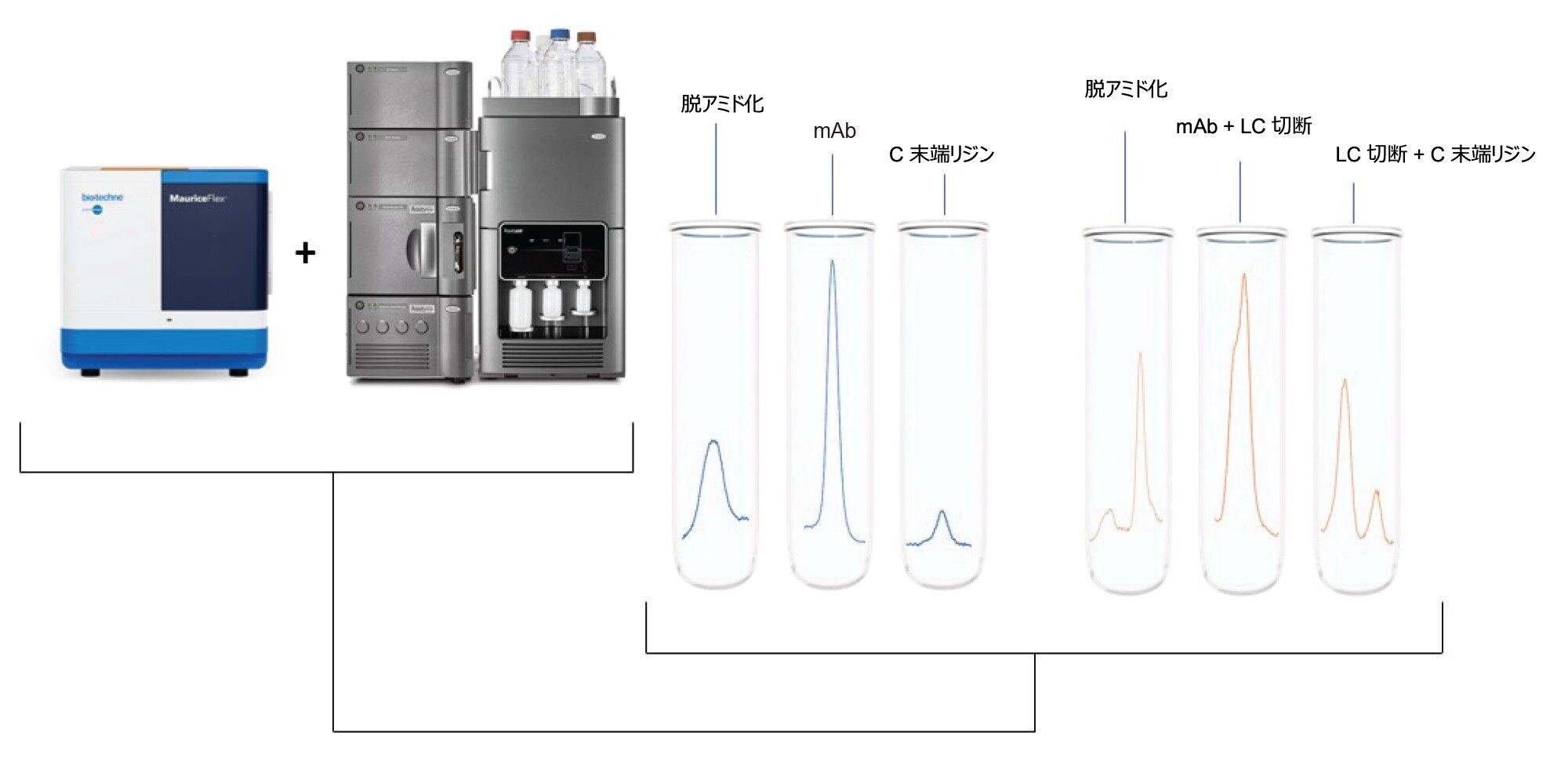
モノクローナル抗体(mAb)のチャージバリアントの分離および特性解析に適した分析ツールがないことが大きな課題になっていました。icIEF は、電荷分離の最も標準的な手法ではありますが、光学検出に限定されます。さらに、試薬が質量分析(MS)に適合しないため、MS では簡単に使用できません1,2。MauriceFlex システムは、電荷に基づく分離および LC-MS に適合するチャージバリアントフラクションの回収を可能にすることでこの限界に対処し、追加のサンプル前処理なしで詳細な質量特性解析を行うことができます。
この試験では、このアプローチを使用してイノベーターである Benlysta™(ベリムマブ)と研究グレードのバイオシミラーを分析しました。市販医薬品開発の現状において、米国食品医薬品局(FDA)などの規制当局からは、イノベーターとバイオシミラーの構造および機能を比較したエビデンスが要求されます3。 この試験では、バイオシミラー医薬品は使用しておらず、得られた結果は臨床的に妥当ではない可能性がありますが、全体を通して使用した手法の選択により、効率的なワークフローであることが実証されています。使いやすいコンパクトなベンチトップ飛行時間(TOF)型装置である BioAccord システムで、規制対応の waters_connect™ インフォマティクスプラットフォーム内の INTACT Mass アプリを利用して、質の高い LC-MS データが得られ、自動データ解析が行えました。
このワークフローでは、MauriceFlex システムで回収されたチャージバリアントフラクションを BioAccord システムで直接分析し、イノベーターとバイオシミラーの間のチャージプロファイルの違いの原因であるプロテオフォームを同定する方法が実証されました。このアプローチにより、詳細な比較分析における MauriceFlex システムと BioAccord システムの有効性が浮き彫りになっています。
材料およびメソッド
icIEF メソッド
イノベーターとバイオシミラーのサンプルを、Pharmalytes(4%)8 ~ 10.5 および 3 ~ 10(4:1)、20% SimpleSol、5 mM アルギニン、Maurice pI マーカー 7.05 および 9.50 を含む両性電解質溶液中に、最終濃度 0.1 mg/mL になるように調製しました。これらのサンプルを Maurice cIEF カートリッジを取り付けた MauriceFlex 装置にロードし、1500 V で 1 分間、次に 3000 V で 12 分間電気泳動を行いました。
分取法
サンプルは、Pharmalytes(4%)8 ~ 10.5 および 3 ~ 10(4:1)、30 mM アルギニン、30% SimpleSol、Maurice pI マーカー 7.05 および 9.50、Simple Western™ pI マーカー 7.00 および 9.70 を含む両性電解質溶液中に、最終濃度 2 mg/mL なるように調製しました。これらのサンプルを MauriceFlex cIEF 分取カートリッジを取り付けた MauriceFlex 装置にロードし、250 V で10 分間、500 V で 10 分間、1000 V で 10 分間、1500 V で 25 分間電気泳動を行いました。検出されたピークは、1000 V で 25 分間移動させた後 1000 V で 45 秒間フラクション回収を行いました。すべてのデータを、Compass for iCE ソフトウェアを使用して分析しました。
インタクト質量分析
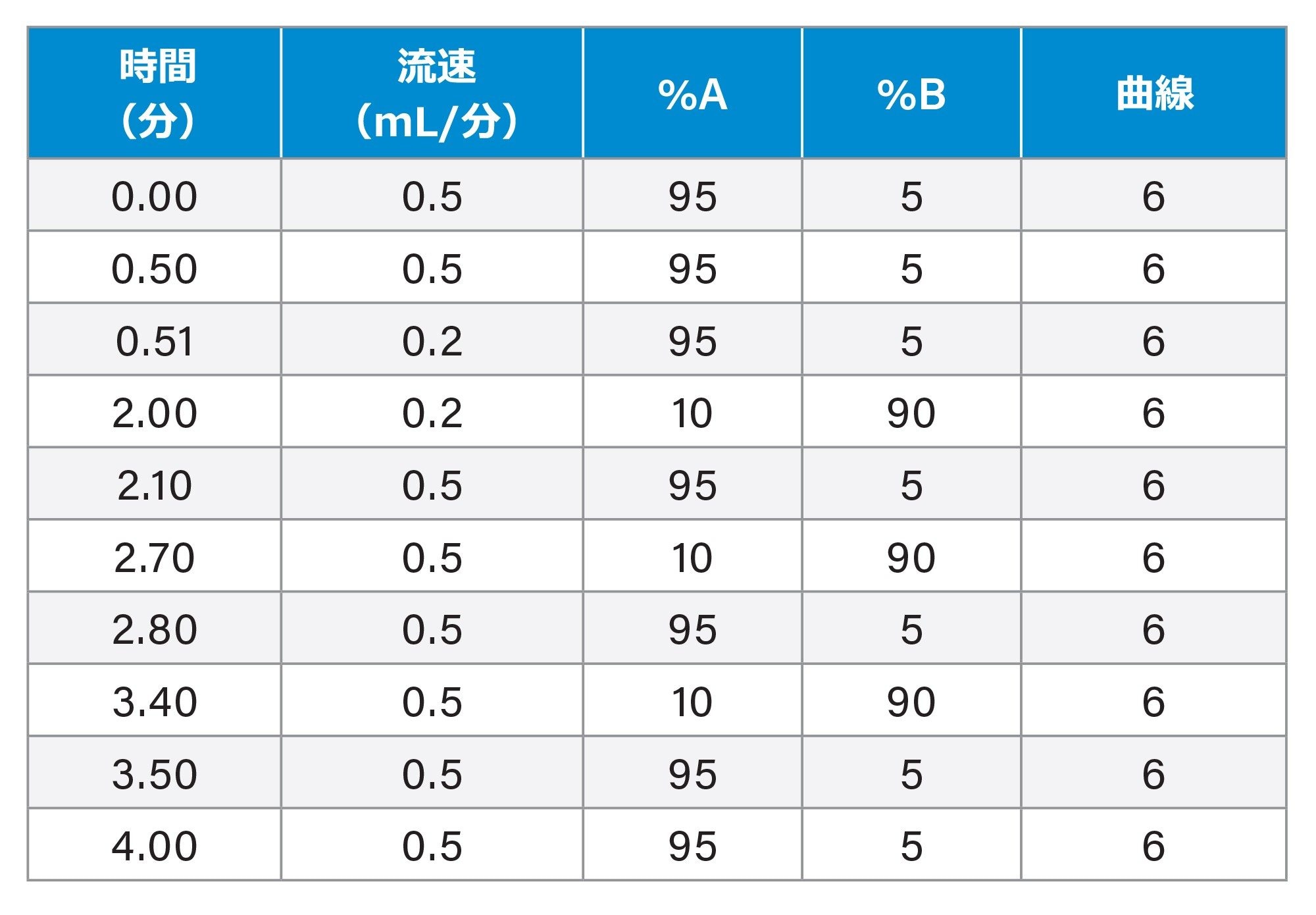
MauriceFlex システムから回収した一部のフラクションを、バッファー交換や追加のサンプル前処理を行わずに BioAccord システムで分析しました。BioAccord システムには、Waters MassPREP マイクロ脱塩カラム(2.1 × 5 mm)を取り付けました。移動相 A は 0.1% ギ酸水溶液、移動相 B は 0.1%ギ酸アセトニトリル溶液を使用しました。分離は以下のグラジエントを使用して行いました(メソッドに要した合計時間 4 分)。カラム温度は 80 ℃ に設定しました。RDa™ 検出器の設定は、既定のキャピラリー電圧 1.5 kV、既定の脱溶媒温度 550 ℃、コーン電圧 70 V としました。各フラクションの質量スペクトルを取り込み、自動でデコンボリューションしたところ、質量は、waters_connect インフォマティクスプラットフォーム内の INTACT Mass アプリで 40 ppm 以内で一致していました。
LC 条件
|
LC システム: |
50 µL サンプル拡張ループを取り付けた ACQUITY™ H-Class バイナリー Bio |
|
検出: |
ACQUITY UPLC™ TUV(280 nm) |
|
カラム: |
Waters™ MassPREP™ マイクロ脱塩カラム(2.1 × 5 mm)(製品番号:186004032) |
|
カラム温度: |
80 ℃ |
|
サンプル温度: |
6 ℃ |
|
流速: |
変化あり(グラジエントテーブルを参照) |
|
移動相 A: |
0.1% ギ酸水溶液 |
|
移動相 B: |
0.1% ギ酸アセトニトリル溶液 |
|
注入量: |
30 µL |
グラジエントテーブル
MS 条件: RDa
|
MS システム: |
ACQUITY RDa™ |
|
イオン化モード: |
ESI +ve、フルスキャン |
|
取り込み範囲: |
m/z 400 ~ 7000(高質量) |
|
キャピラリー電圧: |
1.5 kV |
|
コーン電圧: |
70 V |
|
脱溶媒温度: |
550 ℃ |
|
インテリジェントデータキャプチャ: |
オフ |
結果および考察
電荷不均一性分析および分取
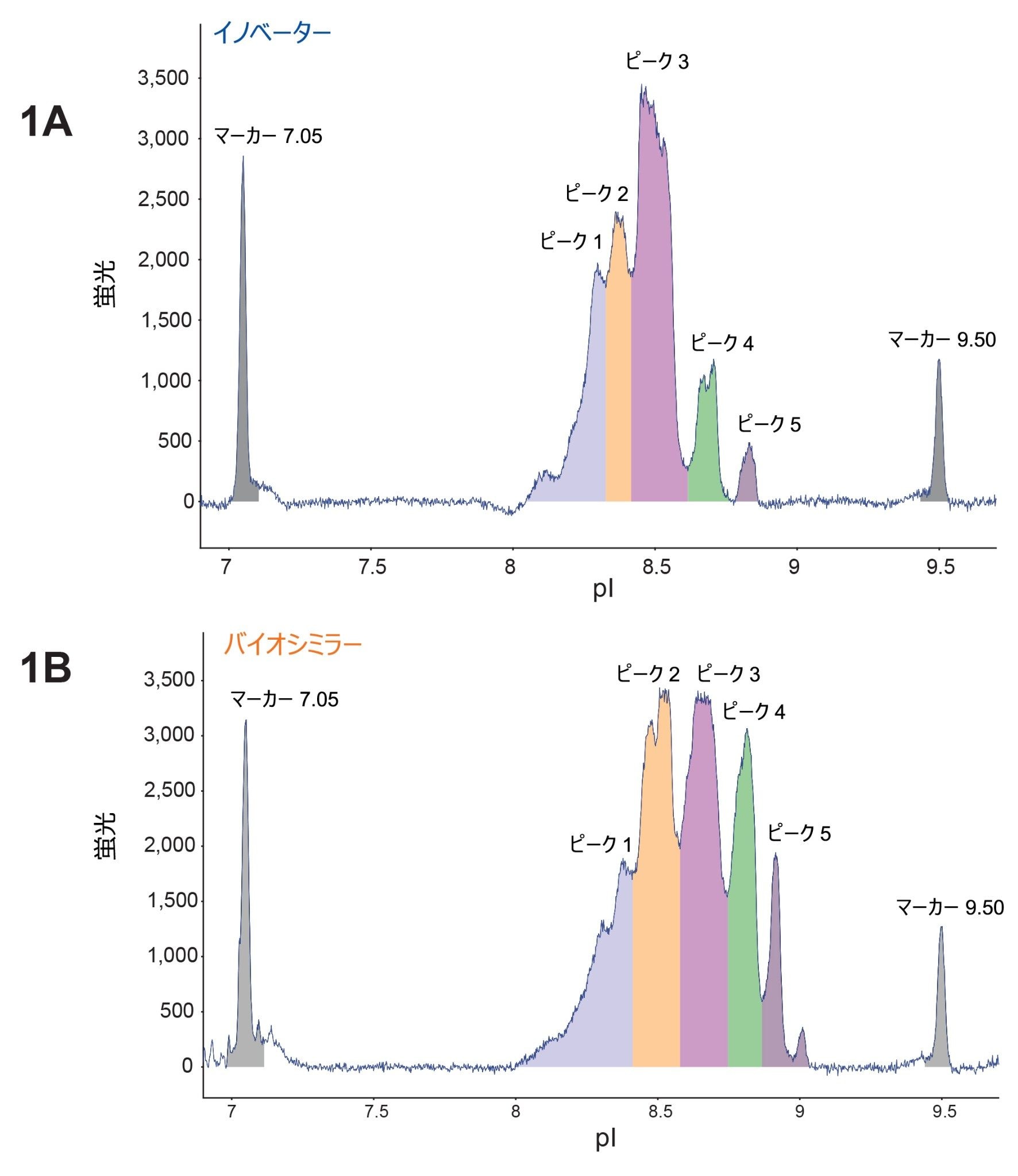
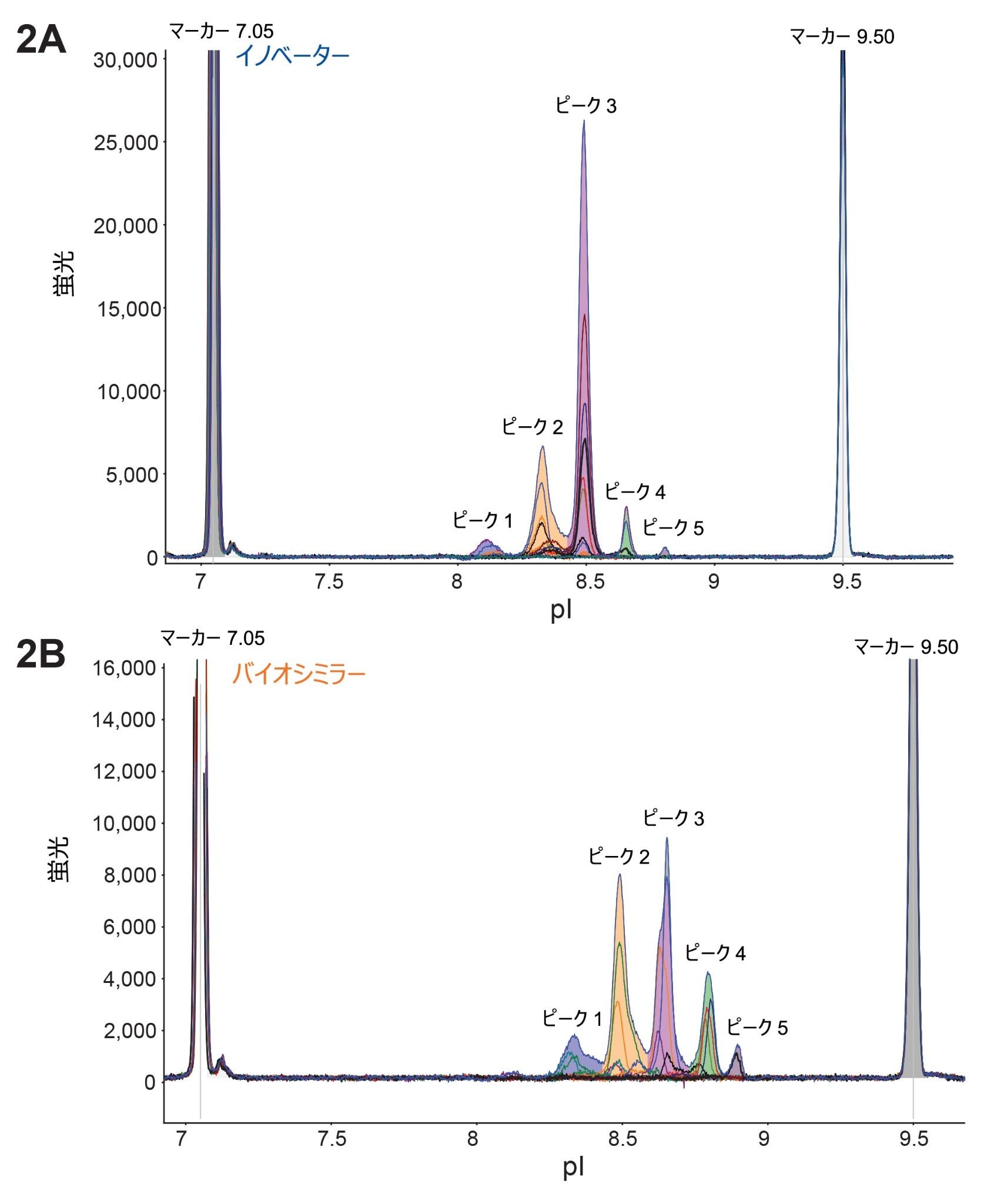
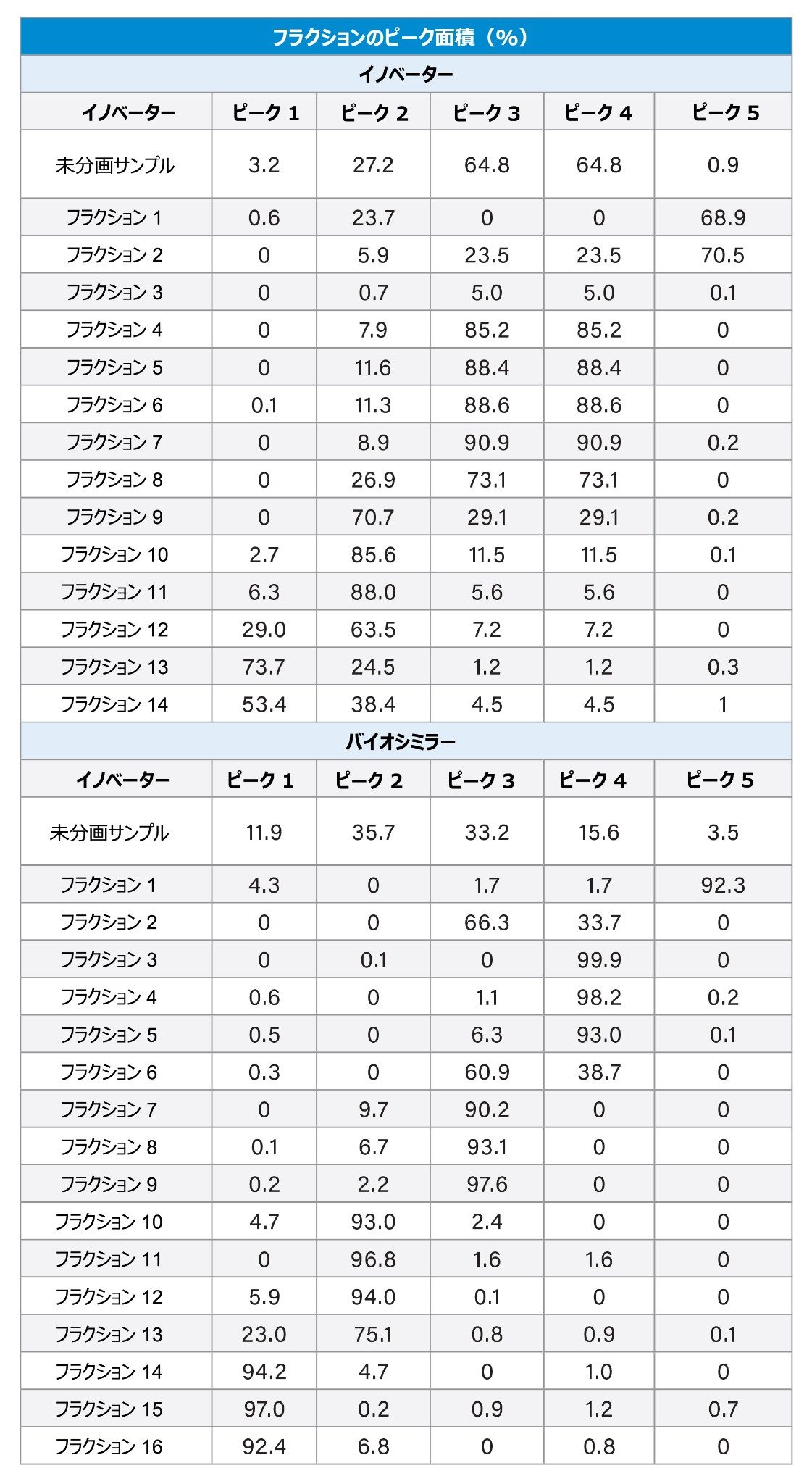
図 1A および 1B に示すように、ベンリスタ(ベリムマブ)のイノベーターおよびバイオシミラーのサンプルについて、MauriceFlex cIEF 分取カートリッジを使用して電荷不均一性を分析しました。その結果、各サンプルで 5 本の主要ピークが検出されました。興味深い点として、バイオシミラーサンプルのピークでは pI 値の全体的なシフトが見られました。このことは、異なる電荷を持つ分子種の存在を示唆しており、さらなる分析が必要であることを示しています。次に、ダウンストリーム分析用に、MauriceFlex システムで両方のサンプルのピークを移動させ、分取しました(図 2A および 2B)。フラクション回収の後、cIEF カートリッジを使用してピークを確認し、ピーク面積の割合を計算しました(表 2)。これらのピークを、BioAccord システムでの LC-MS 分析用に選択しました。
インタクト質量分析
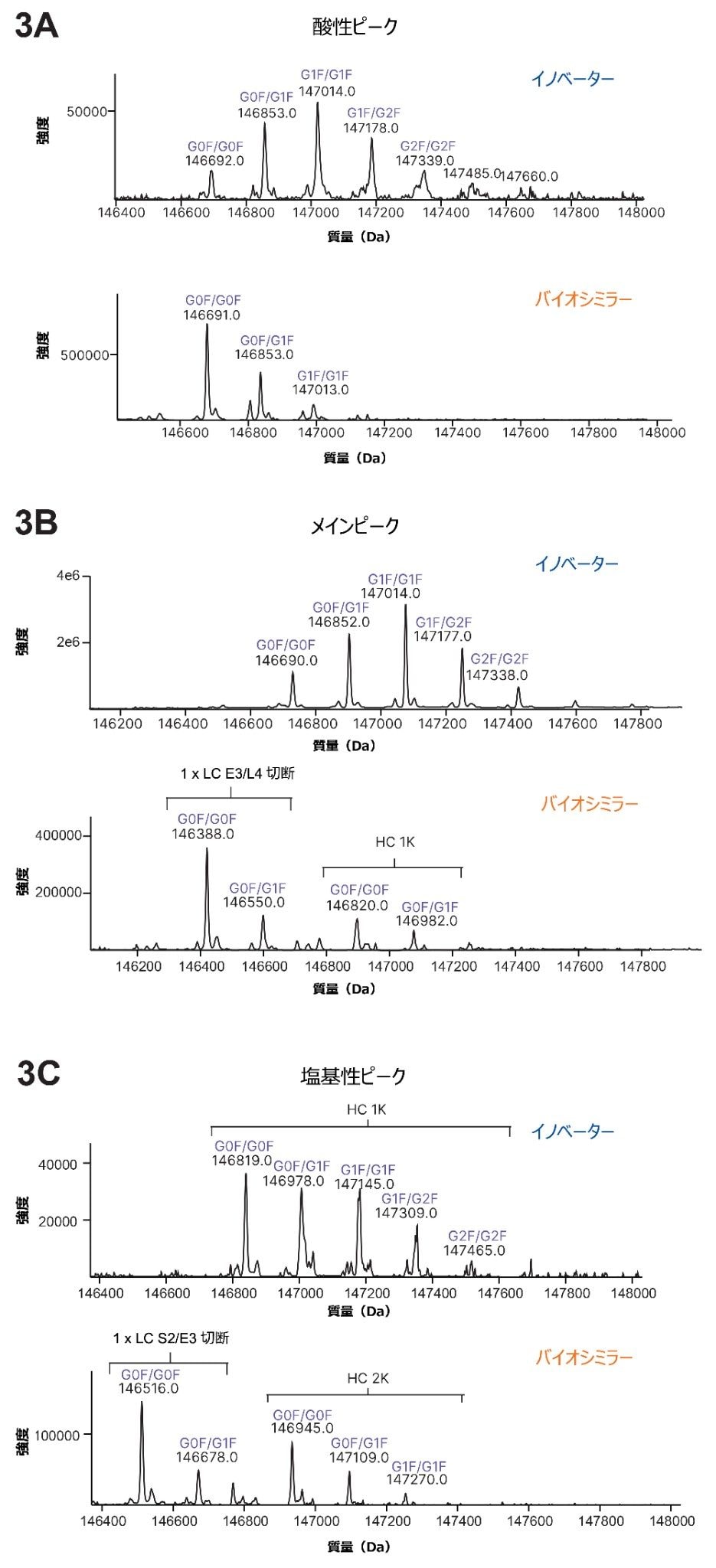
イノベーターとバイオシミラーの酸性フラクション、メインフラクション、塩基性フラクションを LC-MS で分析し、比較しました。デコンボリューションにより、特にバイオシミラーピークにいくつかの重要な修飾が明らかになり、icIEF 分析で見られた見かけ上の pI 値のシフトに関する重要な情報が得られました。図 3A に、イノベーターとバイオシミラーの酸性ピークのスペクトルを示しており、いずれのサンプルのデータも脱アミド化の可能性を示しています。両方のサンプルのメインピーク(MP)の分析でも、いくつかの不一致がありました。MP は、インタクトのモノクローナル抗体またはその主要フォームに対応する最も存在量の多い分子種に対応しています。イノベーターの MP では、メインピークとともに遊離 LC および LC ダイマー(データは示していません)が見られましたが、バイオシミラーの MP では、LC および LC ダイマーに加えて、図 3B でわかるように、重鎖のプロセシングを受けていない C 末端リジン(1K)や軽鎖のグルタミン酸とロイシン(E3/L4)の間の切断など、複数の分子種が見られました。両方のサンプルの塩基性フラクションから複数の分子種の存在が明らかになり、図 3C でわかるように、2 つの mAb の違いがさらに浮き彫りになりました。イノベーターの塩基性フラクションには主に C 末端リジンの存在が見られましたが、バイオシミラーではさらにセリンとグルタミン酸(S2/E3)の間の軽鎖の切断が見られました。2 つのサンプルで見られた主な違いを表 3 にまとめます。分析したすべてのフラクションで、イノベーターとバイオシミラーの間での N 型糖鎖の違いも明らかになりました。
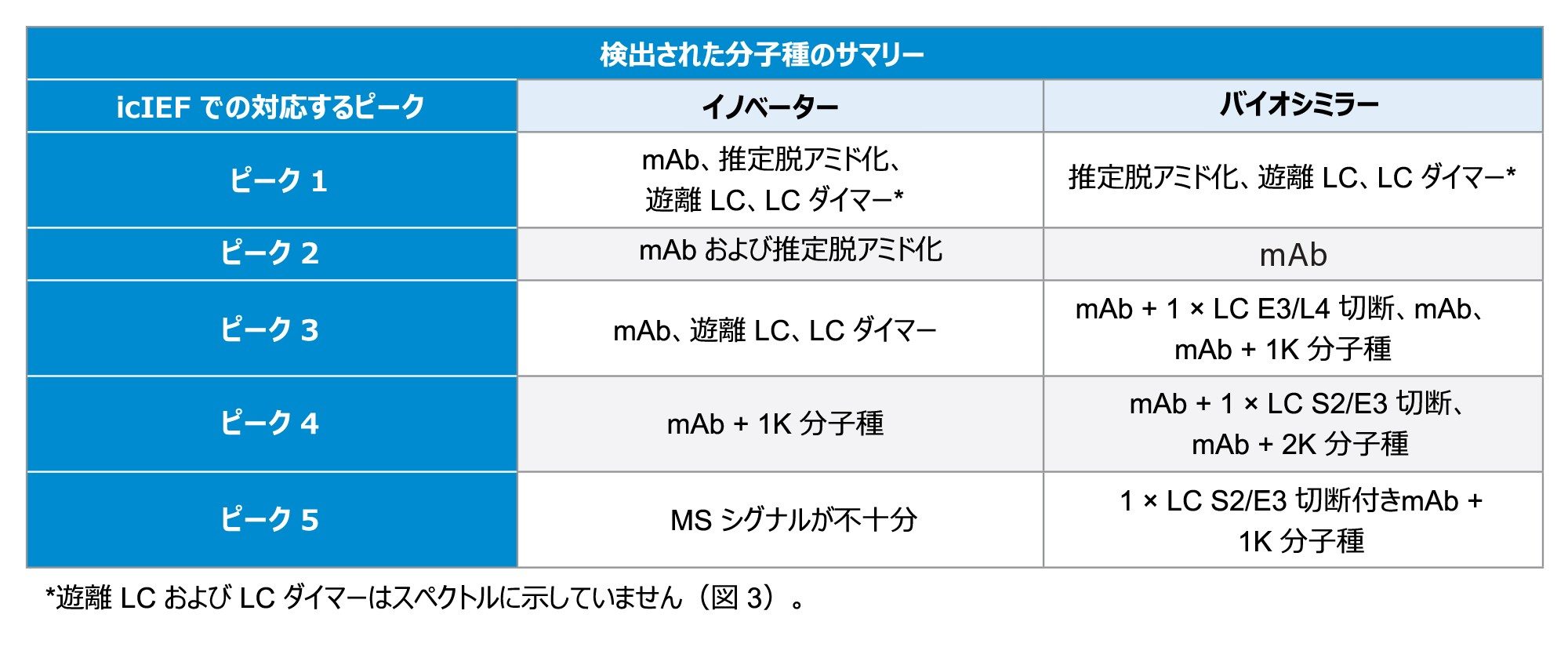
*遊離 LC および LC ダイマーはスペクトルに示されていません(図 3)。
結論
このアプリケーションノートでは、モノクローナル抗体(mAb)のチャージバリアントを分離、回収、特性解析するための効率的なワークフローを実証します。icIEF ベースの分離および分取に MauriceFlex システムを活用し、LC-MS 分析にベンチトップ型 BioAccord システムを使用して、イノベーターと研究グレードのバイオシミラーを分析したところ、両者間の重要な違いが明らかになりました。
酸性フラクションピーク、メインピーク、および塩基性フラクションピークを別々に分析し、C 末端リジン、アミノ酸の切断、推定脱アミド化などのさまざまな荷電分子種の由来が明らかになりました。チャージバリアントは医薬品の安全性に大きな影響を与える可能性があることを考慮すると、プロセスの特性解析、製剤開発、QC ロットリリースなどの開発のさまざまな段階にわたって、継続的にモニタリングを行うことが重要です4。
今回実証したような効率的なワークフローを導入することで、原薬と製剤の品質と一貫性を保つ能力が大幅に向上します。このアプローチにより、規制当局からの期待事項が満たせるようになるだけでなく、チャージバリアントのアイデンティティーに関する情報が得られるため、より安全で有効な医薬品の開発をサポートできます。
参考文献
- Zhang X, Chen T, Li V, Bo T, Du M, Huang T. Cutting-edge mass spectrometry strategy based on imaged capillary isoelectric focusing (icIEF) technology for characterizing charge heterogeneity of monoclonal antibody. Anal Biochem. 2023;660:114961.doi:10.1016/j.ab.2022.114961.
- Dai J, Lamp J, Xia Q, Zhang Y. Anal Chem. 2018;90(3):2246–2254.doi:10.1021/acs.analchem.7b04.
- Review and Approval, Biosimilars.U.S. Food and Drug Administration.
- Chung S, Tian J, Tan Z, et al. Industrial bioprocessing perspectives on managing therapeutic protein charge variant profiles. Biotechnol Bioeng. 2018;115(7):1646–1665.doi:10.1002/bit.26587.
720008541JA、2024 年 10 月