BioAccord™ LC-MS システムと Vion IMS QTof 質量分析計を waters_connect™ CONFIRM Sequence アプリと組み合わせて使用した二本鎖 siRNA の特性解析と配列確認
要約
低分子干渉 RNA(siRNA)は、この 10 年間の遺伝子治療やがん治療における革新的な使用により、医薬品開発において大きな関心を集める治療法になりました。このような関心の高まりとともに、その開発、製造、バッチリリースをサポートする分析ソリューションの需要が確実に増加しています。クロマトグラフィー分離を質量分析検出と組み合わせることで、最先端の分析法になりました。製品およびプロセス開発の用途を超えて、製造ラボおよび品質管理ラボに展開できるバリデーション可能な分析にまで成熟しています。
今回、オンラインクロマトグラフィー分離において、カラム温度が、核酸二本鎖の相互作用を制御する上で、いかに重要な役割を果たしているかを紹介します。カラム温度を調整することで、二本鎖構造を保持することも、二本鎖を変性させて別々のセンス鎖とアンチセンス鎖にすることも可能です。この補完的なアプローチは通常、分子の同定と特性のモニタリングに使用されますが、二本鎖の配列確認にもメリットがあることについて紹介します。このような二本鎖構造に関する試験を、BioAccord LC-MS システムと Vion IMS QTof LC-MS システムの両方で行いました。
アプリケーションのメリット
- MS の専門知識のないユーザーがアクセスできる、コンプライアンス対応の自動 LC-MS ワークフローを使用して、品質管理のメソッドを開発可能に
- 1 回の分析により、二本鎖の純度、二本鎖のアイデンティティー、二本鎖の配列を評価
- コンプライアンス対応の waters_connect インフォマティクスプラットフォーム内で CONFIRM Sequence アプリを使用することにより、複雑なタンデム質量スペクトル(MS/MS)およびデータ非依存的 MSE(特定のプリカーサーイオンを選択しない)の二本鎖 siRNA の質量スペクトルの迅速かつ自動での解釈が容易に行えるように
はじめに
オリゴヌクレオチド医薬品は、さまざまな種類の遺伝性疾患および非遺伝性疾患を治療するための有用なツールとして出現しました1-3。サイレンシング RNA(siRNA)は、二本鎖 RNA 分子で構成され、細胞の mRNA に特異的に結合してその機能を抑制するものであり、有効な疾患治療法として登場しました4。
これらの医薬品は、目的の mRNA 配列を正確にターゲットとし、二次的な副作用を回避することが必要であるため、有効な品質管理手順の確立が製品の質、安全性、有効性を保つ上で不可欠です。siRNA を臨床試験に進めたり、医薬品として進める前に、さまざまな方法を使用して特性解析を行います。イオン対逆相(IPRP)、イオン交換(IEX)、サイズ排除(SEC)、親水性相互作用(HILIC)などの液体クロマトグラフィー手法が導入されてきました5,6,7。 これらの手法を質量分析と組み合わせることが一般的になっています。質量スペクトルによって共溶出する不純物に関する情報が得られ、これらのプロダクトバリアントの割り当てが容易に行えるためです8。これらの分子の配列を確認し、修飾部位を特定するために、衝突誘起解離(CID)を使用する高分解能質量分析が広く使用されています9。
今回、二本鎖 siRNA の検出および配列確認のために、データ依存的(プリカーサーの選択なし)MSE フラグメンテーションと組み合わせたイオン対逆相クロマトグラフィー(IP-RP)を使用する、ルーチンの LC-MS 法を紹介します。このメソッドでは、waters_connect インフォマティクスで動作する、非常にアクセスしやすい BioAccord LC-HRMS システムと組み合わせた自動データ解析を活用して、コンプライアンス対応のデータ取り込み、解析、レポートをサポートします。
BioAccord LC-MS システム(図 1)は、MS の専門知識のないユーザーでもアクセスできる、バイオ医薬品分析用のコンパクトで頑健なプラットフォームとして 2019 年に公表されました。ここで使用している完全統合型の BioAccord LC-MS システムは、ACQUITY™ UPLC™ Premier I-Class PLUS システム、チューナブル紫外線(TUV)光学検出器、ESI-TOF ACQUITY RDa™ 質量検出器で構成されています。次に、配列確認の結果を、Vion IMS-QTof MS 装置を使用したターゲット LC-MSMS 分析と比較しました。
通常の(非修飾)オリゴヌクレオチドと異なり、siRNA 分子は、その複雑さと安定性により、LC-MS による特性解析が困難になる場合があります。カラム温度を制御して調整することにより、二本鎖配座異性体のセンス鎖とアンチセンス鎖への解離を誘発し、MS レスポンスを高めて、スペクトルの複雑さを低減することができます。これにより、シーケンスカバー率と鎖の同定が改善し、単一の注入から純度を評価できるようになります。あるいは、カラム温度を下げてカラム上で二本鎖構造を保持することで、同定が可能になり、純度を完全な二本鎖レベルで測定できるようになります。単一の分析内でこれらの 2 つのアプローチを組み合わせることで、試験対象の二本鎖 siRNA 分子の品質特性に関する情報が得られるかどうかについて評価しました。

実験方法
サンプルの説明
実験には、2 本の RNA 一本鎖をアニール処理して二本鎖にした、以下の配列を使用しました。
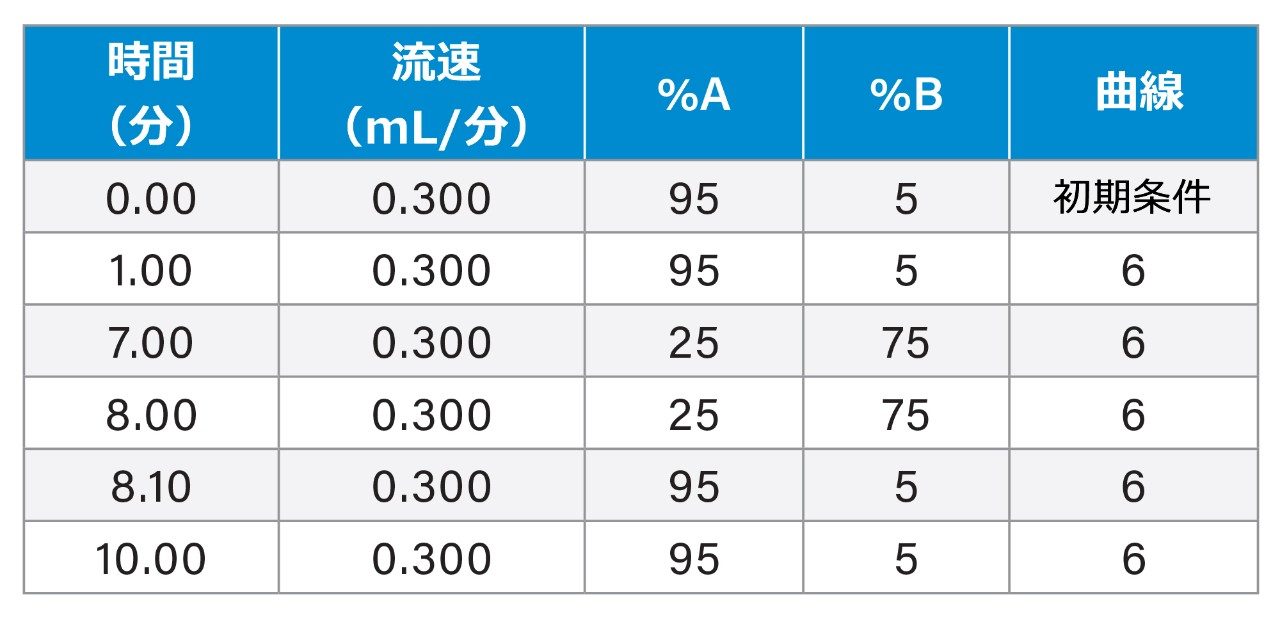
実験テーブル

ハイブリダイゼーション:等モル量の一本鎖をピペッティングし、75 ℃ に加熱して、この温度で 5 分間維持しました。その後、この溶液を冷却速度 1 ℃/分で 37 ℃ に冷却しました。
次に、一本鎖および二本鎖を、カラム温度 25 ℃ および 60 ℃ を使用して測定しました。(タンデム)質量スペクトルは、固定プリカーサー m/z および固定コリジョンエネルギーを使用し、MSE データ非依存的フラグメンテーション取り込み(BioAccord システム)を用いたターゲット MS/MS 取り込み(Vion IMS QTof)で取り込みました。
LC 条件
|
LC システム: |
Waters™ I-Class システム(BioAccord システムの Vion IMS QTof または RDa 検出器に接続) |
|
検出: |
UV 260 nm |
|
バイアル: |
LCGC 認定透明ガラス 12 × 32 mm スクリューネックバイアル、トータルリカバリー(キャップおよびスリット入り PTFE/シリコンセプタム付き(製品番号:186000385C)) |
|
カラム: |
ACQUITY UPLC Oligonucleotide BEH、130 Å、C18、1.7 µm、2.1 × 50 mm(製品番号:186009484) |
|
カラム温度: |
25.0 ℃ および 60.0 ℃ |
|
サンプル温度: |
6.0 ℃ |
|
注入量: |
1 µL |
|
流量: |
0.300 mL/分 |
|
移動相 A: |
7 mM TEA、80 mM HFIP 水系溶液 |
|
移動相 B: |
3.5 mM TEA、40 mM HFIP 含有 50% メタノール |
グラジエントテーブル
MS 条件
|
MS システム: |
Waters BioAccord LC-MS |
|
モード: |
フラグメンテーションによるフルスキャン |
|
質量範囲: |
低(m/z 50 ~ 2000) |
|
極性: |
ネガティブ |
|
スキャンレート: |
10 Hz |
|
コーン電圧: |
40 V |
|
フラグメンテーションコーン電圧: |
90 ~ 110 V |
|
MS システム: |
Waters Vion IMS QTof |
|
モード: |
MS/MS |
|
質量範囲: |
m/z 50 ~ 2000 |
|
プリカーサー: |
センス鎖の場合は m/z 675.4 アンチセンス鎖の場合は m/z 664.9 |
|
スキャン時間: |
0.5 秒 |
|
コリジョンエネルギー |
センス鎖およびアンチセンス鎖の両方で 20 V |
結果および考察
二本鎖の純度およびアイデンティティーを合理的かつ効率的に評価し、不純物を同定し、センス鎖とアンチセンス鎖の正しい配列を確認することを目的として、単一の分析で変性および非変性の二本鎖 siRNA オリゴヌクレオチドに LC-MS/MS 配列確認を適用することを試みました。BioAccord LC-MS のデータは、フルスキャン MSE データ非依存的フラグメンテーションモードで取り込み、waters_connect インフォマティクスプラットフォームで取り込んで解析しました。TIC ピークの下の ESI-MS の組み合わせスペクトルを使用し、waters_connect INTACT Mass アプリで自動スペクトルデコンボリューションを行ってインタクトオリゴヌクレオチドの質量測定値を取得し、鎖の同定、純度評価、修飾部位決定を行いました。次に、waters_connect CONFIRM Sequence アプリを使用して、オリゴヌクレオチド配列の解析を行いました。最後に、Vion IMS QTof データをターゲット MS/MS モードで収集し、BioAccord データ非依存的測定(DIA)配列確認の結果と比較しました。
BioAccord システムまたは Vion IMS QTof 質量検出器を使用した、カラム温度 25 ℃(二本鎖非変性)および 60 ℃(変性)で行った実験により、これらの装置では単一の分析ランで二本鎖オリゴヌクレオチドのさまざまなパラメーターを評価できることを実証しました。
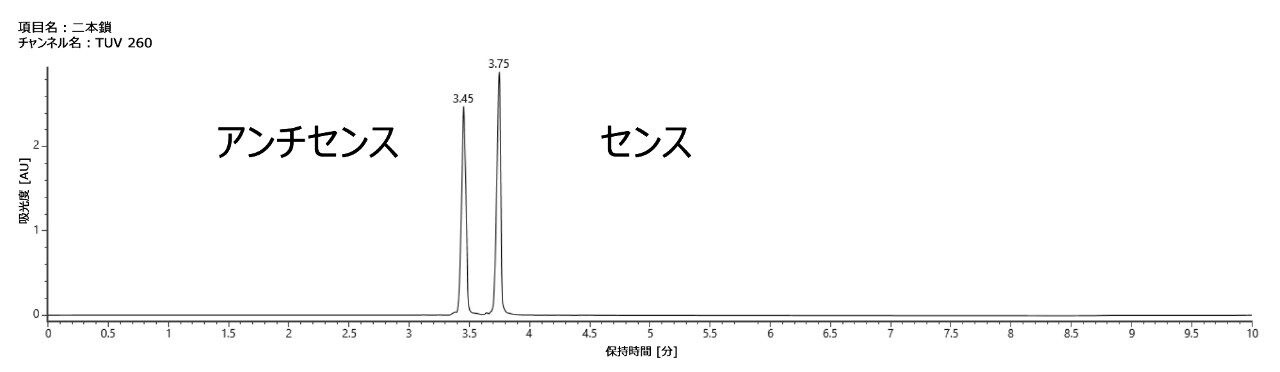
カラム温度 25 ℃ では、二本鎖 siRNA 分子はカラムに保持されます(図 2 を参照)。センス鎖およびアンチセンス鎖の個別のサンプルが、互いにかつ二本鎖分子からクロマトグラフィー分離されます。中程度の温度では二本鎖分子のインタクト構造が LC 分析を通して維持されますが、イオン対試薬と低 pH を使用すると、エレクトロスプレーイオン化時に複合体が変性します。これにより、二本鎖のスペクトルを個々の鎖として確認し、特性解析することができます(図 3A)。
データは、自動 waters_connect INTACT Mass アプリによって解析しました。これにより、短いオリゴヌクレオチドと長いオリゴヌクレオチドの両方を分析できて、TIC および UV ピーク検出、BayesSpray 電荷デコンボリューション、修飾、プロダクト関連不純物の割り当てや、ユーザー操作が少ない合理的な核酸分析のための純度計算などの解析機能がサポートされます(図 3B および 3C)。
INTACT Mass アプリケーションの結果(図 3C)により、5.13 分の二本鎖のクロマトグラフィーピークの下で共溶出するデコンボリューション後の分子種の割り当てが容易になります。この共溶出により、LC-UV での純度は、すべての分子種について 90% と報告されています。INTACT Mass アプリでは、割り当てられたすべての共溶出分子種を、LC および MS での相対レスポンスの積(LC × MS)とみなして MS 純度を計算しました。強度が高い分子種と強度が低い分子種両方のデコンボリューション後の同定すべてで、低 ppm の質量誤差(10 ppm 未満)が見られました。
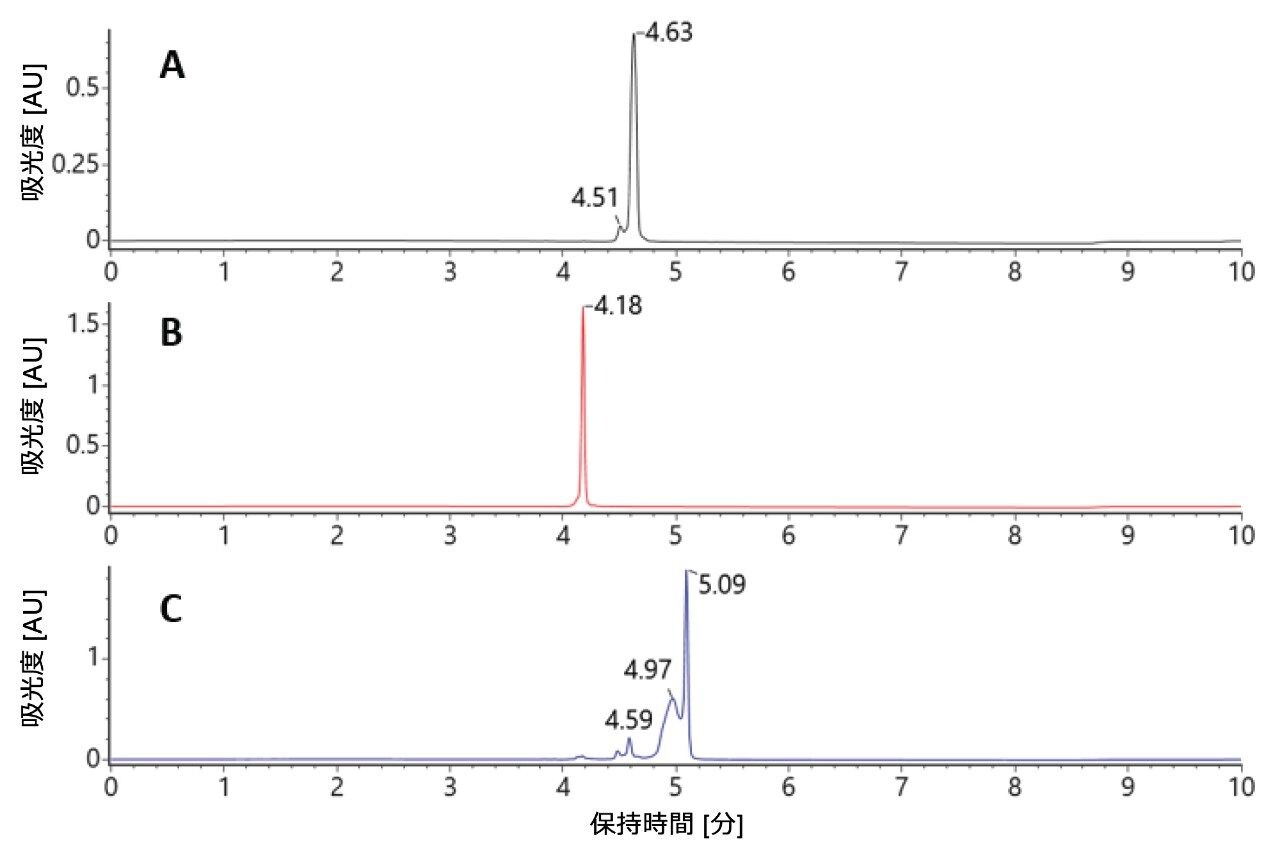
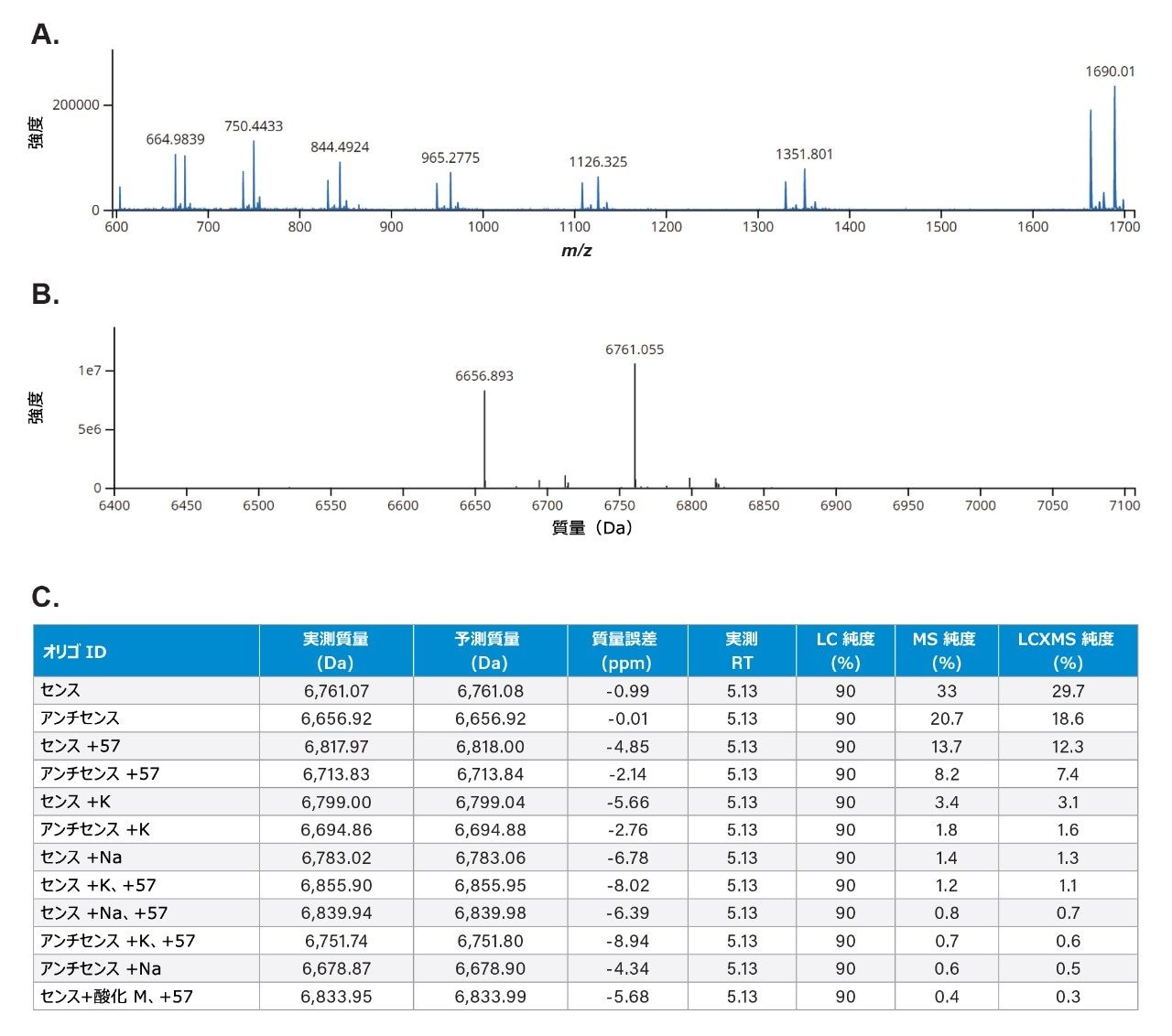
図 3A.エレクトロスプレープロセス中に解離した二本鎖 siRNA のネガティブイオン ESI 生スペクトル。個々のセンス鎖およびアンチセンス鎖のチャージ状態エンベロープが、LC 保持時間 5.09 分で二本鎖ピークの下に溶出していることがわかります。
B. エレクトロスプレープロセス中にセンス鎖およびアンチセンス鎖に解離した二本鎖 siRNA の waters_connect Intact Mass BayesSpray デコンボリューションスペクトル。
C. 解離した二本鎖 siRNA ピークの waters_connect INTACT Mass アプリによるデータ解析の結果。
カラム温度を 60 ℃ に上げることにより、2 本の純粋な標準試料オリゴが再度、クロマトグラフィーでベースライン分離されました。二本鎖分子がカラム上で変性して、クロマトグラフィー分離される 2 本の一本鎖が生じ、それらの保持時間は個々の標準試料と一致していました(図 4)。
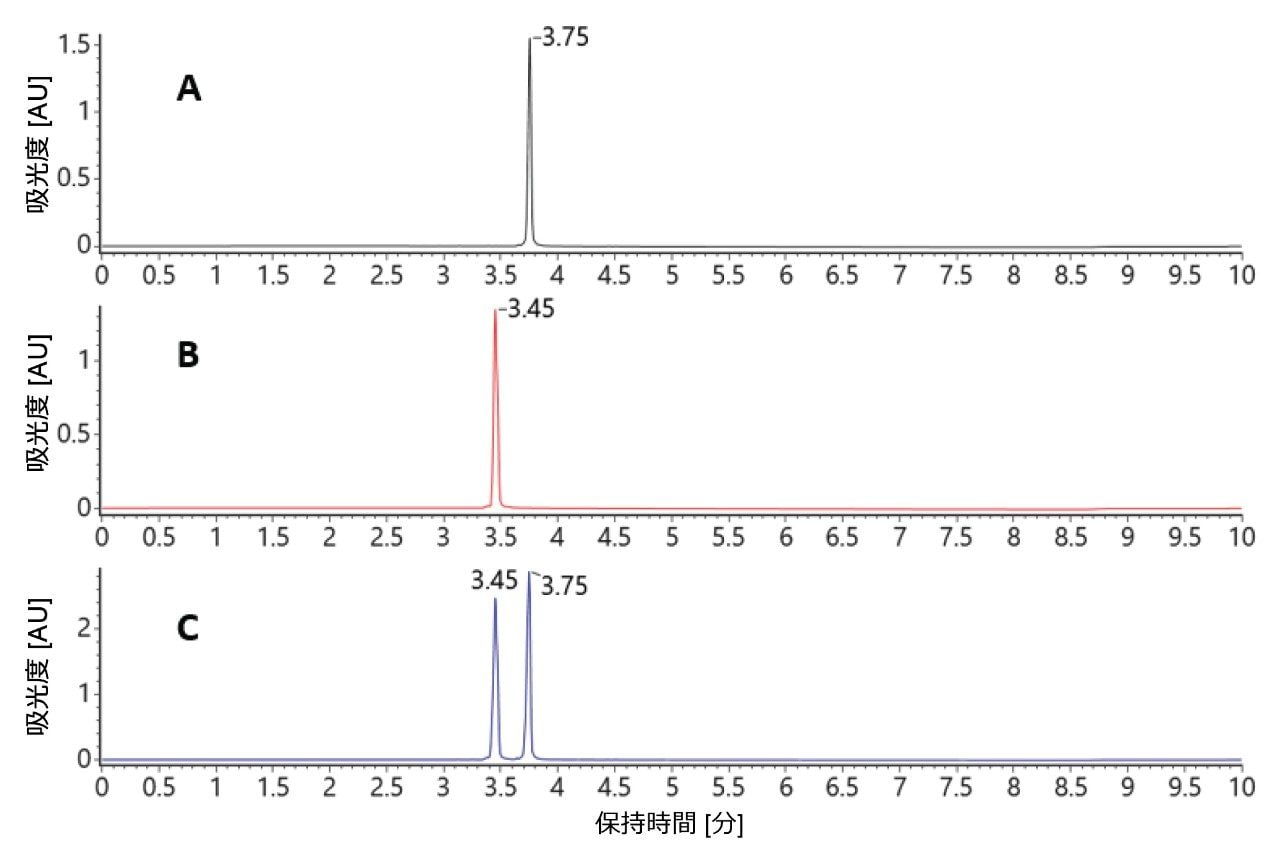
カラム温度を制御し、自動データ解析メソッドを適用するだけで、質量検出を使用する両方のメソッド(変性分離および非変性分離)を、二本鎖 siRNA のアイデンティティーの確認に使用できます。
INTACT Mass で解析したデータにより、迅速なアイデンティティー確認が可能になりますが、完全な配列確認には他のインフォマティクスツールが必要です。CONFIRM Sequence アプリでは、同じ BioAccord MSE フルスキャンとフラグメンテーション取り込みモードのデータを利用して、フラグメンテーションデータが指定した配列に対応することを自動的に確認することができます。
ここでは、siRNA の両方の一本鎖(非変性および共溶出)からのデータを使用して二本鎖配列を確認しました。高エネルギーフラグメンテーションサイクル用に 100 ~ 120 V の電圧グラジエントを使用して、両方の鎖について 90% のシーケンスカバー率が得られました。シーケンスカバー率の約 10% にあたる割り当てされていない領域をさらに調査したところ、アンチセンス鎖のフラグメントからのキメラスペクトル干渉が、割り当てられない理由として特定されました(図 5)。
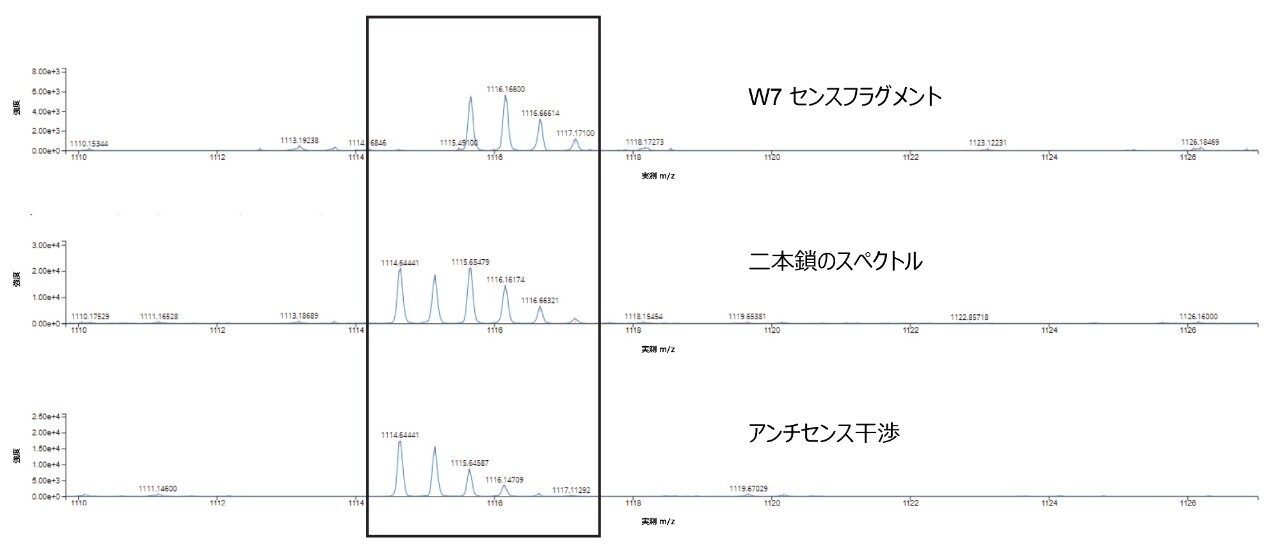
m/z 1114.7 のアンチセンス w7 フラグメントからの MSE フラグメンテーションデータ(図 5)中の重なった同位体パターンにより、共溶出する両方の鎖を合わせたフラグメンテーションからのキメラ二本鎖スペクトルに見られるように、w7 センスフラグメントの自動割り当てが複雑になっています。
二本鎖 siRNA の一本鎖も、Vion IMS-QTof MS システムで、ターゲット MS/MS アプローチ(各鎖から特定のチャージ状態を個別に選択してフラグメンテーションする)を使用して分析し、両方の鎖で 100% のシーケンスカバー率が得られました。このターゲット MS/MS アプローチにより、各一本鎖のフラグメンテーションスペクトルがよりきれいになって干渉の多くが解消するため、より低いカラム温度での分離では二本鎖のクロマトグラフィー分離が得られなかった場合にも、十分なシーケンスカバー率が容易に得られます。
60 ℃ という高いカラム温度で調査および実験を行ったところ、クロマトグラフィー条件が変性条件になり、二本鎖が一本鎖成分にクロマトグラフィー分離されました。一本鎖は、カラムで優れたピーク形状で十分に分離されるため、MSE 高エネルギーフラグメントパターンが互いに独立して得られ、二本鎖がカラムに保持されているときに見られる同位体分子種の重なりを防ぐことができます。
干渉物質が除かれたことで、カラム温度 60 ℃ の変性メソッドにより、BioAccord システム MSE データ非依存的アプローチを使用して、シーケンスカバー率 100% の割り当てができるようになりました(図 7)。このように、この変性/非変性を組み合わせた方法により、単一の取り込みで二本鎖の純度、二本鎖のアイデンティティー、一本鎖のアイデンティティーを調査することができます。配列情報は、QTof システムでのタンデム MS/MS によって取得できますが、BioAccord LC-MS システムでも、ノンターゲットデータ非依存的アプローチを使用して取得することができます。
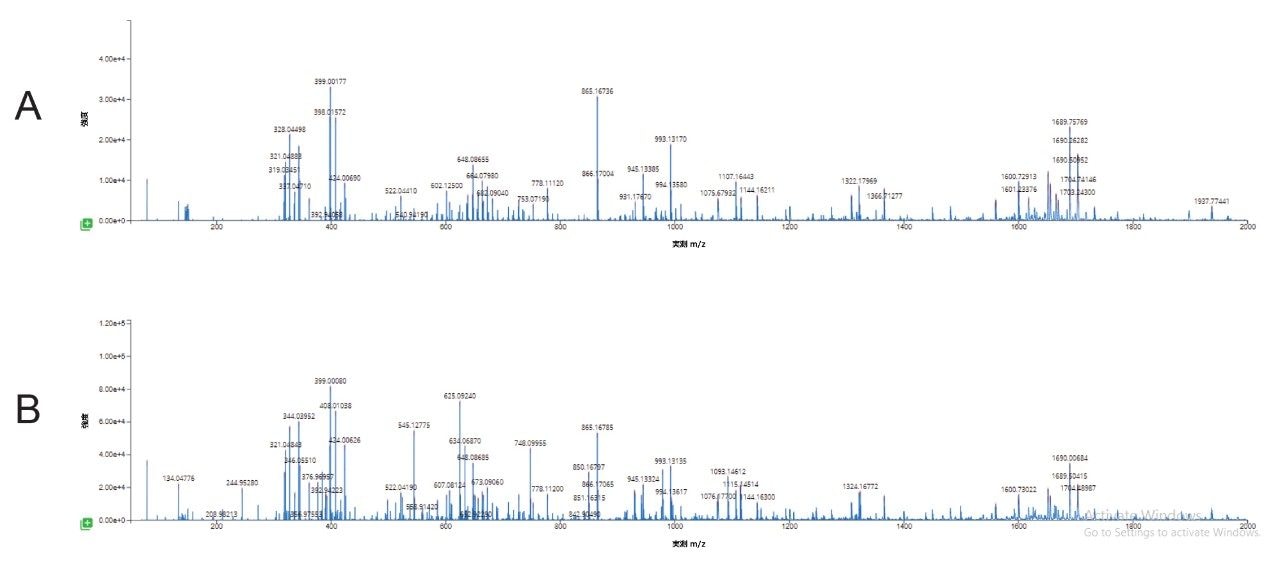
変性した二本鎖 siRNA と純粋な一本鎖標準試料から生成された高エネルギー MSE スペクトルが同等であることを確認するために、追加の実験を行いました(図 8)。
結論
変性(高カラム温度)および非変性(低カラム温度)条件の LC-MS メソッドが開発されており、TOF MS 検出または QTof MS 検出を使用して一本鎖の純度、一本鎖のアイデンティティー、二本鎖 siRNA の純度およびアイデンティティーを評価することができます。
これらのメソッドでは、waters_connect INTACT Mass アプリと CONFIRM Sequence アプリを使用して、インタクト質量およびフラグメンテーションベースの配列解析用のデータ分析の自動化が行えます。
変性 LC 分離で得られるクロマトグラフィー分離の恩恵を受けるデータ非依存的 MS フラグメンテーションアプローチを使用して、BioAccord LC-MS システムで両方の siRNA 鎖について完全な配列確認が行えました。
Vion IMS-QTof システムでは、非変性 LC 分離におけるオリゴヌクレオチド鎖の共溶出に寛容的なターゲット MS/MS により、両方の siRNA 鎖について完全な配列確認が得られました。
このアプリケーションノートで説明したワークフローには、非変性および変性条件での二本鎖 siRNA 分析の補完的な性質、および開発環境中のより複雑な QTof 装置や、開発や規制対象の製造および品質組織でのバリデーション可能な分析におけるルーチン分析用のより目的に適した BioAccord LC-MS システムを利用する機能が見られます。
参考文献
- Al Shaer D, Al Musaimi O, Albericio F, de la Torre BG.2021 FDA TIDES (Peptides and Oligonucleotides) Harvest.Pharmaceuticals (Basel).2022;15(2):222.doi:10.3390/ph15020222
- Al Musaimi O, Al Shaer D, Albericio F, de la Torre BG.2022 FDA TIDES (Peptides and Oligonucleotides) Harvest.Pharmaceuticals.2023;16(3):336.doi:10.3390/ph16030336
- Al Shaer D, Al Musaimi O, Albericio F, de la Torre BG.2023 FDA TIDES (Peptides and Oligonucleotides) Harvest.Pharmaceuticals (Basel).2024;17(2):243.doi:10.3390/ph17020243
- Rossi JJ, Rossi DJ.siRNA Drugs: Here to Stay.Molecular Therapy.2021;29(2):431–432.doi:10.1016/j.ymthe.2021.01.015
- Gilar M, Koshel BM, Birdsall RE.Ion-Pair Reversed-Phase and Hydrophilic Interaction Chromatography Methods for Analysis of Phosphorothioate Oligonucleotides.Journal of Chromatography A.2023;1712:464475.doi:10.1016/j.chroma.2023.464475
- Cook K, Thayer J. Advantages of Ion-Exchange Chromatography for Oligonucleotide Analysis.Bioanalysis.2011;3(10):1109–1120.doi:10.4155/bio.11.66
- Shimoyama A, Fujisaka A, Obika S. Evaluation of Size-Exclusion Chromatography for the Analysis of Phosphorothioate Oligonucleotides.Journal of Pharmaceutical and Biomedical Analysis.2017;136:55–65.doi:10.1016/j.jpba.2016.12.036
- Donegan M, Nguyen JM, Gilar M. Effect of Ion-Pairing Reagent Hydrophobicity on Liquid Chromatography and Mass Spectrometry Analysis of Oligonucleotides.Journal of Chromatography A.2022;1666:462860.doi:10.1016/j.chroma.2022.462860
- Abdullah AM, Sommers C, Hawes J, Rodriguez JD, Yang K. Tandem mass spectrometric sequence characterization of synthetic thymidine-rich oligonucleotides.Journal of Mass Spectrometry.2022;57(4):e4819.doi:10.1002/jms.4819
- Catalin E. Doneanu, Ying Qing Yu, Joseph Fredette, William J. Warren, Weibin Chen.HILIC as an Alternative Separation Mode for Intact Mass Confirmation of Oligonucleotides on the BioAccord System.Waters application note. 720007395. 2021.
謝辞
BioSpring の Rebecca Hirschberger 氏と Michael Rühl 氏の貢献に感謝いたします。
720008654JA、2024 年 12 月