合成オリゴヌクレオチドの純度決定、インタクト質量測定、検出された不純物の MS/MS による配列確認のための Xevo™ G3 ベースのワークフロー
要約
この試験では、インフォマティクスが内蔵されている UPLC™-QToF-MS によって、合成オリゴヌクレオチドとその不純物の特性解析がどのように容易になるかについて評価します。オリゴヌクレオチドのインタクト質量測定と MS/MS フラグメンテーションベースの配列解析の組み合わせは、完全長プロダクト(FLP)の予想配列の確認、および潜在的な不純物に対応する可能性のある修飾バリアントの同定に非常に有効です。Xevo G3 QTof システムは、規制対応のインフォマティクスプラットフォームである waters_connect™ で動作するベンチトップ型高分解能質量分析計であり、データ取り込みと解析の統合が可能になります。データ非依存型(MSE)MS/MS 取り込みおよびターゲット MS/MS 取り込みを使用して、修飾オリゴヌクレオチドを特性解析しました。全体的な分析およびインフォマティクスワークフローは、規制対象ラボおよび規制対象外のラボのいずれにも適しており、特性解析とルーチンのオリゴヌクレオチド品質評価の両方が可能になります。
アプリケーションのメリット
- INTACT™ Mass アプリにより、完全長プロダクトの迅速な自動質量割り当て、オリゴヌクレオチド不純物の推定同定を行える
- CONFIRM™ Sequence アプリにより、DIA(MSE)MS/MS データとターゲット MS/MS データの両方に含まれるオリゴフラグメントイオンのアノテーションが効率化する
- 配列の欠失および挿入を見つけ、配列修飾やスクランブルの箇所を特定できる
- ACQUITY™ Premier UPLC と組み合わせた Xevo G3 QTof MS は、規制対象ラボおよび規制対象外のラボのいずれにも展開できる、合成オリゴヌクレオチド分析用の、高感度で頑健かつ柔軟な分析プラットフォームを提供する
はじめに
多くのオリゴヌクレオチド医薬品(ONT)は化学合成されており、製品関連不純物に一般に分類される合成アーティファクトや分解物が見られます。最も一般的な種類の ONT 分子には、遺伝子やタンパク質の発現を調節するアンチセンスオリゴヌクレオチド(ASO)や干渉 RNA(siRNA)、タンパク質や高分子の機能を調節するアプタマー RNA などがあります1-2。 合成オリゴヌクレオチドに医薬品としての関心が高まり、構造の複雑さが増す傾向にあるため、不純物特性解析のための高度な分析法があることが、製品の安全性と有効性を確保する上で重要です。
オリゴヌクレオチド分析用のいくつかの LC-MS ワークフローが最近、ウォーターズコーポレーションによって導入されました3-6。 これらのワークフローは、頑健で再現性のある LC-MS プラットフォームを提供する GMP 対応の UPLC-Tof MS システムを使用して最適化されており、MS の専門家でないユーザーでも利用できて、手動でのデータ解析の必要性が少なくなる合理化されたインフォマティクスアプリケーションによってサポートされています。以前の試験により、Max Peak テクノロジーを採用した ACQUITY Premier テクノロジーによって、合成オリゴヌクレオチドのクロマトグラフィー分離を、回収率および再現性の面で改善できることがわかっています7,8。 さらに、データ解析に使用するインフォマティクスプラットフォームにより、オリゴヌクレオチドスペクトルの自動ピークピッキングや高速デコンボリューションが可能になり、これによって不純物割り当てが迅速に行え、結果として得られる質量精度および定量機能によって不純物分析がサポートされます5-6。
waters_connect アプリ CONFIRM Sequence が、配列確認のための MS/MS フラグメンテーションスペクトルおよび MSE(データ非依存型)フラグメンテーションスペクトルの自動解析用に導入されました6。シーケンスカバー率を「ドットマップ」図で表示することで、シーケンスカバー率を簡単に評価し、修飾部位を特定することができます。
今回説明する試験では、合成ヌクレオチドの不純物の分析に Xevo G3 QTof システム(図 1)および 2 つの waters_connect アプリケーション(INTACT Mass および CONFIRM Sequence)を使用しました。低レベルの不純物を検出して確認する能力を評価しました。

実験方法
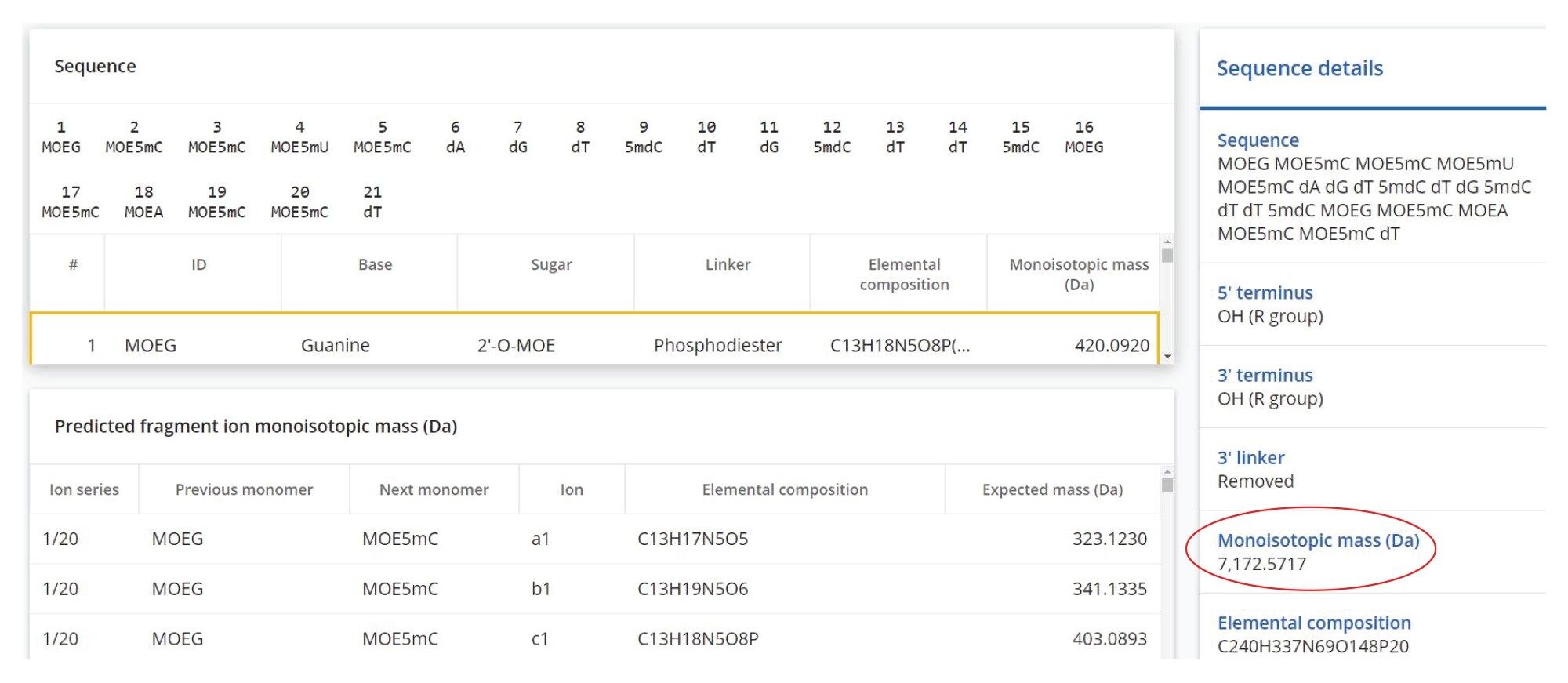
13 の修飾ヌクレオチドを含む 21 mer 合成 siRNA ヌクレオチド(配列:GCC UCA GTC TGC TTC GCA CCT)を ATDBio(英国、サザンプトン)から入手しました。このオリゴヌクレオチド配列では、修飾ヌクレオチドを色付き文字、通常の(修飾されていない)ヌクレオチドを黒色の文字で示しています。2'-O-(2-メトキシエチル)-(2'-MOE) 修飾が、2 つのグアノシン(G)と 1 つのアデノシン(A)に付加されています。また、1 つのウリジン(U)と 6 つのシチジン(C)は、2'-MOE 官能基の付加に加えて、核酸塩基への 5-メチル(5-Me)基の付加によってさらに修飾されており、1 つの 2'-MOE 5-Me ウリジン(U)と 6 つの 2'-MOE 5-Me シチジン(C)になっています。21 mer 配列中に存在する 9 つのシチジン残基のうち 3 つは、核酸塩基への 5-Me 官能基(C)の付加でのみ修飾されていました。最終的に、修飾されていないヌクレオチドは、1 つのアデノシン(A)、2 つのグアノシン(G)、5 つのデオキシチミジン(T)の 8 つでした。ストック溶液は、濃度 1 μM(2.4 μg/mL)で脱イオン水中に調製してから、10 μL を注入しました。これは、21 mer のオリゴヌクレオチドのオンカラムロード 10 ピコモルに相当します。図 2 に、合成オリゴヌクレオチド(21 mer)の構造を示します。
データ取り込みおよび解析は、waters_connect インフォマティクスプラットフォームを使用して行いました。インタクトオリゴヌクレオチドの ESI-MS スペクトルは、INTACT Mass アプリによって自動的に解析されました。自動解析ワークフローの一環として、オリゴヌクレオチドの純度評価を UV レスポンスに基づいて計算しました。個々の MS/MS スペクトルおよび MSE のデータセットを、各オリゴヌクレオチドプリカーサーのフラグメンテーションの最適コリジョンエネルギーを用いて CONFIRM Sequence アプリによって解析し、完全長プロダクトおよび製品不純物を配列確認しました。

LC 条件
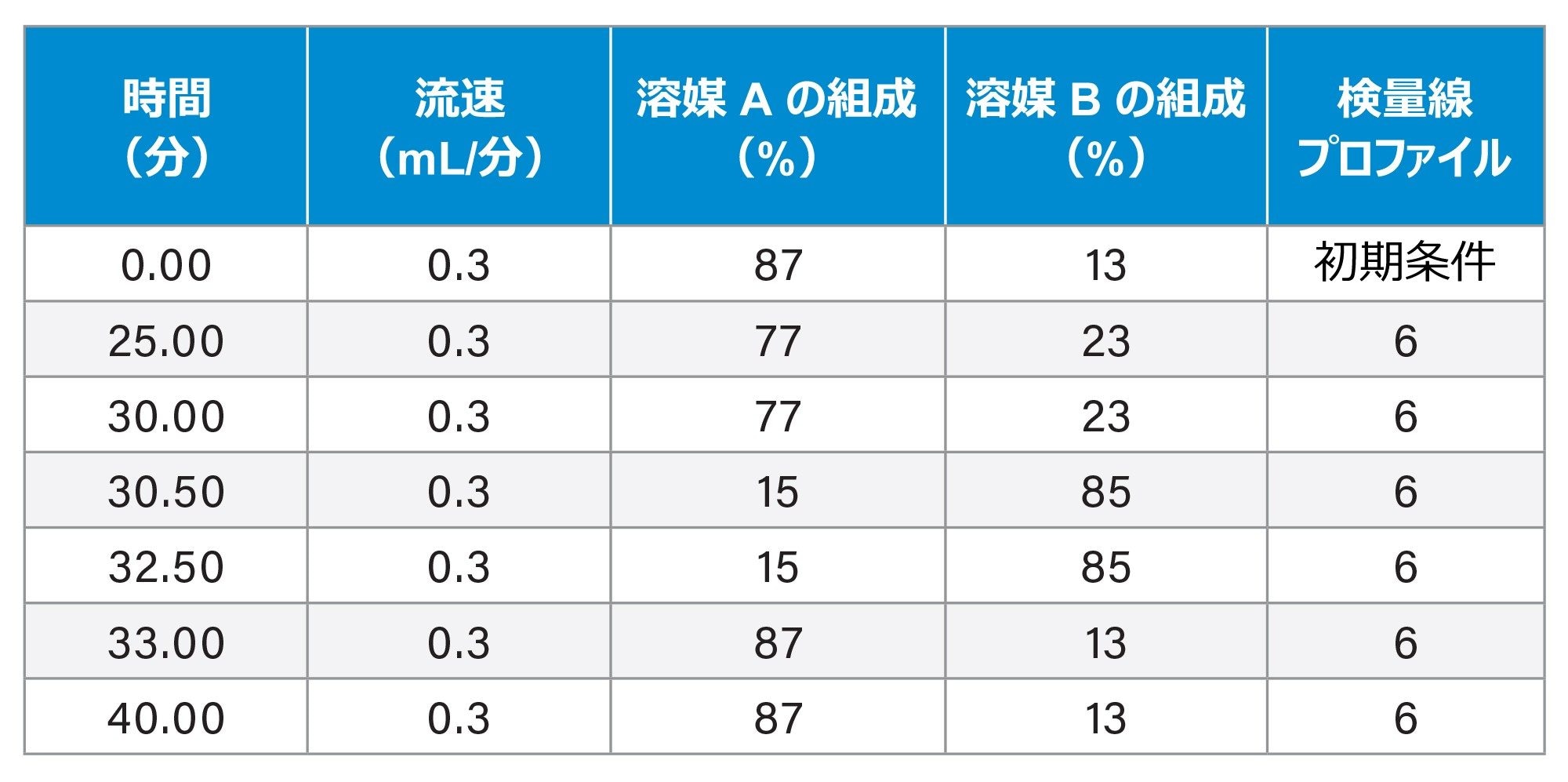
|
LC システム: |
ACQUITY UPLC Premier BSM |
|
カラム: |
ACQUITY Premier OST 2.1 × 150 mm、1.7 μm CSH™ C18 粒子を充塡(製品番号:186009486) |
|
カラム温度: |
60 ℃ |
|
流速: |
300 µL/分 |
|
移動相: 移動相 A: 移動相 B: |
7 mM トリエチルアミン(TEA)および 40 mM ヘキサフルオロイソプロパノール(HFIP)含有 Milli-Q 水(pH 8.6) 3.5 mM TEA および 20 mM HFIP 含有 50% メタノール |
|
グラジエントテーブル: |
表 II を挿入 |
|
注入量: |
10 µL |
|
洗浄溶媒: |
パージ溶媒:50% メタノール |
|
サンプルマネージャー洗浄溶媒: |
50% メタノール |
グラジエントテーブル
MS 条件
|
MS システム: |
Xevo G3 QTof質量分析計 |
|
イオン化モード: |
ESI(-) |
|
キャピラリー電圧: |
2.8 kV |
|
コーン電圧: |
25 V |
|
イオン源オフセット: |
60 V |
|
イオン源温度: |
120 ℃ |
|
脱溶媒温度: |
450 ℃ |
|
コーンガス流量: |
50 L/時間 |
|
脱溶媒ガス流量: |
500 L/時間 |
|
ToF 質量範囲: |
400 ~ 2000(MSE 取り込み) |
|
取り込み速度: |
0.5 秒 |
|
低エネルギー CE: |
6 V |
|
高エネルギー CE ランプ: |
15 ~ 45 V |
|
データ取り込み: |
waters_connect 3.6.0.21 |
|
データ解析: |
waters_connect 3.6.0.21 |
|
INTACT Mass アプリ: |
バージョン 1.8.0.10 |
|
CONFIRM Sequence アプリ: |
バージョン 1.4.0.13 |
結果および考察
Max Peak テクノロジーシステムを採用した ACQUITY Premier UPLC を Xevo G3 QTof MS システムと組み合わせて使用したデータ取り込み
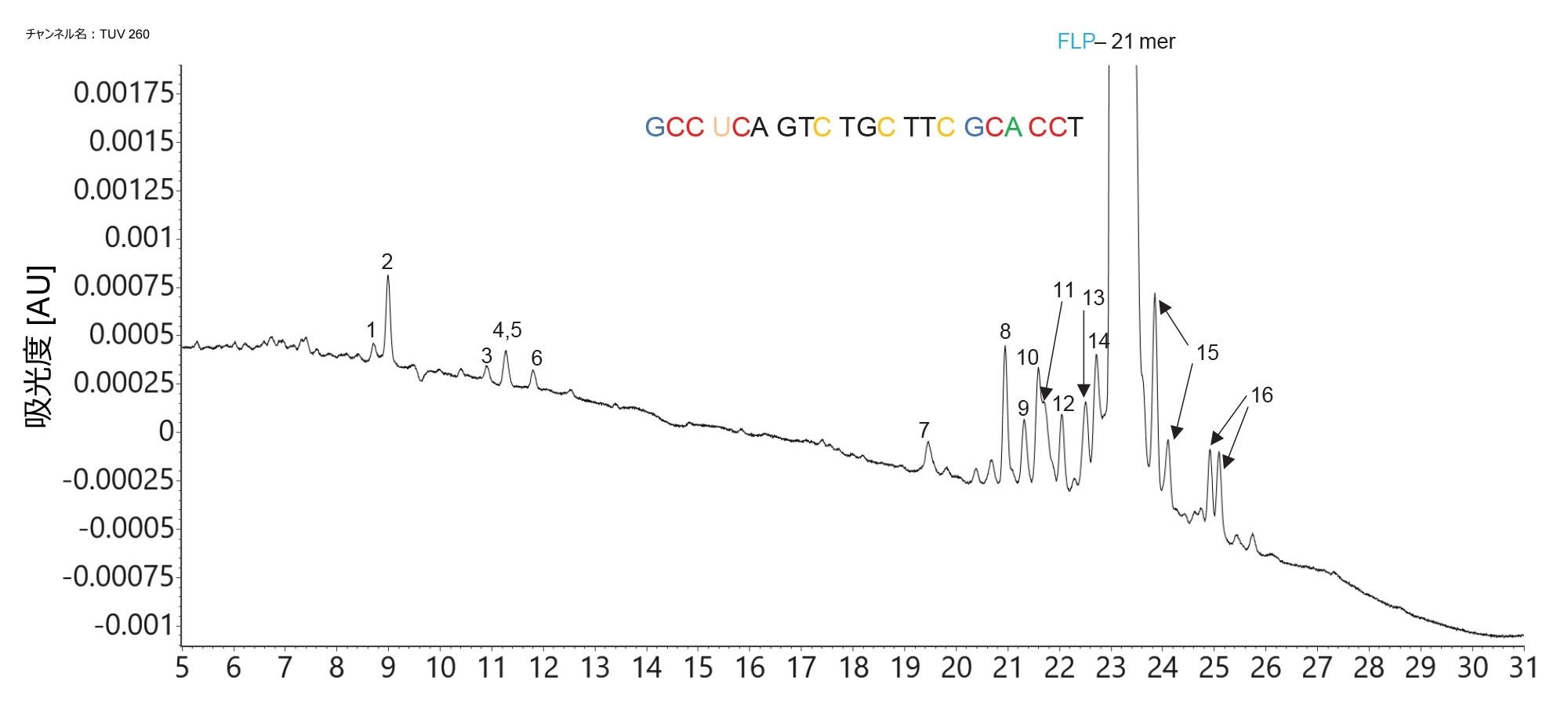
この試験に使用した siRNA サンプル(21 mer)は、通常の固相法を使用して合成しました。以前、High Performance Surfaces テクノロジーを採用した ACQUITY Premier UPLC カラムにより、カラムコンディショニングの必要性が低減し、ピーク形状が改善し、低存在量の不純物の回収率が向上することで、従来のステンレススチール製カラムと比較して、オリゴヌクレオチド不純物に対するクロマトグラフィー性能が向上することを実証しました4。 この siRNA オリゴマーについて分離された 16 種の合成関連不純物が、図 3 に示した LC-UV クロマトグラムに見られます。UV データによると、最も低存在量(FLP のピーク面積に対して 0.05%)の不純物は最初に溶出するピークです。この不純物分析に使用した ACQUITY UPLC Premier システムは、微量レベルのオリゴヌクレオチド不純物の頑健な分離が可能になる非常に不活性なシステムです。
Xevo G3 QTof MS システムは、バイオ医薬品アプリケーション用に最適化された以下の機能を提供することを意図して開発されました:1)低質量の不安定な分子種のイオン透過率を改善、2)包括的定量/定性分析のためのスペクトル間およびスペクトル内の広いダイナミックレンジによる定量機能の向上、3)新規イオン光学系による頑健性と再現性の改善。このプラットフォームを waters_connect インフォマティクスと組み合わせることで、開発における製品の特性解析だけでなく、規制対象の開発、製造、品質管理の各部門におけるよりルーチンなアッセイにも適しています。
存在量が最も少ない不純物(図 3 のピーク 1、6 mer のリン酸化不純物)について記録された ESI-MS スペクトルの組み合わせを図 4 に示します。このスペクトルでは、対応する 2 価および 3 価のプリカーサーが明らかになっており、Xevo G3 装置が微量レベルの不純物を検出できることがわかります。
低存在量のオリゴヌクレオチド不純物から生じるプリカーサーの高感度の透過により、最終的に、ターゲット MS/MS 取り込みモードや DIA(MSE)取り込みモードでの衝突誘起解離によるフラグメンテーションが向上します。図 5 に示すように、データを CONFIRM Sequence アプリで分析すると、5'-リン酸化 6 mer(図 3 のピーク 1 として同定)の 2 価プリカーサー(m/z=1120.7)の MS/MS フラグメンテーションから、高いシーケンスカバー率(83%)が得られました。インタクト質量測定と MS/MS シーケンスデータの組み合わせの相乗効果により、セミ定量データと不純物割り当てに対する強い信頼が得られます。

![5'-リン酸化された 6 mer の最も低存在量のオリゴヌクレオチド不純物(図 1 でピーク 1 とラベル付け)の [M-2H]-2 プリカーサー(m/z=1120.7)の MS/MS フラグメンテーションから得られたドットマップシーケンスカバー率(83%)](/content/dam/waters/en/app-notes/2024/720008480/720008480en-f5.jpg.82.resize/img.jpg)
INTACT Mass アプリを使用した自動質量割り当て
指定したしきい値を超えて検出された各オリゴ不純物について、不純物の分子量および FLP のピーク面積と比較した相対存在量の計算(TUV および/または TIC トレースに基づく)を行いました。INTACT Mass アプリソフトウェアを使用して、IP-RP UPLC-UV-MS クロマトグラムをノンターゲット法で解析しました。ここでは、自動 BayesSprayTM デコンボリューションを用いて、データ解析メソッドで設定した一連のデコンボリューション基準(RT のウインドウおよびイオンカウントしきい値)を満たす成分すべての中性モノアイソトピック質量を計算しました。
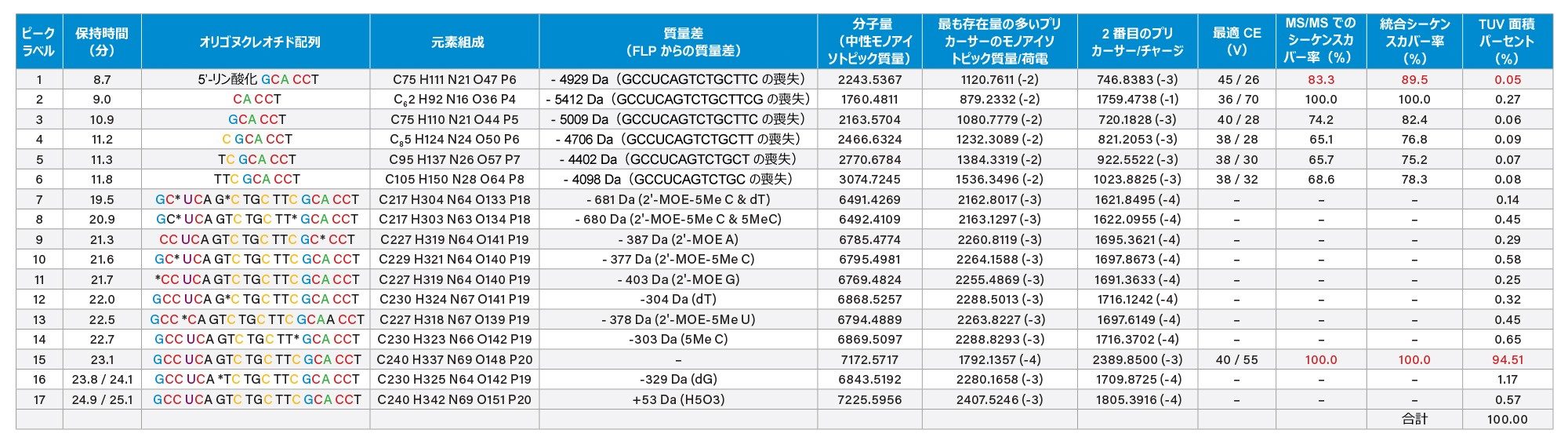
ノンターゲット質量分析の結果は、オリゴの同定および予想精密モノアイソトピック質量(ニュートラル質量)を含む解析メソッド内のターゲットのリストを更新するだけで、ターゲット分析に変換することができます。INTACT Mass の結果は、図 6 に、デコンボリューション済みスペクトル(パネル A - 上段)、さまざまなチャージ状態の存在を示す生 ESI-MS スペクトル(パネル B - 中段)、デコンボリューションプロセスの忠実度の評価に使用したモックスペクトル(パネル C - 下段)の 3 つのパネルに示しています。INTACT Mass の解析結果を含むテーブルの一部を示します(図 7)。16 種の不純物(このサンプル中に検出された不純物の合計数)のうち、この表に FLP とともに示す 9 種類は、10 ppm を超える質量精度で推定割り当てできたと考えられます。


CONFIRM Sequence アプリを使用したオリゴヌクレオチド不純物の配列確認
データ非依存型フラグメンテーションスペクトル(高エネルギー MSE)の自動注釈およびターゲット MS/MS スペクトルの注釈は、waters_connect の CONFIRM Sequence アプリを使用して行われました。複数の MS/MS スペクトルおよび/または MSE スペクトルを、1 つ以上のオリゴヌクレオチド配列について分析することができます。
オリゴヌクレオチド配列を保存する Synthetic Library に、21 mer の高度に修飾された siRNA ヌクレオチドが自動入力されました(図 8)。[M-4H]-4 プリカーサーが選択されて四重極を使用した MS/MS フラグメンテーションを受け、最適固定コリジョン電圧(40 V)を使用して Xevo G3 QTof MS のコリジョンセル内でフラグメント化されました。CONFIRM Sequence アプリでのデータ解析によって得られた結果から(図 9)、FLP のシーケンスカバー率が完全(100%)であることがわかります。この「ドットマップ」カバレッジビューに、21 mer 配列が 5' から 3' 末端まで表示され、割り当てられたフラグメントイオンがドット(個々のヌクレオチド)の上下に表示されています。
FLP に加え、TUV ピーク面積が FLP のピーク面積の 0.05% 以上である 16 種のオリゴヌクレオチド不純物のうち 6 種についてターゲット MS/MS を行いました。ヌクレオチド配列、元素組成、中性モノアイソトピック質量、最も存在量の多いプリカーサー、最適コリジョンエネルギー、(単一の MS/MS スペクトルおよびコンバインされた 2 つの MS/MS スペクトルからの)シーケンスカバー率、FLP に対する不純物の存在量(TUV 面積の割合として)など、これらの分析で得られたデータを表 I にまとめています。図 4 および図 5 に示した ESI-MS スペクトルおよび MS/MS スペクトルによると、最も低存在量(0.05%)の不純物は、5'-リン酸化 GCA CCT と同定されています。表 I に示すように、この不純物の 2 価および 3 価のプリカーサーの MS/MS フラグメンテーションスペクトルの分析から得られた、全体的なシーケンスカバー率は 89.5% です。
![完全なシーケンスカバー率(100%)が 21 mer の siRNA オリゴヌクレオチドの[M-4H]-4 プリカーサー(m/z=1792.14)の MS/MS フラグメンテーションから得られた](/content/dam/waters/en/app-notes/2024/720008480/720008480en-f9.jpg.82.resize/img.jpg)
結論
- 低レベルの不純物を同定して確認する能力は、オリゴヌクレオチド医薬品を効果的に特性解析し、製品バッチの品質をモニターするために重要です。
- インタクト質量分析とフラグメンテーションベースの配列確認の相乗効果により、全体的な不純物プロファイリングおよび不純物割り当てのターゲットを絞った確認が可能になり、この重要なクラスの医薬品の合成製造プロセスの信頼性が向上します。
- UV データと Xevo G3 QTof MS 検出器の両方を使用して、合成オリゴヌクレオチド中に検出された推定不純物の自動割り当てを、waters_connect INTACT Mass アプリを使用して行ったところ、代表的な質量誤差は 10 ppm 未満でした。
- 6 種のオリゴヌクレオチド不純物について記録された MS/MS スペクトルと 21 mer の高度に修飾された FLP について記録された MS/MS スペクトルを、同じシステムで取り込み、CONFIRM Sequence アプリを使用して解析して、予想配列を確認しました。
- CONFIRM Sequence アプリの、低存在量の不純物(相対存在量約 0.05%)について高いシーケンスカバー率(83.3%)を達成できることが確認されました。
参考文献
- Sharma VK, Watts JK Oligonucleotide therapeutics: chemistry, delivery and clinical progress, Future Med Chem, 2015, 7(16), 2221–2242.
- Roberts TK, Langer R, Wood MJA Advances in oligonucleotide drug delivery, Nat Reviews, 2020, 19, 673–694.
- Catalin E. Doneanu, Jonathan Fox, Emma Harry, Chris Knowles, Ying Qing Yu, Joseph Fredette, Weibin Chen, An Automated Compliance-Ready LC-MS Workflow for Intact Mass Confirmation and Purity Analysis of Oligonucleotides, Waters application note, 720006820, 2020.
- Catalin E. Doneanu, Chris Knowles, Jonathan Fox, Emma Harry, Ying Qing Yu, Joseph Fredette, Weibin Chen, Analysis of Oligonucleotide Impurities on the BioAccord System with ACQUITY Premier, Waters application note, 720007301, 2021.
- Catalin E. Doneanu, Patrick Boyce, Henry Shion, Joseph Fredette, Scott J. Berger, Heidi Gastall, Ying Qing Yu, LC-MS Analysis of siRNA, Single Guide RNA and Impurities using the BioAccord System with ACQUITY Premier System and New Automated INTACT Mass Application, Waters application note, 720007546, 2022.
- Catalin E. Doneanu, Chris Knowles, Matt Gorton, Henry Shion, Joseph Fredette, Ying Qing Yu, CONFIRM Sequence: A waters_connect Application for Sequencing of Synthetic Oligonucleotides and Their Impurities, Waters application note, 720007677, 2022.
- DeLano M, Walter TH, Lauber MA, Gilar M, Jung MC, Nguyen J, Boissel C, Patel AV, Bates-Harrison A, Wyndham K Using Hybrid Organic-Inorganic Surface Technology to Mitigate Analyte Interactions with Metal Surfaces in UHPLC, Anal Chem, 2021, 93, 5773–5781.
- Gilar M, DeLano M, Gritti F Mitigation of Analyte Loss on Metal Surfaces in liquid chromatography, J Chrom A, 2021, 1650, 5773–5781.
720008480JA、2024 年 8 月