改変 GlycoWorks 手順による検出感度の向上
要約
このアプリケーションノートでは、低存在量の遊離 N 型糖鎖の検出において、データの質や使いやすさを損なうことなく FLR および MS の感度が向上する、改変 GlycoWorks™ RapiFluor-MS™ 手順について紹介します。この更新された手順は、検出感度の向上と N 型糖鎖の過剰標識低減の両方において、NHS カルバメート修飾プロカインアミド(InstantPC™)ベースのメソッドよりも優れていることがわかりました。
アプリケーションのメリット
- 改変 GlycoWorks 手順により、使いやすさを損なうことなく、FLR 感度が 3 倍、MS 感度が 2 倍向上
- IPC を用いる Agilent™ AdvanceBio™ Gly-X™ N 型糖鎖調製キットと比較して、FLR 感度が 1.5 倍、MS 感度が 2.5 倍向上
- IPC を用いる Agilent AdvanceBio Gly-X N 型糖鎖調製キットと比較して、N 型糖鎖の過剰標識が 1.5 ~ 2 倍減少
はじめに
N 結合型グリコシル化は、バイオ医薬品の開発中に詳細にモニターする重要品質特性(CQA)です。バイオ医薬品の N 型糖鎖プロファイルは、クリアランス速度、エフェクター機能、免疫原性に影響する可能性があります1,2。 例えば、高マンノース糖鎖は抗体医薬品の血清半減期を低減させることが報告されています3。 したがって、バイオ医薬品の効率的な開発および承認には、N 型糖鎖解析用の迅速で頑健な分析法が必要です。さらに、これらの分析法には、高マンノース 5(Man5)などの低存在量の糖鎖の変化を検出するのに十分な感度が必要です。
Waters™ GlycoWorks RapiFluor-MS(RFMS)N 型糖鎖標識キットは、高感度の蛍光検出および MS 検出のために、N 型糖鎖を遊離させて標識するための迅速で簡便なメソッドになります。この手順では、迅速な PNGase F を使用して N 型糖鎖を酵素で遊離させ、遊離 N 型糖鎖を RFMS で標識し、HILIC-SPE を用いてサンプルをクリーンアップします。前処理するサンプルの数によってプロセス全体で 1 ~ 2 時間かかり、幅広いサンプルに適用できます4–7。
このアプリケーションノートでは、開始時のサンプル量を増やすことにより、RFMS 標識 N 型糖鎖の FLR 検出および MS 検出の感度がそれぞれ 3 倍および 2 倍増加しています。この高感度プロトコルを使用して前処理したサンプルの N 型糖鎖プロファイルおよび HILIC-SPE 回収率を報告し、Agilent AdvanceBio Gly-X N 型糖鎖前処理・クリーンアップキットと比較しています。最後に、遊離 N 型糖鎖の過剰標識を評価しています。GlycoWorks キットを用いると、InstantPC(IPC)を用いる Agilent の AdvanceBio Gly-X N 型糖鎖調製キットよりも、過剰標識が 1.5 ~ 2 倍少ない N 型糖鎖が得られます。
実験方法
GlycoWorks によるサンプル前処理
遊離 N 型糖鎖および RFMS 標識 N 型糖鎖は、GlycoWorks RapiFluor-MS N 型糖鎖エコキット(製品番号:176005289)を使用して調製しました。試薬およびサンプルは、アプリケーションノート 720005506 で発表している QC/自動化に適したプロトコルに従って調製しました。簡単に説明すると、10 µL のサンプル(40 µg の場合は 4 mg/mL、15 µg の場合は 1.5 mg/mL)を 10 µL の RapiGest™ SF 界面活性剤(3%)と混合し、90 ℃ で 3 分間加熱しました。室温で 3 分間冷却した後、10 µL の希釈済み PNGase F を添加し、サンプルを 50 ℃ で 5 分間加熱しました。サンプルを室温で 3 分間冷却し、10 µL の RFMS(82.5 µg/µL)で処理し、混合して、室温に 5 分間置きました。サンプルは、GlycoWorks 取扱説明書(715005359)に従って HILIC-SPE によってクリーンアップし、希釈せずに直接分析しました。
Gly-X によるサンプル前処理
遊離 N 型糖鎖および IPC 標識 N 型糖鎖を、Agilent の IPC を用いる AdvanceBio Gly-X N 型糖鎖調製キット(製品番号:GX96-IPC)を使用して、ユーザーマニュアル(5994-1231EN)に記載されている手順に従って調製しました。すべての試薬をユーザーマニュアルに概説されているとおりに調製しました。簡単に説明すると、20 µL のサンプル(40 µg の場合は 2 mg/mL、15 µg の場合は 0.75 mg/mL)を 2 µL の Gly-X 変性剤と混合し、90 ℃ で 3 分間加熱しました。室温で 2 分間冷却した後、2 µL の N-グルカナーゼ作業用溶液を添加し、サンプルを 50 ℃ で 5 分間加熱しました。5 µL の IPC 色素液を直ちに添加し、サンプルを 50 °C で 1 分間加熱しました。Agilent の AdvanceBio Gly-X InstantPC クリーンアップモジュール(製品番号:GX96-102)を使用し、ユーザーマニュアルに概説されている手順に従って HILIC-SPE でサンプルをクリーンアップし、希釈せずに直接分析しました。
LC 条件
|
LC システム: |
ACQUITY™ UPLC™ H-Class(FLR)または ACQUITY Premier UPLC(MS) |
|
カラム: |
ACQUITY Premier Glycan BEH™ Amide、130 Å、1.7 µm、2.1 × 100 mm(製品番号:186009523) |
|
カラム温度: |
60 ℃ |
|
サンプル温度: |
6 ℃ |
|
注入量: |
1 µL |
|
移動相 A: |
50 mM ギ酸アンモニウム水溶液、pH 4.4(LC-MS グレード、製品番号:186007081) |
|
移動相 B: |
アセトニトリル |
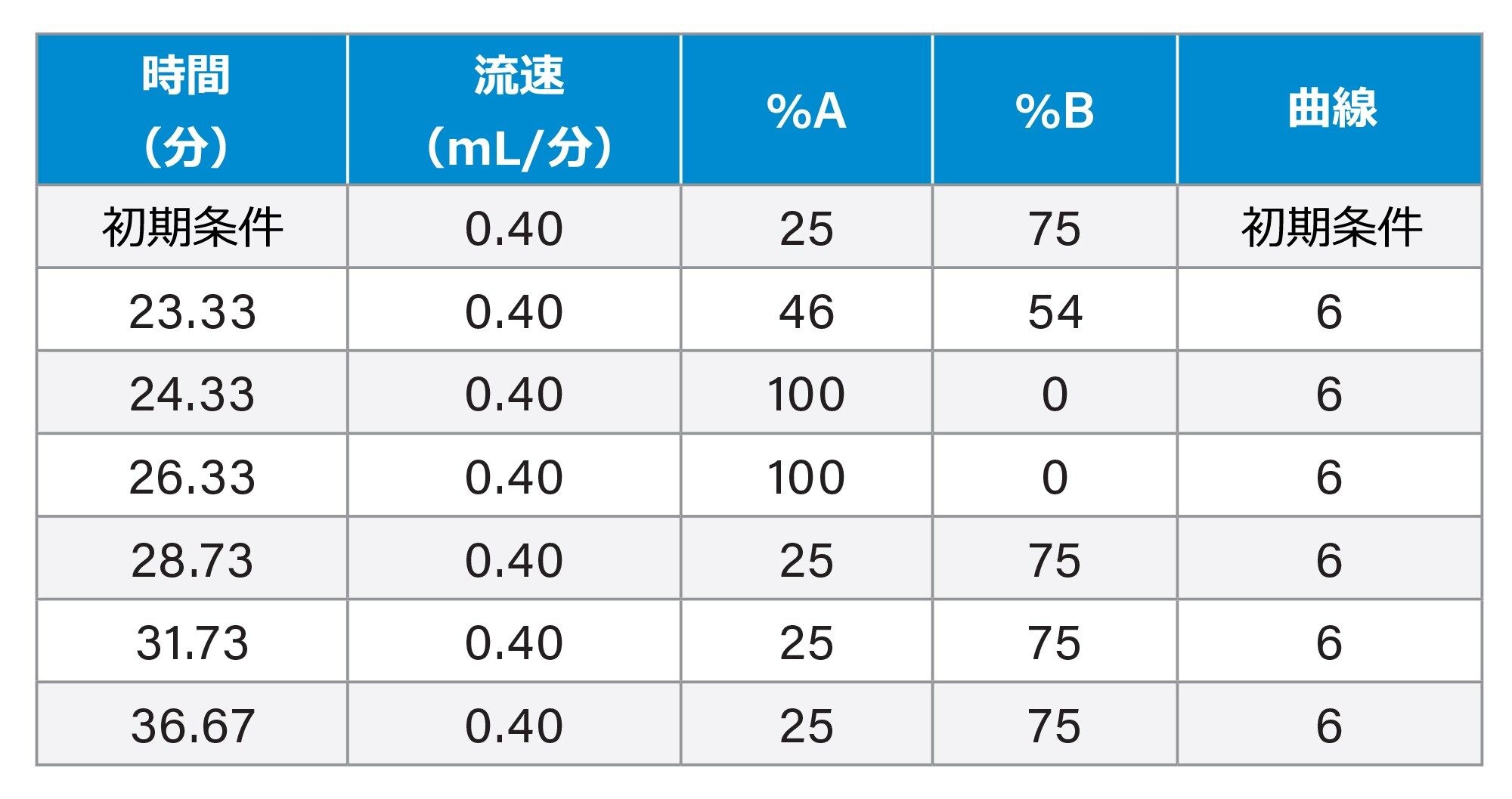
グラジエントテーブル
ACQUITY UPLC FLR 検出器設定
|
λex (RFMS): |
265 |
|
λem (RFMS): |
425 |
|
λex (IPC): |
285 |
|
λem (IPC): |
345 |
|
サンプリングレート: |
2 Hz |
Xevo G2-XS QToF 検出器設定
|
質量範囲: |
m/z 50 ~ 2000 |
|
イオン化モード: |
ESI+ |
|
測定モード: |
感度 |
|
実験の種類: |
MSE |
|
サンプリングレート: |
1 Hz |
|
キャピラリー電圧: |
3.00 kV |
|
コーン電圧: |
80 V |
|
イオン源温度: |
120 ℃ |
|
脱溶媒温度: |
300 ℃ |
|
コーンガス流量: |
50 L/時間 |
|
脱溶媒ガス流量: |
800 L/時間 |
|
コリジョンエネルギー: |
6 V |
|
高エネルギーランプ: |
15~40 V |
結果および考察
RFMS 標識 N 型糖鎖の感度向上
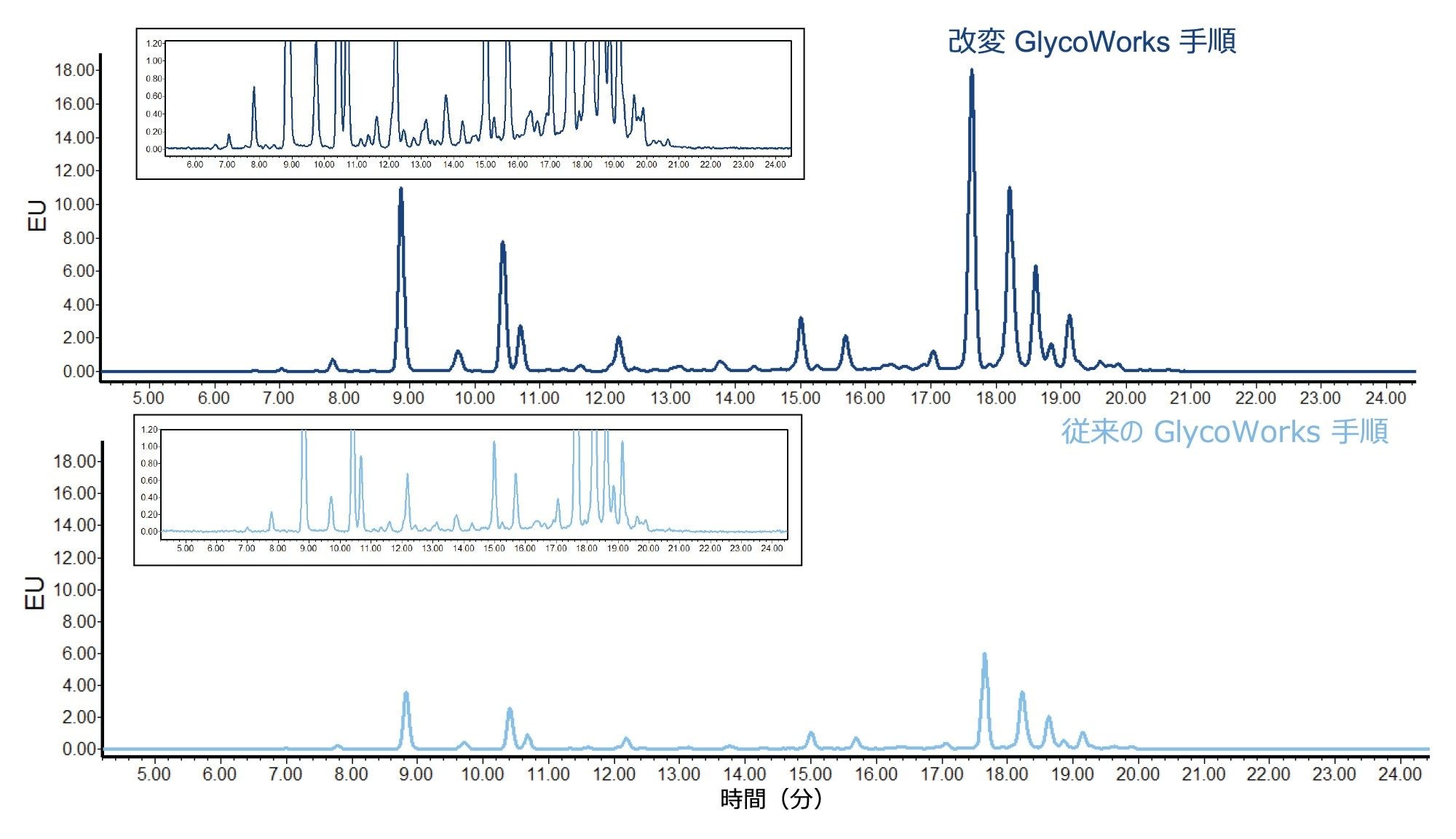
出発サンプル量を増やした改変 GlycoWorks 手順を使用して、モノクローナル抗体(NISTmAb)とウシフェチュインの混合物から N 型糖鎖を遊離させ、標識しました。この糖タンパク質の混合物を選択して、mAb 中の存在量が多い低分岐の中性型から、フェチュインに存在する高分岐の高シアル化型まで、広範な N 型糖鎖をカバーしました。図 1 に、従来の GlycoWorks 手順(各糖タンパク質 15 µg)および改変 GlycoWorks 手順(各糖タンパク質 40 µg)を用いて前処理した RFMS 標識 N 型糖鎖の HILIC-FLR クロマトグラムを示します。いずれのクロマトグラムも、NISTmAb/フェチュイン混合物に予想される N 型糖鎖のプロファイルを示しています。HILIC-FLR クロマトグラムにおいて、改変手順を使用して前処理したサンプルからは、従来の GlycoWorks 手順を使用して前処理したサンプルと比較して約 3 倍高いシグナルが見られます。HILIC-MS クロマトグラムでも同様のシグナル増加が見られます(下記のシグナル対ノイズデータ参照)。
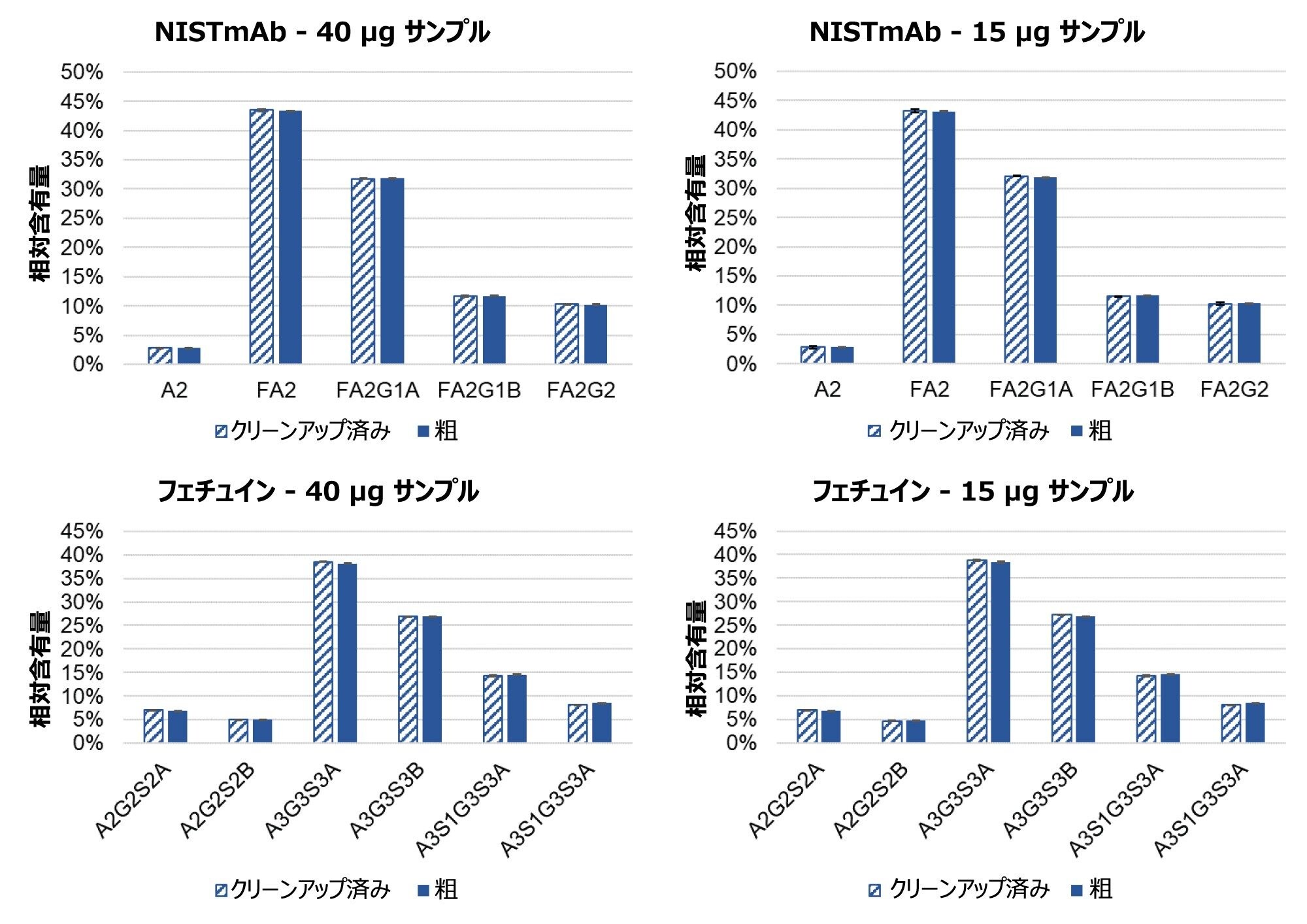
GlycoWorks キットを使用して、40 µg および 15 µg のサンプルから遊離させた、一部の NISTmAb およびフェチュインの N 型糖鎖の FLR ピークの相対存在量を図 2 に示します。NISTmAb とフェチュインのいずれの場合も、出発サンプル量を 15 µg から 40 µg に増やしても、N 型糖鎖の分布は変化していません。これらの結果から、広範なサンプル濃度にわたってキットの有効性が実証され、遊離反応および標識反応に悪影響を与えることなく検出感度を高められることが確認されます。相対存在量を HILIC-SPE クリーンアップの前後で示しており、クリーンアップのステップがサンプル濃度に関係なく非選択的であることを示しています。
Agilent の AdvanceBio キットとの比較
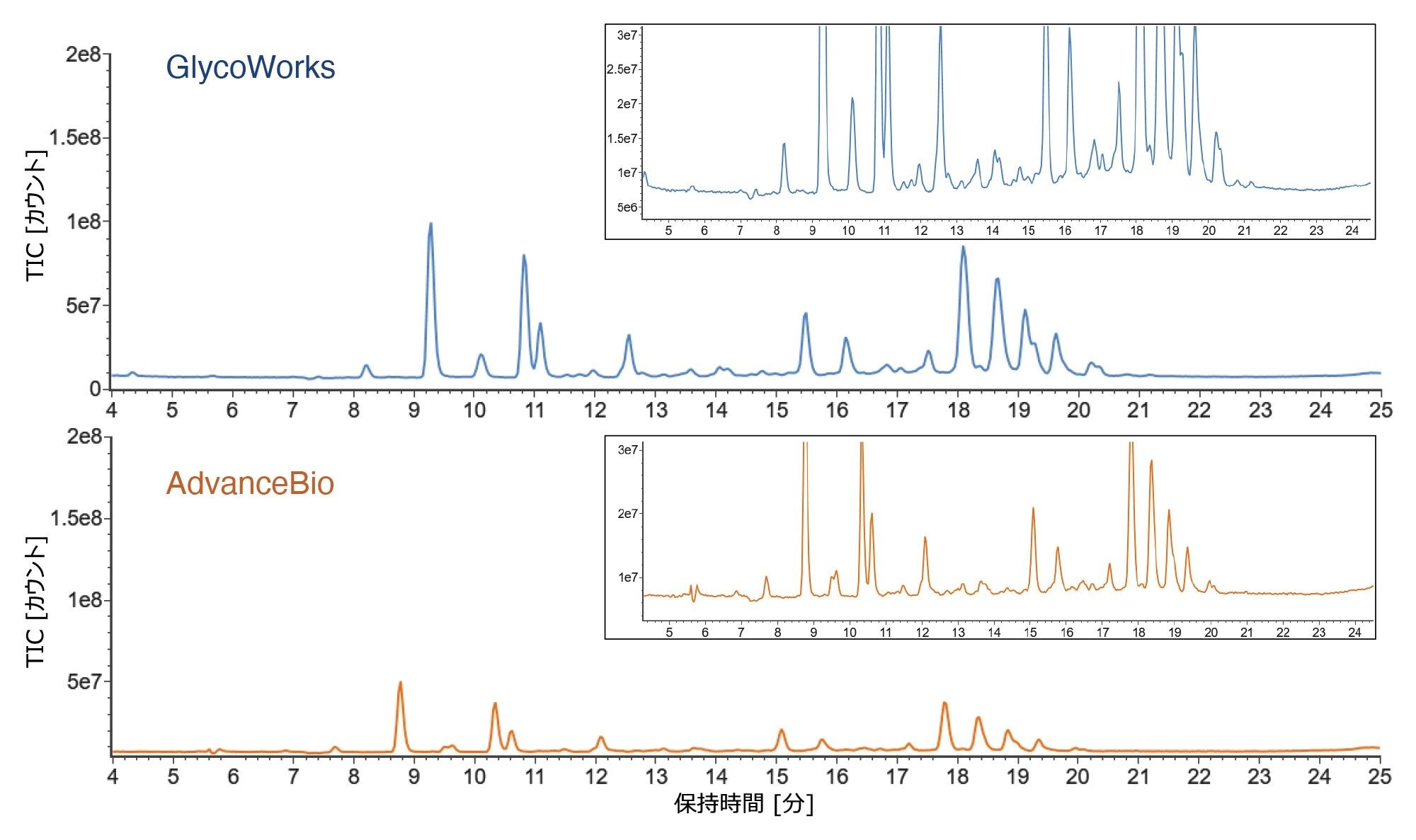
IPC を用いる Agilent の AdvanceBio Gly-X N 型糖鎖前処理キットも使用して、2 種類の濃度(各糖タンパク質 40 µg および 15 µg)の同じ NISTmAb/フェチュイン混合物から N 型糖鎖を遊離させて標識し、Gly-X の結果を Glycoworks で得られた結果と比較しました。GlycoWorks キットおよび AdvanceBio キットは、出発サンプル量に関係なく、同等の N 型糖鎖プロファイルを提供します(図 3 の MS クロマトグラムを参照)。
両方のキットの HILIC-SPE 回収率を、サンプルクリーンアップ前後の FA2 N 型糖鎖の FLR でのピーク面積を比較することで評価しました(図 4)。各糖タンパク質 15 µg ではどちらのキットでも同等の SPE 回収率ですが、各糖タンパク質 40 µg の場合は GlycoWorks クリーンアップキットの方が AdvanceBio キットよりも 1.5 倍高い回収率を得られます。GlycoWorks キットの SPE 回収率は、サンプル量を増やすことで向上しました。これは、総サンプル濃度を増やすと、クリーンアップ中のサンプル損失の相対レベルが低下するためと予想されます。AdvanceBio キットの SPE 回収率は、サンプル量を増やすと低下します。これはおそらく、SPE 手順のキャパシティー(推奨最大糖タンパク質量 40 µg)が限られているためです。
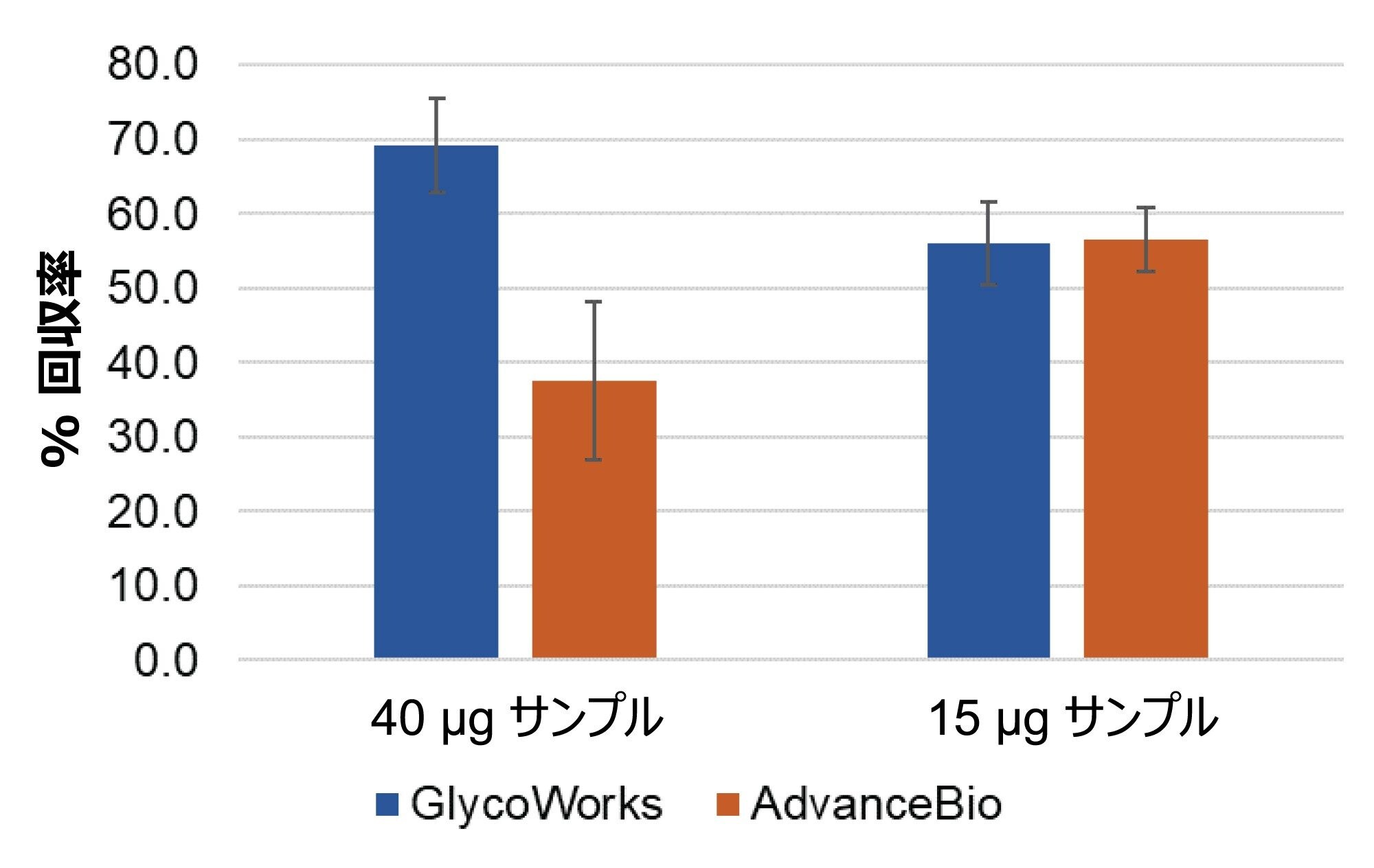
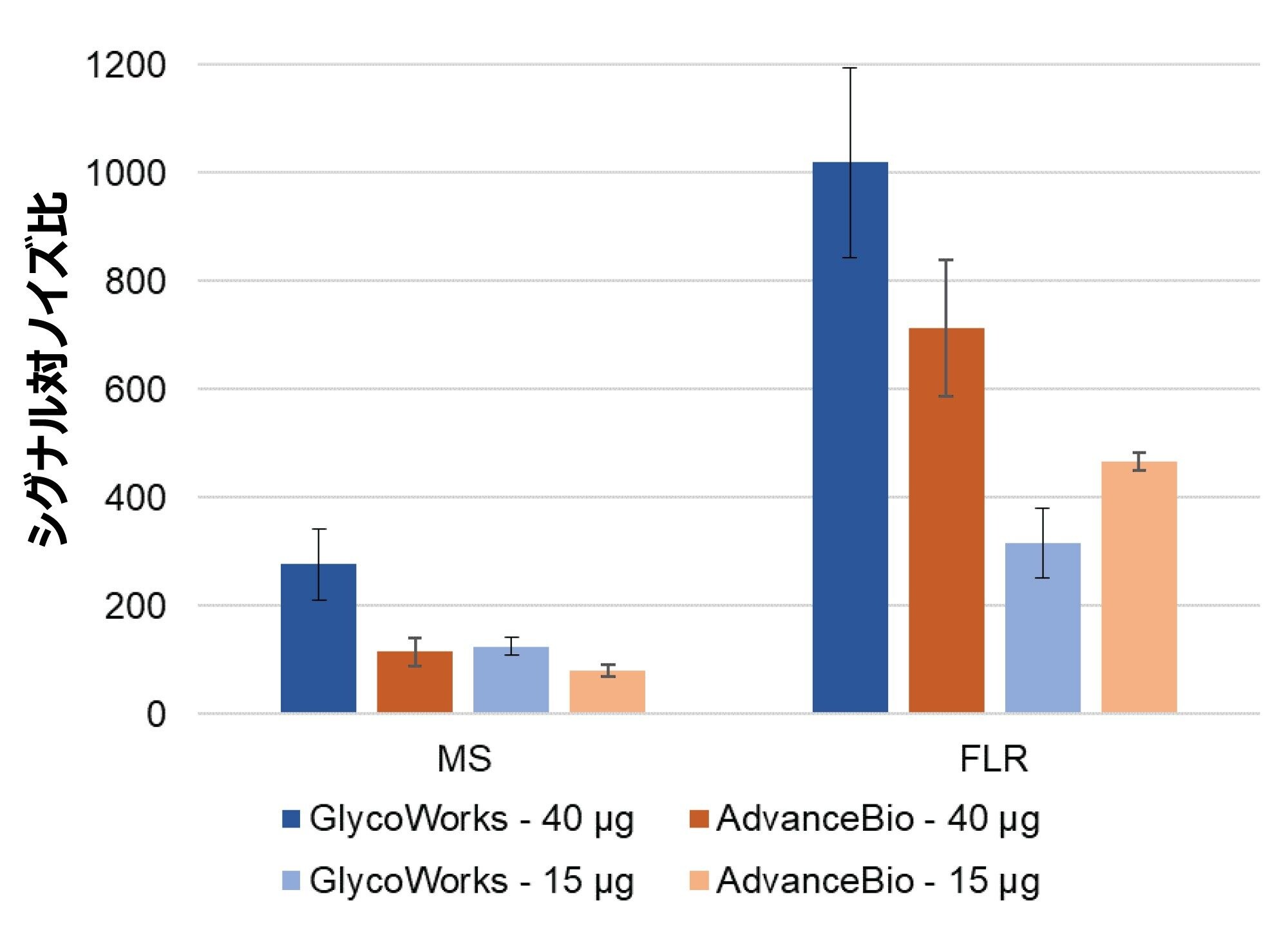
遊離 N 型糖鎖解析用のサンプル前処理キットを選択する際は、低存在量の糖鎖の変化を確実に検出するために、シグナル対ノイズ比(SNR)を考慮する必要があります。GlycoWorks キットおよび AdvanceBio キットを使用して前処理した、遊離標識 N 型糖鎖の FLR 検出および MS 検出の SNR を図 5 に示します。GlycoWorks キットでは、出発サンプル量に関係なく、AdvanceBio キットよりも高感度の MS 検出が得られます。FLR 検出では、各糖タンパク質 40 µg から開始する場合は、GlycoWorks キットの方が AdvanceBio キットよりも高感度ですが、各糖タンパク質 15 µg から開始する場合は、GlycoWorks キットの方が感度が低くなります。GlycoWorks キットは SPE 回収率が高いため、より高いサンプル量では、FLR 感度において AdvanceBio キットを上回る可能性があります。
遊離 N 型糖鎖の過剰標識
GlycoWorks キットおよび AdvanceBio キットでは、タンパク質中のリジン残基の修飾 N-ヒドロキシスクシンイミド(NHS)エステルによる架橋と同様の、遊離グリコシルアミンの NHS エステルによる化学的架橋を用います。ただし、タンパク質の NHS エステルによる架橋は、リジン以外の求核部位(例:N 末端、チロシン、セリン、スレオニン)との反応性により、過剰標識になる可能性があります8。 同様に、GlycoWorks キットおよび AdvanceBio キットを使用して前処理した遊離標識 N 型糖鎖は、複数の RFMS または IPC 分子による過剰標識について詳しく調べる必要があります。遊離 N 型糖鎖が過剰標識されると、保持時間のシフトが発生し、低存在量の N 型糖鎖の同定および定量が不正確になる可能性があります。
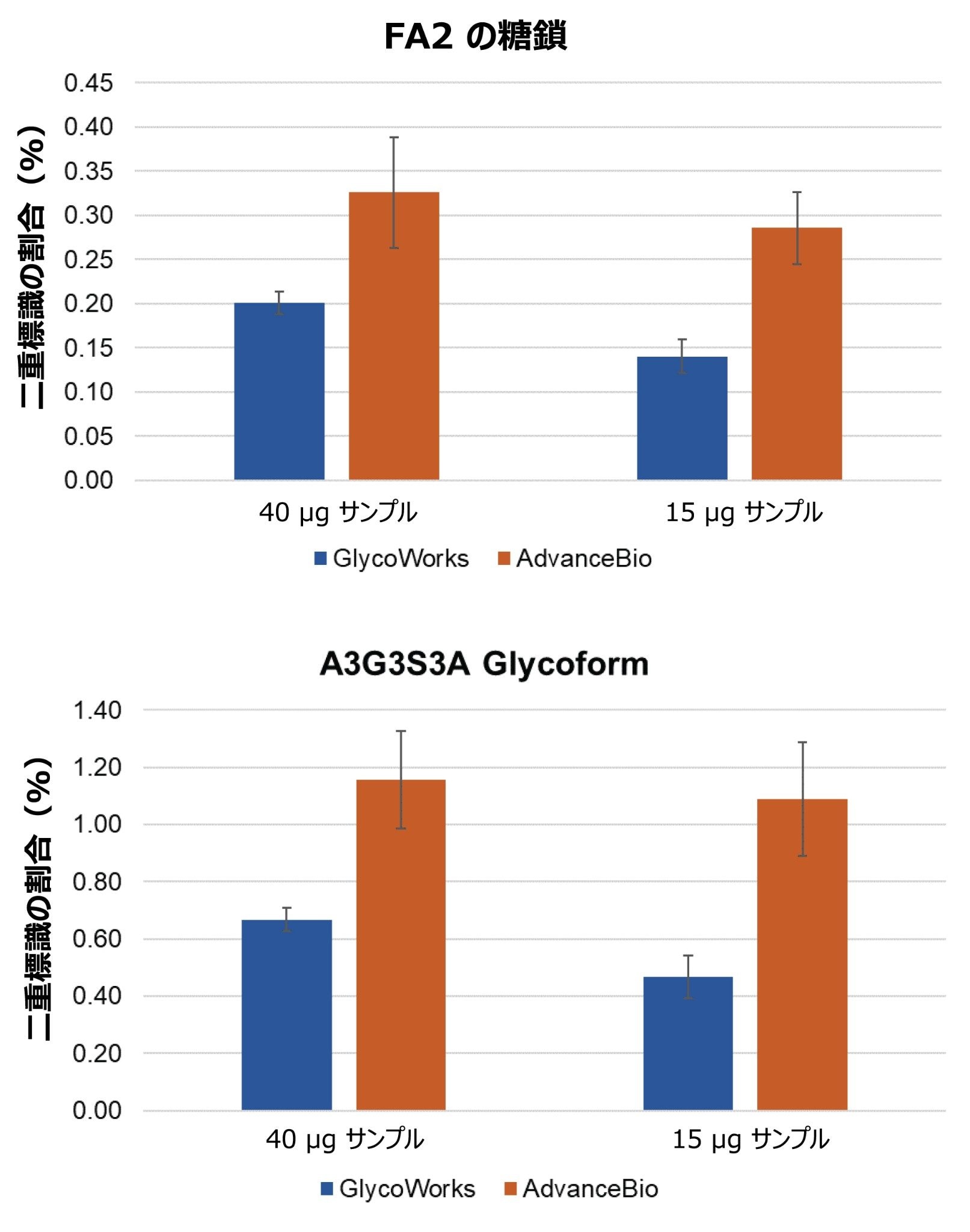
RFMS および IPC での過剰標識を、二重標識および一重標識の FA2 と A3G3S3 の N 型糖鎖の抽出イオンクロマトグラム(EIC)の波形解析によって測定しました。図 6 に、GlycoWorks キットおよび AdvanceBio キットを使用して前処理したサンプルにおける、二重標識分子種と一重標識分子種の合計に対する二重標識分子種の割合を示します。どちらのキットでも、A3G3S3 N 型糖鎖の方が FA2 N 型糖鎖よりも多くの過剰標識が見られ、出発サンプル量を 15 µg から 40 µg に増やすと、過剰標識がわずかに増加します。GlycoWorks キットを使用して前処理したサンプルでは、AdvanceBio キットよりも過剰標識が 1.5 ~ 2 倍少ない可能性があります。これらの結果から、過剰標識により低存在量の N 型糖鎖の同定および定量が不正確になるリスクが低減するという、GlycoWorks キットの大きな利点が明らかになっています。
結論
バイオ医薬品の効率的な開発および承認には、N 型糖鎖解析用の迅速で頑健かつ高感度の分析法が必要です。遊離の標識 N 型糖鎖の相対的定量に悪影響を与えることなく、検出感度が高くなる改変 GlycoWorks 手順が確立されました。この新しい手順では、出発サンプル量を増やすことで、FLR の SNR が 3 倍、MS の SNR が 2 倍高くなります。これらの高いサンプル濃度では、GlycoWorks キットでは、IPC を用いる Agilent の AdvanceBio Gly-X N 型糖鎖前処理キットと比較して、SPE 回収率の増加、FLR 感度の向上(1.5 倍高い)、MS 感度の向上(2.5 倍高い)が見られます。さらに、GlycoWorks キットを使用して前処理したサンプルでは、AdvanceBio キットと比較して、過剰標識が 1.5 ~ 2 倍少なくなっています。
参考文献
- Zhang, P., Woen, S., Wang, T., Liau, B., Zhao, S., Chen, C., Yang, Y., Song, Z., Wormald, M. R., Yu, C., Rudd, P. M. Challenges of glycosylation analysis and control: an integrated approach to producing optimal and consistent therapeutic drugs.Drug Discovery Today.2016, 21 (5), 740–765.
- Reusch, D., Tejada, M.L. Fc glycans of therapeutic antibodies as critical quality attributes.Glycobiology.2015, 25 (12), 1325–1334.
- Goetze A. M., Liu Y. D., Zhang Z., Shah B., Lee E., Bondarenko P. V., Flynn GC.High-mannose glycans on the Fc region of therapeutic IgG antibodies increase serum clearance in humans.Glycobiology.2011, 21 (7), 949–959.
- Lauber, M. A.; Yu, Y.-Q.; Brousmiche, D. W.; Hua, Z.; Koza, S. M.; Magnelli, P.; Guthrie, E.; Taron, C. H.; Fountain, K. J. Rapid Preparation of Released N-Glycans for HILIC Analysis Using a Labeling Reagent That Facilitates Sensitive Fluorescence and ESI-MS Detection.Anal.Chem.2015, 87 (10), 5401–5409.
- Koza, S. M.; McCall, S. A.; Lauber, M. A.; Chambers, E. E. Quality Control and Automation Friendly GlycoWorks RapiFluor-MS N-Glycan Sample Preparation (720005506).Waters Corporation May 2020.
- Zhang, X.; Reed, C. E.; Birdsall, R. E.; Yu, Y. Q.; Chen, W. High-Throughput Analysis of Fluorescently Labeled N-Glycans Derived from Biotherapeutics Using an Automated LC-MS-Based Solution.SLAS Technology.2020, 24 (4), 380–387.
- Hanna, C.M.; Koza, S. M., Yu, Y. Q. Automated High-Throughput N-Glycan Labelling and LC-MS Analysis for Protein A Purified Monoclonal Antibodies (720007854). Waters Corporation February 2023.
- Kalkhof, S., Sinz, A. Chances and pitfalls of chemical cross-linking with amine-reactive N-hydroxysuccinimide esters.Anal Bioanal Chem 392, 305–312 (2008).
720008222JA、2024 年 2 月