USP クエチアピンフマル酸不純物分析法の Alliance™ iS HPLC System への移行
要約
規制対象のラボにおいて、確立した分析法をある高速液体クロマトグラム(HPLC)システムから同じまたは異なる HPLC システムに移行する分析法移行は重要な側面です。ラボには同じベンダー製または異なるベンダー製のさまざまな HPLC 装置があるため、規制対象の多くのラボでは分析法を移行する必要があります。さらに、これらのラボでは、スループットの向上に対応するために、古い装置の新しいテクノロジーへのアップグレードが望まれます1。 装置の違いによってクロマトグラフィーの結果に影響を及ぼす可能性があるため、新しい HPLC システムへの正常な分析法移行が困難な場合があります。Alliance iS HPLC System は、分析法移行後も同等以上の結果が得られるように、多くの重要な機能および特性が備わるように設計されています。このアプリケーションノートでは、Alliance iS HPLC System に備わっている、分析法移行を成功させるのに役立つ多くの重要な要素について説明します。クエチアピンフマル酸不純物の USP 分析法を、2 種類の従来の HPLC システムで分析した後、Alliance iS HPLC System で分析し、原薬の未知サンプルおよび USP 分析法に記載されているシステム適合性要件を使用して、比較および評価を行います2。
アプリケーションのメリット
- USP 不純物モノグラフの Alliance iS HPLC System への簡単かつ円滑な分析法移行
- クエチアピンフマル酸原薬について、再現性のある定量結果を取得
- Alliance iS HPLC System により注入精度が向上
はじめに
分析法移行においては、さまざまな HPLC システムにわたって一貫した再現性のある結果が得られることが重要です。HPLC システムの設計が異なると、クロマトグラフィーの結果にばらつきが生じることがあります。この試験では、クエチアピンフマル酸不純物のグラジエント USP 分析法を、2 種類の従来の HPLC システムと Alliance iS HPLC System の新しいテクノロジーで分析します。各 HPLC システムで、面積および保持時間の %RSD、テーリング係数、および 2 つのクリティカルペアのピークの分離に関してシステム適合性要件を評価します。システム適合性要件に加えて、3 種類の HPLC システムすべてにわたって一貫した定量結果が得られることを実証するために、クエチアピンフマル酸原薬のサンプルの不純物を分析します。この試験の結果から、Alliance iS HPLC System によって、最新のテクノロジーへの分析法移行を行えることが実証されます。
実験方法
サンプルの説明
USP 分析法には、クエチアピンフマル酸のレファレンス標準試料およびシステム適合性レファレンス標準試料が必要です。クエチアピン標準試料溶液は、USP クエチアピンフマル酸レファレンス標準試料(カタログ番号:1592704)を使用して、希釈溶媒(溶媒 A:溶媒 B 86:14)中に 0.001 mg/mL の濃度で調製しました。システム適合性溶液は、USP クエチアピンシステム適合性 RS(USP 製品番号 1592715)から調製したもので、クエチアピン、クエチアピンデスエトキシ(1 ~ 5%)、類縁物質 G および類縁物質 B の標準試料の混合物で構成されています。システム適合性溶液は、希釈溶媒(86:14 溶媒 A/溶媒 B)中に 1 mg/mL の濃度で調製しました。
クエチアピン原薬は、Hangzhou Think Chemical Co., Ltd. から入手したもので、有効期限を過ぎていました。サンプルは、溶媒 A 中に 1.0 mg/mL の濃度で調製しました。
LC 条件
|
LC システム: |
HPLC システム 1、HPLC システム 2、Alliance iS HPLC System |
|
|
検出: |
いずれのシステムも UV/Vis 検出 |
|
|
波長: |
250 nm |
|
|
カラム: |
XBridge BEH C8、3.5 µm、4.6 mm × 150 mm(製品番号:186003055) |
|
|
カラム温度: |
45 ℃ |
|
|
サンプル温度: |
10 ℃ |
|
|
注入量: |
20 µL |
|
|
流速: |
1.50 mL/分 |
|
|
移動相 A: |
溶媒 A:アセトニトリル/バッファー(75:25) |
|
|
移動相 B: |
溶媒 B:アセトニトリル |
|
|
バッファー: |
3.1 g/L 酢酸アンモニウム水溶液。2 mL の 25% 水酸化アンモニウムをそれぞれ 1 リットルの溶液に添加しました。最終 pH は 9.2 以上(NLT) |
|
|
シール洗浄溶媒: |
90:10 水:アセトニトリル |
|
|
パージ溶媒: |
50:50 水:アセトニトリル |
|
|
洗浄溶媒: |
50:50 水:アセトニトリル |
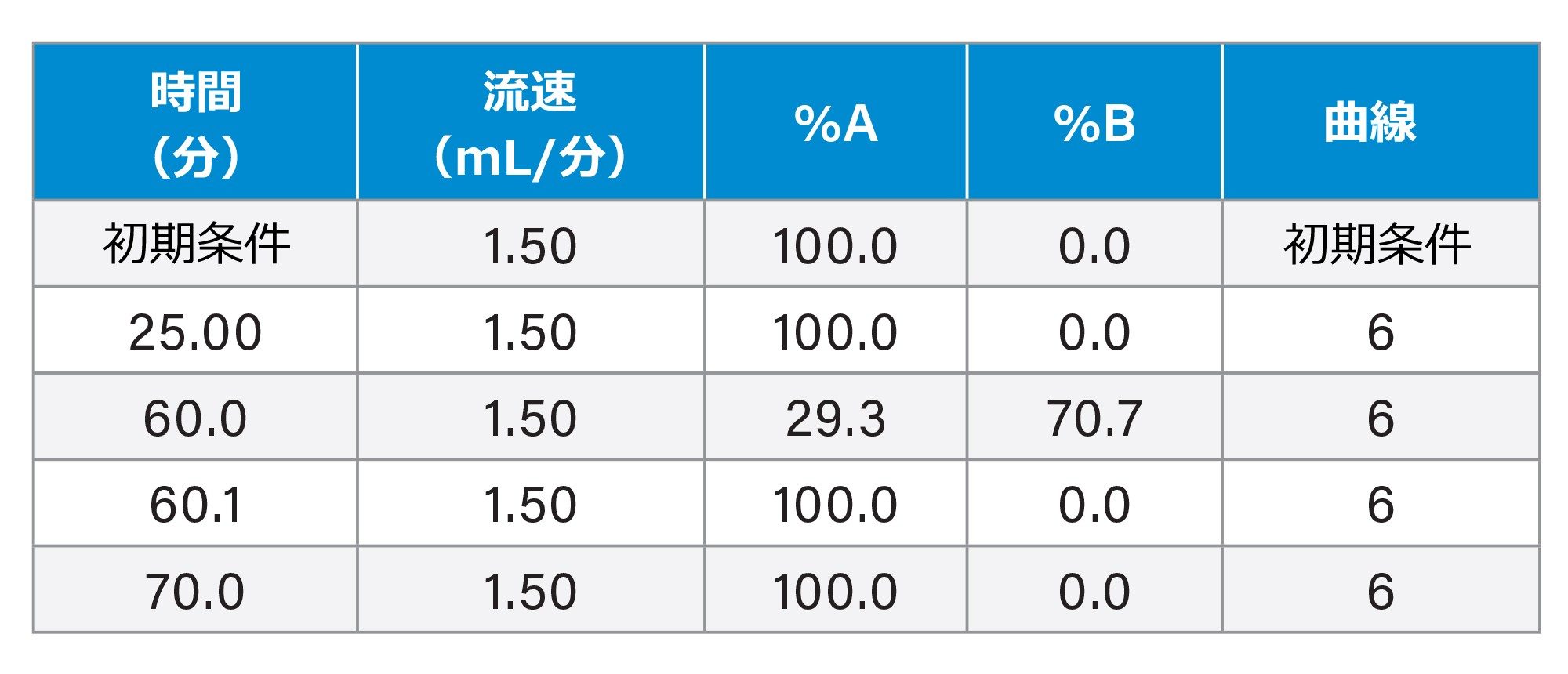
グラジエント
データ管理
|
データ管理: |
Empower 3 クロマトグラフィーデータソフトウェア |
結果および考察
規制対象のラボに最新の HPLC システムを導入するには、古い HPLC システムのデータおよび結果を新しい最新の HPLC システムで再現する必要があります。Alliance iS HPLC System には、FTN ソルベントマネージャー、フロースルーニードル(クオータナリー)サンプルマネージャー、TUV 検出器など、従来の HPLC システムに一般的に見られたものと同様の装置特性の多くが備わっており、使いやすさと設計が向上しています。これらの特性により、同じ定量結果が得られ、従来のシステムと同様および/または向上したシステム適合性結果が得られる性能が備わっています。このアプリケーションでは、Alliance iS HPLC System が、グラジエント分析法であるクエチアピンフマル酸不純物の USP モノグラフの分析に関して、2 種類の従来の HPLC システムと同等であることを実証します。分析法移行が成功したかどうかを評価するため、システム適合性要件を分析します。さらに、原薬の有機不純物の分析および定量も行います。すべての結果と分析は USP 分析法の基準に従い、6 回繰り返し注入に基づいて行います。
クエチアピン標準試料のシステム適合性(注入精度および併行精度)
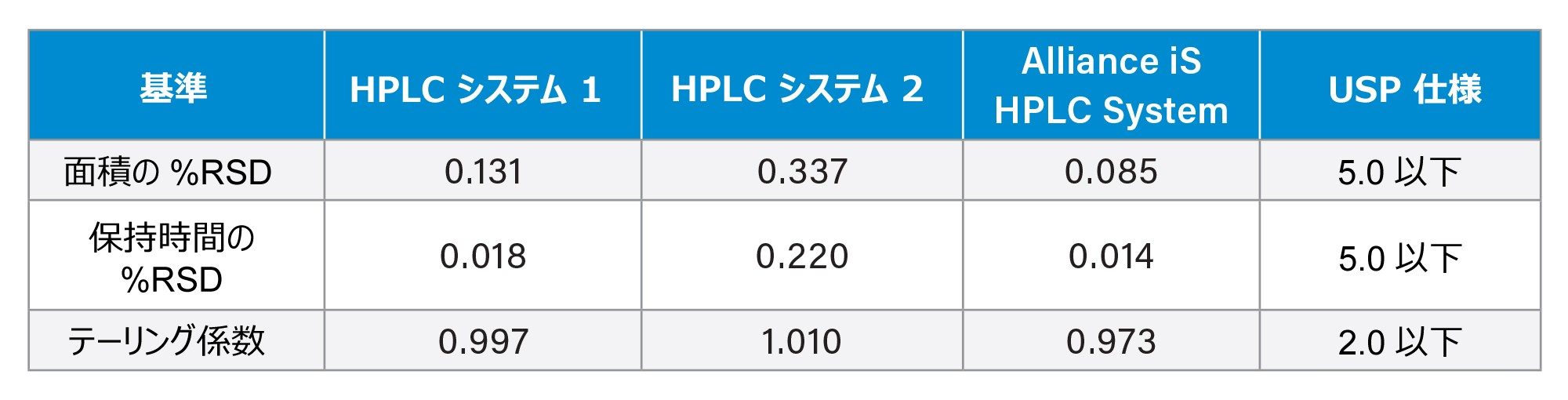
システム適合性要件は、LC システムが USP 分析法を実行するのに適していることを確認するために、すべての USP 分析法において重要な部分です。USP クエチアピンフマル酸不純物分析法のシステム適合性要件には、クエチアピンフマル酸標準溶液に関する 2 つの基準(面積および保持時間の相対標準偏差(%RSD)が 5.0% 以下(NMT))が含まれます。3 種類の HPLC システムはすべて、面積と保持時間の %RSD 要件を問題なく満たしていました(表 1)。
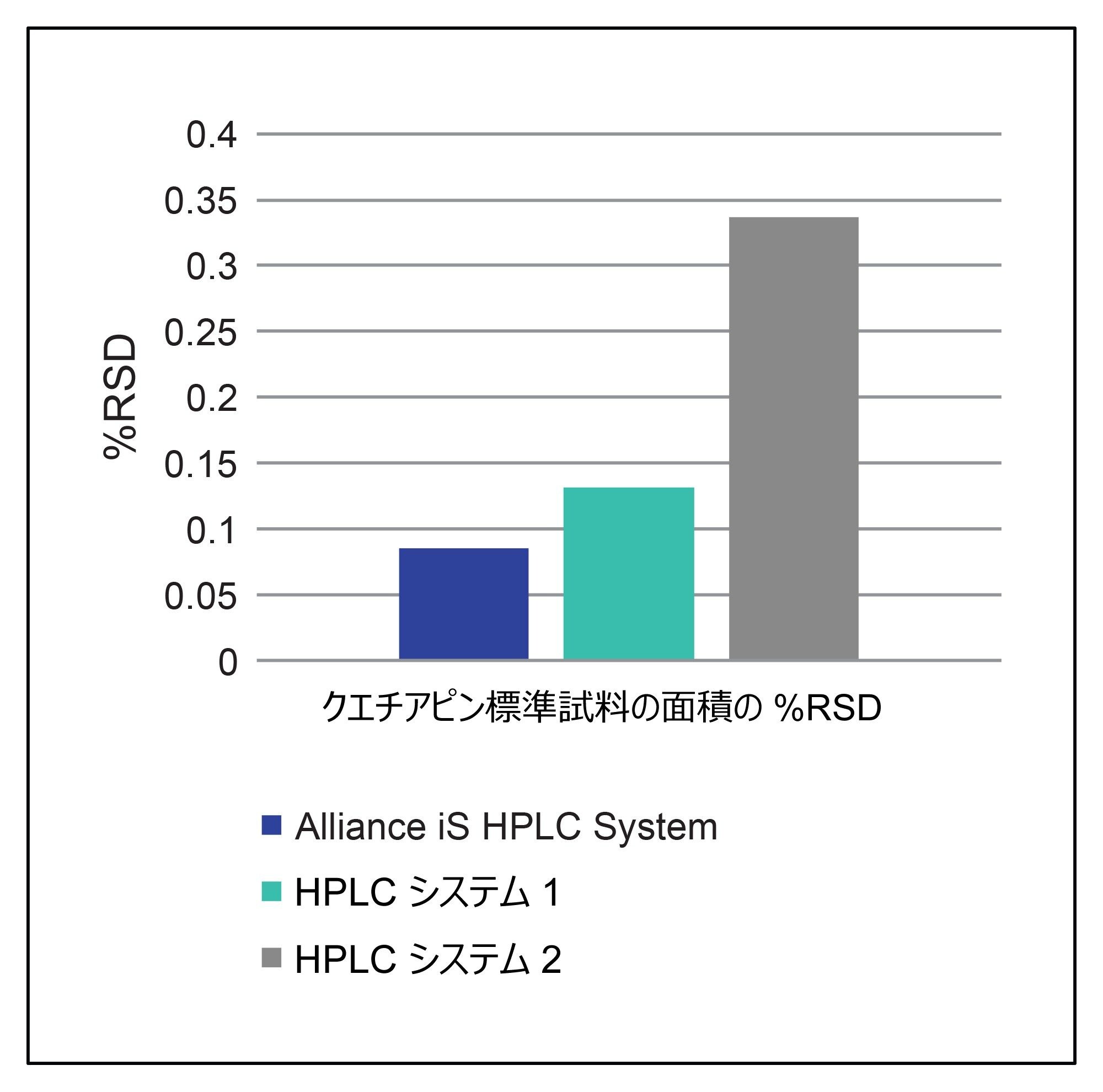
HPLC システムの重要なシステム性能指標の 1 つは、注入精度です。システム適合性要件はシステムの性能を実証するものであるため、面積の %RSD は規定の分析法条件における注入メカニズムの精度を示します。3 種類の HPLC システムはすべて、5% という要件を満たす良好な %RSD 値を示しましたが、Alliance iS HPLC System が 3 種類のシステムの内で最良の結果を示しました。Alliance iS HPLC System では注入メカニズムが再設計されており、新たに高圧サンプル計量デバイスが含まれています。これにより、システムはわずか 0.085% という面積 RSD を達成することができました。Alliance iS HPLC System で得られた面積の %RSD のシステム適合性要件では、新たに設計されたサンプル計量デバイスにより、他の 2 種類の HPLC システム(図 1)よりも注入精度の値が向上していることがわかります。
さらに、標準溶液のシステム適合性要件には、保持時間(RT)の %RSD およびテーリング係数が含まれます。3 種類の HPLC システムの併行精度は RT の %RSD で示され、3 種類のシステムすべてで良好な併行精度が見られました(表 1)。3 種類の HPLC システムはすべて、テーリング係数について良好な性能を示し、2.0 以上(NLT)というシステム要件に十分収まっていました(表 1)。
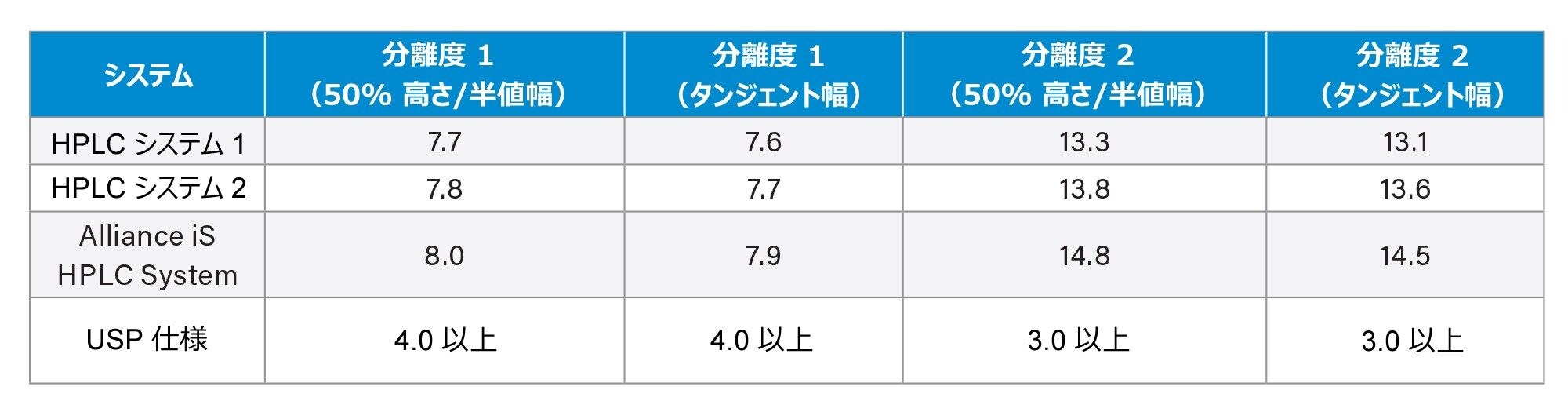
分離度について改訂された USP システム適合性の計算
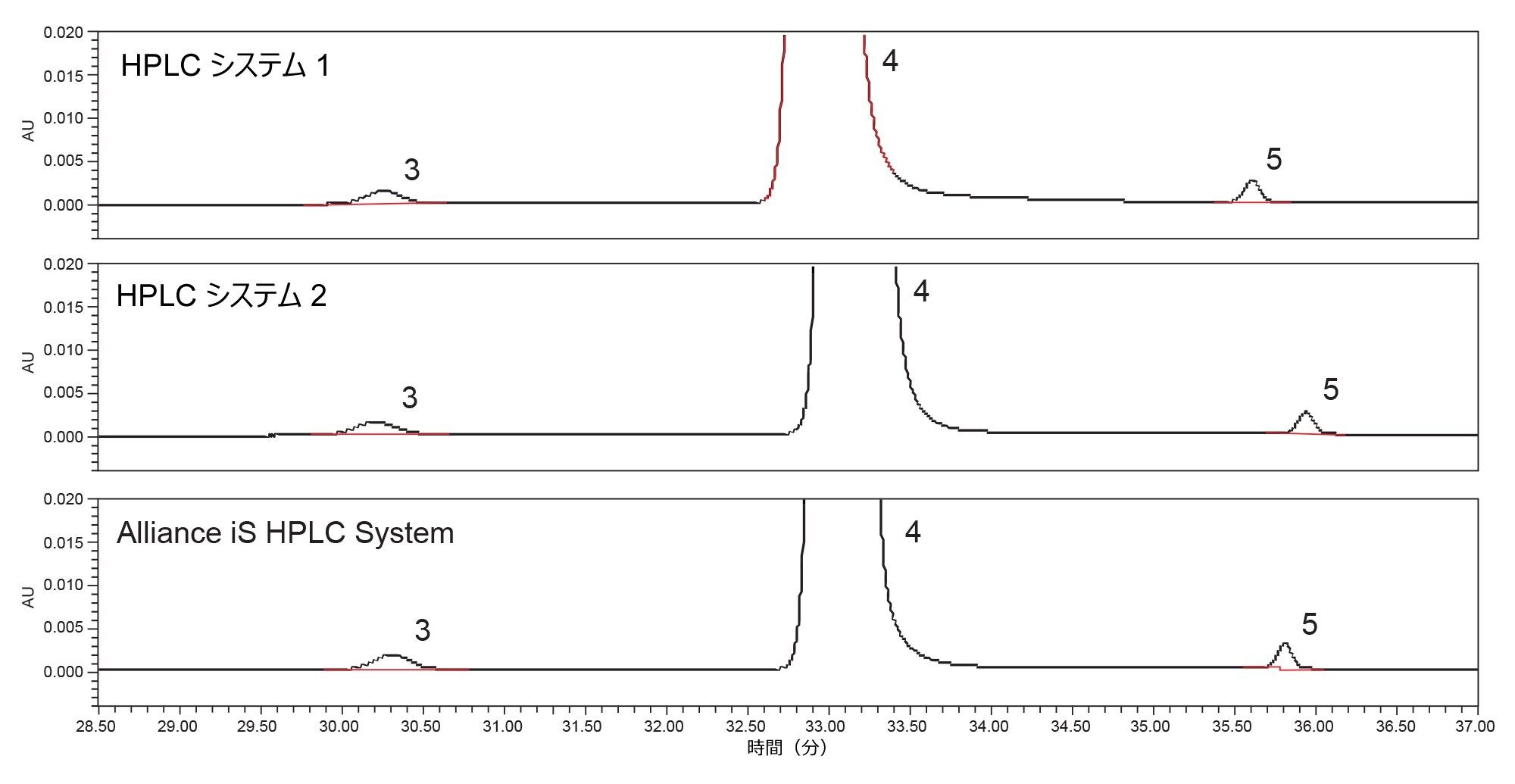
USP General Chapter <621> に対する最近の変更により、分離度の計算に使用する方法が影響を受けました3。 2 つのピークの分離度を、以前はピークのタンジェント幅に基づいて算出していましたが、<621> の改訂版ではピークの半値幅で算出することが求められています4。 クエチアピンフマル酸分析法の 2 つのクリティカルペアの分離度を、改訂された計算法と以前の計算法の両方で算出しました(表 2)。収集されたデータによると、すべての計算値がいずれの HPLC システムでも非常に類似していたため、分離度の計算を変更しても、システム適合性の結果に大きな影響はありませんでした。分離度 1 は、クエチアピンデメトキシ(ピーク 3)とクエチアピン(API、ピーク 4)のクリティカルペアの分離度です。分離度 2 は、類縁物質 G(ピーク 1)と 類縁物質 B(ピーク 2)のクリティカルペアの分離度です。3 種類の HPLC システムすべてで分離度 1 と分離度 2 を比較すると、Alliance iS HPLC System が最も高い分離度を示しました(図 2)。
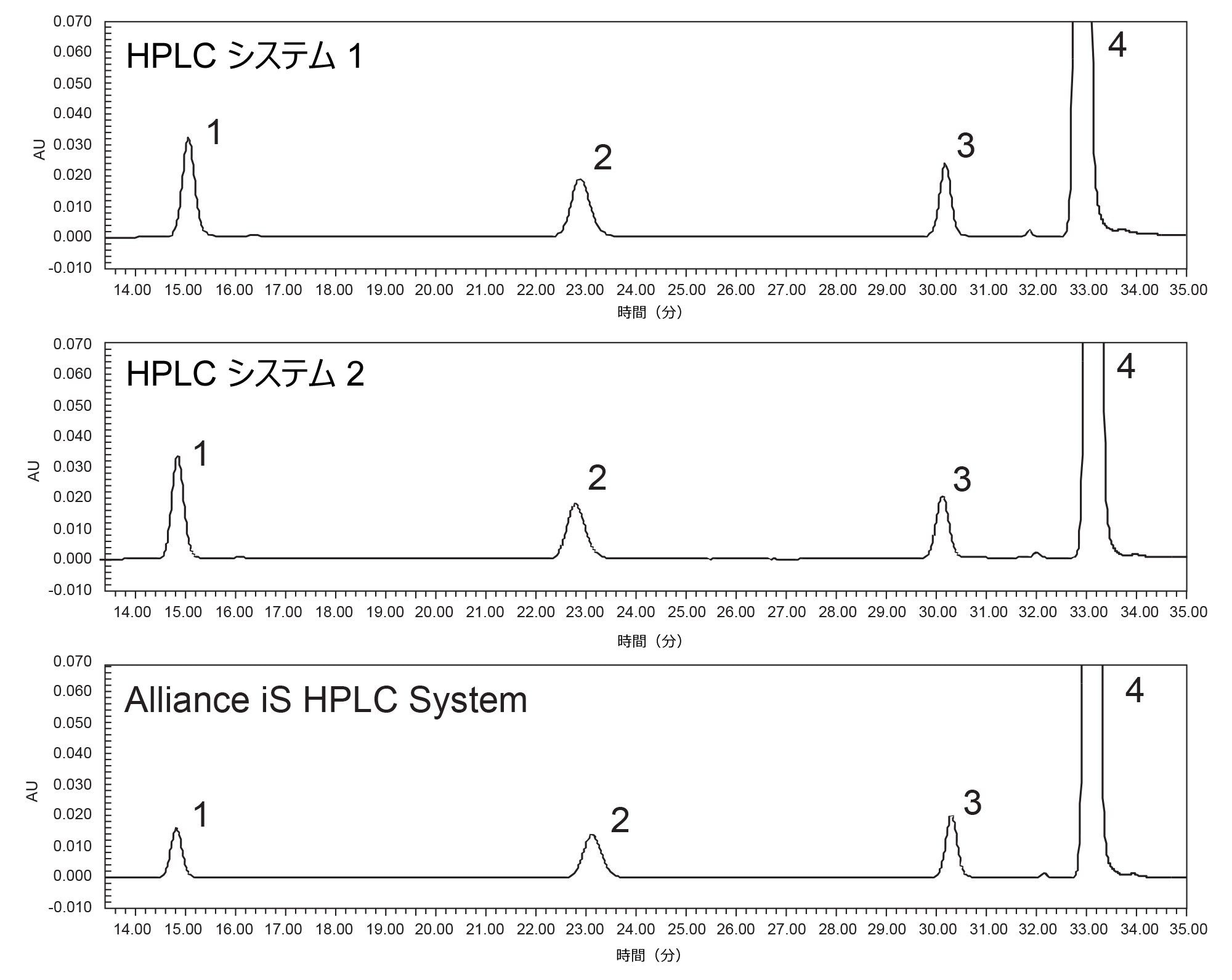
原薬の定量結果
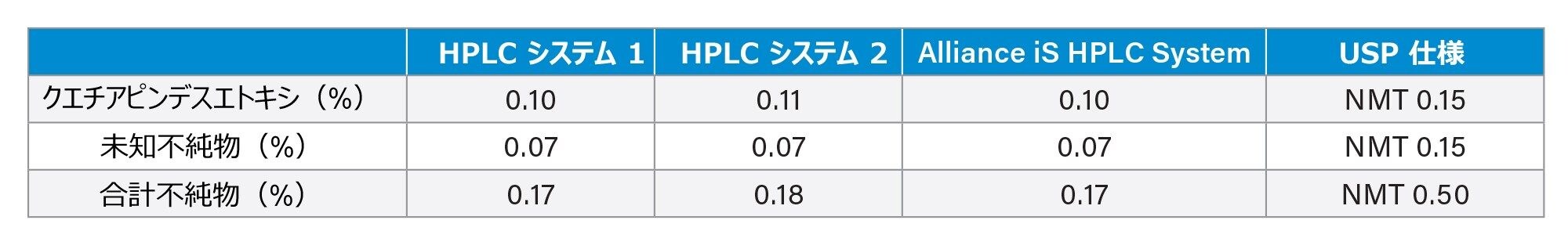
あるシステムから別のシステムに分析法を移行する際に重要な点は、すべてのシステムで同じ定量結果が得られることの確認です。クエチアピンフマル酸不純物の USP モノグラフでは、原薬に含まれる不純物の相対量を測定しています。そのため、分析法を分析するすべてのシステムにわたって定量データに一貫性があることが不可欠です。クエチアピンフマル酸原薬は 3 種類すべての HPLC システムで試験されています。3 種類の HPLC システムそれぞれで、分析ごとに個別にサンプル前処理を行いました(図 3)。HPLC システム 1、HPLC システム 2、Alliance iS HPLC System での原薬分析において、すべて 0.01% の範囲に収まる同様の定量データが得られました(表 3)。
結論
規制対象のラボにおいて、十分に確立した HPLC 分析法による一貫して再現性のある結果を得るためには、分析法の移行が不可欠です。このアプリケーションノートでは、USP クエチアピンフマル酸不純物分析法を、2 種類の従来の HPLC システムと新しい Alliance iS HPLC System の 3 種類の HPLC システムの間で移行しました。3 種類の HPLC システムはすべて問題なくシステム適合性要件を満たしており、Alliance iS HPLC System では、注入精度の向上および 2 つのクリティカルペアの分離度の向上が見られました。分析法の移行を成功させるための重要な要件の 1 つは、すべてのシステムで同じ定量結果が得られることです。本試験では、3 種類の HPLC システムすべてで、クエチアピンフマル酸原薬について同等の定量結果が得られました。このデータは、Alliance iS HPLC System が、規制対象のラボにおける確立された HPLC 分析法の移行に使用できることを実証しています。
参考文献
- Stephanie Harden and Phil Nethercote.Error Mitigation in Pharmaceutical Quality Assurance and Control.Innovations in Pharmaceutical Technology.13 Dec 2022.
- GUID-DBEED03E-7C75-4167-BD21-4E30BA2EFF2B_2_en-US (Quet Imp.Method).
- GUID-6C3DF8B8-D12E-4253-A0E7-6855670CDB7B_6_en-US (USP 621 current).
- GUID-6C3DF8B8-D12E-4253-A0E7-6855670CDB7B_1_en-US (USP 621 old version).
720007944JA、2023 年 7 月