Xevo™ G3 QTof を用いた細胞外小胞のメタボロミクスおよびリピドミクスプロファイリング
研究目的のみに使用してください。診断用には使用できません。
要約
リピドミクスおよびメタボロミクスの LC-MS ワークフローは、疾患の潜在的なバイオマーカーを決定し、試験対象のシステムの根底にある生物学の理解を深めるために広く使用されています。通常、バイオマーカーはさまざまな形で存在し、血漿、血清、尿などの生体液から日常的に分離されています。しかし最近では、細胞外小胞(EV)がバイオマーカーの候補として関心を集めています。このアプリケーションノートでは、EV に適用できて最適なリピドミクスおよびメタボロミクス抽出が可能になる、さまざまなサンプル前処理バッファーを評価しました。
アプリケーションのメリット
- MSE というをデータに依存しないワークフローを使用し、標識を使用しない相対定量と組み合わせた、包括的なメタボロミクスおよびリピドミクスのプロファイリング
- Xevo G3 QTof により、リピドームとメタボロームのディーププロファイリングが可能になり、5 桁にわたるサンプル内ダイナミックレンジを実現
- ACQUITY™ Premier LC により、極性代謝物/脂質(リン酸化分子種など)の回収率の向上が実現(低存在量の生物学的に関連のある化合物に特に重要)
- データ解析および化合物の同定は、社内のソフトウェアツール(waters_connect™)を使用して行い、さらに Lipostar や MARS などのサードパーティー製ソリューションとも互換性あり
- 社内およびサードパーティ製のソフトウェアツールのアウトプットと、MetaboAnalyst などの統計/データ視覚化ツールのアウトプットの互換性により、ワークフローの柔軟性が浮き彫りになり、統計および化合物の同定のカバレッジが向上
はじめに
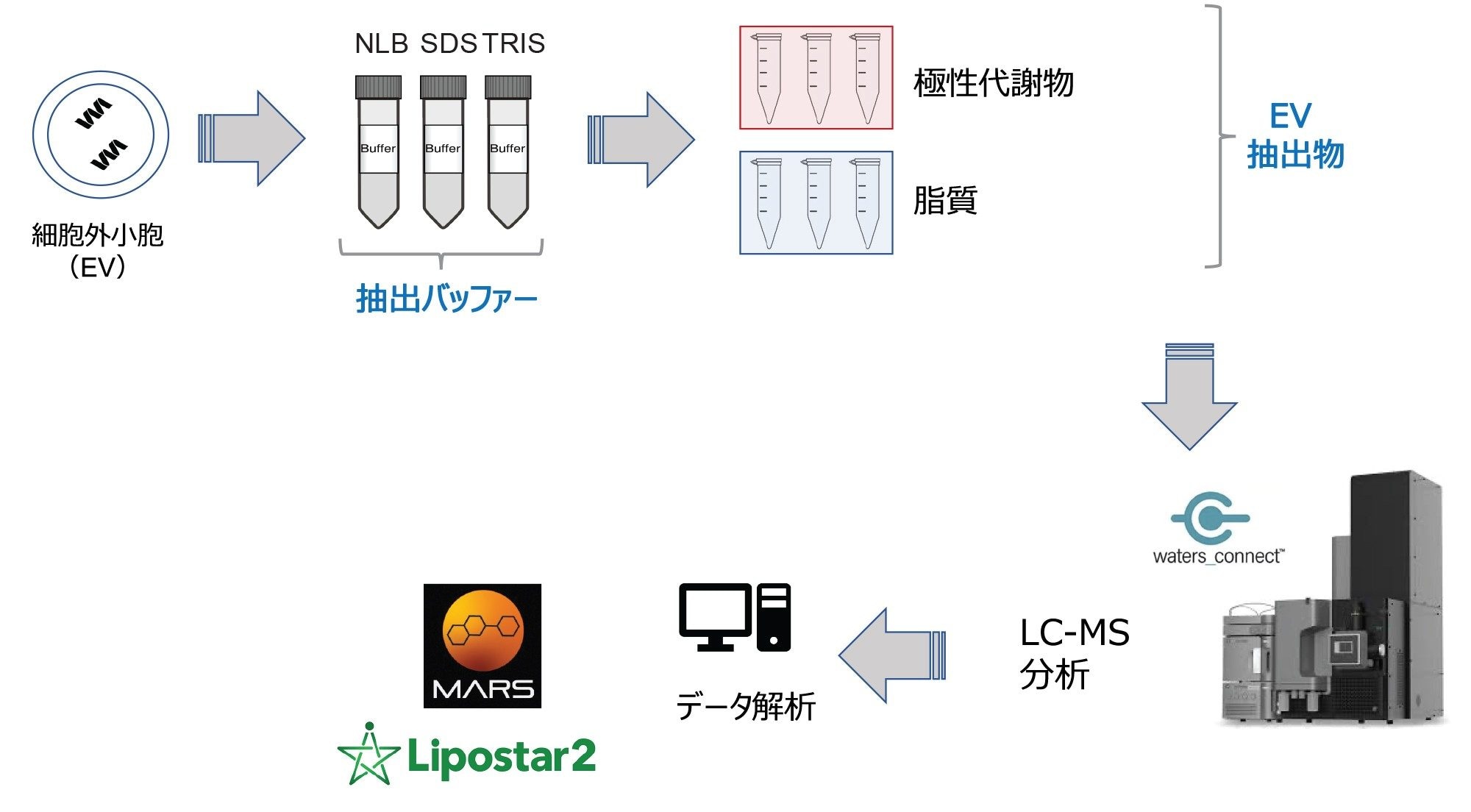
細胞外小胞(EV)とは、脂質二重層を有する、不均一な非増殖性のナノ粒子の一群です。EV はほとんどの細胞から放出され、細胞由来の DNA、RNA、脂質、タンパク質、代謝物を中に入れて運びます。末梢血などさまざまな生体液に含まれる循環 EV は、容易にモニターでき、親細胞を生理的に反映しています。そのような生体液に含まれる EV の濃度は、疾患の状態にも依存するようです1。 最近、EV は、特に腫瘍学や神経学などの領域において、疾患の潜在的なバイオマーカーとして特定されています2-3。 その後、小胞輸送経路を調べるオミックス研究が行われました。本稿で概説する研究の目的は、LC-MS 分析と互換性がある、EV に富んだサンプル用のマルチオミックスサンプル前処理メソッドを最適化することです。
実験方法
サンプル前処理
C2C12 マウスの筋芽細胞を、コンフルエントになるまで増殖させ、American Type Culture Collection(米国培養細胞系統保存機関、ATCC)のガイドラインに従って筋管に分化させました4。 その後、差動超遠心法を用いて EV を培地から分離しました。3 種類の溶解バッファーを使用して、LC-MS 分析用の抽出の実行可能性を評価しました。これらのバッファーの成分は次のとおりです:(i)2% ドデシル硫酸ナトリウム(SDS)、(ii)20 mM Tris 含有 2% SDS。(iii)溶解バッファーなし(NLB)。
LC 条件(メタボロミクス - HILIC)
|
LC システム: |
ACQUITY Premier FTN |
|
カラム: |
ACQUITY UPLC™ BEH™ Amide(2.1 mm × 100 mm、1.7 µm、製品番号:186009505) |
|
カラム温度: |
40 ˚C |
|
注入量: |
2 µL パーシャルループ |
|
流速: |
0.7 mL/分 |
|
移動相 A: |
5:95 アセトニトリル:水 + 0.1% ギ酸、10 mM ギ酸アンモニウム |
|
移動相 B: |
95:5 アセトニトリル:水 + 0.1% ギ酸、10 mM ギ酸アンモニウム |
|
グラジエント: |
初期は 100% B、0.1 ~ 5.0 分で 100 ~ 80% B、5.0 ~ 6.0 分で 80 ~ 50% B、6.0 ~ 6.5 分で 50% B、6.5 ~ 7.0 分で 50 ~ 100% B、7.0 ~ 10.0 分で初期条件に再平衡化。 |
LC 条件(リピドミクス - 逆相)
|
LC システム: |
ACQUITY Premier FTN |
|
カラム: |
ACQUITY Premier CSH™ C18(2.1 × 100 mm、1.7 µm、製品番号:186009461) |
|
カラム温度: |
55 ℃ |
|
注入量: |
2 µL パーシャルループ |
|
流速: |
0.4 mL/分 |
|
移動相 A: |
600:390:10 アセトニトリル:水:1 M ギ酸アンモニウム、0.1%ギ酸 |
|
移動相 B: |
900:90:10 IPA:アセトニトリル:1 M ギ酸アンモニウム、0.1% ギ酸 |
|
グラジエント: |
初期は 50% B、0.5 分で 50 ~ 53% B、0.5 ~ 4.0 分で 53 ~ 55% B、4.0 ~ 7.0 分で 55 ~ 65% B、7.0 ~ 7.5 分で 65 ~ 80% B、7.5 ~ 10 分で 80 ~ 99% B、10 ~ 11 分で 99%、11 ~ 12 分で初期条件に再平衡化。 |
MS 条件
|
MS システム: |
Xevo G3 QTof |
|
イオン源: |
ESI |
|
イオン化モード: |
ESI+/- |
|
キャピラリー電圧: |
2.8 (+)/1.5 (-) kV |
|
サンプルコーン電圧: |
40 V |
|
イオン源温度: |
150 ℃ |
|
脱溶媒温度: |
500 ℃ |
|
コーンガス流量: |
150 L/時間 |
|
脱溶媒流量: |
900 L/時間 |
|
コリジョンエネルギー: |
ランプは 20 ~ 45 eV から適用 |
|
スキャン時間: |
0.1 秒 |
インフォマティクス
データは、Lipostar や MARS(Mass Analytica、Barcelona、Sign)などのさまざまなソフトウェアプラットフォームを使用して解析しました。MetaboAnalyst に加えて、データ解析に使用したソフトウェアプラットフォーム内に組み込まれた統計ツールを使用して統計解析を行いました5。 さらに、Spotfire(Tibco、米国カリフォルニア州、パロアルト)を使用して、データの視覚化を行いました。
結果および考察
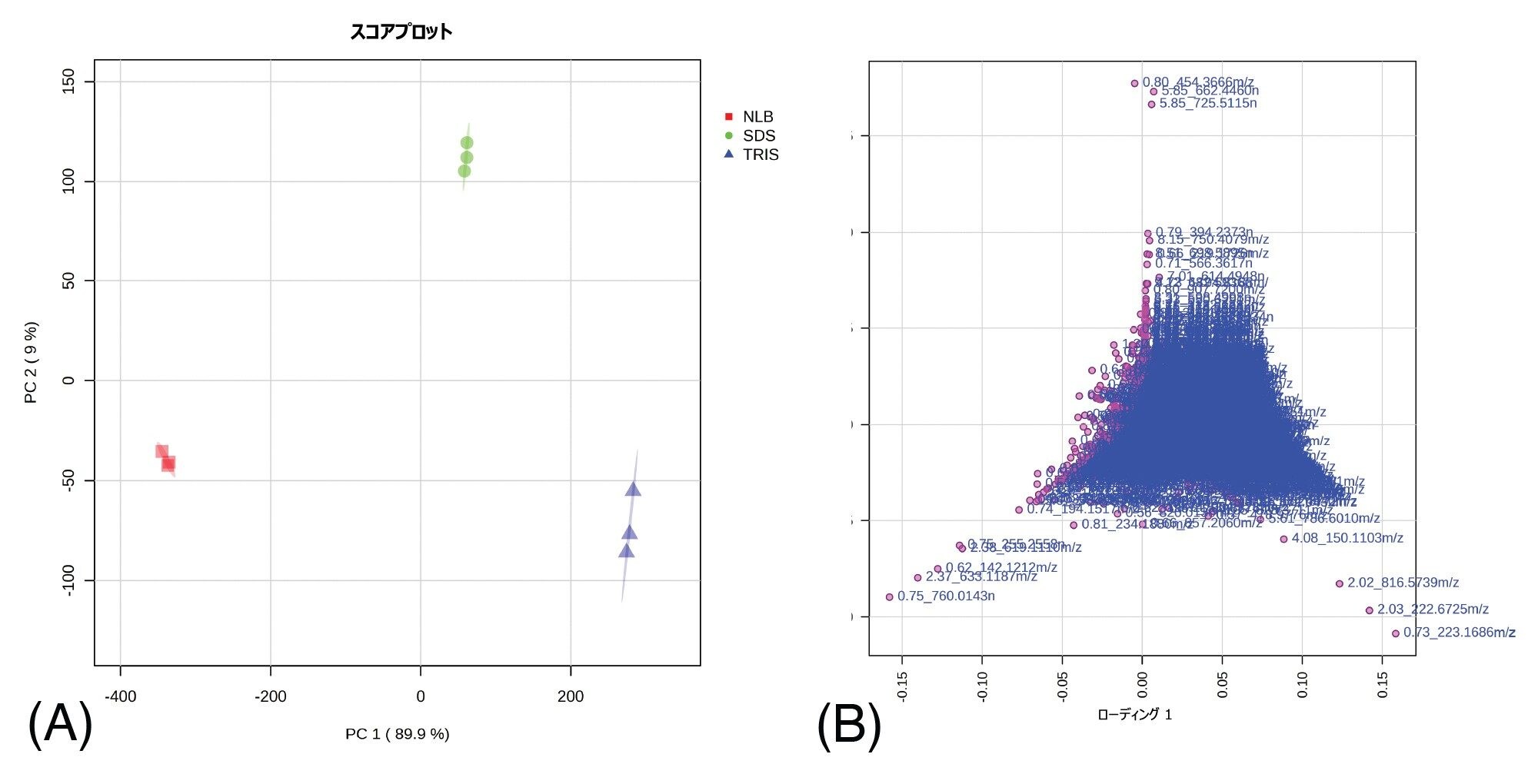
さまざまな抽出プロトコルに基づく EV 関連のメタボロミクス抽出物およびリピドミクス抽出物に対応するデータを、Xevo G3 QTof を使用して、データ非依存的測定(DIA)である MSE で取り込みました。続いて、さまざまなインフォマティクスツールを使用してデータ解析しました(図 1)。リピドミクス抽出物に関連する解析データの統計解析により、さまざまな抽出メソッドの間に大きな違いがあることが浮き彫りになりました。逆相(RP)分析(ESI+)に対応する教師なし主成分分析(PCA)を図 2 に示します。各抽出メソッドの繰り返し測定(n=3)はしっかりとクラスタリングされており、システムの測定の再現性が高いことが示されました(ESI- データでも観測済み)。3 種類の抽出プロトコルの間で明確に分かれていることから、抽出される分析種および/または抽出される量に大きな違いがあることが示唆されます。関連するローディングプロットは、データベース検索の対象となった、PCA から観察された差異の原因となる特徴を表しています。
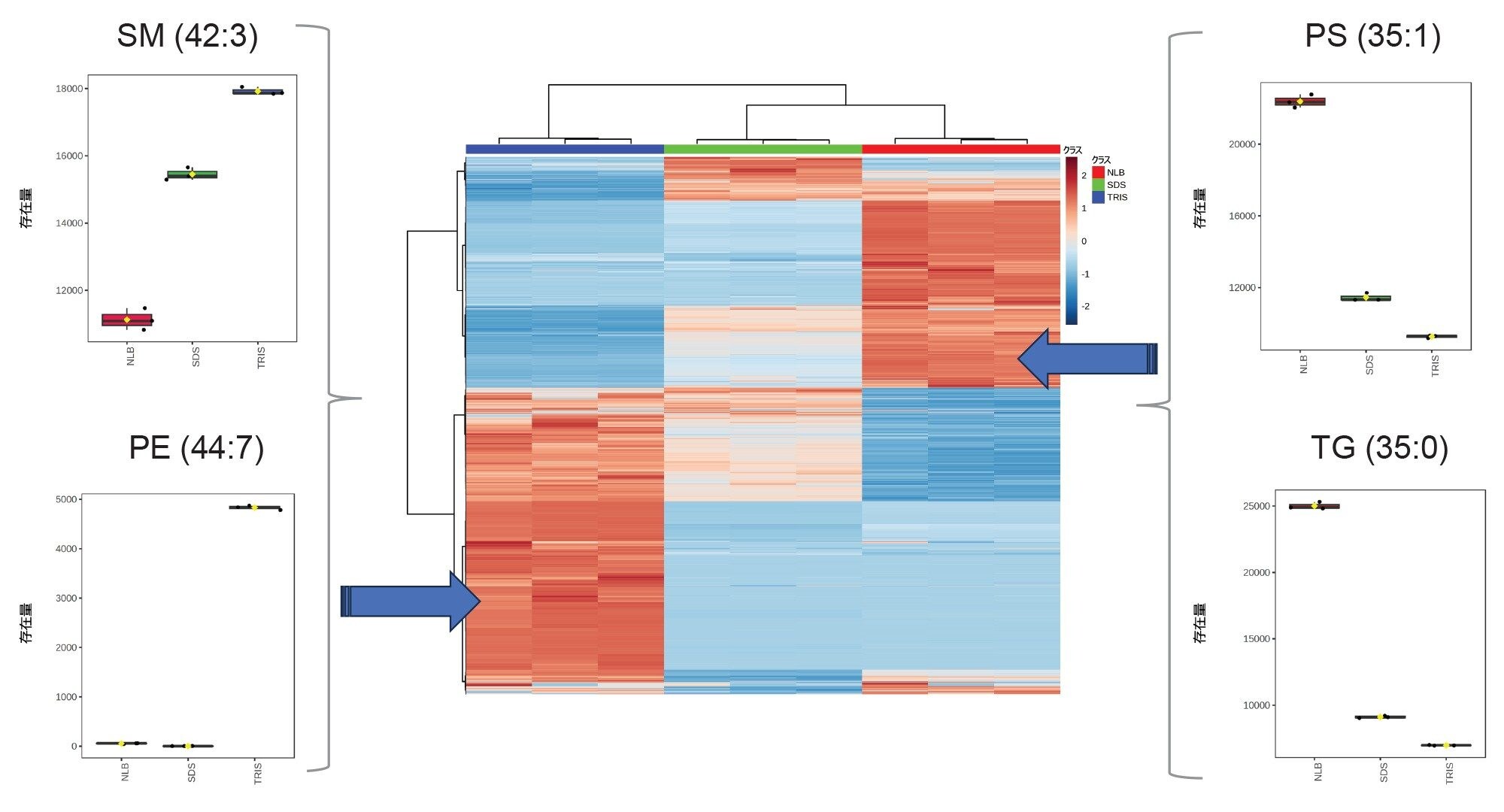
統計的に最も関連性の高い脂質を比較すると、主に同定されたクラスには、トリグリセリド、スフィンゴミエリン、リン脂質が含まれていました(図 3)。3 種類のバッファー条件を比較すると、Tris バッファーの場合、リン脂質/スフィンゴミエリンの大部分が高存在量で存在し、NLB 条件を使用すると、割合がより低いリン脂質がより豊富に存在することが示されました(図 3 – ヒートマップ/箱ひげ図)。
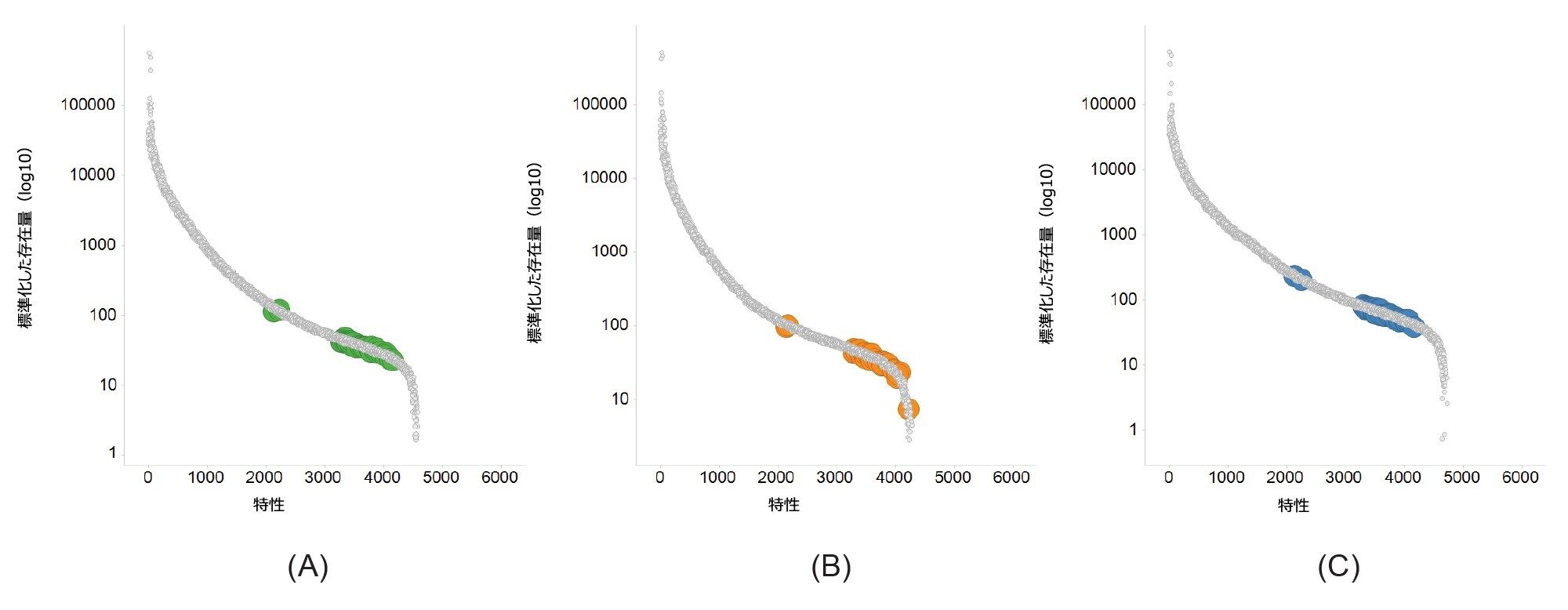
3 種類のバッファー条件すべてでリン脂質の存在は明らかであり、これらの主要なリン脂質の存在レベルは比較的低いため、Xevo G3 QTof によって得られる高レベルの感度とダイナミックレンジが必要になります。標準化した存在量曲線(図 4)は、Tris バッファーで得られるサンプル内ダイナミックレンジが広く(約5 桁)、同定されたリン脂質の大部分の存在量がわずかに高くなることを示しています。
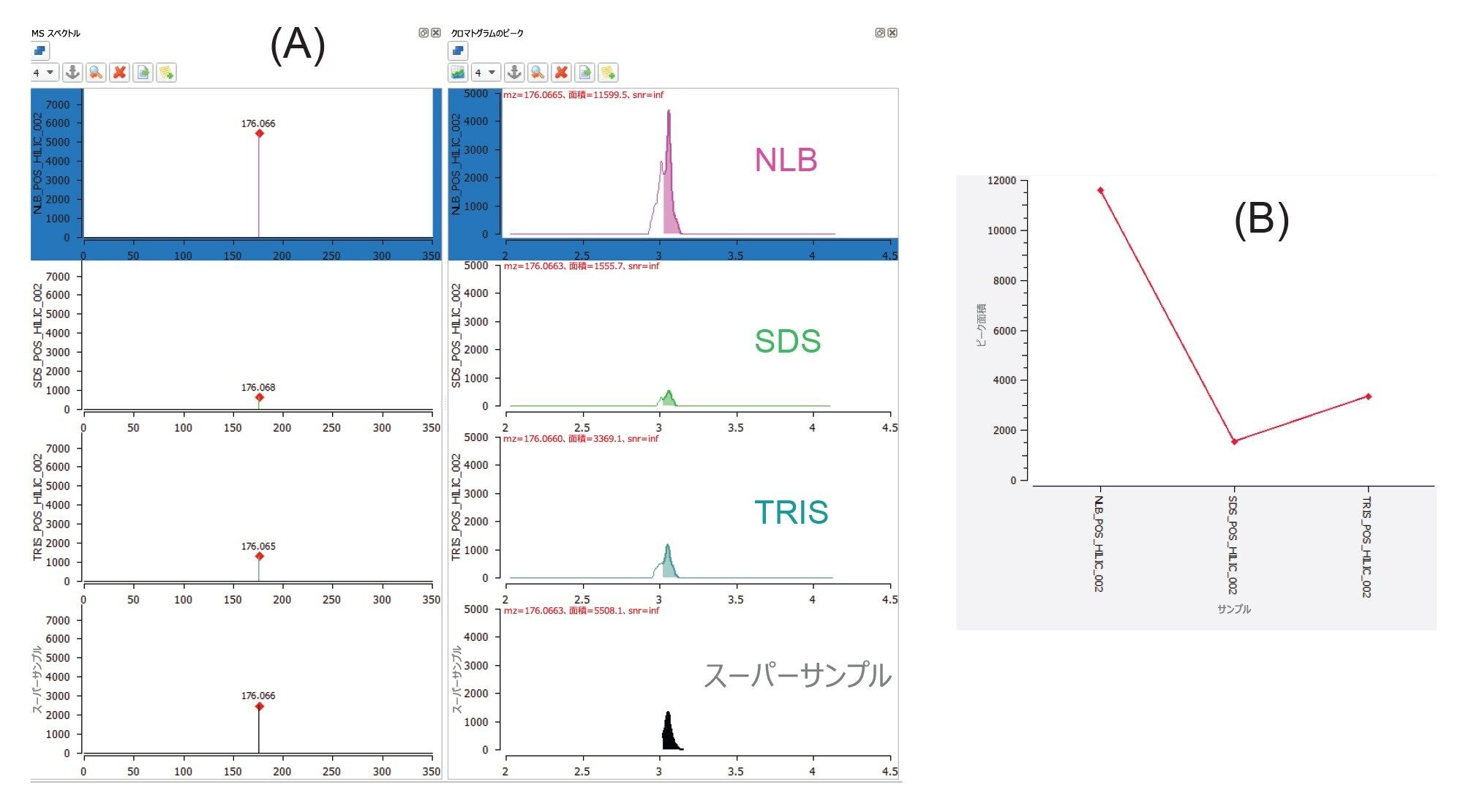
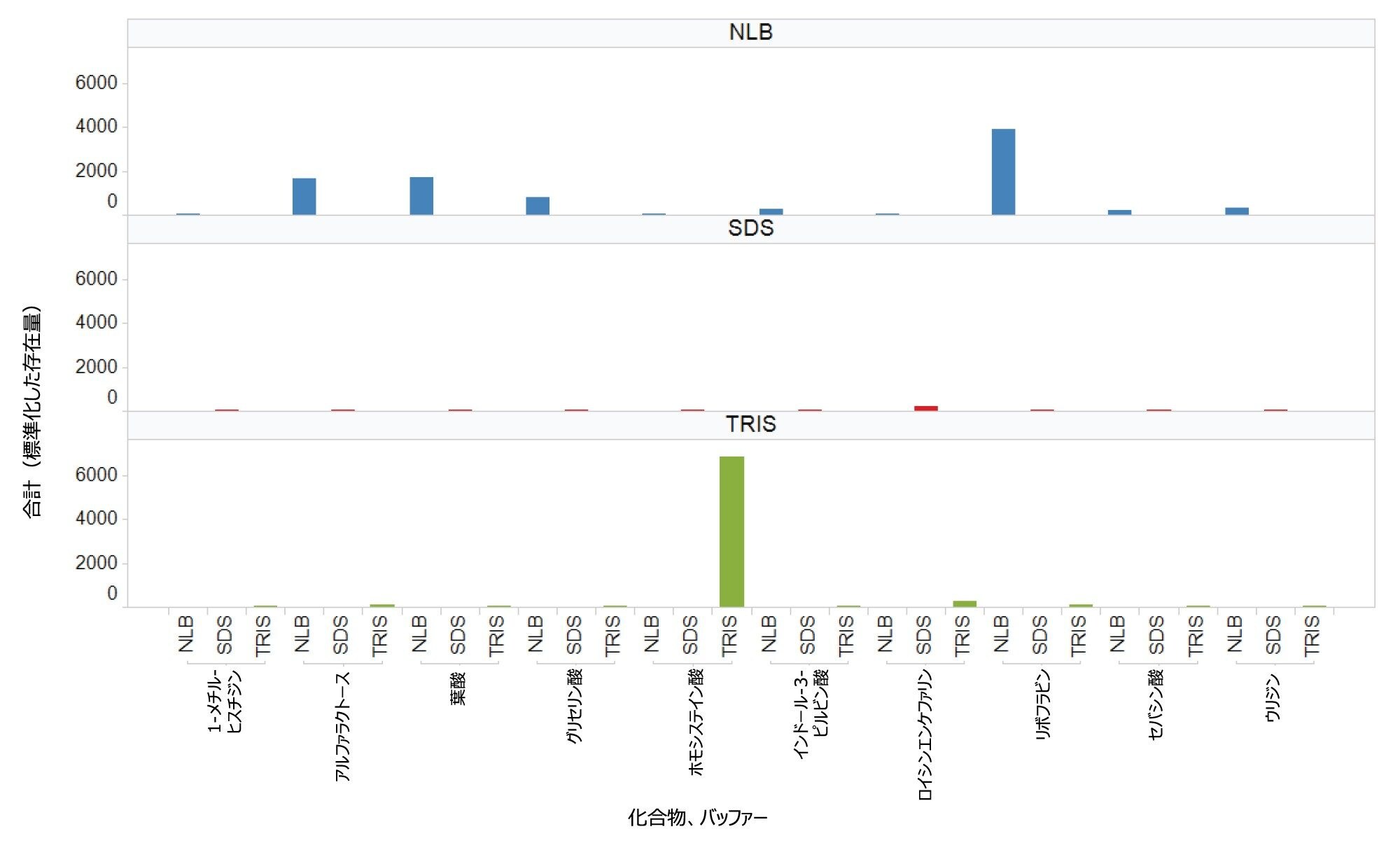
EV の濃縮サンプルから抽出した極性代謝物の数と種類は、サンプル前処理の一環として使用する抽出バッファーの種類に大きく影響されるようです。一般に、NLB 条件を使用すると、(i)独自の代謝物が同定される、または(ii)3 種類のバッファーすべてに共通の代謝物については、NLB によって高回収率がしばしば得られます。waters_connect API の有用性により、柔軟性が追加され、サードパーティー製のインフォマティックツールを使用してデータを調査することができます。MARS メタボロミクスインフォマティクパッケージを使用して、化合物同定のためのピークの選択および検索を行い、相対的定量も行えました。グアニジノコハク酸(図 5)は、3 種類のバッファー条件すべてで抽出される代謝物の一例ですが、(抽出クロマトグラム(図 5A)および関連するトレンドプロット(図 5B)で見られるように)その存在量は、NLB 抽出物中の方が少なくとも 4 倍高いことがわかります。これらの化合物クラスは、がん由来の細胞に関わっていると以前に報告されています6。 図 6 では、他のいくつかの化合物(ホモシステイン酸を除く)について、この観察結果がさらに浮き彫りになっています。
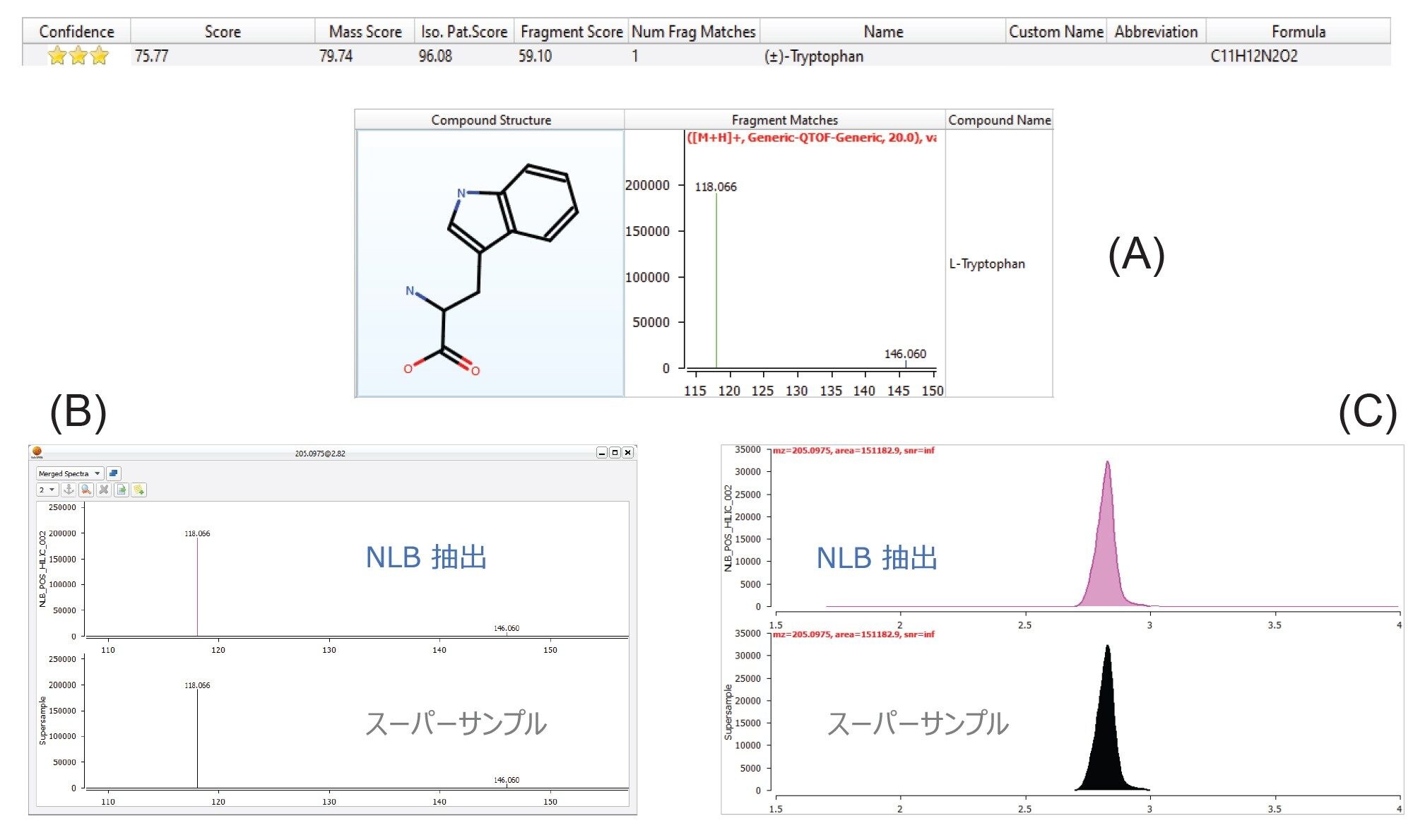
MARS ワークフローを使用して、アミノ酸、脂肪酸、ピリジン、インドールなど、いくつかの重要な生物学的に関連のある極性代謝物が同定されました。トリプトファン(図 7)は、非常に確実に同定された化合物で、NLB 抽出物からのみ同定されました。この化合物は以前、骨格筋のシグナル伝達経路で重要な役割を果たしていることが示されています7。質量精度(プリカーサーイオンおよびフラグメントイオン)、同位体パターン、フラグメントイオンマッチ、保持時間の組み合わせすべてが、全体的な信頼スコアに寄与します。
結論
EV からの脂質および極性代謝物の LC-MS 分析を、3 種類のバッファー条件(NLB、SDS、Tris)を使用して実証しました。全体として、抽出バッファーの選択は、検出される脂質の種類とその存在量に影響しましたが、極性メタボロームの観点からは、バッファーの選択がより大きな影響(独自の極性代謝物の存在量と検出に関して)を与えるように見えました。Xevo G3 QTof の導入により、広いダイナミックレンジにわたって低濃度化合物の検出が可能になりました。API を介した MARS などのサードパーティ製インフォマティックツールとの統合により、非常に信頼性の高い化合物の同定と相対的定量が可能になり、低分子 OMIC 分析のための柔軟なデータ分析ワークフローが実証されました。
参考文献
- Rikkert, L.G., Beekman, P., Caro, J., Coumans, F.A.W., Encisco-Martinez, A., Jenster, G., et al.Toward Identification of Cancer by Tumor-Derived Extracellular Vesicles in Blood.Front.Oncol.(2020) (doi: 10.3389/fonc.2020.00608).
- Liu, L., Kawashima, M., Sugimoto, M., Sonomura, K., Pu, F. et al.Discovery of Lipid Profiles in Plasma-Derived Extracellular Vesicles as Biomarkers for Breast Cancer Diagnosis. Cancer Science (2023) (doi: 10.1111/cas.15935).
- Blommer, J., Pitcher, T., Mustapic, M, Eren, E., Yao, P.J., Vreones, M.P. et al.Extracellular Vesicle Biomarkers for Cognitive Impairment in Parkinson’s Disease.Brain (2023) (doi:10.1093/brain/awac258).
- https://www.atcc.org/resources/culture-guides/animal-cell-culture-guide.
- Pang, Z., Zhou, G., Ewald, J., Chang, L., Hacariz, O., Basu, N., and Xia, J. Using MetaboAnalyst 5.0 for LC-HRMS Spectra Processing, Multi-Omics Integration and Covariate Adjustment of Global Metabolomics Data. Nature Protocols (2022) (doi: 10.1038/s41596–022–00710–w).
- Harmati, M., Bukva, M., Bőrőczky, T., Buzás, K., Gyukity-Sebestyén, E. Cancer and Metastasis Reviews (2021) (doi: 10.1007/s10555–021–10014–2).
- Dukes, A., Davis, C., Refaey M.E., Upadhyay, S., Mork, S., Arounleut, P., Johnson, M.H., Hill, W.D., Isales, C.M., Hamrick, M.W. The Aromatic Amino Acid Tryptophan Stimulates Skeletal Muscle IGF1/p70s6K/Mtor Signaling in Vivo and the Expression of Myogenic Genes in Vitro.Nutrition (2015) (doi: 10.1016/j.nut.2015.02.011).
ソリューション提供製品
720008142JA、2023 年 12 月