ACQUITY™ Premier システムで MaxPeak™ Premier カラムテクノロジーを用いた、ホスホペプチドのペプチドマッピングにおける分離の改善
要約
リン酸化ペプチドには、クロマトグラフィー流路全体にわたって露出した金属表面に結合する親和性があるため、リン酸化ペプチドの存在によって、ペプチドマッピング試験が複雑になることがあります。RPLC で一般的に使用される移動相添加剤ではこれらの相互作用が十分に軽減されず、元々困難な RPLC 分離におけるクロマトグラフィーの質の低下につながります。MaxPeak High-Performance Surface(HPS)テクノロジーは、この困難な問題に対する Waters™ の解決策です。これは、流路の表面に吸着しやすい分析種の非特異的相互作用を低減する、MaxPeak HPS テクノロジーの革新的な設計によって実現しています。この論文では、MS 検出を使用したホスホペプチドマッピングアプリケーションに、ACQUITY Premier カラムを使用した、ACQUITY Premier バイナリー UPLC™ システムと、業界をリードする生体高分子分析用バイナリー UHPLC システムを比較しています。ピークテーリング、ピーク面積、シグナル対ノイズ比など、クロマトグラフィーの質において重要なパラメーターをモニターします。より MS に適した条件が得られるかどうかを確認するため、移動相添加剤の濃度を変更しています。ACQUITY Premier システムおよびカラムは、ホスホペプチドなどの困難な化合物の MS 検出を行う RPLC アプリケーションで使用した場合に、従来の生体高分子分析用システムと比較して、有意なメリットがあることが示されました。
アプリケーションのメリット
- ACQUITY Premier システムおよびカラムによるホスホペプチドマッピングにおけるクロマトグラフィー性能が向上
- 移動相添加剤を少なくすることで、より高感度の MS 検出およびより低い LOD が可能に
はじめに
タンパク質のペプチドマッピング試験は、特に大きなタンパク質の場合には複雑になることがあるため、単一の分析で複数のピークを分離できるメソッドが必要になります。ペプチドマッピングをモニターするのに一般的に使用されるアプローチは、エレクトロスプレーイオン化質量分析(ESI-MS)と逆相液体クロマトグラフィー(RPLC)の組み合わせです。この手法は、消化物中にリン酸化ペプチド(ホスホペプチド)が存在することにより、複雑になる場合があります。細胞増殖や分化などの多くの細胞プロセスは、タンパク質キナーゼによるアミノ酸残基(セリン、スレオニン、チロシン)でのタンパク質リン酸化によって制御されます1。 さらに、ヒトのゲノムにコードされているすべてのタンパク質の少なくとも 2/3 は、そのライフサイクルのある時点でリン酸化が含まれることが示されています2。 ホスホペプチドは「付着しやすい」化合物であり、負に荷電したリン酸基が原因で、クロマトグラフィー流路全体にわたる正に荷電した金属表面にすぐに吸着します。この相互作用は、ピークテーリングやホスホペプチドのピークの回収率低下だけでなく、クロマトグラフィーの結果が複雑であることから、ペプチドマップの全体的な質の低下につながることがあります3。
逆相ペプチドマッピングメソッドにおける分析種の選択性および回収率を制御するため、トリフルオロ酢酸(TFA)やギ酸(FA)などの酸性移動相添加剤が使用されます。これらのイオン対試薬により、遊離の金属イオンが中和され、分析種のクロマトグラフィーシステムへの結合が制限されます4。 RPLC-MS ペプチドマッピングの場合、FA は他の添加剤と比較してイオン化抑制が少ないために、よく使用される弱イオン対試薬です5。 イオン化抑制は、検出器のレスポンスに大きく影響する場合があるため、質量分析ベースのメソッドを使用する際の重要な考慮事項です。低存在量のピークをモニターする場合、シグナル対ノイズ比(S/N 比)の最適化が、検出限界(LOD)およびアッセイの正確性を改善するために重要です。
この試験では、ACQUITY Premier カラムを使用したホスホペプチドの分離について、ACQUITY Premier バイナリーシステム(図 1)を従来の生体高分子分析用 UHPLC システム(システム X)と比較しています。生体高分子分析用システムでは、ステンレススチール製のシステムコンポーネントの代わりに PEEK や MP35N を使用して流路から鉄を取り除くことで、腐食やサンプル汚染の可能性を低減しています。ACQUITY Premier システムおよび MaxPeak Premier カラムでは、サンプルの喪失につながる可能性のある分析種と表面の相互作用を最小限に抑えるように設計された MaxPeak HPS テクノロジーにより、付加価値が得られます。複数の日にわたって分析した複数のサンプルセットについて、ACQUITY QDa™ 質量検出器を使用して、ピークテーリング、S/N 比、ピーク面積などの適合性パラメーターをモニターしています。さらに、移動相中の FA を 0.1% から 0.01% に減らして、よりマイルドな移動相条件を使用して、より高感度の MS 検出が行えるかどうかを判定しています。

実験方法
LC 条件
|
LC システム: |
1. ACQUITY APC リザーバーキャップキットを取り付けた ACQUITY Premier バイナリーシステム(製品番号:205001152) 2. 標準リザーバーキャップを取り付けた System X 生体高分子分析用 UHPLC バイナリーシステム |
|
バイアル: |
トータルリカバリー(製品番号:186002805) |
|
カラム: |
ACQUITY Premier Peptide CSH™ C18 カラム、130 Å、1.7 µm、2.1 × 150 mm(製品番号:186009489) |
|
カラム温度: |
65 ℃ |
|
サンプル温度: |
6 ℃ |
|
注入量: |
1.ホスホペプチド混合物を含む MassPREP エノラーゼ消化物 = 1 µL 2. MassPREP ホスホペプチドエノラーゼ標準試料 = 1、3、5 µL |
|
移動相 A: |
0.1% または 0.01% のギ酸(FA)含有 Milli-Q 水 |
|
移動相 B: |
0.1% または 0.01% の FA 含有アセトニトリル(ACN) |
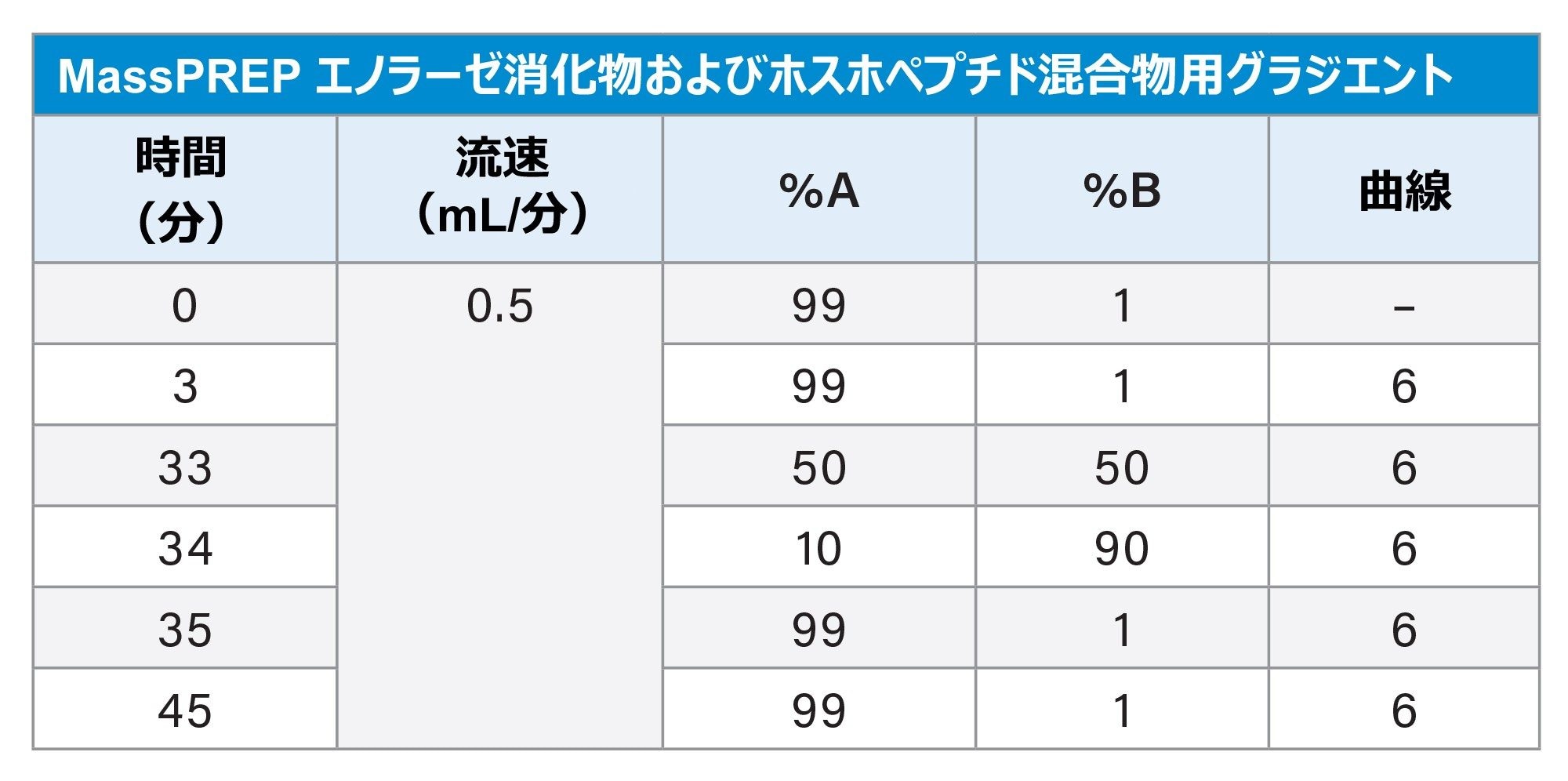
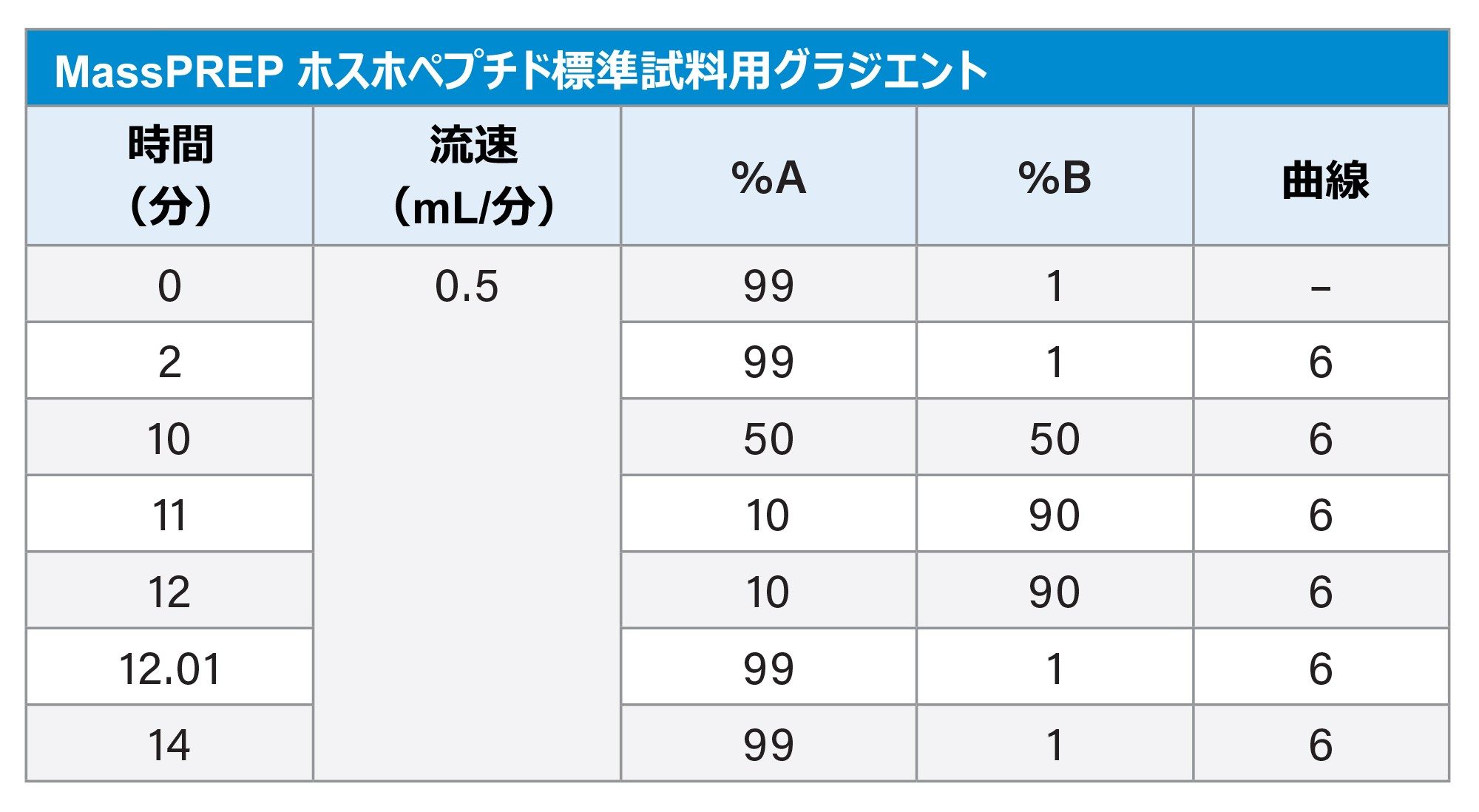
グラジエントテーブル
MS 条件
|
MS システム: |
QDa |
|
イオン化モード: |
ポジティブ |
|
キャピラリー電圧: |
1.5 kV |
|
コーン電圧: |
15 V |
データ管理
|
クロマトグラフィーソフトウェア: |
Empower™ 3.6.1 |
結果および考察
ホスホペプチドの RPLC-MS 分離で使用する両方の UHPLC システムを評価するため、両方のシステムで 3 日間にわたって試験を行いました。使用したサンプルは、3 種類の一重リン酸化ペプチドと 1 種類の二重リン酸化ペプチドからなるホスホペプチド標準試料、および同じ 4 種類のホスホペプチドをスパイクした酵母エノラーゼのタンパク質トリプシン消化物などです。ホスホペプチド標準試料とエノラーゼ消化物にそれぞれ 6.13% B/分および 1.63% B/分のグラジエント勾配を使用して、ペプチドの十分な分離を得ました。ホスホペプチド混合液の複数の注入量(1 µL、3 µL、5 µL)を試験して、LOD を評価しました。いずれのシステムも同じ QDa 質量検出器を使用して実行し、質量データのみを比較に使用しています。タンパク質のペプチド配列を解析するためにピークの質量確認が必要なペプチドマッピング試験には、質量データを使用することが不可欠です。この試験で使用した酸性移動相添加剤である FA の濃度を、ペプチドピークの望ましい選択性が得られるように最適化することができます。一般に、ペプチドマッピングのほとんどのピークを良好に分離するのに、移動相システム中の添加剤の濃度は 0.1% で十分です6-8。 ACQUITY Premier システムおよびカラムに使用されている表面修飾により、分析種と表面の相互作用を軽減する必要性が低減され、移動相添加剤の使用量を減らすことができます。この目的のために、2 種類の移動相システム(標準の 0.1% FA およびより低濃度の 0.01% FA を含むイオン対形成移動相)を試験して比較しました。
エノラーゼ消化物のトータルイオンクロマトグラム(TIC)を試験の開始時に収集して、グラジエント全体にわたってターゲットペプチドのピークの位置を特定しました。ターゲットペプチドを選択した後、シングルイオンレコーディング(SIR)を使用して、試験全体を通してペプチドをモニターしました。この分析法により、スキャン時間を増やして検出器の感度を最大化できるとともに、1 価および 2 価に荷電したペプチドイオンを収集してターゲットをさらに確認することができます。
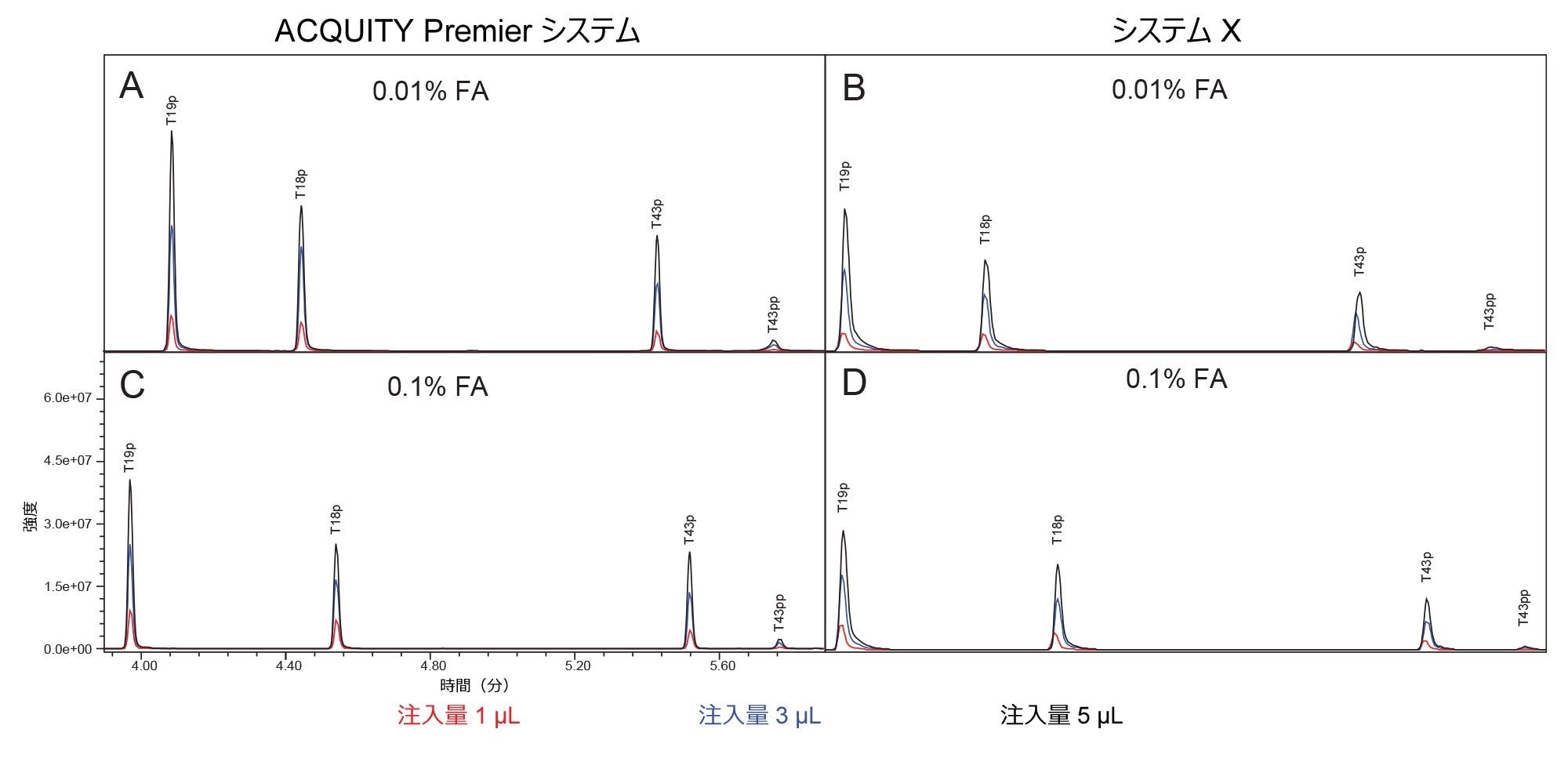
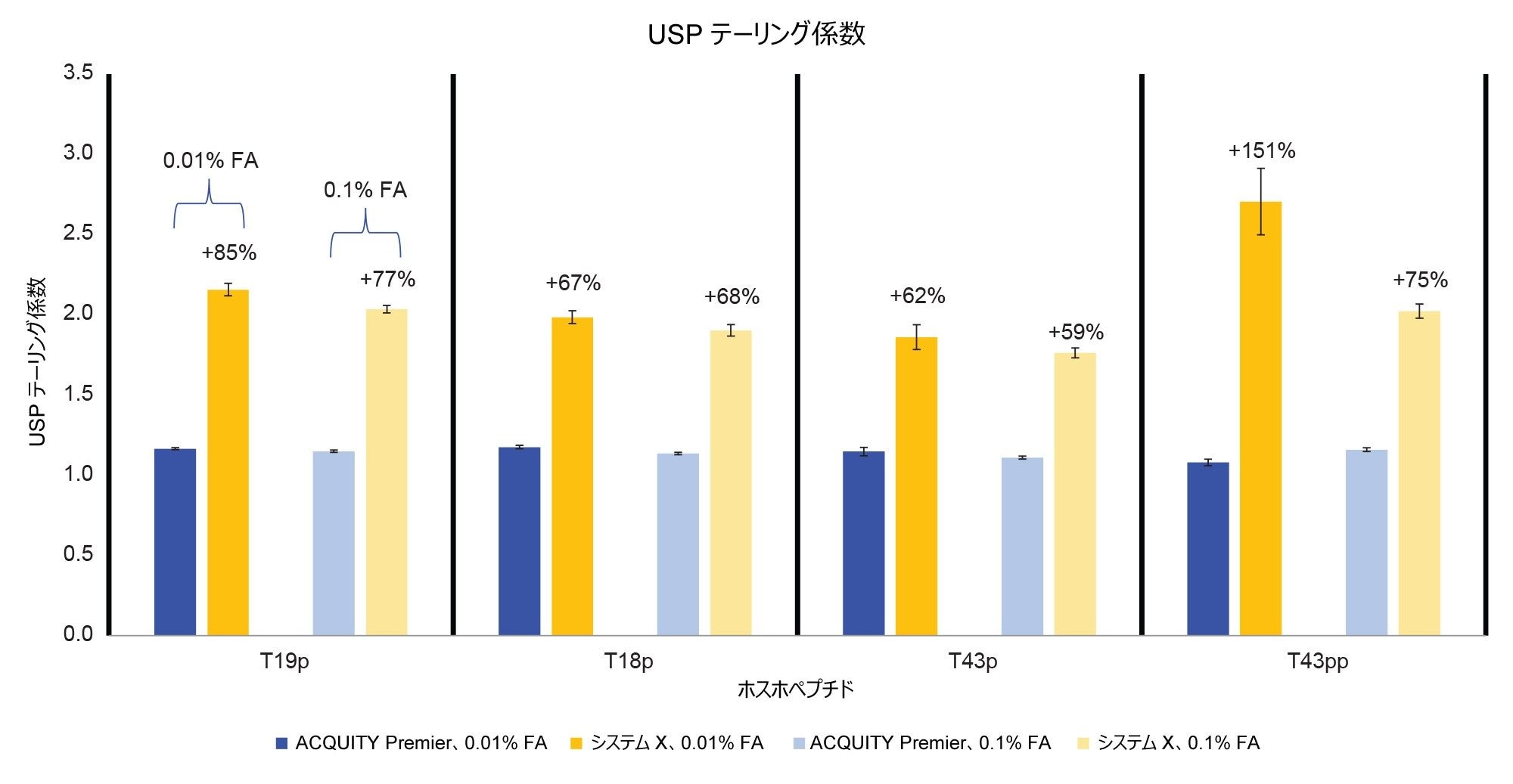
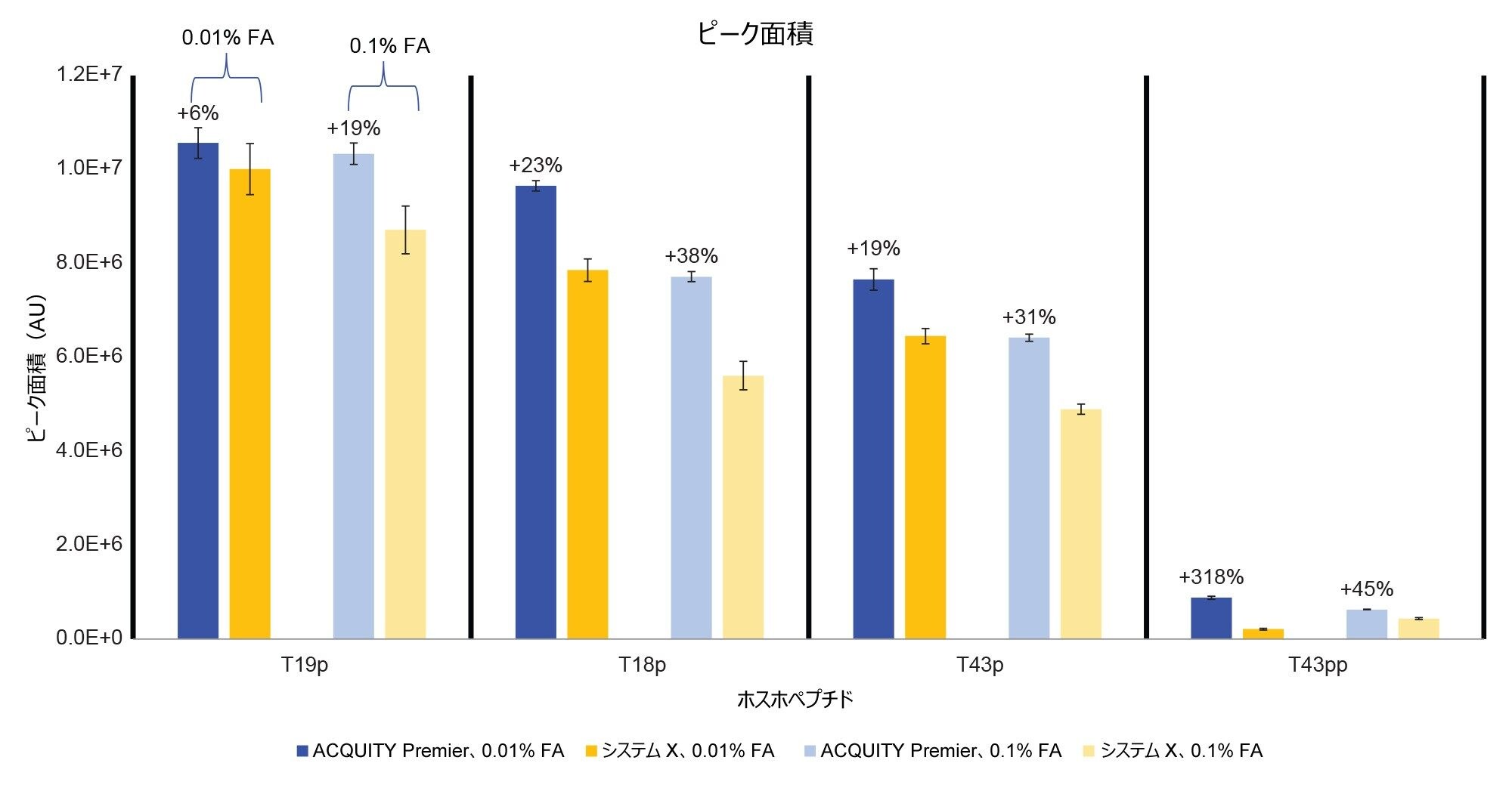
図 2 に、0.1% FA および 0.01% FA の移動相条件を使用した、それぞれのシステムでの MassPREP ホスホペプチド混合液の分離を示します。いずれの条件でも、ACQUITY Premier システムではシステム X よりも良好なピーク形状が見られます。さらに、ACQUITY Premier システムでは移動相添加剤の濃度を下げても、ピークテーリングは有意に増加しませんが、システム X ではピークテーリングがわずかに増加しています。これらの結果は、注入量 5 µL でのピークテーリングを比較している図 3 で確認できます。システム X では、0.01% FA 移動相を使用した場合に、ピークテーリングが 62% ~ 151% 多く見られます。0.1% FA 移動相を使用する場合、システム X では、ACQUITY Premier と比較してピークテーリングが 59% ~ 75% 増加していました。イオン対試薬はオフターゲット相互作用を抑制する働きをするため、システム間の差が減少することが予想されます。FA のレベルがより高い場合でも、システム X の方が ACQUITY Premier システムよりも大きいピークテーリングが一貫して見られました。さらに、ACQUITY Premier システムは、いずれの条件下でも、すべてのピークにわたってピークテーリングの偏差が小さくなりました。ACQUITY Premier システムを使用すると、移動相添加剤を標準の 0.1% FA から 0.01% FA に減らしても、ピークテーリングは有意に増加しませんでした。このことは、MaxPeak HPS により、クロマトグラフィー性能を損なうことなくイオン対形成試薬の使用量を減らせるという考えを裏付けています。これは特に、流路とオフターゲット相互作用しやすい T43 ペプチド(T43pp)の二重リン酸化型に当てはまります。システム X では、標準試料中の 3 種類の一重リン酸化ペプチドについて複数の移動相条件間で同等の結果が得られ、0.01% FA を含む移動相ではピークテーリングがわずかに増加しましたが、これは 0.1% FA で見られた偏差の範囲内です。一方、T43pp ペプチドについては、システム X において、ACQUITY Premier システムでは見られないテーリングの大幅な増加が見られます。
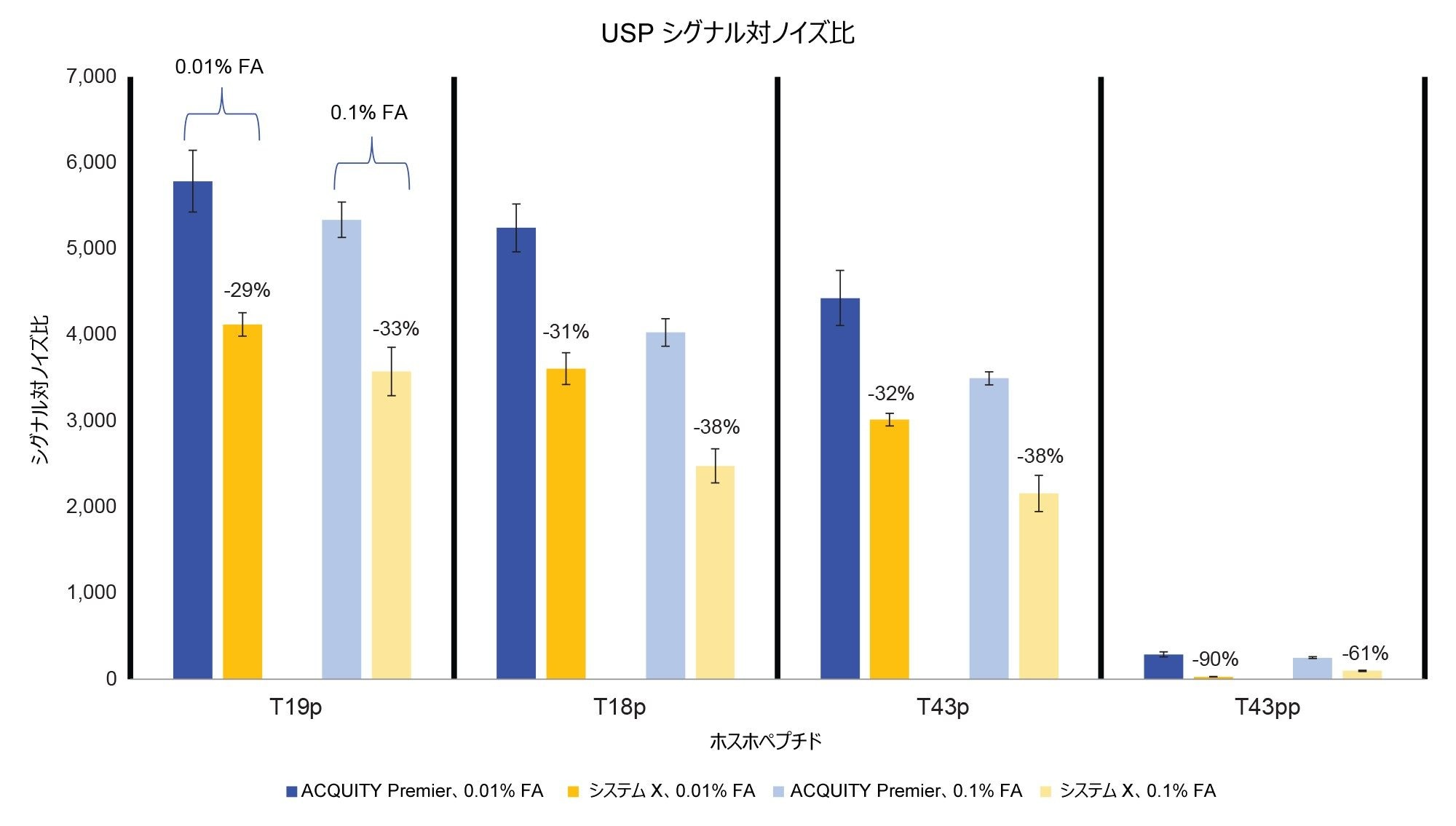
ACQUITY Premier システムは、ピーク形状が優れていることに加え、より高い分析種の回収率と S/N 比を示しました(図 4 および 5)。ACQUITY Premier システムにおいて、生体高分子分析用システムと比較して見られたピーク面積の増加は、低塩濃度の移動相を使用した場合、T19p ホスホペプチドの 6% 増加から T43pp ペプチドの 3 倍増加までの範囲でした。同様に、高塩濃度の移動相でも分析種の回収率向上(19% および 45%)が見られ、Premier テクノロジーによって従来の分析に付加価値が与えられたことがわかります(図 4)。さらに、生体高分子分析用システムを使用する場合に移動相の塩濃度を増加させても、0.1% FA を使用した ACQUITY Premier システムでのピーク面積がシステム X より大きいことからわかるように、この分析種の喪失は十分に低減しません。移動相添加剤の濃度を減らすと、いずれのシステムでも、おそらくイオン化抑制が少なくなるため、すべての一重リン酸化ペプチドのピーク面積とシグナル/ノイズ比が増加しました。システム X では、両方の測定値がニ重リン酸化ペプチドについて減少しました。これは ACQUITY Premier システムでは見られません。この不一致は、生体高分子分析用システムの方が、困難な分析種のオフターゲット相互作用の防止において、移動相添加剤により大きく依存していることを示します。ACQUITY Premier システムでは、T43pp ペプチドのシグナル/ノイズ比またはピーク面積に大きな改善は見られませんが、HPS により、0.01% FA を使用した場合に生体高分子分析用システムで見られた性能の低下が軽減されていることに注意してください。図 2 に示すクロマトグラムを見ると、T43pp は、システム X ではほとんど見えませんが、ACQUITY Premier システムを使用すると、ピーク面積とシグナル/ノイズ比の測定値からわかるように、容易に識別することができます。システム X では、0.01% FA 移動相を使用した場合、ACQUITY Premier システムと比較して、S/N 比が -29%(T19p)~ -90%(T43pp)低下しています。より高塩濃度の移動相を使用すると、同じピークについての S/N 比の減少がそれぞれ -33% および -61% になっています。
ホスホペプチド標準試料の注入における低存在量の T43pp ペプチドについて、各システムで両方の条件での LOD を計算しました。S/N 比 3 をカットオフ基準として使用しました。0.1% FA を使用した場合、LOD は、ACQUITY Premier システムでは 1.53 pmol、システム X では 2.74 pmol になりました。0.01% FA 移動相を使用した場合、LOD は、ACQUITY Premier システムでは 5.06 pmol、システム X では 10.67 pmol になりました。予想どおり、高濃度の移動相添加剤によりシステムの流路内の結合部位がマスクされ、いずれのシステムでも LOD が低くなります。ACQUITY Premier システムの LOD はシステム X の 2 分の 1であったため、添加剤の濃度を下げると、クロマトグラフィーシステム間の違いがより顕著になっています。これは、移動相添加剤の濃度を減らしても、ACQUITY Premier システムの MaxPeak HPS によって、クロマトグラフィーシステム内の分析種のオフターゲット相互作用が継続的に制限されていることに起因すると考えられます。
ここまで説明してきた結果により、ホスホペプチドなどの吸着しやすい分析種の MS 検出に HPS テクノロジーを使用することで得られるメリットが実証されています。しかし、ペプチドマップは複雑で、多数のペプチド(リン酸化型および非リン酸化型)が含まれています。この試験を完全なペプチドマッピングメソッドが包含されるように拡張するため、エノラーゼ消化物標準試料を使用しました(図 6)。この標準試料には、酵母エノラーゼのトリプシン消化によって生じるペプチドが含まれており、ホスホペプチド混合液の 4 種類のホスホペプチドがスパイクされています9。 SIR によるモニタリングに、グラジエント全体にわたって存在する 4 種類のホスホペプチドを含む 9 種類のペプチドを選択しました。ACQUITY Premier システムでは、クロマトグラムのピーク形状とピーク高さが優れていることが容易にわかります。このことは、図 7 および 8 に示されているピークテーリングおよびピーク面積の測定値によって確認できます。非リン酸化ペプチドのピークを含め、モニターしたすべてのピークが、ACQUITY Premier システムにおいて、0.01% FA 移動相では 12%(T6) ~ 77%(T43pp)、0.1% FA 移動相では 4%(T4)~ 85%(T43pp)の範囲のピークテーリングを示しました(図 7)。低塩濃度の移動相を使用すると、ピーク面積が 11%(T14)~113%(T43pp)の範囲で増加しています。高塩濃度の移動相の場合、ACQUITY Premier システムで、T18 ペプチドにはピーク面積の大きな変化は見られませんでしたが、T6 ペプチドは 212% の改善を示しました。
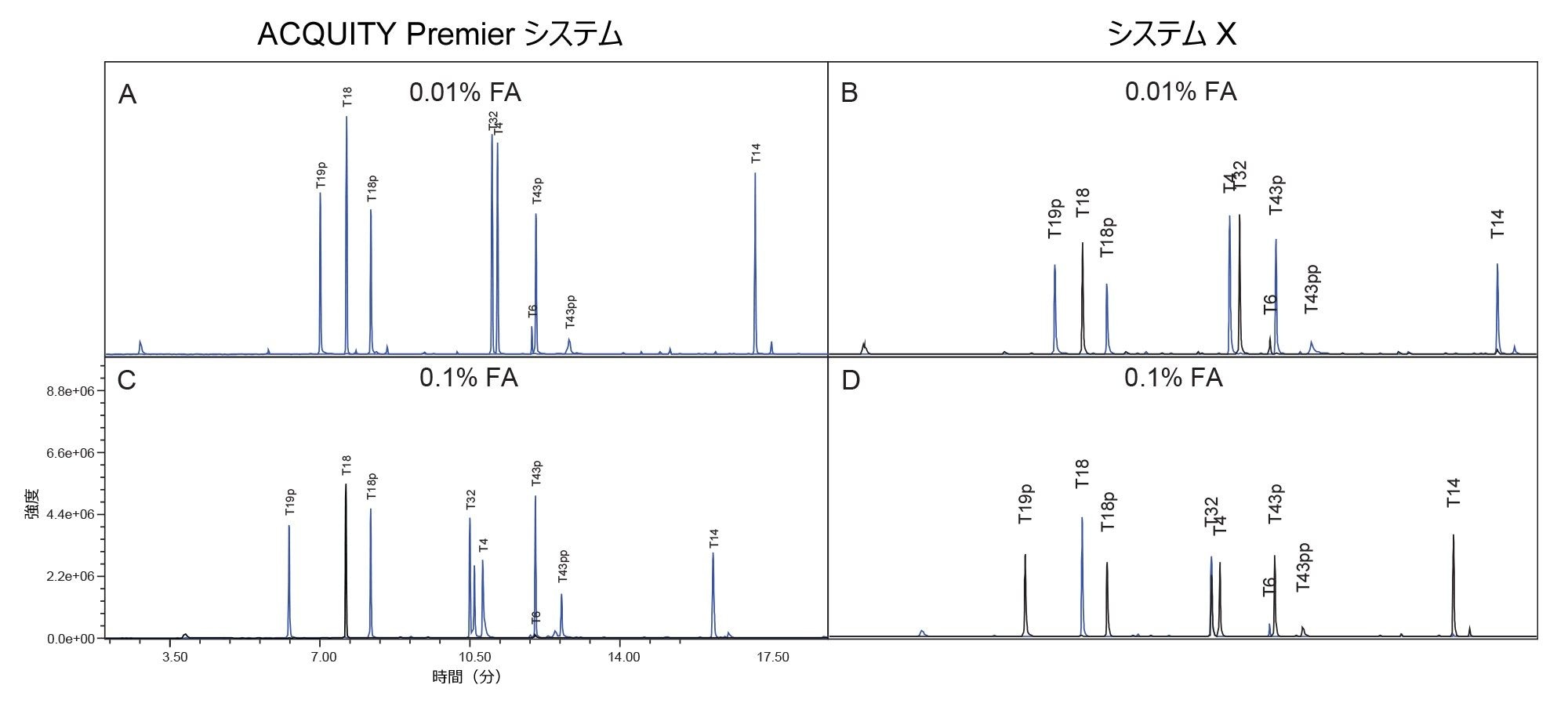
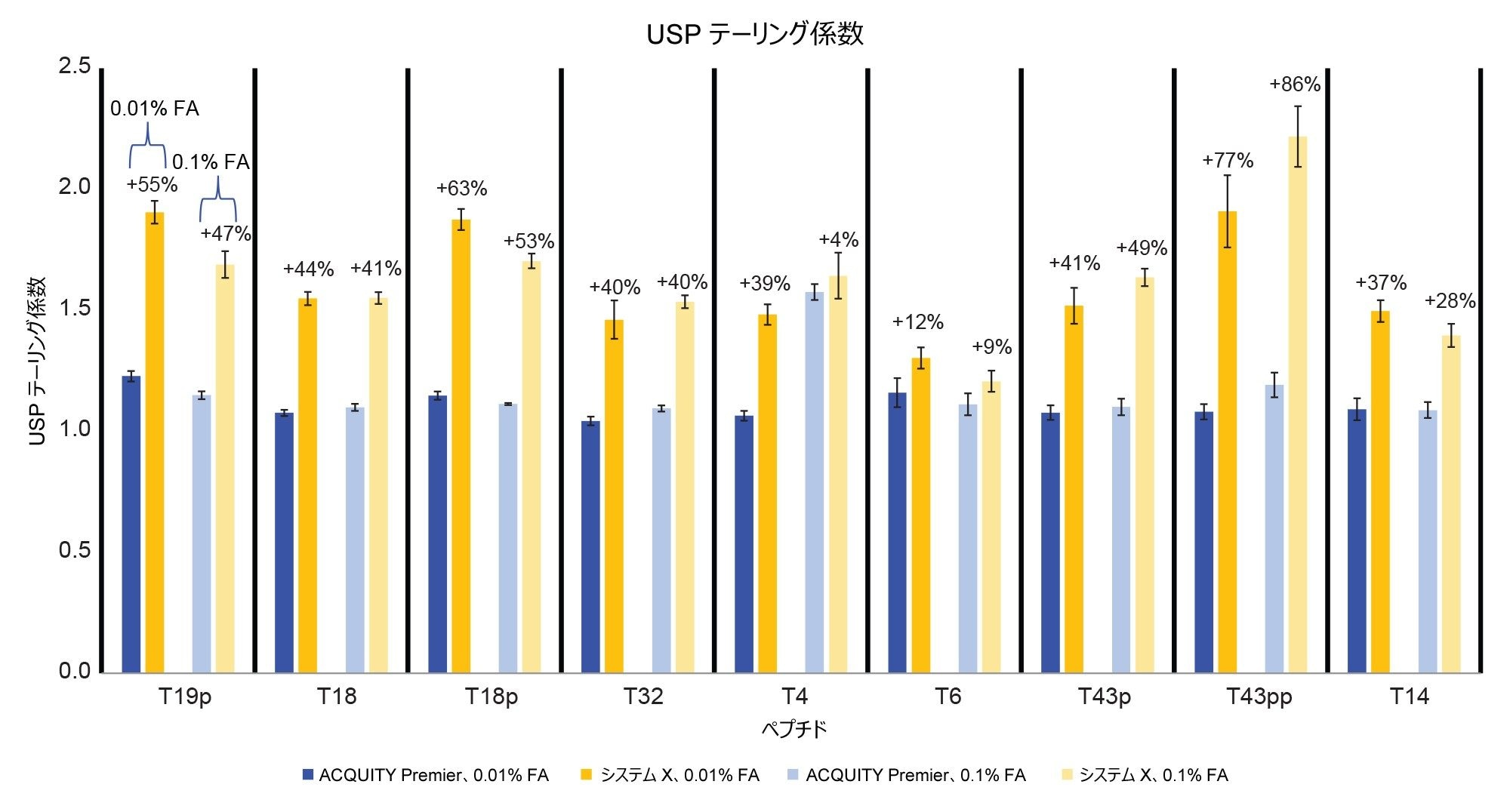
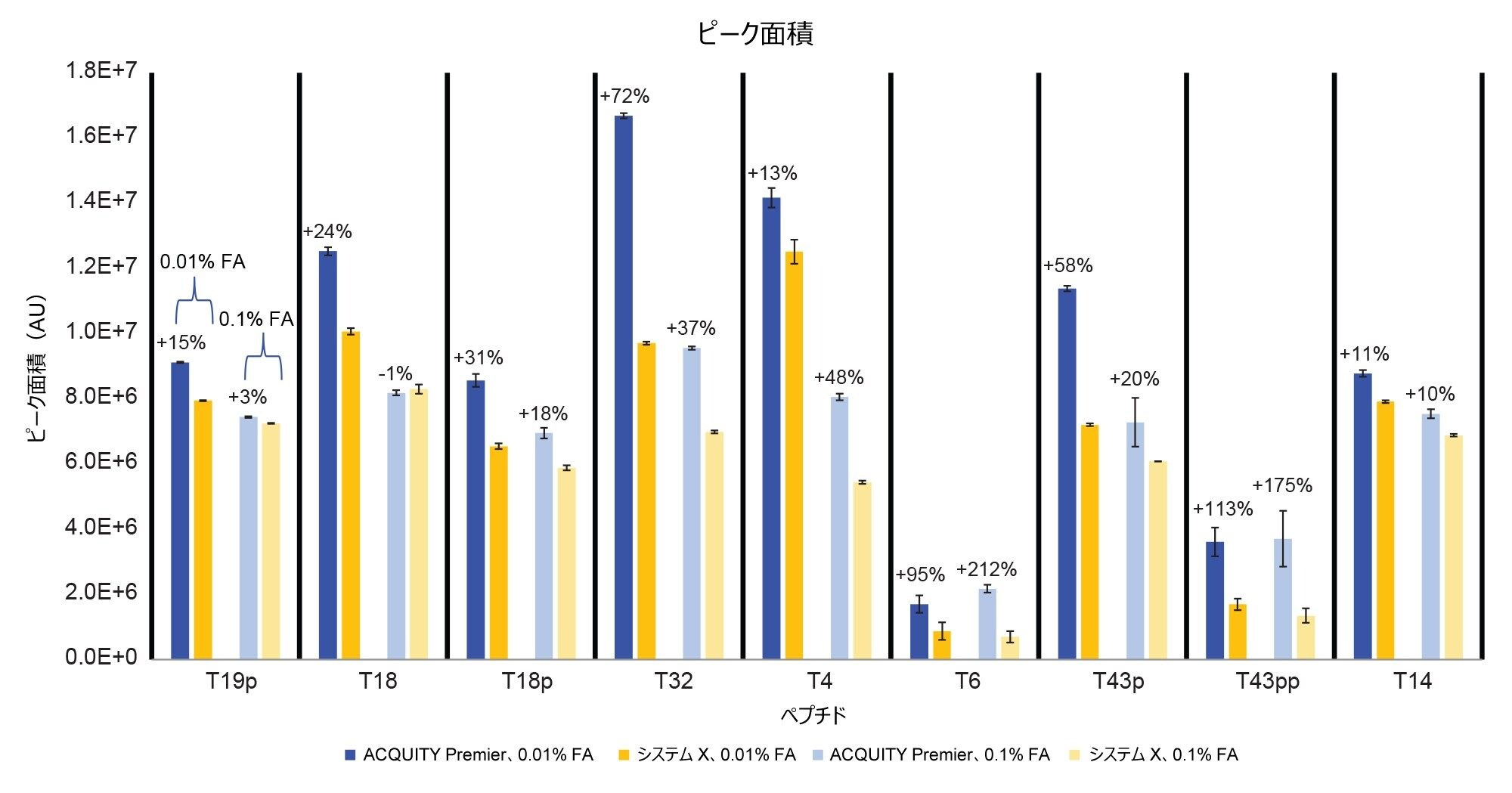
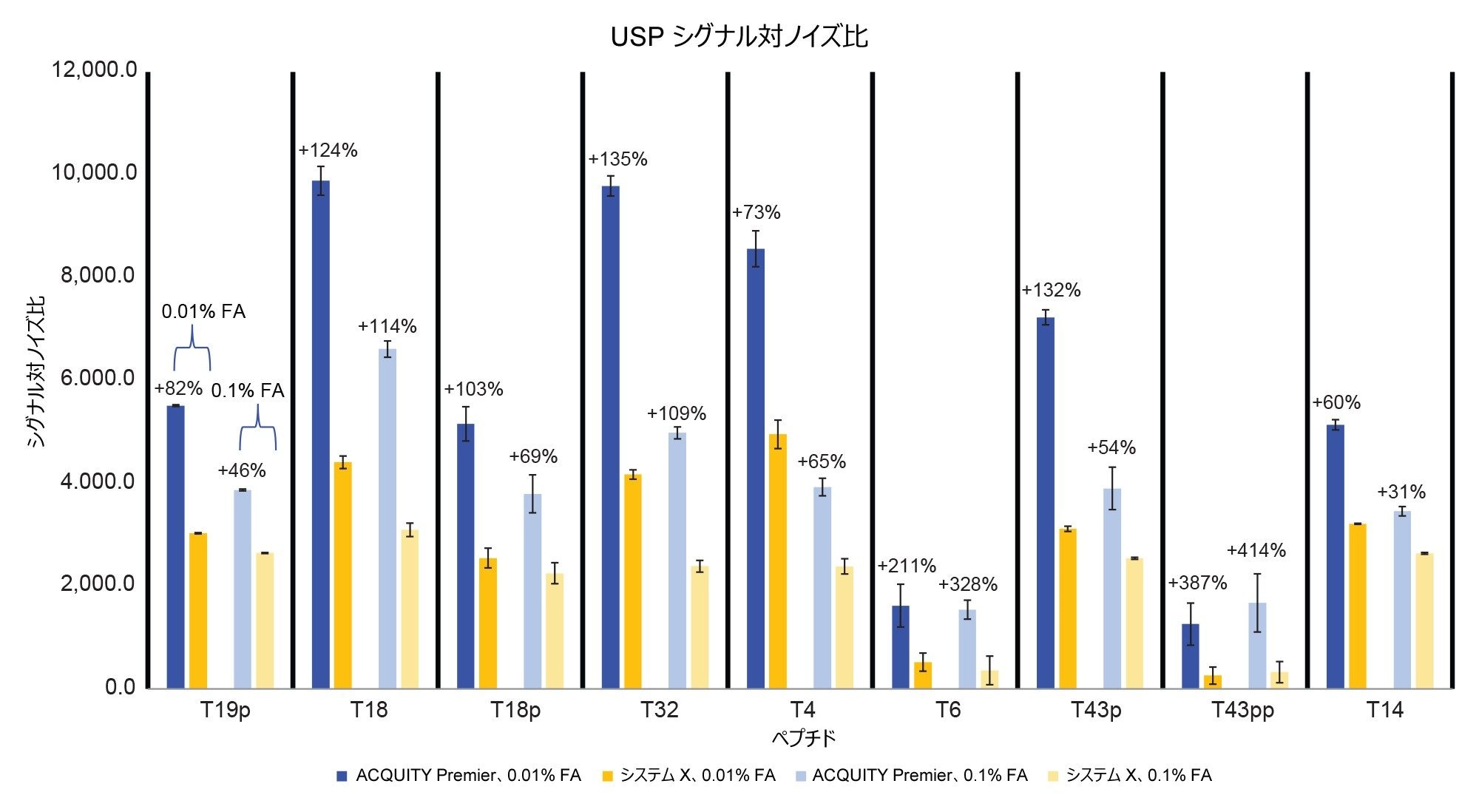
図 9 に、2 つのシステム間のシグナル/ノイズ比の比較を示します。高塩濃度の移動相を使用することで、ACQUITY Premier システムでは、31%(T14)~ 414%(T43pp)の範囲でシグナル/ノイズ比が改善しています。低塩濃度の移動相を使用すると、改善の範囲は 60%(T14)~ 387%(T43pp)になります。この測定における最大の改善は、前に説明した、存在量が少なく検出が困難になる場合がある二重リン酸化された T43pp ペプチドにおいて見られます。全体として、MaxPeak Premier カラムを搭載した ACQUITY Premier システムは、質量検出器を使用するホスホペプチドマッピング試験において優れたクロマトグラフィーソリューションであると言えます。
結論
2 種類の移動相条件で MaxPeak Premier カラムを使用したホスホペプチドの RPLC-MS 分離において、MaxPeak High-Performance Surface テクノロジーを採用した ACQUITY Premier システムを、従来の生体高分子分析用システムと比較しました。ホスホペプチド混合物の分析において ACQUITY Premier システムを使用する場合、生体高分子分析用システムよりも、ピークテーリングが少なく、ピーク面積が大きく、シグナル対ノイズ比が優れており、低塩濃度の移動相を使用するとより大きなメリットが得られることが示されました。これらの改善により、ACQUITY Premier システムでの検出限界が低くなっています。ホスホペプチドをスパイクしたトリプシンエノラーゼ消化物を使用した場合、ACQUITY Premier システムでは、複雑なペプチドマップ中のリン酸化ペプチドおよび非リン酸化ペプチドの両方について、生体高分子分析用システムの性能を上回っていました。生体高分子分析用システムでは、ピークテーリングが、移動相の塩濃度に応じて最大 77%(T43pp、0.01% FA)および 86%(T43pp、0.1% FA)まで増加しました。低塩濃度の移動相を使用した ACQUITY Premier システムでは、ピーク面積とシグナル対ノイズ比の増加がそれぞれ最大 113%(T43pp)および 387%(T43pp)でした。これらの改善は、高塩濃度の移動相を使用した同じ測定では、最大 212%(T6)および 414%(T43pp)に変わります。ACQUITY Premier システムの MaxPeak HPS により、生体高分子分析用システムで見られたように分離の質を犠牲にすることなく、RPLC 分離における酸性移動相添加剤を低減することができます。このことは、ペプチドアッセイに質量分析を使用する際のイオン化抑制の低減につながり、シグナル/ノイズ比の改善および最終的には検出限界の低下が得られます。全体として、MaxPeak HPS テクノロジーを採用した ACQUITY Premier システムにより、従来の生体高分子分析用システムでは困難であった条件を使用して、ホスホペプチドなどの分析が難しい化合物の質の高いペプチドマップを生成することができます。
参考文献
- Lord, J.; Bunce, C.; Brown, G. The Role of Protein Phosphorylation in the Control of Cell Growth and Differentiation.Br.J. Cancer 1988, 58 (5), 549–555.https://doi.org/10.1038/bjc.1988.256.
- Ardito, F.; Giuliani, M.; Perrone, D.; Troiano, G.; Lo Muzio, L. The Crucial Role of Protein Phosphorylation in Cell Signaling and Its Use as Targeted Therapy (Review).Int.J. Mol.Med. 2017, 40 (2), 271–280.https://doi.org/10.3892/ijmm.2017.3036.
- Separation of Phospho- and Non-Phosphopeptides Using Reverse Phase Column Chromatography.FEBS Lett. 1995, 368 (3), 452–454.https://doi.org/10.1016/0014-5793(95)00710-Q.
- Birdsall, R. E.; Kellett, J.; Yu, Y. Q.; Chen, W. Application of Mobile Phase Additives to Reduce Metal-Ion Mediated Adsorption of Non-Phosphorylated Peptides in RPLC/MS-Based Assays.J. Chromatogr.B 2019, 1126–1127, 121773.https://doi.org/10.1016/j.jchromb.2019.121773.
- Núñez, O.; Lucci, P. Applications and Uses of Formic Acid in Liquid Chromatography-Mass Spectrometry Analysis; 2014; pp 71–86.
- Reed, C. E.; Simeone, J.; Hong, P. Demonstrating the Applicability of the ACQUITY Premier Binary System for Long Shallow Gradient Peptide Mapping Analysis.Waters Application Note 720007631. 2022.
- Dao, D.; Koshel, B. M.; Birdsall, R. E.; Yu, Y. Q. Peptide Mapping Retention Time Repeatability Under Shallow Gradient Conditions.Waters Application Note 720007086. 2020.
- Simeone, J.; Hong, P.; McConville, P. R. Performance of the ACQUITY UPLC I-Class PLUS System for Methods Which Employ Long, Shallow Gradients.Waters Application Note 720006290. 2018.
- ホスホペプチド混合物を含む MassPREP エノラーゼ消化物。
720008136JA、2023 年 12 月