Waters ACQUITY および XBridge Premier Protein SEC 250 Å カラム:不活性 SEC カラム設計の新たな評価基準
要約
タンパク質のサイズ排除クロマトグラフィー(SEC)の大きな制約の 1 つとして、充塡剤およびカラムハードウェアの不活性度が不十分なことによる望ましくない二次的相互作用が挙げられます。タンパク質(mAb、ADC、およびその他のバイオ医薬品分子を含む)の強い活性表面により、カラムハードウェアに存在する金属酸化物表面(シリカおよびハイブリッドシリカパーティクルに存在する疎水性部位および静電的活性部位の両方)と相互作用する傾向が見られます。これらの望ましくない二次的相互作用により、タンパク質の凝集体、モノマー、フラグメントの分離や、これらの分子種の正確な定量において重大な問題が生じます。市販の SEC カラムの一部では、カラムの材質またはタンパク質のプレコンディショニングのいずれかにより、この問題に対処する試みがなされていますが、そのほとんどにおいては、最適な結果を得るのに、分析法開発に相当の時間をかける必要があります。高塩濃度の移動相の使用や、有機溶媒の添加は、二次的相互作用の抑制に有効であることが知られていますが、色々な意味で制約があり、クロマトグラフィー分析者の作業がさらに困難になります。カラムの不活性度を改善することで、このような対策が不要になり、分析法がより柔軟かつ頑健になります。そのため、ウォーターズでは、カバー率の高いヒドロキシ末端を持つポリエチレンオキシドによる新しいエチレン架橋型ハイブリッド粒子(BEH-PEO)表面を開発し、これをこの種で最初の親水性 High Performance Surfaces(HPS)カラムハードウェアと組み合わせました。これにより、SEC における望ましくない二次的相互作用の問題に対する総合的な解決が得られました。対応する Waters XBridge および ACQUITY Premier Protein SEC 250 Å カラムは、タンパク質 SEC に新たなレベルの不活性度をもたらします。一連のクロマトグラフィー試験や主流の代替製品との比較を行ったところ、XBridge および ACQUITY Premier Protein SEC 250 Å カラムにより、塩や有機溶媒添加剤をほとんど必要とせずに、タンパク質凝集体およびフラグメントについて優れた分離および定量を達成できることが示されました。これにより、このカラムは汎用性が非常に高く、市販のリン酸緩衝生理食塩水(PBS)などの単純な生理的バッファーで使用することができます。
アプリケーションのメリット
はじめに
バイオ医薬品タンパク質が増加し続ける中で、特性解析および製品モニタリングのためのアッセイがますます重要になっています。これらの医薬品は一般にタンパク質ベースであるため、凝集1 やフラグメント化2 が起きやすく、有効性低下や患者における副作用の可能性が生じます。そのため、多くの場合、バイオ医薬品タンパク質のサイズバリアントの正確な定量が、規制機関によって義務付けられています3。サイズ排除クロマトグラフィー(SEC)は、この目的に向けた強力なツールであり、モノクローナル抗体(mAb)、抗体薬物複合体(ADC)、バイオシミラー、二重特異性モノクローナル抗体、およびその他の治療用タンパク質の分析に広く採用されています4。
SEC では、分子は、流体力学的半径に応じて、充塡剤の内部多孔質に様々な程度に侵入します。大きい分子は排除され、狭いポアのそばを通過します。その結果、大きい分子は小さい分子よりも早くカラムから溶出します。通常、SEC 分離がクロマトグラフィー流路に沿った吸着による相互作用の影響を受けない場合に、最良の分析種回収率および最高のピーク分離が得られます。タンパク質表面には一連の化学的に反応する部分が含まれるため、このような相互作用を防ぐことは非常に困難です。タンパク質は、正および負の電荷を帯び、疎水性部位および親水性部位の両方を持つため、二次的相互作用が生じる傾向が強くなります。
したがって、タンパク質 SEC カラムのメーカーは、不活性かつ頑健なカラムを製造するという課題を突きつけられています。金属製カラムハードウェアでは、小粒子径の効率的な充塡が可能ですが、静電的に活性な表面が生じるため、イオン性二次的相互作用を軽減するために、高塩濃度の移動相の使用が必要となります。ポリエーテルエーテルケトン(PEEK)カラムハードウェアは、非イオン性の代替策となりますが、圧力に制約があり、疎水性も導入されます。充塡剤の分野では、ジオール結合粒子が、タンパク質 SEC に使用されてきた長い歴史がありますが、活性部位が残存している場合があります。最近では、疎水性の問題に対処するために、ポリエチレンオキシド(PEO)結合粒子が導入されましたが、それでもなおカラムハードウェアによるイオン性相互作用に対処する必要がありました。
つまり、理想的な UPLC または HPLC SEC カラムでは、現時点でこのような課題に対処できていません。この事を念頭に置き、ウォーターズでは、新規のポア径 250 Å のヒドロキシ末端 PEO 結合エチレン架橋型ハイブリッド粒子を、この種で最初の親水性 MaxPeak High Performance Surfaces(HPS)カラムハードウェアに統合した、ACQUITY および XBridge Premier Protein SEC カラムシリーズを開発しました。これらのカラムでは、望ましくない二次的相互作用が軽減され、タンパク質サイズバリアントの定量において、信頼性の高い結果をより簡単に得ることが可能になりました。
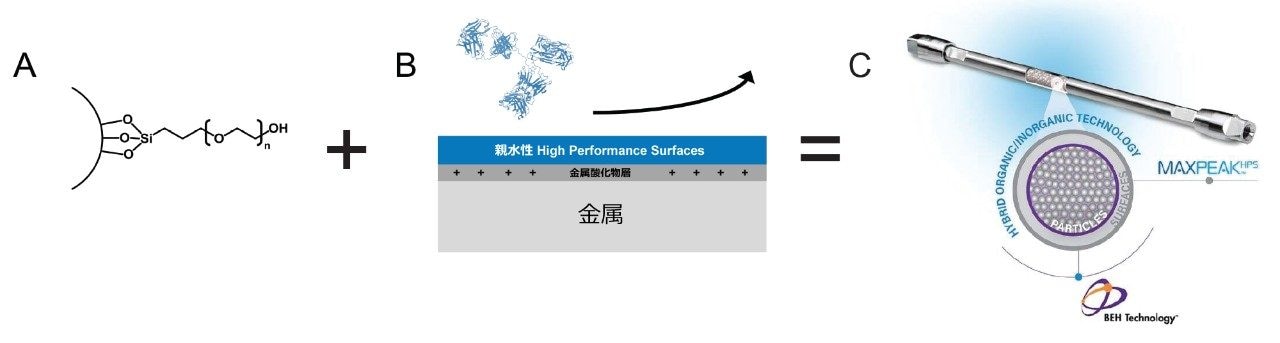
今回、リン酸緩衝生理食塩水(PBS)移動相を用いて、Waters XBridge および ACQUITY Premier Protein SEC 250 Å カラムをタンパク質、mAb、ADC 分析に適切に適用できることが示されました。
実験方法
サンプルの説明
各試験で示されているように、NISTmAb(RM 8671)のサンプル濃度は 2 mg/mL、トラスツズマブエムタンシンのサンプル濃度は 2 ~ 5 mg/mL でした。いずれのサンプルも Milli-Q 水で希釈して調製しました。使用した試薬は、LC-MS グレードのアセトニトリル(Honeywell、製品番号:LC015-4)、無水二塩基性リン酸ナトリウム(Fisher Scientific、製品番号:S374-500)、36.5 ~ 38% 塩酸(J.T. Baker、製品番号:9535-02)、塩化ナトリウム(Fisher Scientific、製品番号:S271-1)などです。28.39 ± 0.02 g の無水二塩基性リン酸ナトリウムを 1000 ± 0.02 g の 18.2 MΩ 水で希釈して 200 mM のリン酸ナトリウムバッファー(移動相 A)を調製しました。次に、これに塩酸(36.5 ~ 38%)を滴下して pH を 6.8 に調整しました。58.44 ± 0.02 g の塩化ナトリウムを 1,000 ± 0.02 g の 18.2 MΩ 水で希釈して、1.0 M の NaCl(移動相 B)を調製しました。頑健な SEC 性能を得るには、移動相が清浄であることが重要です。今回概説した試験では、移動相 A および B をいずれも無菌 0.2 µm ナイロンフィルター(Thermo Scientific、製品番号:1630020)でろ過しました。
LC 条件
|
LC システム: |
ACQUITY UPLC H-Class Bio |
|
システム容量: |
< 10 µL |
|
検出: |
ACQUITY TUV 検出器(チタン製フローセル、5 mm、1,500 nL) |
|
波長: |
280 nm |
|
データ取り込み: |
Empower 3 |
|
バイアル: |
マキシマムリカバリーバイアルおよびキャップ(ウォーターズ製品番号:186000327C)、Waters 300 μL ポリプロピレンスクリューネックバイアル(ウォーターズ製品番号:186004112) |
|
カラム: |
XBridge Premier Protein SEC、250 Å、2.5 μm、4.6 × 150 mm(ウォーターズ製品番号:186009959) BioResolve SEC mAb 200 Å、2.5 µm、4.6 × 150 mm(ウォーターズ製品番号:186009435) 他社製ジオール結合シリカ 250 Å、2 μm、4.6 × 150 mm 他社製 MeO-PEO 結合シリカ 300 Å、2.7 μm、4.6 × 150 mm |
|
カラム温度: |
30 ℃ |
|
サンプル温度: |
8 ℃ |
|
注入量: |
NISTmAb RM 8671(2 mg/mL、1 µL)、ADC(MeCN モディファイヤー使用の場合 2 mg/mL を 1 µL、IPA モディファイヤー使用の場合 5 mg/mL を 1 µL) |
|
流速: |
0.350 mL/分 |
|
移動相 A: |
200 mM リン酸ナトリウムバッファー、pH 6.8 |
|
移動相 B: |
1.0 M NaCl |
|
移動相 C: |
50% アセトニトリル/50% Milli-Q 水または 50% イソプロパノール/50% Milli-Q 水 |
|
移動相 D: |
Milli-Q 水(18.2 MΩ) |
グラジエント
- アイソクラティック(イオン性二次的相互作用試験)
0 mM NaCl – 100 mM リン酸 pH 6.8(50% A/50% D)
50 mM NaCl – 100 mM リン酸 pH 6.8(50% A/5% B/45% D)
100 mM NaCl – 100 mM リン酸 pH 6.8(50% A/10% B/40% D)
200 mM NaCl – 100 mM リン酸 pH 6.8(50% A/20% B/30% D) - アイソクラティック(疎水性二次的相互作用試験)
0% MeCN – 100 mM リン酸 pH 6.8 + 200 mM NaCl(50% A/20% B/0% C/30% D)
5% MeCN – 100 mM リン酸 pH 6.8 + 200 mM NaCl(50% A/20% B/10% C/20% D)
10% MeCN – 100 mM リン酸 pH 6.8 + 200 mM NaCl(50% A/20% B/20% C/10% D)
15% MeCN – 100 mM リン酸 pH 6.8 + 200 mM NaCl(50% A/20% B/30% C/0% D) - 実験の一部では MeCN の代わりに IPA(イソプロパノール)を使用しました。
結果および考察
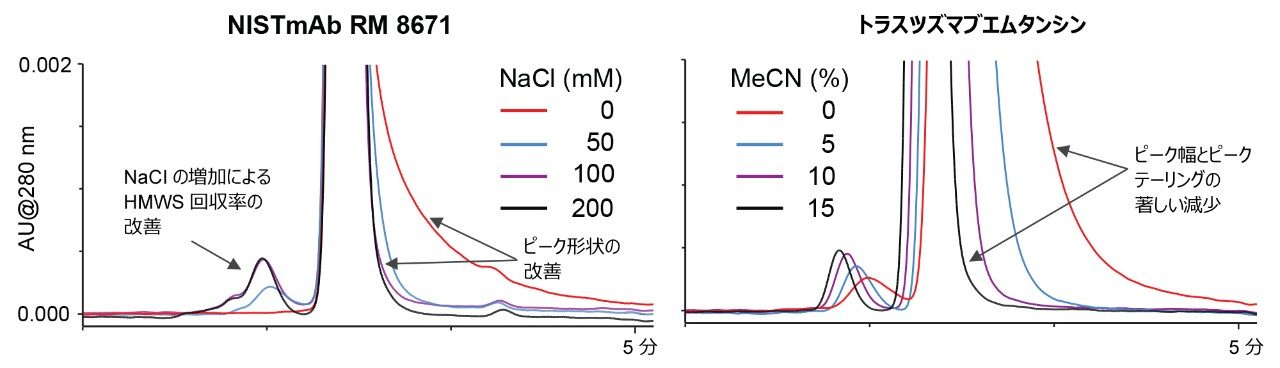
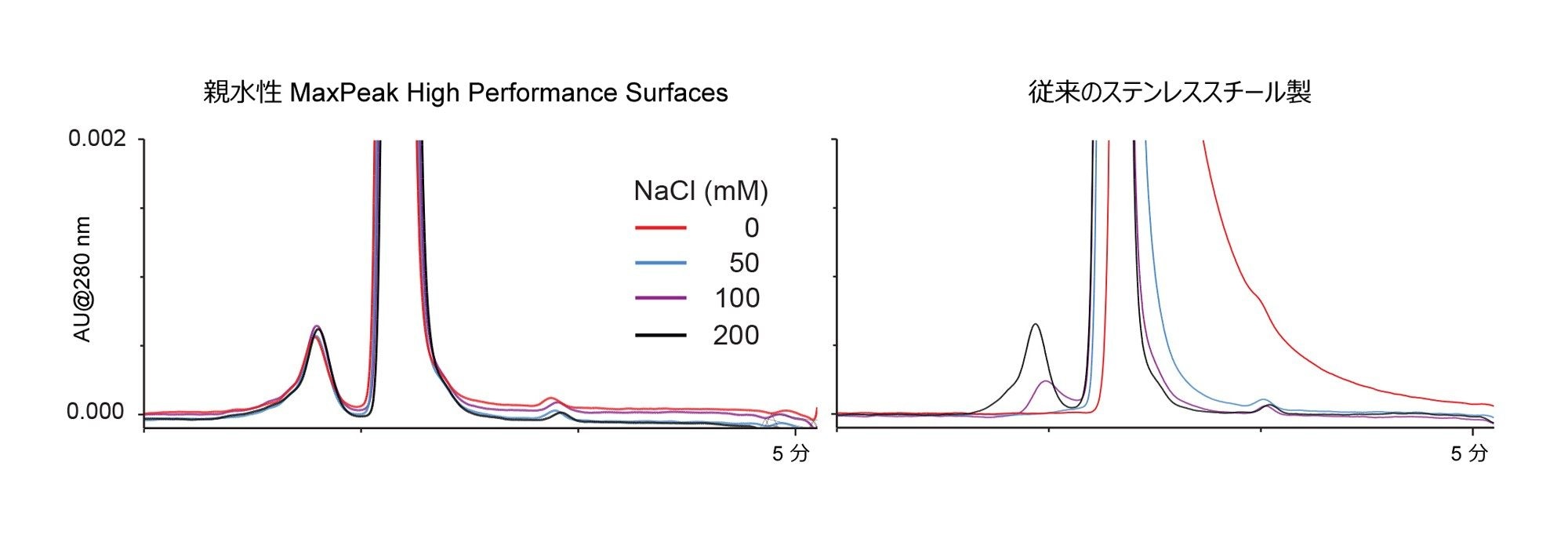
Goyon ら5の公表済みの研究に基づき、カラムが二次的相互作用を示す度合いを実証する一連の試験を考案しました。NISTmAb とトラスツズマブエムタンシンの分離において、NaCl またはアセトニトリルの添加による移動相滴定を適用し、イオン性および疎水性の二次的相互作用について調査しました。移動相中の NaCl またはアセトニトリルの濃度を徐々に増加させることで、それぞれの種類の二次的相互作用が徐々に抑制されました。低濃度から高濃度の NaCl またはアセトニトリルを用いた場合のタンパク質回収率およびピーク形状の改善の程度を調べることで、カラムのモディファイヤーへの依存度を判定することができます。図 2 に、この試験を従来のステンレススチール製ハードウェアに充塡したジオール結合粒子の分析に適用した例を示します。
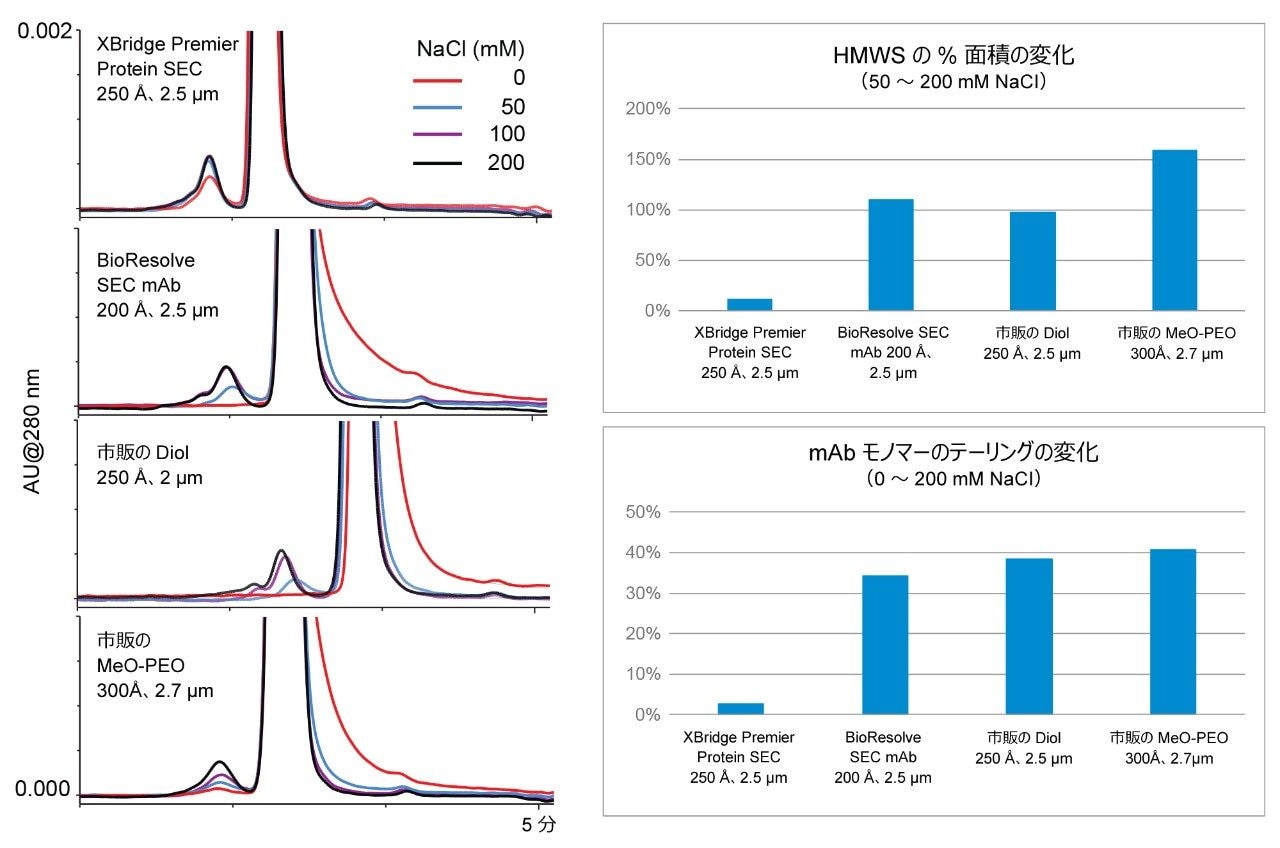
このアプローチを用い、XBridge Premier Protein SEC 250 Å、2.5 µm を使用して二次的相互作用試験を実施し、Waters BioResolve SEC mAb 200 Å、2.5 µm、および市販の SEC カラム 2 種と比較しました。比較に用いたこれらのカラムはそれぞれ、mAb、ADC、およびその他の同様のサイズのバイオ医薬品分子の特性解析および製品モニタリング用に設計および販売されたものです。これらのカラムはそれぞれ、分析法開発上の検討事項を考慮した上で、この目的において高性能を発揮することが知られています。
イオン性二次的相互作用は、クロマトグラフィーのピーク形状(テーリング)および、重要な点としてタンパク質凝集体の回収率(HMWS)に、重大な悪影響を及ぼす可能性があります。凝集体は、高分子で比較的荷電残基が多いため、イオン性相互作用を受けやすいという性質があります。非共有結合による凝集体は、分子間で疎水性相互作用を形成する傾向があるため、露出表面もかなり多くの電荷を持ちます。また、凝集体は SEC カラム中を最も速く移動する分析種です。したがって凝集体は、カラム全長を通過する間に最も強い(最も不動態化されていない)活性部位と接触します。いずれにしても、既知の重要品質特性(CQA)である凝集体の正確な定量は、タンパク質のサイズバリアント分析用に設計されたタンパク質 SEC カラムの重要な機能です。この測定のための頑健な性能が不可欠です。
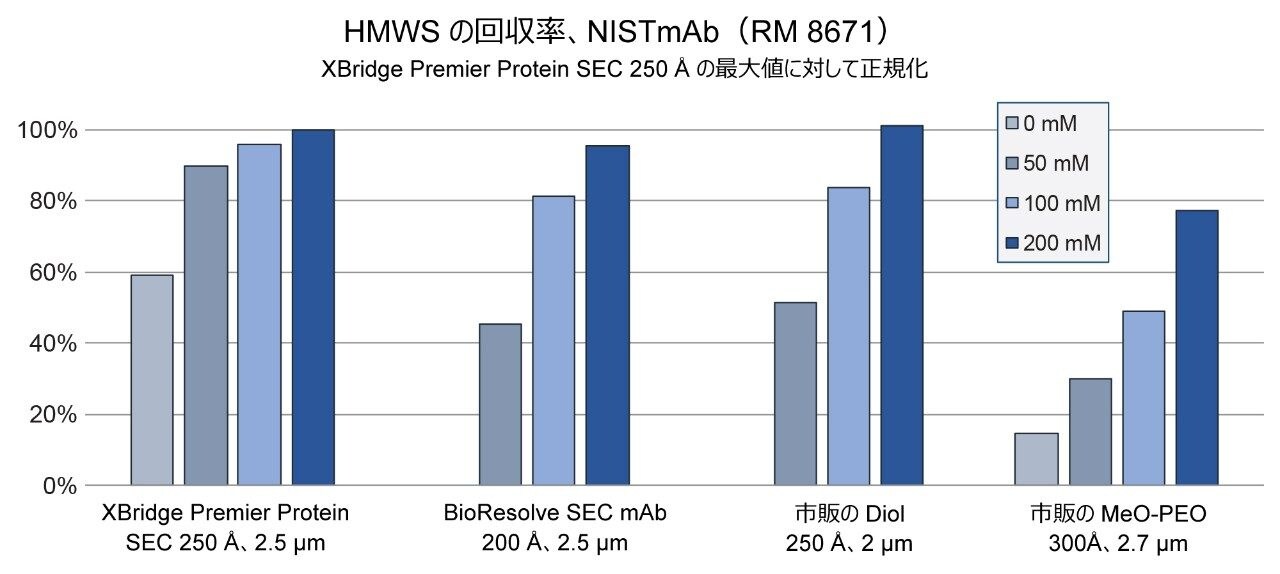
この試験に用いたカラムがイオン性二次的相互作用の影響を受ける度合いを実証するため、塩基性移動相 100 mM リン酸ナトリウム pH 6.8 を使用し、NaCl 濃度を 0 mM から最大 200 mM まで徐々に増加させました。NISTmAb(RM 8671)の濃度 2 mg/mL の希釈液 1 µL を各間隔で 3 回繰り返しで注入し、3 回目の注入を報告しました。代表的なクロマトグラムを図 3 に示します。特筆すべき点として、XBridge Premier Protein SEC 250 Å、2.5 µm カラムでは、NaCl 濃度の全範囲においてモノマーのピークにほとんど変化が見られず、凝集体の回収率も同様に優れていました。対照的に、従来のステンレススチール製カラムでは、NaCl 濃度が低い場合に、顕著なイオン性二次的相互作用が見られました。2 種類のジオールベースのカラムでは、100 mM NaCl で悪くない性能を示しましたが、凝集体(HMWS)の正確な定量には、NaCl 濃度を 200 mM に増加させることが必要でした。MeO-PEO ベースのカラムでは、NaCl 濃度が最も高い場合でも HMWS が過小評価されました。これより高濃度の NaCl については調査していません。
まとめると、XBridge Premier Protein SEC 250 Å、2.5 µm カラムにおけるイオン性二次的相互作用の減少は、親水性 MaxPeak HPS カラムの不活性なステンレススチール製ハードウェアによるものと思われます。この点を確認するため、SEC 250 Å、2.5 µm カラムを、MaxPeak HPS と従来のステンレススチール製ハードウェアの両方を用いて作製しました。これらのカラムを試験することにより、ハイブリッド表面カラムハードウェアにより、大きなメリットが得られることが示されました(図 5)。
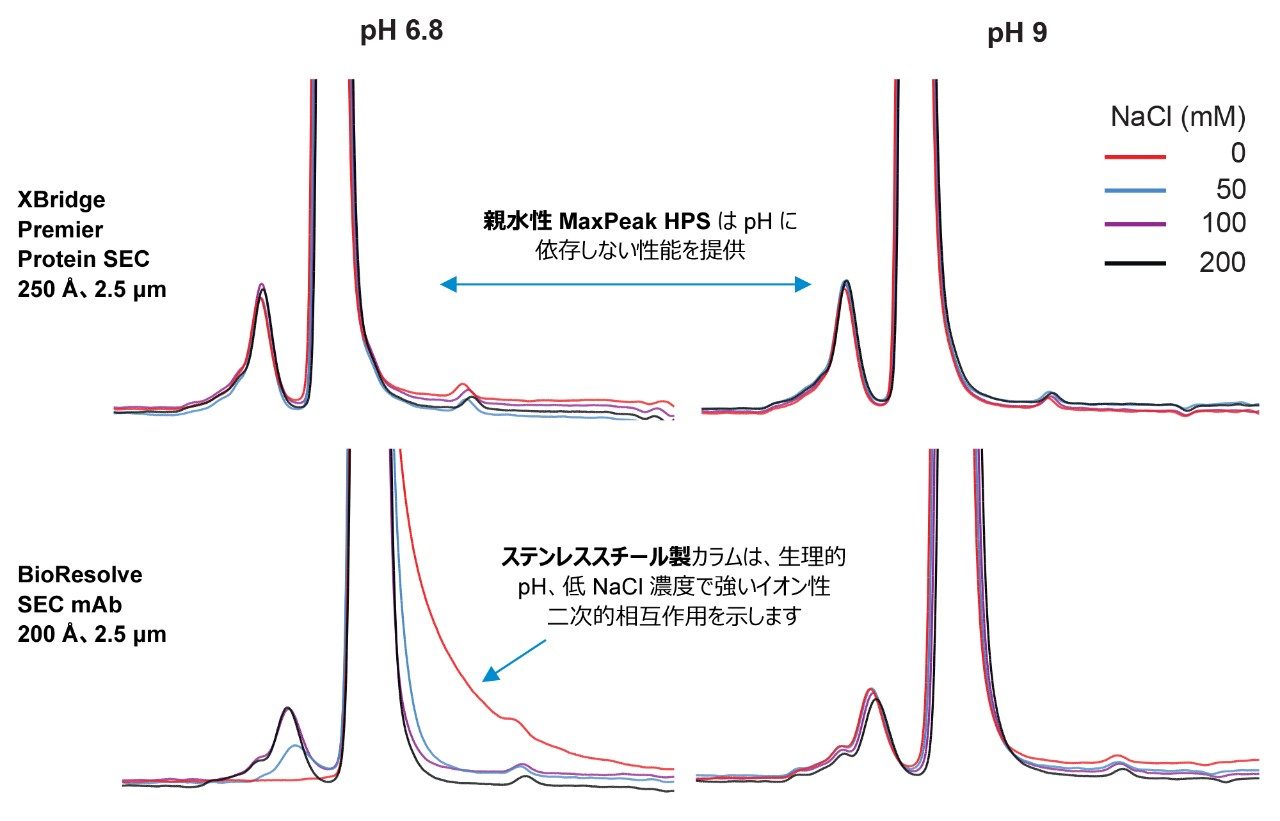
イオン性二次的相互作用を軽減する手段として、移動相の塩濃度の制御に加えて、pH も活用しました。この効果を検討する理由の 1 つは、pH を上げることで、金属製ハードウェアの静電ポテンシャルが減少するためです。一般に、移動相の pH が高いと、イオン性二次的相互作用を軽減できますが、サンプルの安定性およびアッセイの正確性が犠牲になる場合があります。XBridge および ACQUITY Premier Protein SEC 250 Å カラムでは、MaxPeak HPS ハードウェアにより、移動相の pH に対する依存度が低減しました。これにより、生理的 pH で調製したバッファーを導入しやすくなります。図 6 に、以前使用した pH 6.8 の移動相および pH 9 のバッファーでのイオン性相互作用試験で得られたクロマトグラムを示します。
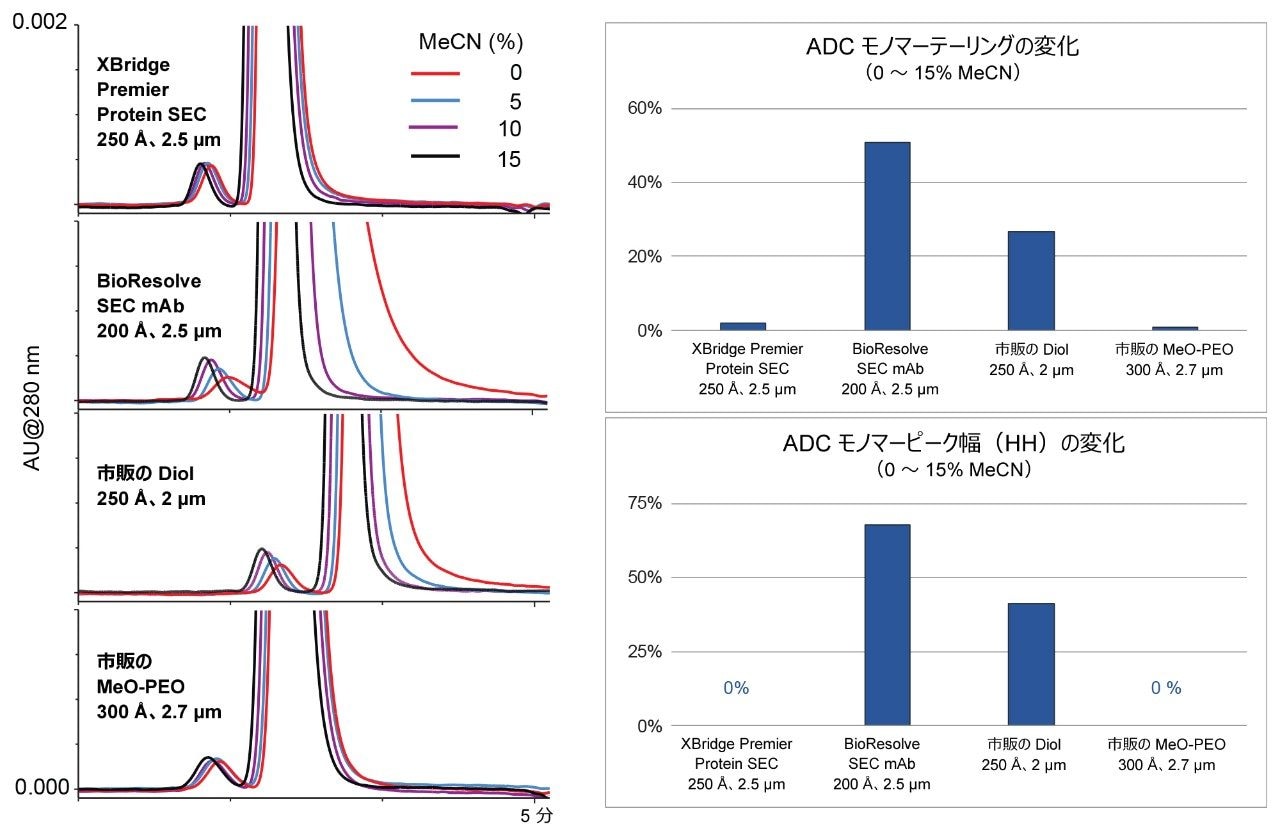
疎水性の二次的相互作用は、主にタンパク質分子と SEC 充塡剤自体の疎水性部位の間で発生します。このような相互作用により、特に ADC などの極端に疎水性の分子では、モノマーのピーク形状が損なわれます。モノマーの過剰なテーリングがピーク効率に大きく影響し、フラグメント分子種を分離・定量する性能が阻害されます。SEC カラムの有機溶媒に対する依存性を調査した結果の例を図 7 に示します。アセトニトリルなどの有機移動相モディファイヤーは、タンパク質 SEC における疎水性二次的相互作用を抑制する効果があることで知られています7。 一方、PEO ベースのカラムは、特にアセトニトリル添加の効果が少なく、添加してもしなくてもほぼ同じです。これに対して、ジオール結合シリカまたはハイブリッドパーティクルカラムは、疎水性が強くなる傾向があり、トラスツズマブエムタンシンのように疎水性の非常に強い ADC の分析でピーク形状を十分に改善するには、大量のアセトニトリルが必要になる可能性があります。XBridge 粒子および ACQUITY Protein SEC 250 Å 粒子では、カバー率の高いヒドロキシ端末 PEO 結合により、他の SEC 充塡剤よりも大幅に親水性が高くなっています。これにより、100% 水系移動相で非常に効率的なピークが得られました。
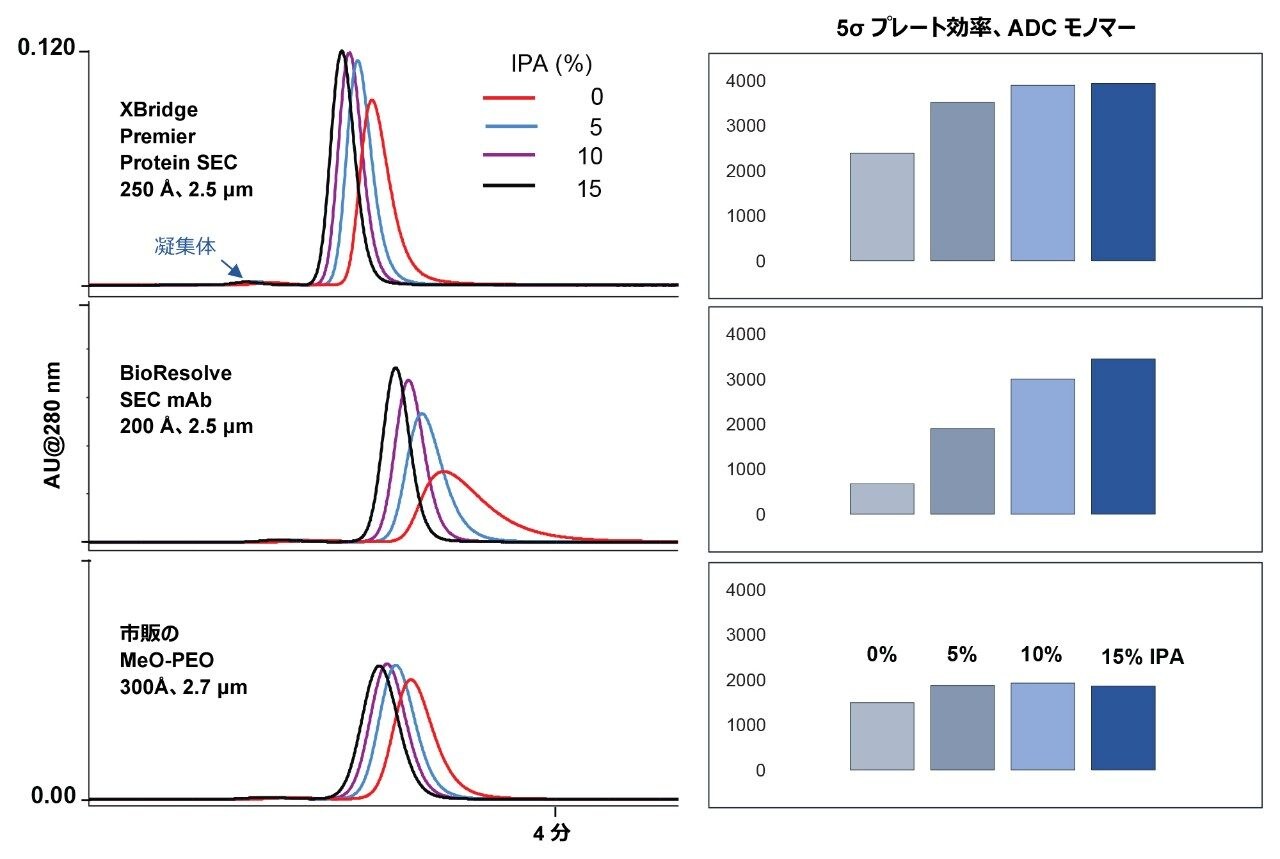
PEO ベースの粒子のカラムは、疎水性が元々低いため、特にアセトニトリル添加の効果が少ないですが、分析種によっては有機添加剤の添加によるメリットが得られる可能性があります。そこで、移動相へのイソプロパノール(IPA)の添加について試験しました。アセトニトリルの代わりに IPA で移動相を滴定した場合のデータを表 8 に示します。この結果は、少量の IPA を使用することで、トラスツズマブエムタンシンの分離性能が改善することを示しています。性能改善の大部分は、わずか 5% の IPA を使用した時点で生じています。有機溶媒を低濃度に留めることで、タンパク質変性の懸念を減らすことができます。IPA の 5% 使用は、分離が非常に困難な場合の分析法開発の選択肢として取っておくことができます。
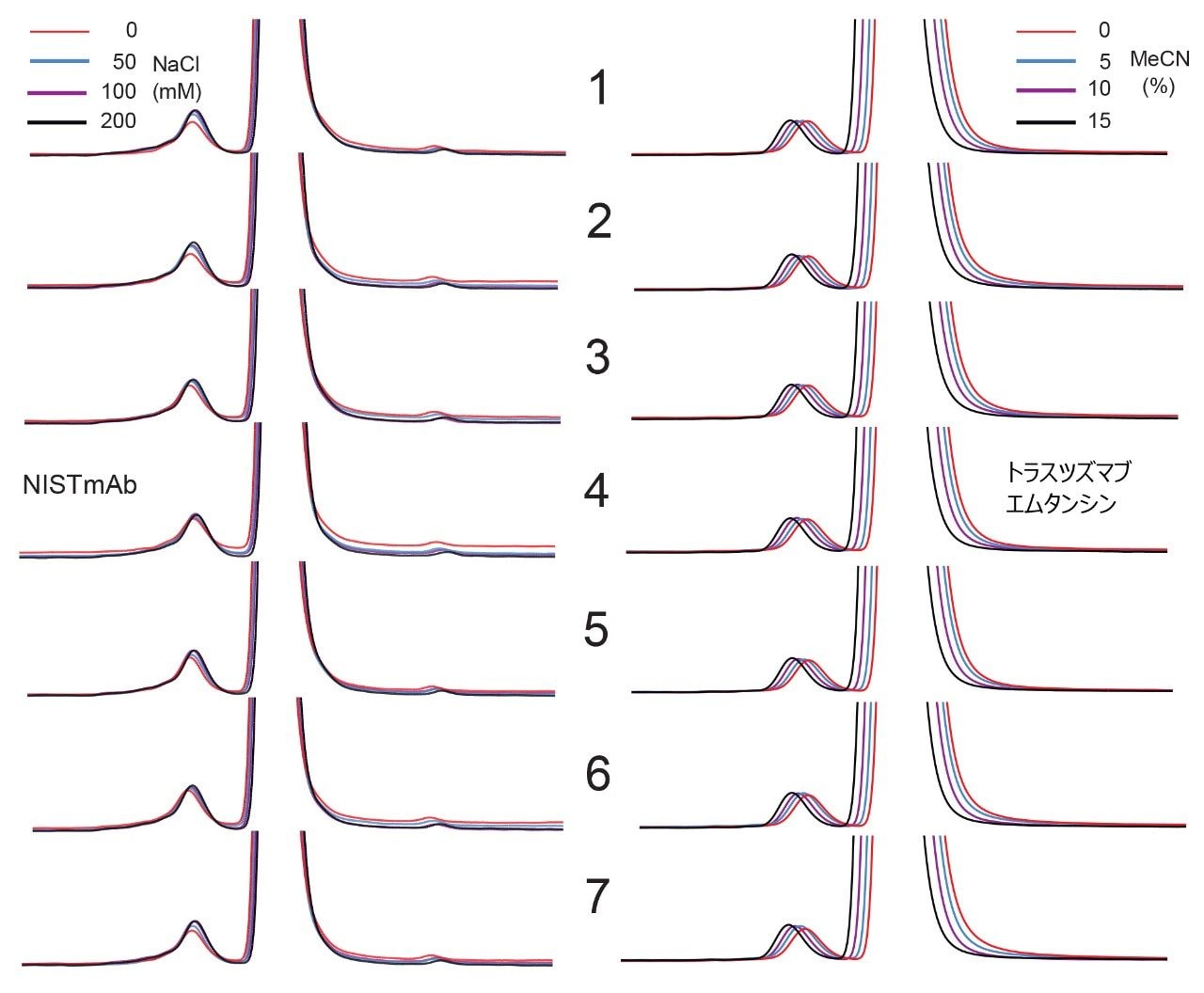
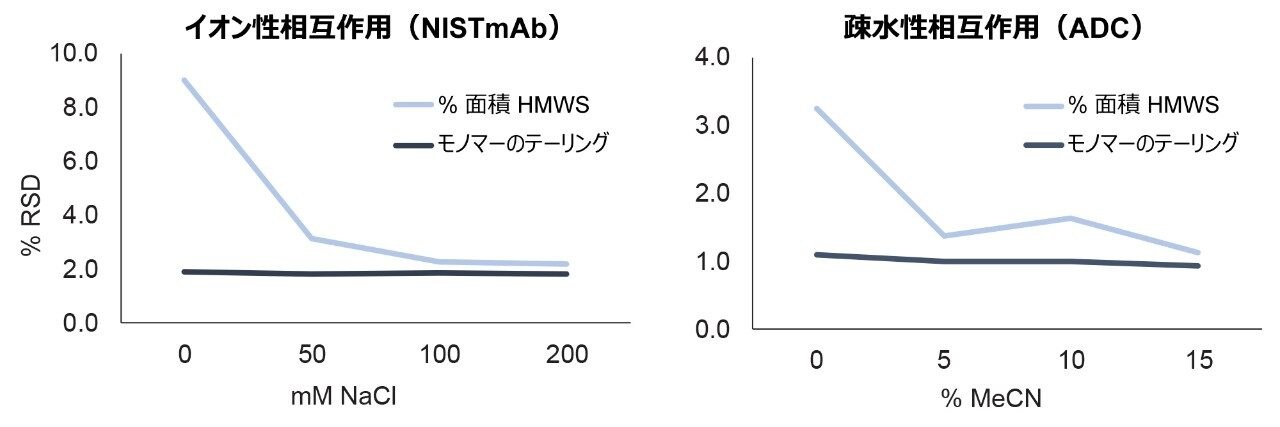
二次的相互作用の低減および分析法の汎用性というこれらのメリットは、分析法のライフサイクル全体を通じて信頼性および再現性の高いカラム性能が得られる場合にのみ、その真価を発揮します。そこで、XBridge および ACQUITY Premier Protein SEC 250 Å カラムのロット間再現性を試験しました。7 つの異なるロットの XBridge Protein SEC 250 Å、2.5 µm 充塡剤を用いて 7 本のカラムを用意し、親水性 MaxPeak HPS ハードウェアの異なる複数ロットと混ぜて組み合わせました。これらのカラムについて二次的相互作用の試験を行い、得られたクロマトグラムを図 9 に示します。カラムのロット間で卓越した再現性が見られました。イオン性相互作用の試験において、50 mM NaCl と 200 mM NaCl で得られた結果の差として NISTmAb 凝集体の面積比の変化を測定したところ、7 つのカラムロット全体で差は 20% 未満でした。0 mM ~ 200 mM NaCl で測定した NISTmAb モノマーのテーリングの変化は、全ロットを通じて 5% 未満でした。疎水性相互作用試験の結果も同様に納得のいくもので、アセトニトリルの濃度範囲 0% ~ 15% にわたる ADC(トラスツズマブエムタンシン)凝集体の面積割合の変化は 10% 未満、ADC モノマーのテーリングの変化は 5% 未満でした。図 10 に示すように、試験内の各単一間隔でも、ロット間に非常に強い再現性が認められました。
結論
SEC は、mAb、ADC、およびその他の同様のサイズのバイオ医薬品の特性解析および製品のモニタリングにおいて、強力なツールになり得ます。理想的には、これらの分離はエントロピーに駆動され、タンパク質の凝集体、モノマー、フラグメントが流体力学半径にのみ基づいて分離されます。しかし、カラムが十分に不活性でないために生じる二次的相互作用がしばしば存在し、重大な課題となっていました。タンパク質とカラムハードウェアおよび粒子の静電的活性部位または疎水性活性部位の間の望ましくない吸着相互作用が、回収率の低下、ピーク形状の歪みの原因になり、医薬品の重要品質特性の定量が不正確になります。このような問題に対処するには、多くの場合、分析法開発に多大な時間と労力を要します。多くの場合、望ましくない高濃度の塩または有機溶媒を使用するなどの妥協を強いられていました。
今回、SEC での望ましくない二次的相互作用の問題に対する総合的な解決をもたらす、新しいカラムテクノロジーの性能を実証しました。カバー率の高いヒドロキシ末端を持つ PEO 表面粒子と MaxPeak High Performance Surfaces(HPS)カラムハードウェアを組み合わせることで、移動相に低濃度の塩または有機溶媒を用いて、凝集体、モノマー、フラグメントについて優れた回収率、ピーク形状、分離能が得られました。このような性能により、ACQUITY および XBridge Premier Protein SEC 250 Å カラムは、極めて汎用性が高く、現在および将来の SEC アッセイの頑健性が改善する性能特性をもたらします。
参考文献
- Van der Kant R, Karow-Zwick AR, Van Durme J, et al. Prediction and Reduction of the Aggregation of Monoclonal Antibodies. J Mol Biol. 2017;429(8):1244-1261.doi:10.1016/j.jmb.2017.03.014.
- Glover ZK, Basa L, Moore B, Laurence JS, Sreedhara A. Metal Ion Interactions with mAbs: Part 1.MAbs.2015;7(5):901-11.doi: 10.1080/19420862.2015.1062193. PMID: 26121230; PMCID: PMC4622628.
- Roberts, Christopher J. Therapeutic Protein Aggregation: Mechanisms, Design, and Control.バイオテクノロジー第 1 巻 32,7 (2014): 372-80.doi:10.1016/j.tibtech.2014.05.005.
- Separation pf Monoclonal Antibodies by Analytical Size Exclusion Chromatography – Atis.
- Goyon A, Beck A, Colas O, Sandra K, Guillarme D, Fekete S. Evaluation of Size Exclusion Chromatography Columns Packed With Sub-3μM Particles for the Analysis of Biopharmaceutical Proteins.J Chromatogr A.2017 May 19; 1498:80-89.doi: 10.1016/j.chroma.2016.11.056. Epub 2016 Nov 27.PMID: 27914608.
- Goyon A, Excoffier M, Janin-Bussat MC, Bobaly B, Fekete S, Guillarme D, Beck A. Determination of Isoelectric Points and Relative Charge Variants of 23 Therapeutic Monoclonal Antibodies. J Chromatogr B Analyt Technol Biomed Life Sci. 2017 Oct 15;1065-1066:119-128.doi: 10.1016/j.jchromb.2017.09.033. Epub 2017 Sep 22.PMID: 28961486.
- S. Fekete, A. Beck, J. Veuthey, D. Guillarme.Theory and Practice of Size Exclusion Chromatography for the Analysis of Protein Aggregates.Journal of Pharmaceutical and Biomedical Analysis Anal (2014) 101:161–73.doi: 10.1016/j.jpba.2014.04.011.
720007493JA、2022 年 1 月