Empower™ ソフトウェアを利用した、バイオ医薬品のペプチドマップ内のサンプル間相違検出の合理化および自動化
要約
ハイスループットのバイオ医薬品ワークフローでは、分析時間を最小限に抑えると同時に、ユーザーに適切な情報を提供するために、効率的なデータ分析が必要です。Waters Empower クロマトグラフィーデータシステム(CDS)は、データの取り込みからレポート生成まで、ワークフローのすべてのステップをサポートします。また、プロセス開発から品質管理までの分析ニーズに対応する、強力でカスタマイズ可能な機能も備えています。この試験では、バイオ医薬品ワークフロー全体にわたって Empower ソフトウェアを使用する方法について実証します。インフリキシマブを例として、ペプチドマッピングデータとカスタムフィールドのバイナリー比較を行うことで、プロセス管理パラメーターの迅速な評価が容易に行えました。ピークレシオおよびレファレンスサンプルの分析との比較におけるそれらの有無に基づいて対象となる特性を選択しました。製品品質特性(PQA)を特定した後、Empower ソフトウェアの統合型不純物モニタリングワークフローに移すことで、ターゲットを絞ったハイスループット液体クロマトグラフィー(LC)分析法を使用する迅速なモニタリングとレポート作成が可能になりました。この比較法により、シームレスで規制準拠した方法で導入でき、医薬品開発と製造活動をサポートするワークフローが得られます。
アプリケーションのメリット
- QDa™ 質量検出器を備えた ACQUITY™ Premier LC システムにより、ペプチドマッピングアッセイワークフローの感度と再現性の高い結果が実現
- Empower ソフトウェアによりデータ分析の効率が向上し、対象となる特性の迅速な特定とモニタリングが実現
- 比較ワークフローはダウンストリームの作業に迅速に適応させられるため、テクノロジーの移管が効率的で円滑に
はじめに
バイオ医薬品ワークフローでは、結果を適時に得るために、容易に導入および評価できる分析法が不可欠です。このプロセスで見落とされがちなボトルネックはデータ分析です。これまでのデータ分析は煩雑で、多くの場合、意味のある結果を伝えるためには複数のソフトウェアプラットホームが必要でした。特に、タンパク質ベースのバイオ医薬品の特性解析、開発、および製造において一般的に使用されているペプチドマッピングアッセイに当てはまります。これらのアッセイでは多くの場合、データ分析を完了するためにユーザーの操作が必要になり、そのためにレビュープロセスに時間がかかり、結果の一貫性が低下し、報告される結果にエラーが含まれるリスクが増大する可能性があります。そのため、組織全体に広く導入でき、自動で実行できるソフトウェアプラットホームが強く望まれます。
Waters Empower CDS は、規制対象および規制対象外の製薬環境ですぐに利用できる、規制準拠した強力なソフトウェアプラットホームです。データ取り込みからレポート生成まで、この単一プラットホーム内でプロセスを合理化することで、開発から製造までのワークフローを、高い効率で容易に適応、移管、実行でき、品質特性の迅速な評価とモニタリングが可能になります。
ここでは、Empower インフォマティクスにより、データ分析を簡素化し、ペプチドマッピングアッセイにおけるサンプル間相違を調べる作業を自動化する方法を実証します。インフリキシマブを例として用い、対象となる特性を特定するとともに、QC または製造環境に移行して Empower ソフトウェアで特定の特性をモニターする方法を示しました。以下の結果からは、バイオ医薬品ワークフローにおいて、Empower ソフトウェアを容易に活用して、分析時間を短縮するとともに結果の精度を高め、より効率的な分析を可能にする方法が実証されます。
実験方法
Remicade®(インフリキシマブ)のサンプルを 37 ℃ で 0 週間(苛酷処理なし)、1 週間、または 2 週間インキュベートしました。次にサンプルを還元、アルキル化、脱塩、トリプシン消化して、0.1% ギ酸で酸性にしました。最終濃度は、ペプチドアッセイに基づいて 0.16 μg/μL と測定されました。
LC 条件
|
LC システム: |
ACQUITY Premier UPLC™ BSM、カラムマネージャー搭載 FTN サンプルマネージャー |
|
検出: |
ACQUITY Premier TUV、10 mm 分析フローセル、波長 = 214 nm |
|
バイアル: |
MaxPeak™ HPS を採用した QuanRecovery™ バイアル(製品番号:186009186) |
|
カラム: |
ACQUITY™ Premier CSH™ C18 1.7 μm、2.1 × 100 mm |
|
カラム温度: |
60 ℃ |
|
サンプル温度: |
8 ℃ |
|
注入量: |
10 μL |
|
流速: |
0.200 mL/分 |
|
移動相 A: |
0.1% ギ酸水溶液(LCMS グレード) |
|
移動相 B: |
0.1% ギ酸アセトニトリル溶液(LCMS グレード) |
苛酷試験のグラジエントテーブル
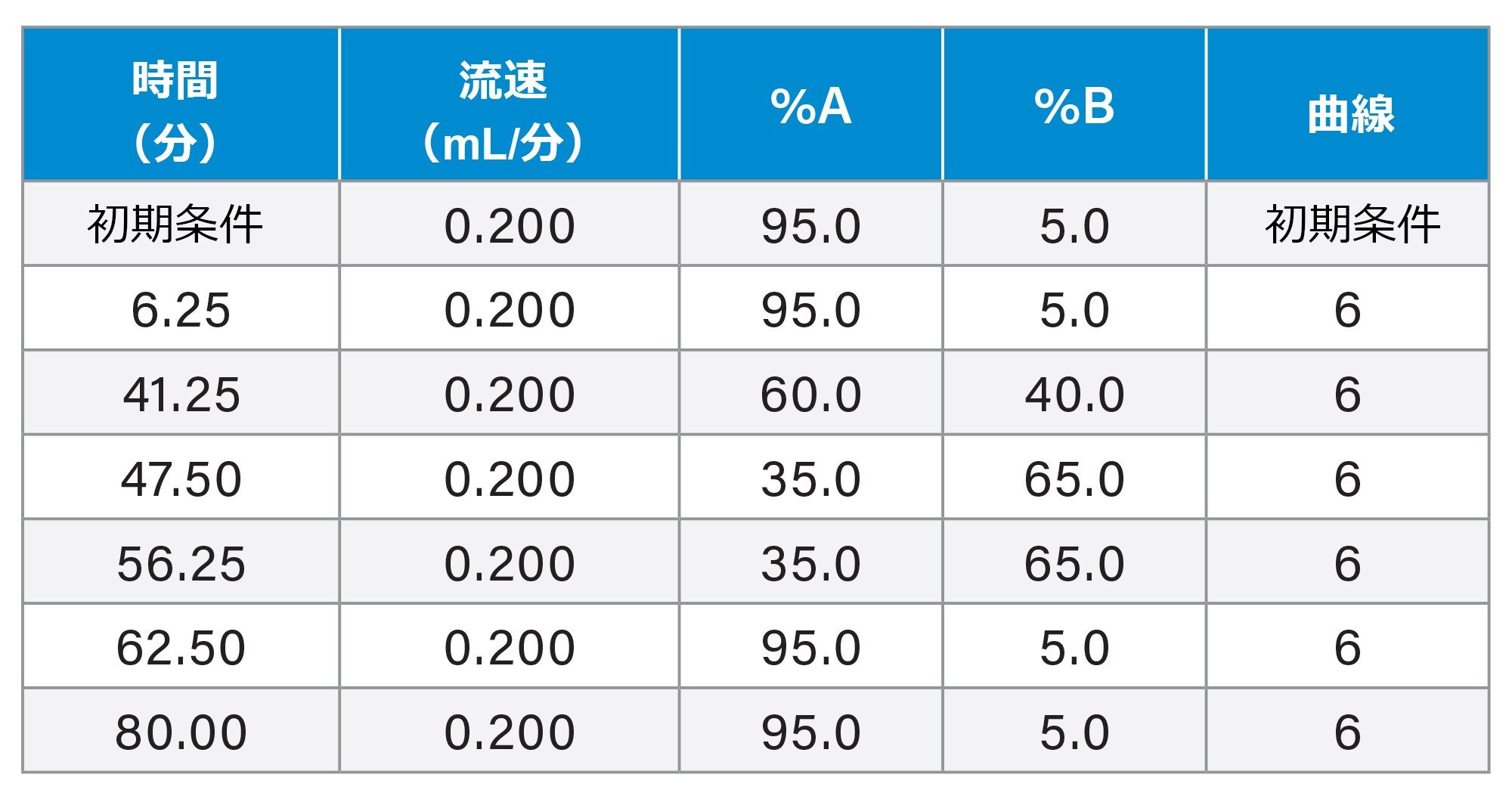
ターゲット LC 分析法のグラジエントテーブル

SIR 値
|
ペプチド |
m/z |
|
HC:T22 |
418.2 |
|
HC:T22 [酸化] |
426.2 |
|
HC:T42 |
561.4 |
|
HC:T42 [酸化] |
564.6 |
|
HC:T38 |
849.2 |
|
HC:T38 [脱アミド化] |
849.6 |
|
HC:T07 |
469.6 |
|
HC:T07 [脱アミド化] |
469.9 |
MS 条件
|
MS システム: |
ACQUITY QDa |
|
イオン化モード: |
ポジティブスキャン |
|
取り込み範囲: |
m/z 350 ~ 1,250 |
|
キャピラリー電圧: |
1.5 kV |
|
コーン電圧: |
15 V |
データ管理
|
ソフトウェア: |
Empower 3 FR4 |
結果および考察
強制分解は製薬業界で一般的に使用されており、工程管理、不純物プロファイリング、安定性試験、および品質リリースアッセイに使用されるアッセイの開発を支援しています1。 通常、ストレス要因(熱、化学的、機械的)により検出および特性解析が容易になるために、製品が実際に遭遇すると予想されるよりも極端な条件を用いることで、分解プロセスが加速され、不純物レベルが上昇します。バイオ医薬品の場合、これらの試験はトップダウン(インタクト/サブユニット)とボトムアップ(ペプチド)の両方で実施し、有効性と安全性に影響を与える可能性のある製品品質特性(PQA)に関する補完的な情報が得られます。開発から製造に至るまで医薬品がパイプラインを移行するにつれて、製品の安全性と有効性に不可欠な PQA である重要品質特性(CQA)がダウンストリームの品質管理(QC)ワークフローで特定され、積極的にモニターされます。これらのアッセイがバイオ医薬品の開発および製造において重要な役割を果たすことを考慮し、苛酷試験を実施して、これらの種類のワークフローにおけるデータ分析を支援および自動化する Empower ソフトウェアツールの能力を実証しました。
バイオ医薬品ラボの生産性を最大限に高めるには、ハイスループット分析に対応できる装置が必要です。分析法をダウンストリームに移行させる際に、対象となる特性すべてを正確に観察およびモニターするには、アッセイの感度も重要です。最後に、アッセイの再現性も不可欠です。アッセイのバリデーションを支援し、規格外試験結果(OOS)の発生を回避するために、一貫した結果が必要になるためです。以前の試験では、ACQUITY Premier システム(BSM 設定)により、プロセス開発(高分離能の長いグラジエント)と製造環境(ハイスループットの短いグラジエント)の両方が行える条件下で、ペプチドマッピングのアプリケーションにおいて再現性の高い結果が得られることが示されました2。同じ試験で、ACQUITY QDa 質量検出器がダイナミックレンジが数桁にわたる低存在量の分子種の検出に適していることも実証されました。このため、Premier UPLC BSM プラットホームで、紫外線(UV)検出器と質量分析(MS)検出器の両方を使用したところ、Empower ベースの分析法が UV ベースまたは MS ベースのワークフローに適応できることを実証するデータが得られました。
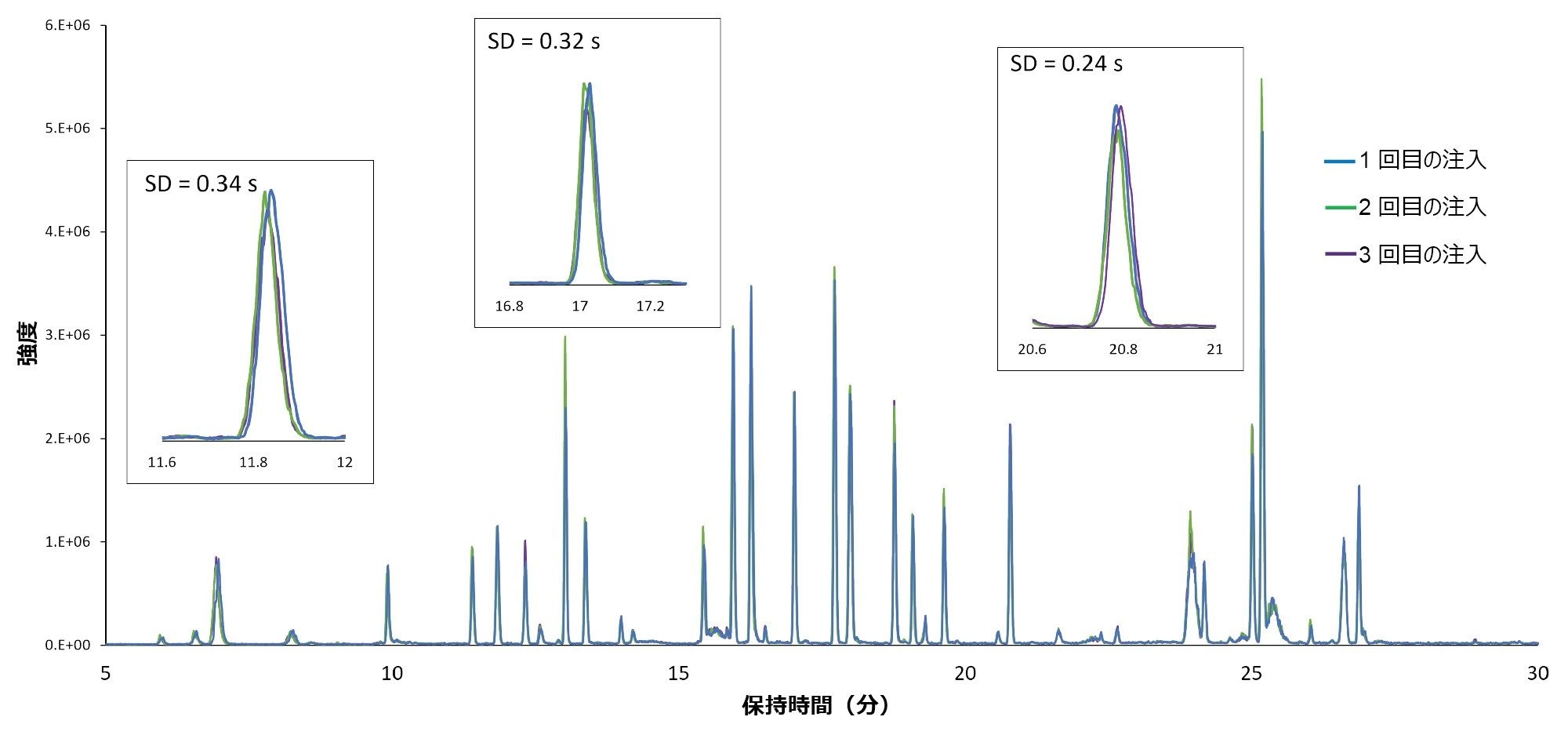
この LC-UV/MS プラットホームを使用して得られた性能を図 1(インフリキシマブ消化物の 3 回繰り返し注入によるクロマトグラムの重ね描き)に示します。このクロマトグラムでは、保持時間のアライメントなどの前処理ステップを使用しないピークアライメントを示します。以前に報告された結果と同様に、保持時間の標準偏差はほとんどのペプチドで 1 秒未満で、平均標準偏差は 0.45 秒(相対標準偏差 0.06%)でした。さらに、このハイフネーテッド(複数の手法を同時に使用した)構成の ACQUITY QDa 質量検出器による感度とダイナミックレンジの向上により、10 pg 以下の質量負荷で再現性のよいペプチド定量が可能になりました(図 2A)。このことは、ネイティブのペプチドよりも大幅に低い強度のことが多い低存在量の修飾体や不純物のモニタリングに特に有用です。修飾バージョンのペプチドは多くの場合、存在量がネイティブ型のわずか 1% ~ 5% であるため、UV 検出器での検出が困難です。この点に関し、対象となる特性が特定されると、図 2B に示すように、MS スキャンまたは選択イオンレコーディング(SIR)スキャンを使用して質量(m/z 値)での追跡を行い、高選択性(最小のノイズ干渉)で感度を高めることができます3。 提案されたシステム構成を使用して再現性のある性能が見られたことから、ACQUITY Premier システムは、比較試験やラボ間での分析法移管のためにアップストリーム(MS ベース)およびダウンストリーム(UV ベース)のラボに導入できる柔軟な UPLC プラットホームとして理想的です。

ペプチドマッピング試験により、バイオ医薬品の安全性と有効性に寄与する特性についての重要な情報が得られますが、検出された百以上の成分に関わる大量のデータをモノクローナル抗体トリプシン消化物マップで解析するには時間がかかり、手作業での操作が必要になるため、生産性が低下します。Empower ソフトウェアを用いると、カスタムフィールドを生成してデータ分析を簡素化および自動化することができます。強制分解試験では、対照サンプルと苛酷処理したサンプルの間でペプチド含量の変化を比較する必要があります。従来、このような分析では、すべての注入のデータをスプレッドシートなどの外部ソフトウェアにエクスポートする必要がありました。これは、コンプライアンス違反であり、ユーザーがデータを操作する必要がありました。
一方、Empower ソフトウェアでは、カスタムフィールドを設定して、苛酷処理したサンプルと対照サンプルの間のピーク面積の比を自動的に計算し、この値を報告するようにできます。図 3A に、この単純なカスタムフィールドの設定方法を示します。この情報を次に、レファレンスクロマトグラムと比較してペプチドが増加、減少しているか、あるいは新しい、または欠落しているかどうかを示す 2 番目の列挙型カスタムフィールドを使用して、単純な「メモ」に抽出することができます(図 3B)。この比較をさらに合理化するため、提案している分析法では、フィルターをかけて、一意のペプチドおよび/またはユーザーが定義した強度比のしきい値を超えたペプチドのみの情報を表示します。これにより、ほぼ類似するデータの表を手作業で調べる必要がなくなり、大規模なデータセットや複雑なデータセット中の結果を見落とすリスクが低減します。この比較ワークフローを用いた結果の例を図 4 に示します。
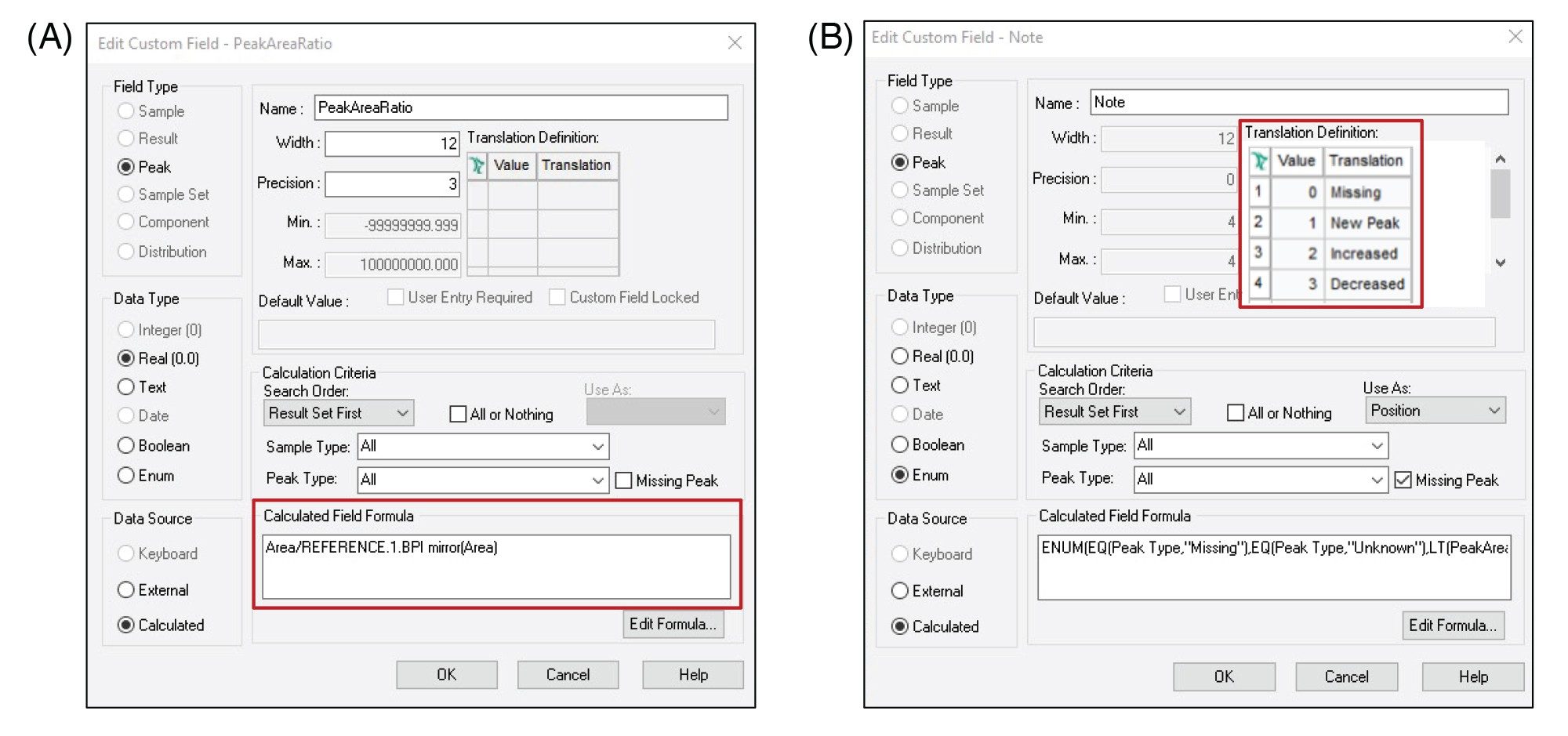
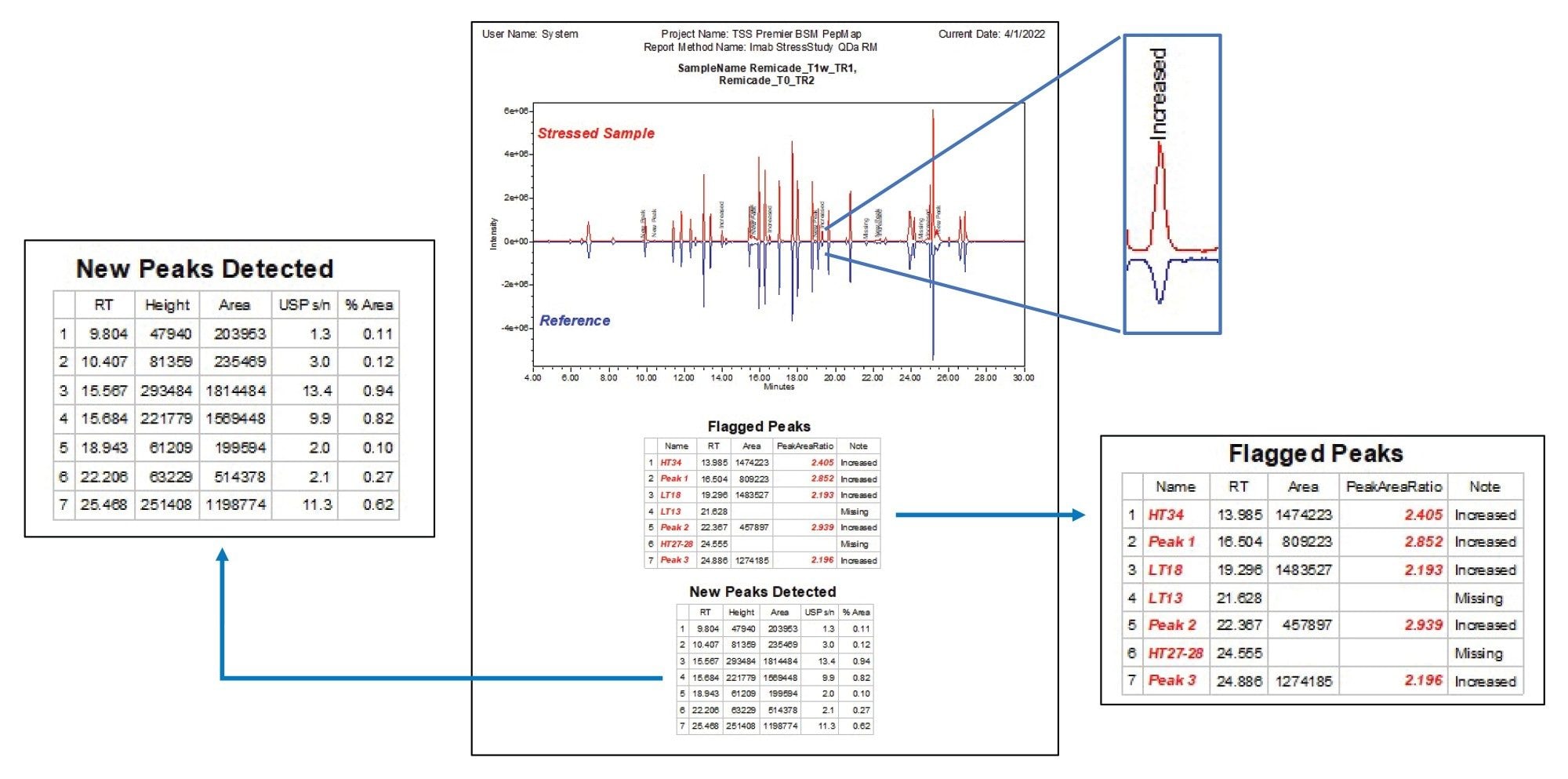
図 4 に示すように、苛酷処理したサンプルとレファレンスの相違を、バイナリー比較プロットを作成してクロマトグラム中に示しています。レファレンスサンプルを水平軸に沿って鏡像の形で示すことで、各ピークを並べて比較することができます。また、サンプルの差が容易に視認できるように、対象のピークに「メモ」カスタムフィールドをラベル付けしています。クロマトグラムの下の表形式データに、ユーザーが定義した条件に基づいてフラグが付けられたピークとその関連情報が一覧表示されています。苛酷処理したサンプルで検出された、レファレンスには存在しない新しいピークを記録する追加の表が生成され、これにより、潜在的な不純物や新しい分解生成物を確認することができます。この例では、図に示すように、モニターしている 41 のピークのうち 7 つが欠落しているか、あるいは変化のスレッシュホールドを超えている(レファレンスの 0.5 倍未満または 2 倍超の差)ことが確認され、レファレンスに存在しない新しいピークが 7 つ検出されました。視覚的なデータと表形式のデータを並べて表示することで、迅速に結果をレビューし、対象のデータポイントを判定することができます。全体として、この戦略は、分析ニーズに合わせたカスタマイズ可能なやり方でサンプル処理を迅速化し、よりターゲットを絞った分析を必要とするダウンストリームの活動に容易に適応させることができます。
この強制分解法を、多数のサンプルを迅速に分析し、重要特性や不純物を迅速に評価する必要がある、安定性試験やプロセス開発のタイプのワークフローに移管しました。この例では、図 5A に示すように、80 分間の強制分解法を 15.5 分間のフォーカスグラジエントに凝縮して、2 種類のペプチド、およびモニタリングが必要な CQA を代表する、関連する酸化型をモニターしました。LC 法では、これらのペプチドをベースライン分離することができ、より QC に適した UV 検出器を使用できるようになりました。保持時間の標準偏差は 0.16 秒、ピーク面積の相対標準偏差は 1% であり、この目的でのターゲット分析法の再現性が十分であることを示しています。強制分解試験で行ったと同様のやり方で、ペプチドをレファレンスと比較し、新しいピークが特定されるようにカスタムフィールドを設定しました。図 5B に示すように、[Impurity](不純物)タブを使用して不純物の結果を要約する Empower 機能を使用しました。これにより、規制のガイダンスに基づいて不純物のしきい値を設定できるため、追加のカスタムフィールドのプログラミングを必要とせず、データ分析とレポート作成を簡素化できました4,5。
タブ](/content/dam/waters/ja/app-notes/2022/720007610/720007610en-f5.jpg.82.resize/img.jpg)
この種類のワークフローのレポートを図 6 に示します。ここで、「未知」サンプルとレファレンスサンプルはいずれもインフリキシマブのサンプルで、修飾ペプチドを異なる濃度でスパイクしています。図からわかるように、この分析法は、MS 検出器と UV 検出器の両方に適しています。「Flagged Peptides」(フラグ付きペプチド)および「New Peaks Detected」(検出された新規ピーク)の表は、強制分解試験と同じフィールドに基づいており、レファレンスサンプルからの偏差を強調しています。不純物のサマリーセクションには、酸化 T22 および酸化 T42 の 2 つの異性体を含む各修飾ペプチドの、不純物のレスポンス(ここでは各不純物の割合調整済み面積と定義)並びにペプチドが ICH 報告スレッシュホールドを超えているかどうかを示すフラグ付けの詳細が示されています。この種の自動化されたレポートにより、サンプルを迅速に評価して、規格を満たしているか、また調査が必要かを判定することができます。また、すべての注入における不純物のレスポンスを一覧表示するサマリーレポートを生成することもでき、大量の注入を迅速かつ容易に評価することができます(データは示していません)。Empower ソフトウェアでデータ解析メソッドとレポート作成メソッドを、各アッセイに不可欠な正確な結果を自動的に表示できるように調整することで、ラボの効率と生産性を最大限に高めて規制遵守に関するリスクを最小限に抑えることができるとともに、安全で有効な薬剤を患者に迅速に届けるのに要する時間とリソースの両方を節約することができます。

結論
バイオ医薬品の開発において、効率的なワークフローを確保し、手作業でのデータ分析によるボトルネックやエラーを排除するためには、効率化され、自動化されたソフトウェアソリューションが不可欠です。この試験では、重要なアッセイの測定に対する分析ごとの特定のニーズに合わせてデータレポートをカスタマイズすることで、バイオ医薬品の開発と商品化を支援する Empower ソフトウェアの能力について紹介しています。バイナリーアプローチを使用したカスタムフィールドにより、サンプルをレファレンスと迅速に比較することができます。この比較アプローチは、開発段階に簡単に導入でき、迅速に適応させてダウンストリームの活動を支援することができます。光学検出および/またはルーチン質量検出を備えた ACQUITY Premier LC システムで得られる質の高い結果とともに、Empower ソフトウェアによる効率化されたソリューションは、バイオ医薬品の特性解析およびターゲットを絞った特性モニタリングワークフロー全体にわたる効率を大幅に向上させます。
参考文献
- Haw A, Wiggenhorn M, van de Weert M, Garbe JHO, Mahler H, Jiskoot W. Forced Degradation of Therapeutic Proteins.J Pharm Sci.2012 March, 101(3), 895–913.
- DeLaney K, Birdsall RE, Yu YQ.Improving Peptide Mapping Studies and Reducing Assay Failures Through Reproducible Performance Using the ACQUITY Premier UPLC System (BSM).Waters Application Note. 2022 Apr; 720007593.
- Birdsall RE, McCarthy SM.Increasing Specificity and Sensitivity in Routine Peptide Analyses Using Mass Detection with the ACQUITY QDa Detector.Waters Application Note.2015 Apr; 720005377.
- Koshel BM, Birdsall RE, Yu YQ.LC-UV-Based Synthetic Peptide Impurity Tracking and Reporting with Compliant-Ready Empower 3 Software.Waters Application Note.2017 Apr; 720005968.
- Koshel BM, Birdsall RE, Yu YQ.Using Empower 3 Software for Monitoring Synthetic Peptide Impurities with an ACQUITY QDa Detector for Improved Confidence in Analysis.Waters Application Note.2017 Apr; 720005967.
720007610JA、2022 年 4 月