臨床研究用 Immundiagnostik Hepcidin-25 LC-MS/MS キット(Ruo)を使用した、血漿中のヘプシジンの定量
研究目的のみに使用してください。診断用には使用できません。
要約
血漿中の低分子ペプチドヘプシジンの LC-MS/MS ベースの定量は、ヘプシジンの複数の分子内ジスルフィド結合、非特異的吸着、複数のチャージ状態により、困難な課題です。
このアプリケーションノートでは、臨床研究用にクエン酸血漿中の低レベルのヘプシジンを測定する分析法を説明します。Immundiagnostik の Hepcidin-25 LC-MS/MS キット(RUO)で提供されている試薬を、96 ウェル形式の Waters™ OASIS™ HLB サンプル前処理用テクノロジーと組み合わせて使用して、簡単なサンプル前処理を行います。LC-MS/MS 分析は、ESI ポジティブモードで動作する Xevo™ TQ-S マイクロタンデム四重極質量分析計に接続した、フロースルーニードル(FTN)付き ACQUITY™ UPLC™ I-Class システムで実行されます。
この分析法では、血漿中のヘプシジンを、良好な直線性(R2 > 0.99)および高精度(CV < 10%)で定量できます。チャージ状態 4+ および 5+ の分析では、それぞれ正確さ 95% および 98% が測定されました。最低のキャリブレーターのシグナル対ノイズ比からの外挿に基づいて、検出限界は 2 ng/mL 未満と判断されました。
アプリケーションのメリット
- Immundiagnostik Hepcidin-25 キット(RUO)により、サンプルの前処理と LC-MS/MS のセットアップが簡素化
- Waters OASIS HLB µElution プレートおよび QuanRecovery™ コレクションプレートにより、吸着による損失が最小限に抑えられ、ヘプシジンの低レベル定量が容易になる
- Waters ACQUITY I-Class UPLC(FTN)および TQ-S micro 質量分析計により、血漿中のヘプシジンを優れた精度と正確さで定量できる
はじめに
ヘプシジンは、システインが豊富な小さなシグナルペプチドであり、25 種のアミノ酸で構成され、4 つの内部ジスルフィド結合が含まれています。最初にヒトの尿から分離され、その合成部位である肝臓(hep-)、インビトロ抗菌性(-cidin)にちなんで名付けられました1。 ヘプシジンは哺乳動物の鉄代謝に関与しています2-4。
血漿中のヘプシジンの臨床研究用の測定では、ジスルフィド結合を低減できます。インタクトペプチドは、その多くの帯電可能部位により、帯電した表面で、特に低レベルで非特異的に吸着されやすい状態です。このアプリケーションノートでは、頑健な結果を得るための低吸着表面の消耗品の有用性について実証しています。固相抽出により、可能性のあるマトリックス干渉がサンプルから取り除かれ、頑健なクロマトグラフィー手順の基礎が提供されます。質量分析パラメーターの最適化(特に、モニターするプリカーサーイオンのチャージ状態とフラグメントの選択)により、クエン酸血漿中のヘプシジンを低 ng/mL 範囲で低レベルで定量できます。
実験方法
Immundiagnostik Hepcidin-25 LC-MS/MS キット(Immundiagnostik 製品番号:KM4000 RUO)を使用して、使用説明書(IFU)に従ってサンプル前処理および LC 分離のセットアップを行いました。これには、次記の必要な試薬と溶液が含まれています:移動相 A および B、内部標準試料、活性化溶液、サンプルバッファー、洗浄溶液 1 および 2、溶離バッファー、および希釈剤と再溶解希釈剤。
Immundiagnostik 25-Hepcidin LC-MS/MS キットのマニュアルに従って、分析前に、移動相、サンプルバッファー、洗浄溶液 2、希釈剤と溶離溶液を活性化しました。タンパク質-表面の相互作用を防ぐため、サンプルの取り扱いには Sørensen 社の低吸着チップ(Sigma-Aldrich、製品番号:Z719579-1000EA)と 15 mL タンパク質低吸着チューブ(Eppendorf、 製品番号:0030122216)を使用しました。
サンプルの説明
6 レベルのキャリブレーター (CAL 1 ~ 6) および 3 レベルの品質管理サンプル (QC 1 ~ 3) は Immundiagnostik によって提供され、Hepcidin-25 LC-MS/MS キット内に含まれています。クエン酸血漿の 19 サンプルも Immundiagnostik によって提供されました。
サンプル前処理は、OASIS HLB µElution 96 ウェルプレートで、加圧マニホールドと QuanRecovery コレクションプレートを使用して、簡単な固相抽出(SPE)プロトコル(下記を参照)に従って行いました。分析種のクロマトグラフィー分離に 5.5 分かかります。ペプチドは、MRM(マルチプルリアクションモニタリング)モードで、4 倍または 5 倍のチャージ状態と、対応する特徴的なフラグメントイオンを介して定量しました。
固相抽出:クエン酸血漿サンプルを、固相抽出(SPE)の前に 13,400 rpm で 5 分間遠心分離しました。µElution プレートを 200 µL のメタノールで洗浄し、200 µL の水(Milli-Q 超純水)で平衡化しました。200 µL のサンプル、CAL または CTRL を、200 µL の内部標準試料とともに各ウェルに加えました。µElution プレートを洗浄液 1、洗浄液 2、再度洗浄液 1 の順に、それぞれ 200 µL で洗浄しました。QuanRecovery コレクションプレートを取り付けた後、サンプルを 2 × 25 µL の溶出溶液で溶出しました。固相抽出(SPE)溶出液を希釈溶液で 1:2 に希釈しました。UPLC 注入量は 20 µL でした。
LC 条件
|
LC システム: |
ACQUITY UPLC I-Class(FTN)、カラムヒーター(CH)付き |
|
ニードル: |
50 µL の拡張ループ付き 10 µL 標準注入ニードル |
|
カラム: |
XSelect™ CSH C18、3.5 µm、2.1 × 100 mm |
|
プレカラム: |
XSelect CSH C18 VanGuard™ カートリッジ、130 Å、3.5 µm、2.1 × 5 mm |
|
カラム温度: |
50 ℃ |
|
注入量: |
20 µL |
|
流速: |
0.4 mL/分 |
|
移動相 |
Immundiagnostik |
|
グラジエント: |
15 ~ 98% B |
MS 条件
|
MS システム: |
Xevo TQ-S micro |
|
MS モード(分解能): |
MS1 および MS2(0.75 FWHM) |
|
取り込みモード: |
マルチプルリアクションモニタリング(MRM) |
|
イオン化モード: |
ESI+ |
|
イオン源温度: |
150 ℃ |
|
脱溶媒温度: |
650 ℃ |
|
脱溶媒ガス流量: |
1200 L/時間 |
|
コーンガス流量: |
0 L/時間 |
|
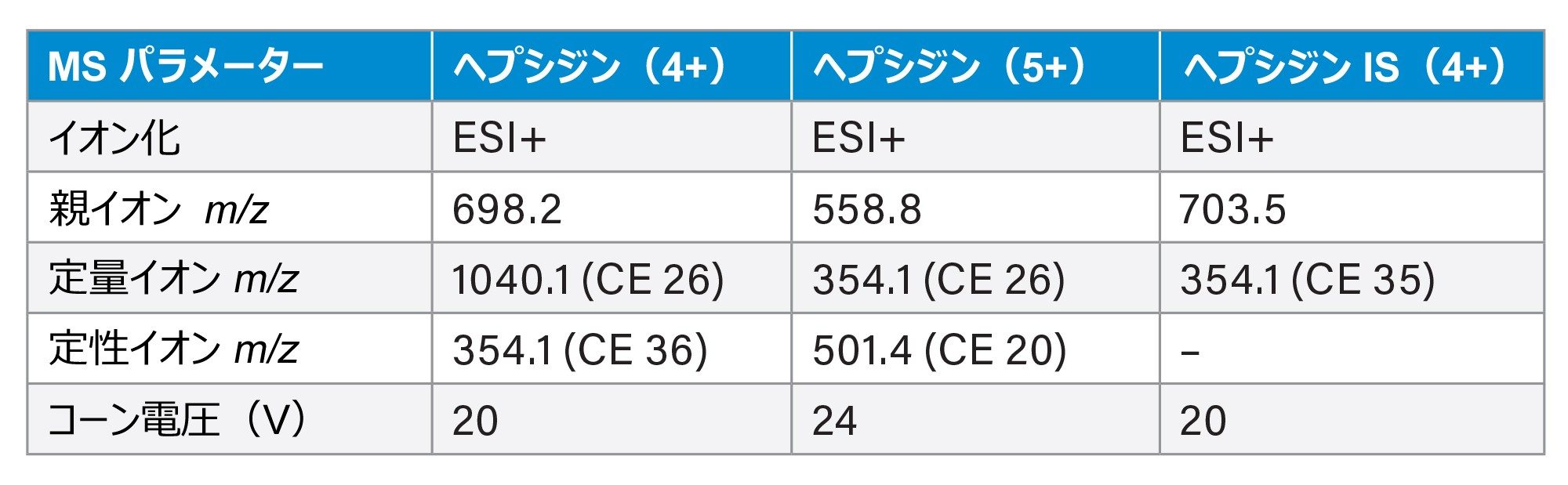
コーン電圧: |
表 1 参照 |
|
コリジョンエネルギー: |
表 1 参照 |
データ管理
|
MS ソフトウェア: |
TargetLynx™ XS を搭載した MassLynx™ 4.2 |
結果および考察
IntelliStart™ による MS プリカーサーの最適化
キットのマニュアルでは、4 倍に帯電したヘプシジン親イオン [M+4H]4+ に由来する 698 > 354(定量)および 698 > 1040(定性)のトランジションに基づいてヘプシジン分析を行うことが、提案されました。ただし、MassLynx の自動 IntelliStart™ サンプルチューニング機能により、[M+5H]5+ 親イオンの強度がより高いことが見つかりました。IntelliStart™ により、質量位置、コーン電圧、コリジョンエネルギーが再調整されます。
この実験では、親イオンのシグナルとそれらに対応する MRM トランジションの両方が記録され、比較されました。4+ 分子種では、698 > 1040 および 698 > 354 のトランジションによりほぼ同等のシグナル強度が得られましたが、前者ではノイズ値がわずかに低かったです。存在量が少ない状況ではノイズレベルの低下はきわめて重要な可能性があるため、Immundiagnostik によって提案されている試験プロトコルから逸脱して、698 > 1040 のトランジションを定量イオンとして、698 > 354 トレースを定性イオンとして割り当てました。
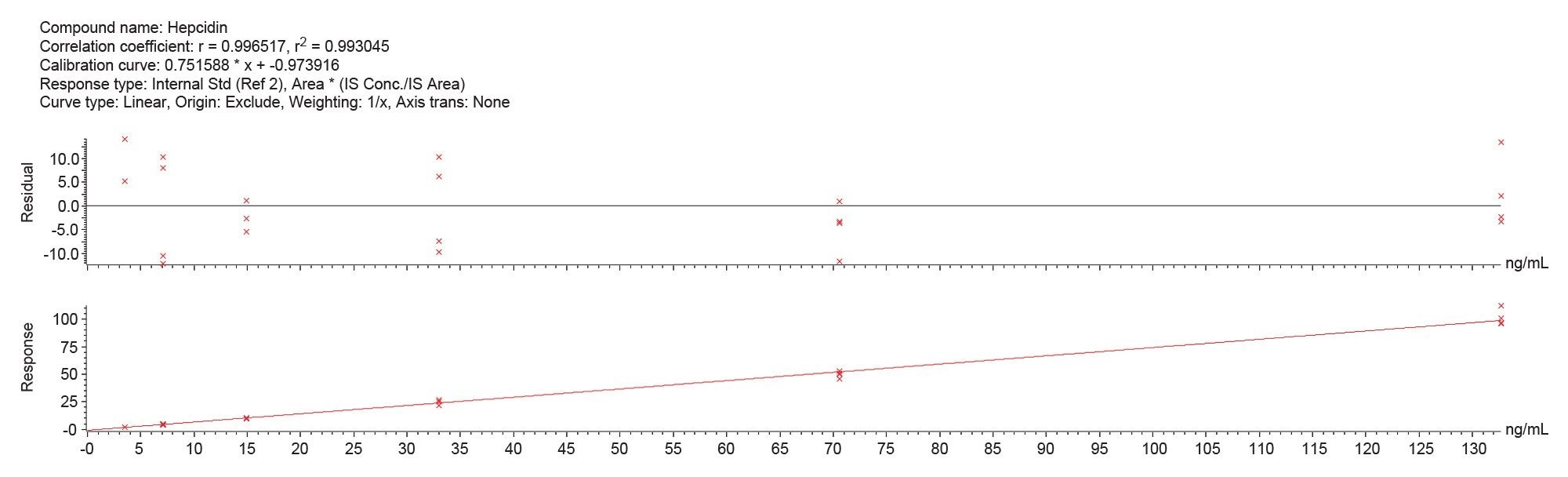
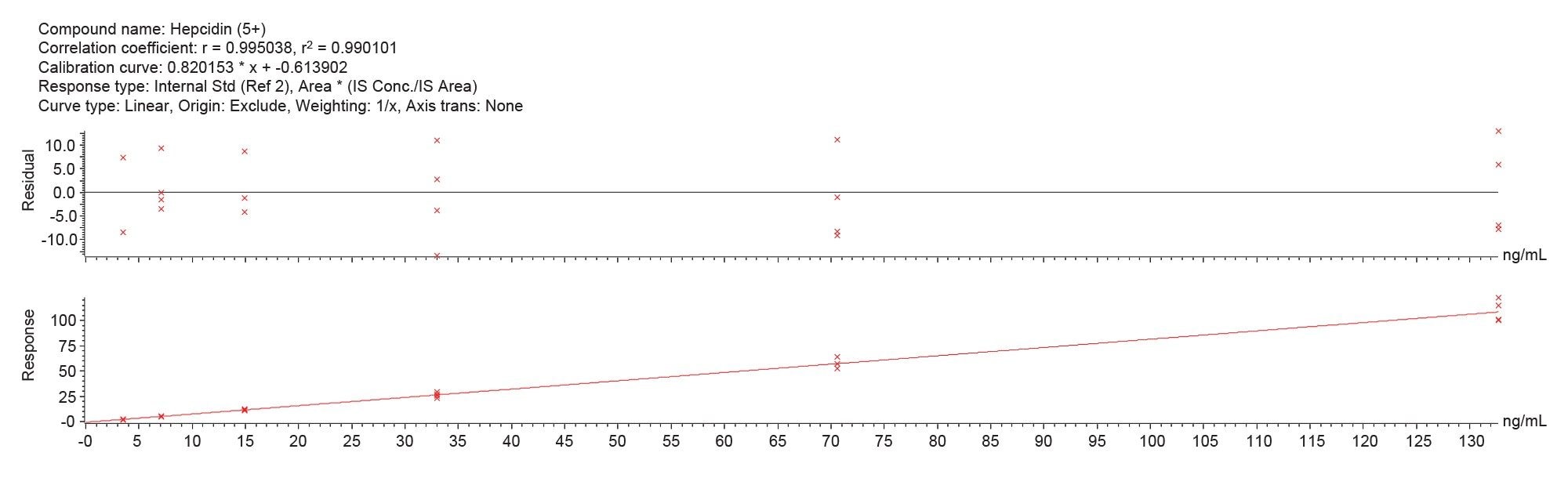
直線性
キャリブレーション範囲は 3.5 ~ 132.7 ng/mL でした。各キャリブレーションレベルについて 2 回の独立したサンプル前処理を 2 回繰り返して測定(合計 4 回の繰り返し)することにより、メソッドの直線性を決定しました。相関係数(R²)は、[M+4H]4+ 分子種で 0.993 を超え(図 1)、[M+5H]5+ 分子種で 0.990 を超えました(図 2)。個々の測定ポイントのばらつきは 15% 未満であり、許容基準内でした。
精度
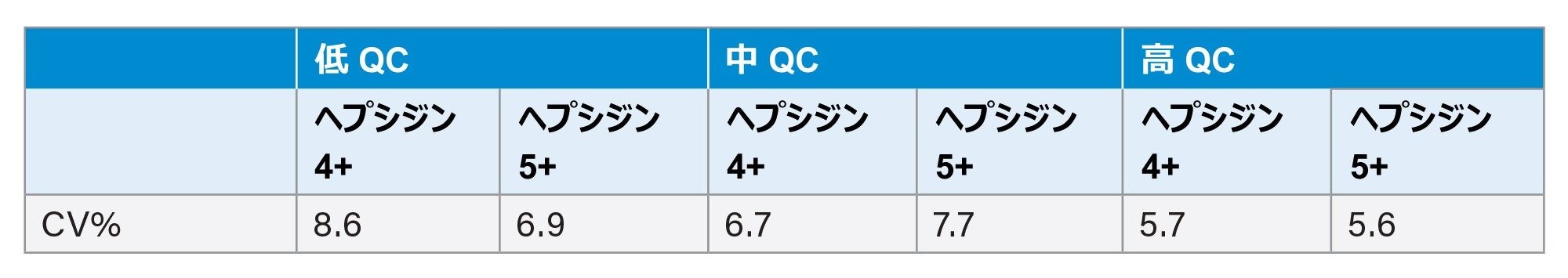
アッセイ内精度は、QC レベルあたり 8 回の測定(低、中、高)に基づいて決定しました。3 つの QC レベルすべてで、2 つの異なる QC サンプル(異なるサンプル容器、同じ材料バッチ)をそれぞれ 2 回繰り返し前処理しました。各サンプルを 2 回注入し、1 レベルあたり 8 回注入しました。結果が表 2 に変動係数(CV)として示されています。
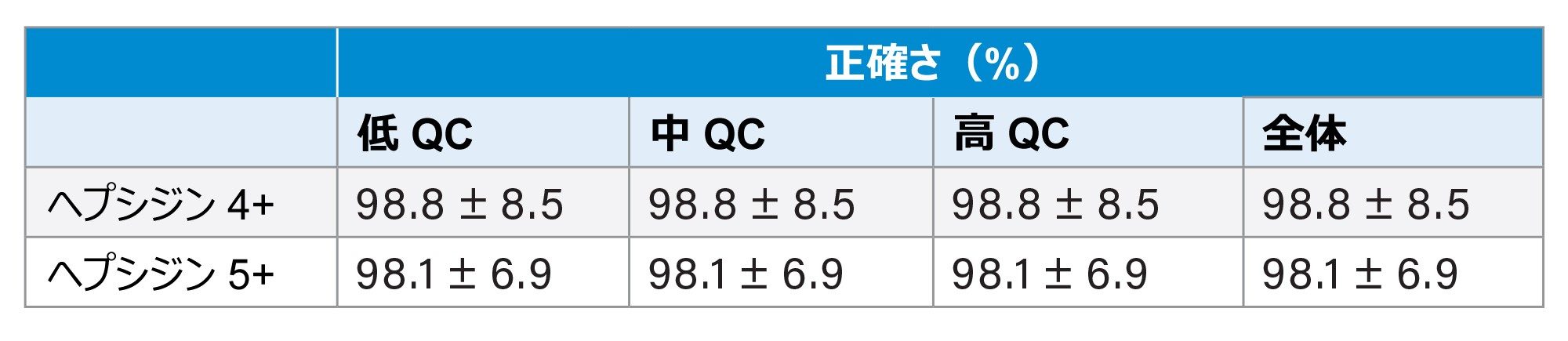
正確さ
正確さは、すべての QC サンプルからヘプシジンレベルを抽出および定量することによって、決定しました。計算されたサンプル濃度を、Immundiagnostik によってキットの IFU で提供されている設定値と比較しました。すべての QC サンプルで、予想値からの偏差は 15% 未満であり、許容基準内です(表 3)。
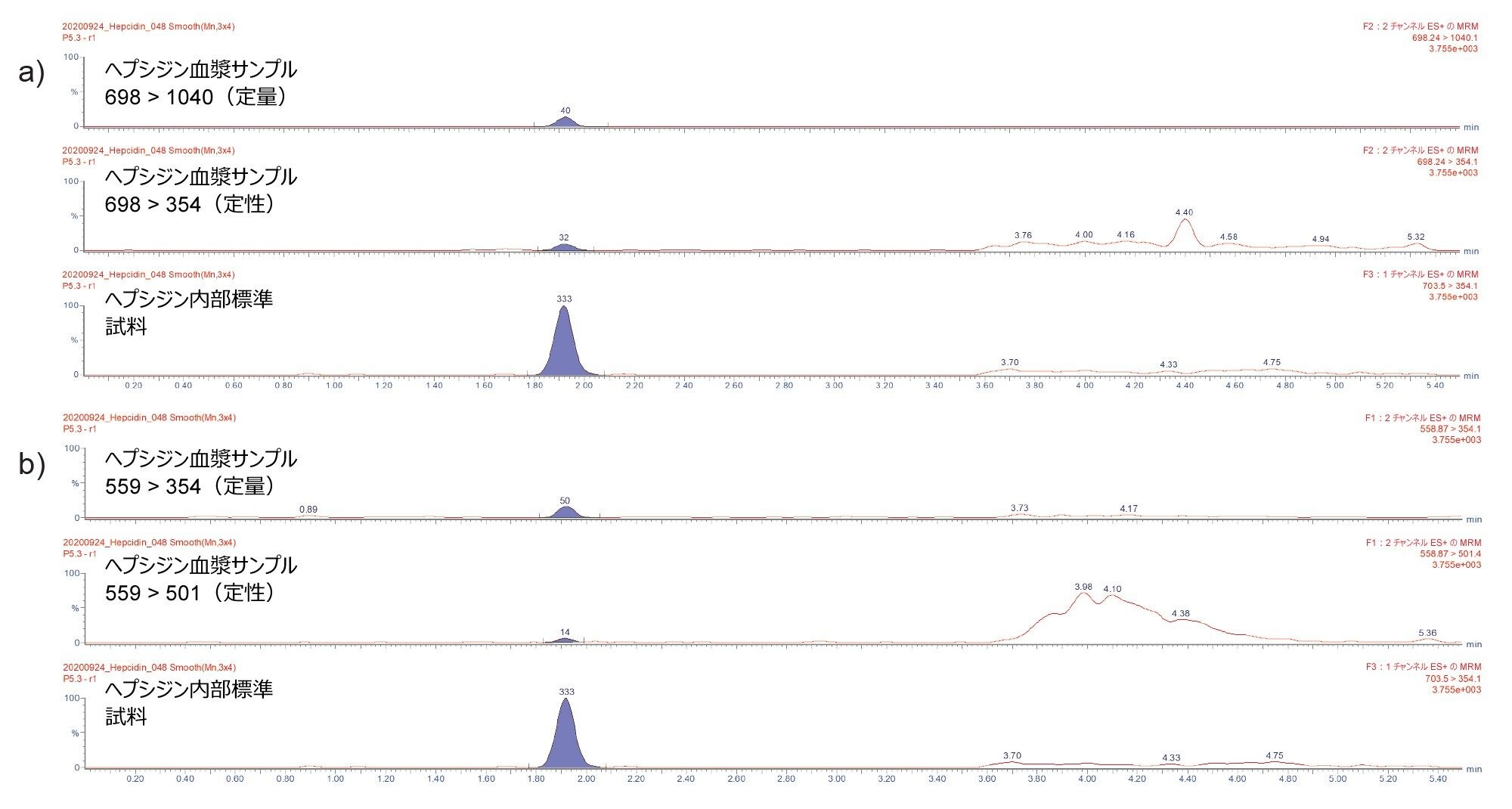
分析の感度および選択性
推定濃度 2.9 ng/mL ヘプシジンを含む血漿サンプルのクロマトグラムが、図 3a および 3b に示されています。定量トランジション 698 > 1040(ヘプシジン 4+、3a)および 559 > 354(ヘプシジン 5+、3b)により、血漿中のヘプシジンが低い内因性レベルでも、再現性のあるピーク波形解析と定量が可能です。両方のメソッドで、定性トレースは低レベルでも検出可能であり、イオン比(定性:定量)の一貫性は許容基準に適合しています。
定量限界(LOQ)は、最低キャリブレーションポイント(CAL 1)のシグナル対ノイズ(S/N)比を計算し、S/N 値 10:1 に外挿することによって決定しました。ヘプシジン 4+ およびヘプシジン 5+ の LOQ は、それぞれ 1.4 ng/mL および 1.8 ng/mL で推定されます。この実験の時点では利用可能ではありませんでしたが、Immundiagnostik によって現在では、ヘプシジンキットを使用して、より低い CAL 1 レベル(LOQ 1.9 ng/mL)が提供されています。
定量トランジションの比較(ヘプシジン 4+ vs ヘプシジン 5+)
血漿中のヘプシジンの定量に使用される両方のトランジションで、精度、正確さ、LOQ、直線性に関して同様の結果が示されています。両方のチャージ状態が存在し、これらは許容誤差内の同じ結果を示し、両方を妥協することなく使用できます。
クエン酸血漿サンプルの分析/メソッド比較
Immundiagnostik AG から、定量用に 19 の血漿サンプル(各 700 µL)が提供されました。各サンプルを、試験手順に従って 3 回前処理しました。個々のサンプル前処理は、それぞれ 1 回注入されました。ヘプシジン 4+ およびヘプシジン 5+ の定量結果を、キット IFU に記載されている元のメソッドを使用して Immundiagnostik AG で得られた結果と、比較しました(図 4 を参照)。
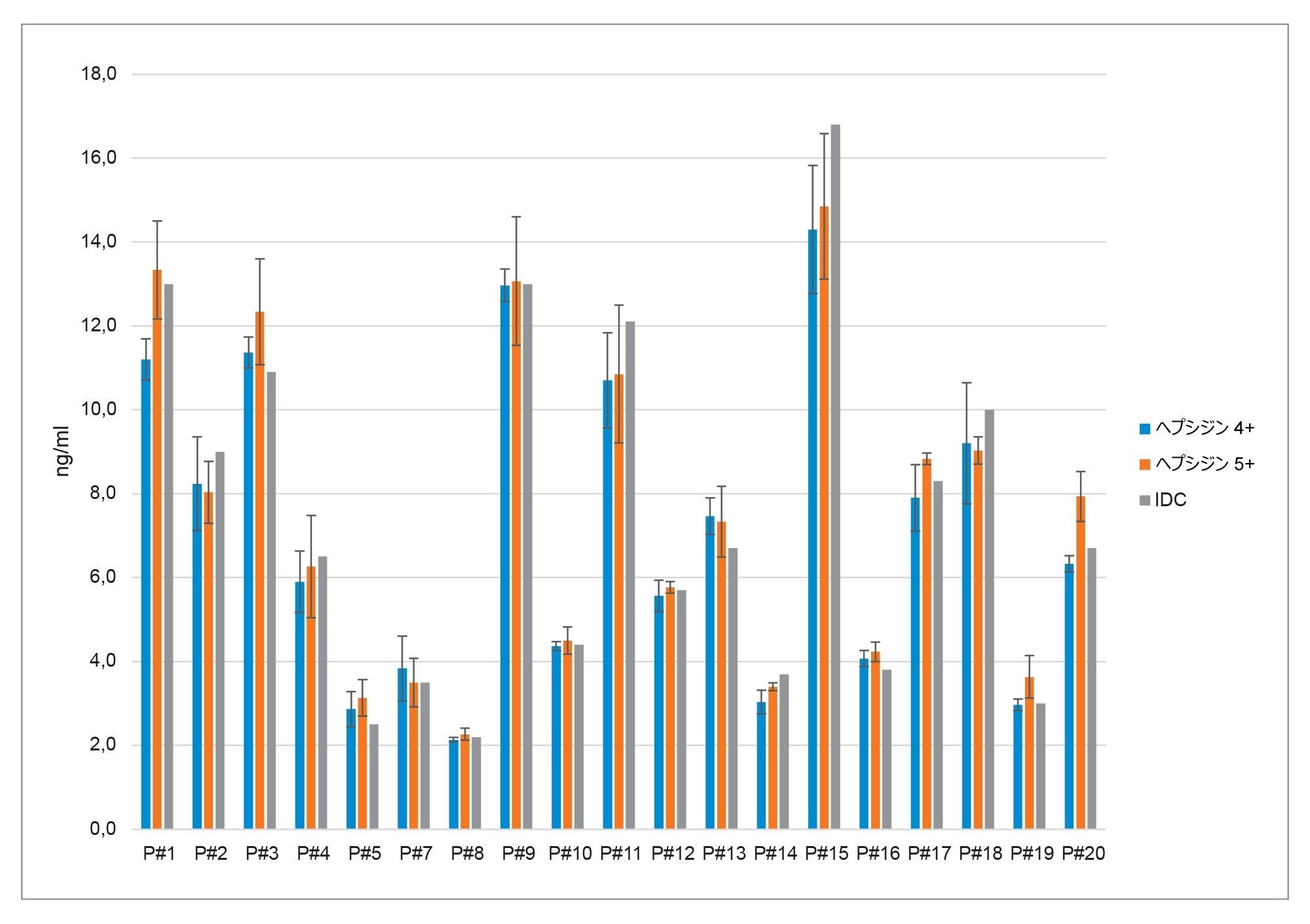
ヘプシジン 4+ およびヘプシジン 5+ の計算濃度を、Immundiagnostik AG によって提供された元のメソッドとブランド-アルトマン法で比較すると、非常に一致する結果が示されました。元のメソッドから得られた結果と比較した、ヘプシジン 4+ および 5+ を使用した計算濃度の平均バイアスは、それぞれ -0.4 および 0.03 でした(図 5)。
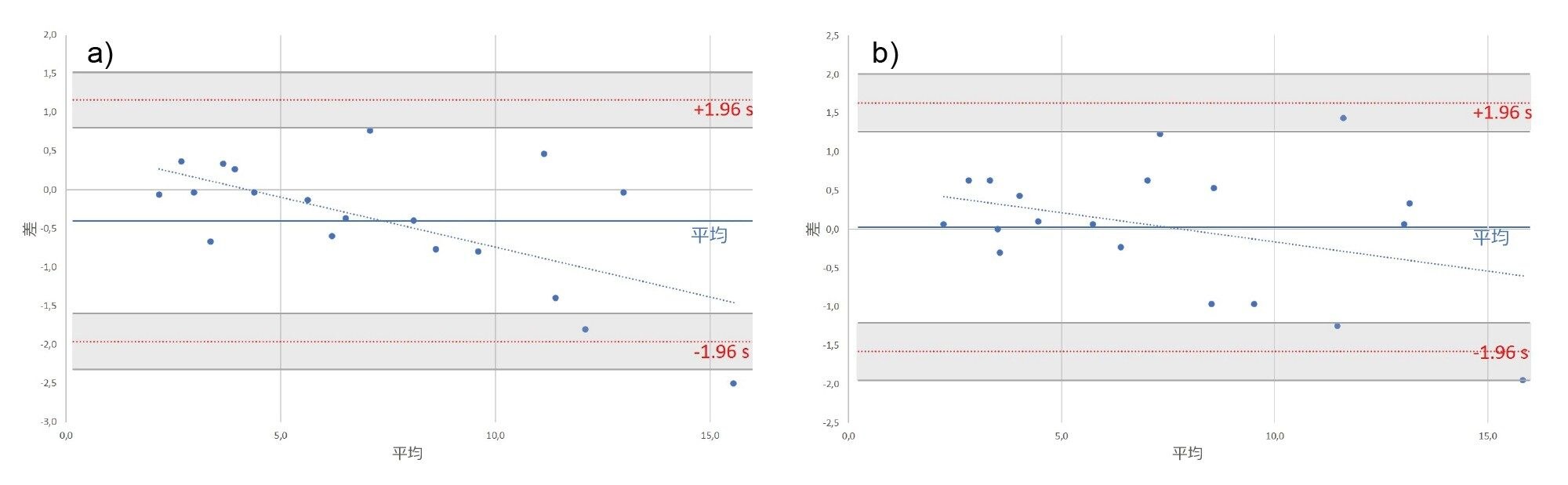
ヘプシジンの分析および定量用に開発した LC-MS/MS メソッドで、良好な直線性(r² > 0.99)、精度(CV < 10%)、正確さ(ヘプシジン 4+ で 95±7%、ヘプシジン 5+ で 98±7%)が示されています。両方のチャージ状態とそれらに対応する MRM トランジションは、正確な定量に使用できます。分析したクエン酸血漿サンプルの定量結果は、元の結果と比較して、すべて一致限界内でした。
結論
Waters ACQUITY UPLC I-Class/Xevo TQ-S micro システムは、Immundiagnostik Hepcidin-25 LC-MS/MS RUO キットを使用したヘプシジンの分析で、優れた精度と正確度によって、分析感度と選択性の高いパフォーマンスを提供する機能が実証されました。
参考文献
- https://www.ncbi.nlm.nih.gov/pmc/articles/PMC1240030/.
- https://www.ncbi.nlm.nih.gov/pmc/articles/PMC2855274/.
- https://www.frontiersin.org/articles/10.3389/fphys.2019.01294/full.
- https://www.haematologica.org/article/view/9512.
720007796JA、2022 年 12 月