
タンパク質のイオン交換クロマトグラフィー(IEX)は、高濃度の不揮発性の塩を使用するため、従来、質量分析計(MS)と適合しませんでした。IEX-MS は、従来使用されていた塩を MS に適した揮発性塩に置き換えることで実現しました。したがって、移動相の変更に伴う新たな検討事項に対処する必要があります。このブリーフは、装置の観点から IEX-MS のための実用的な手引きを提供することを目的としています。
イオン交換クロマトグラフィーは、質量分析の分野で大きな注目を集めている分離手法です。塩の水溶液を使用するために、この技術に特有の課題があります。移動相およびサンプル前処理に関するこれまでの検討事項に加えて1、液体クロマトグラフィー(LC)と質量分析計(MS)の両者を総合的に検討することが重要です。
水系移動相を使用すると、微生物の増殖や汚染が発生し、クロマトグラフィーや装置の寿命に悪影響を与える可能性があります。この持続的で致命的な問題を回避するには、ラボの良好な衛生状態とメンテナンスが必要です。サイズ排除クロマトグラフィー(SEC)などの他のネイティブ水系セパレーションに精通している方は、汚染防止必要性について熟知しているはずです。シンプルで厳格に管理された洗浄ルーチンが、IEX-MS の最適な性能の確保に役立ちます。さらに、単一の装置を様々なクロマトグラフィーモードで使用する場合、専用の部品の使用が大幅な改善をもたらすこともあります。
MS に適したネイティブのイオン交換バッファーは、一般に Waters IonHance CX-MS バッファー(製品番号: 186009280、186009281)などの、酢酸アンモニウムベースの組成のアンモニウムベースの溶液です。多くの理由からこれらが一般的に好まれています2。 これらの溶液は、微生物が増殖するのに適した条件であることを考慮する必要があります。最も簡単なアプローチは、調製した水溶液には、調製時に起動するタイマーがあると考えることです。通常、水系移動相(希釈して調製した IonHance CX-MS バッファーなど)は、微生物による汚染の危険性があるため、室温で 1 週間を超えてシステム上に放置しないことが推奨されます。包装された濃縮液における静菌作用のあるアセトニトリルの濃度は、調製を行う際に濃度が微生物が増殖できる程度まで希釈されてしまいます。そのため、バッファーを調製した後、LC システムに設置しない場合、冷蔵(4℃)することをお勧めします。調製後冷蔵したバッファーは、約 1 ヶ月間保管することができます。
移動相自体以外にも、微生物によってシステムやカラムが汚染される可能性があります。一度汚染されてしまったカラムは、処分しなければなりません。このような事態を防ぐために、カラムはメーカーの指示に従って保管し、使用する LC ラインは、週末などの使用しない間に、強有機水溶液(70% イソプロパノール 30% 18.2 MΩ 水など)でパージしておくことを推奨します。定期的(例えば毎週)に有機溶媒でフラッシュ洗浄することも、微生物のコロニーが LC システム内に定着するのを防ぐのに役立ちます。システムが汚染されている場合は、強有機物および/または酸(例えば、20% リン酸)が有用で、これによって状況が改善することがあります。
移動相インレットフィルターは非常に多孔性の構造で、微生物の生息と増殖の温床になります。ネイティブ LC-MS を用いた測定では、インレットフィルターを LC ラインの末端から取り外すことが推奨されています。高品質の溶媒と移動相試薬のみを使用することに特に注意しつつ、ラインの端を移動相リザーバーに簡単に配置することができます。

複数のクロマトグラフィー分離に LC-MS システムを使用する場合、トリフルオロ酢酸(TFA)は、IEX-MS の性能に悪影響を及ぼす可能性があることに注意してください。システムから TFA をフラッシュ洗浄するのに、相当時間がかかることがあります。そのため、可能であれば、LC ラインを逆相および IEX 専用にすること(例えば、TFA を用いる逆相には A1/B1、IEX-MSには A2/B2)を推奨します。さらに、カラムを TUV に、そして TUV から MS に接続するために専用の PEEK キャピラリーを使用することで、逆相と IEX の間の移行が容易になり、IEX-MS の感度が向上します。専用の PEEK チューブを割り当てることで、時間のかかるクリーニングが不要になり、分離モード間の迅速かつシームレスな移行が可能になります。
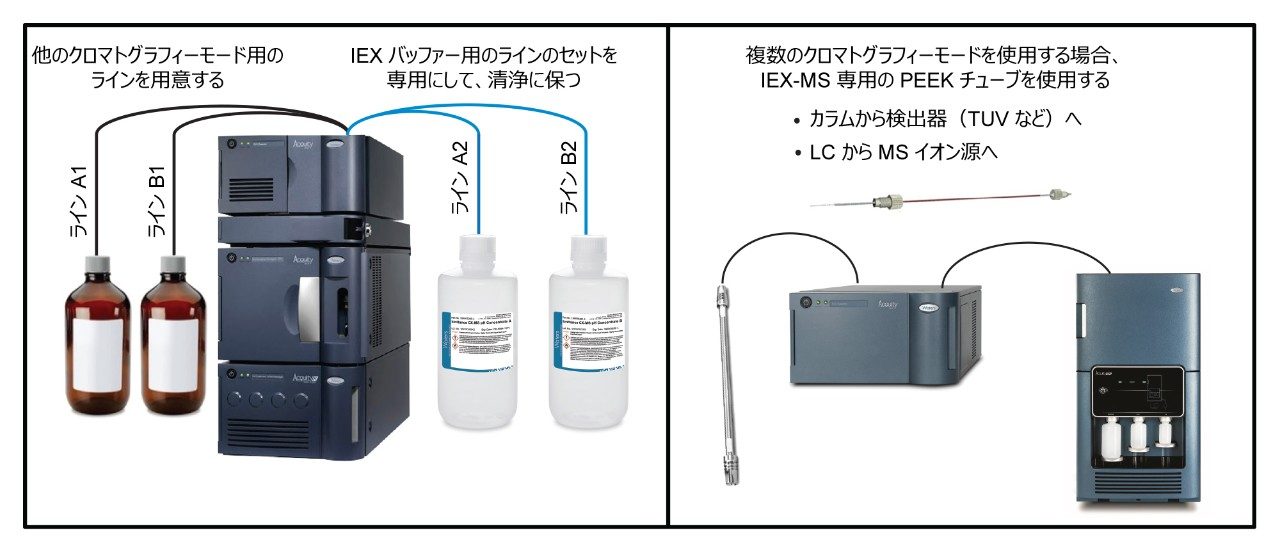
以前に示したように、IEX-MS は汚染に対して非常に敏感です。ピーク性能を確保するため、特に IEX と他の分離手法の両方に LC-MS システムを使用する場合は、LC を定期的にクリーニングすることを推奨します。システムを IEX-MS 専用で使用する場合、およびシステムをクロマトグラフィーモード間で切り替える任意の時点で、水/アセトニトリル/イソプロパノール/メタノール 25/25/25/25 の溶液で毎月フラッシュ洗浄することを推奨しています。
内径 2.1 mm のカラムを搭載した IEX-MS では、動作時の LC 流速を 50~250 µL/分の間で変更できます。ESI-MS で低流速を使用することは、生体分子の検出にメリットがあることがわかっています。高流速を使用すると、クロマトグラフィーの分離能にもマイナスの影響を及ぼす可能性があります。流速を変更するときは、ΔpH/ΔCV(カラム容量)に関して合理的なグラジエント勾配で分離を達成するように注意する必要があります。
揮発性の水性バッファーを使用することで、ネイティブ LC 分離後の MS 検出が可能になりますが、この手法では、酸または塩基で調整した水/有機移動相を使用する分析法よりも感度が低くなります。そのため、成功のためには、最適な MS チューニングパラメーターおよび慎重なシステムのメンテナンスが必要です。IEX-MS 分析法のガイダンスおよびチューニングの詳細については、「参考文献」セクションのアプリケーションノートを参照してください1-4。
メンテナンスについては、MS ソースエンクロージャーを毎月点検することが、塩の析出が生じていないことを確認する確実な手段です。Tof および QTof 装置の場合、迅速なクリーニング法として、ソースエンクロージャーの表面を MS グレードのメタノールを含むリントフリーティッシュで拭くだけで十分です。コーンに塩が付着している場合は、使用している装置のオペレーター概要・メンテナンスガイドに従ってコーンをクリーニングすることを推奨します。BioAccord システムで、システムの正常性表示に、詰まりや感度低下が示された場合、アパーチャーディスクの交換が必要です。
専用の ESI プローブキャピラリーを使用することでも、逆相から IEX への移行をスムーズにできます。これはポストカラムの PEEK チューブを専用にすることと似ています。専用の ESI プローブを使用することで簡単に交換できるようになり、IEX-MS のシグナルを最適化するための大がかりなフラッシュ洗浄が必要なくなります。
システムに生体物質や塩の蓄積がないように注意していれば、装置を年に 1 回定期メンテナンス(PM)訪問するだけで十分です。日常的な観点からは、清浄な溶媒(IonHance CX-MS バッファーなど)、移動相ボトル(MS 品質の熱可塑性材)、カラムへのサンプルロードが適切であることを確保する方がより重要です。
最後に、システム適合性試験(SST)用サンプル(例えば、ヒト化モノクローナル抗体質量チェック用標準、製品番号: 186009125)を設定して、分析ごとに予測シグナル強度、シグナル対ノイズ比、データ品質をモニターすることを推奨します。データ品質の低下が認められた場合、上記のメンテナンス手順の一部またはすべてをシステムに行うことが必要になることがあります。
低容量の濃縮サンプルを注入することにより(例えば、10 mg/mL を 1 µL)、より高容量の希釈されたサンプル(例えば、1 mg/mL を 10 µL)を注入するよりも、良好なデータが得られる傾向が認められています。そのため、サンプルを希釈するのではなく、濃いサンプルを使用することを推奨します。さらに、サンプルは使用する移動相中に調製することが推奨されます。移動相の調製については、Milli-Q 水などの 18.2 MΩ の水が、移動相の濃縮液に適した希釈液です。ガラス瓶入りの水は、金属イオンをもたらすことがあります。一般に、ガラス製の移動相ボトル、シリンダー、およびサンプルバイアルの使用を避けることで、塩/金属の付着を最小限に抑え、最終的に良好な結果が得られます。
水系移動相を使用したネイティブ LC-MS では、微生物汚染が発生すると、データ品質および装置の正常性に悪影響が生じます。本資料に記載した良好な衛生管理プロトコルと推奨するメンテナンスにより、データ品質が向上し、汚染や塩の沈着による感度不良やクロマトグラフィー分離の低下による装置のダウンタイムを短縮できます。データの品質低下や装置の汚染について他の問題がある場合は、iRequest で Waters テクニカルサポートサービスまでお問い合わせください。
720007144、2021 年 2 月