より頑健なクロマトグラフィー材料の登場により、幅広い分析法条件を使用できるようになりました。一方、分析種の化学特性によっては、クロマトグラフィー分離中にサンプルの分解が発生する場合があります。発生原因としては、高温、特定の移動相中での安定性、pH 条件、あるいは固定相やカラムとの相互作用など、様々な要因が挙げられます。
オンカラム分解は一般的に、低分子よりもバイオ医薬品でよく報告されています。これらの高分子は、固定相および LC 条件によってそれぞれ、構造変化およびオンカラム分解を受ける場合があります。低分子のオンカラム分解の報告例は稀ですが、顕著な事例が観察されています。アミノ化合物のオンカラム分解の例が知られており、高 pH の移動相を用いることで分解が更にひどくなることが分かっています。
このアプリケーションノートでは、従来のステンレススチール製カラムで分離を行った場合には、低分子のアミンでもオンカラム酸化が発生することを実証しています。ただし、ACQUITY Premier カラムを使用することで、分解を軽減できます。ACQUITY Premier カラムは、金属と分析種の間の相互作用に対するバリアとなる MaxPeak High Performance Surfaces を採用しています。分析種の分解が更にひどくなる原因となる金属の LC 表面の腐食も、無機/有機ハイブリッドシリカに基づいたこのバリアで保護することができます。これらの結果から、MaxPeak Premier テクノロジーにより、酸化を含むオンカラムの金属触媒反応を低減できることが実証されました。このことにより、LC での作業、純度測定、不純物プロファイリング、あるいは分析上のアーティファクトにより分析の価値が下がる可能性がある場合には常に、ACQUITY Premier カラムの使用を検討する必要があります。
様々な理由により、分析種とクロマトグラフィーシステムとの相互作用が問題となる場合があります。例として、固定相または LC システム表面への吸着により、回収率および再現性が低下する場合があります。また、カラム内で分析種が反応を受ける場合もあります。弱酸性条件では、ペプチドおよびタンパク質に様々な分解が生じることが知られています1。 つまり、酸性の移動相およびカラムで高温を使用した場合に、オンカラム分解が発生します。ペプチドおよびタンパク質は、加水分解反応を受けやすいことに加えて、システイン残基やメチオニン残基が酸化を受ける可能性があります2,3。時間の経過とともに、このような酸化分子種の増加につれて、メチオニン残基を含むペプチドの相対含有量が減少することが分かっています3。低分子については、過去 20 年間でオンカラム分解の観察が増加しました。これは恐らく、新しい pH 抵抗性の固定相と組み合わせて、より広範な移動相および pH が使用できるようになったためと考えられます4。塩基性化合物の分析法開発においては、高 pH の移動相の使用が特に重要になってきました。しかしながら、この条件により酸化が進行することが確認されています5,6。2011 年に Wang らにより、従来の金属カラムテクノロジーおよび水酸化アンモニウムの高 pH 移動相の使用時に、アニリンのオンカラム分解が発生することが発見されました5。観察された酸化は、アゾ二量体およびヒドラゾ二量体の形成の原因となり、カラムを使用し続けることで、時間の経過とともに更にひどくなりました5。
Wang らは酸化のソースおよび原因については説明していませんが、2013 年にこの研究を Myers らがフォローアップしています6。 Wang と同様、時間の経過とともに、アミン化合物の酸化的ニトロソ化が増加しているという結果を得ました。実験を通じて、原因はアンモニアの反応により、ニトロソ化剤である酸化窒素を生成することが示唆されました。これは、アセトニトリルなどの特定の有機溶媒を使用した場合にも悪化が見られる金属触媒性反応と考えられます6,7。
このアプリケーションノートでは、Myers、Wang らが発表した知見に基づき、MaxPeak Premier テクノロジーによりオンカラム反応を軽減できるかどうかを調査しました。ここでは、従来のステンレススチール製カラムと MaxPeak High Performance Surfaces(HPS)を採用した ACQUITY Premier カラムを比較して、低分子アミンである抗精神病薬クロザピンの分離を比較しました。以前、この表面は金属と分析種の相互作用に対するバリアとして作用することが示されています8。 本研究では、クロザピン N-オキシドおよびニトロソ不純物のオンカラムでの酸化物生成を観察し、ステンレススチール製カラム、およびアセトニトリルと水酸化アンモニウム水溶液の溶離液を使用した場合に、時間の経過とともにこれらの分子種が増加し続けることを確認しました。MaxPeak High Performance Surfaces を採用した ACQUITY Premier を使用することで、クロザピンのオンカラム酸化が大幅に減少することが分かり、複数回の注入後でも UV クロマトグラム中に不純物は観察されませんでした。
クロザピンを 0.1%(w/v)の 20/80/0.08(アセトニトリル/水/酢酸)中に濃度 6 mg/mL になるように調製し、サンプル容量 0.25 µL(ロード量 0.15 µg)を注入しました。
|
LC システム: |
ACQUITY UPLC I-Class* |
|
検出: |
290 nm での UV 検出 |
|
バイアル: |
マキシマムリカバリーバイアル(製品番号:186002802) |
|
カラム: |
ACQUITY UPLC BEH C18、130 Å、1.7 μm、2.1 × 50 mm(製品番号:186002350) ACQUITY Premier BEH C18、130 Å、1.7 μm、2.1 × 50 mm(製品番号:186009452) |
|
カラム温度: |
30 ℃ |
|
サンプル温度: |
4 ℃ |
|
注入量: |
0.25 µL |
|
流速: |
0.31 mL/分 |
|
移動相 A: |
0.05%(w/v)水酸化アンモニウム水溶液 |
|
移動相 B: |
アセトニトリル |
|
サンプル希釈液: |
20/80/0.08(w/v)アセトニトリル/水/酢酸 |
|
グラジエント: |
25 ~ 80% B、10.31 分 |
|
*分析種を酸化からさらに保護するために、ACQUITY Premier システムの使用を検討する必要があります。 |
|
MS システム: |
Vion IMS QTof |
|
イオン化モード: |
ESI+感度 |
|
取り込み範囲: |
m/z 50 ~ 1500 |
|
キャピラリー電圧: |
3.5 kV |
|
サンプルコーン電圧: |
40 V |
|
ソースオフセット: |
80 V |
|
イオン源温度: |
100 ℃ |
|
脱溶媒温度: |
250 ℃ |
|
脱溶媒ガス: |
600 L/時間 |
|
四重極オプション: |
自動 |
|
クロマトグラフィーと MS ソフトウェア: |
UNIFI v1.8 |
クロザピンおよび分解物について観察されたピーク面積(UV または TIC)から、酸化分子種(%)の相対量を予測しました。
本研究では、統合失調症治療薬として開発されたアミノ化合物クロザピンを調査しました。Myers らは、論文中で、オンカラムのニトロソ化を受ける可能性がある一連のアミンの記載において、クロザピンについて簡単に触れています。文献でその存在が既知の別の主な酸化経路として、クロザピンの第 3 級アミンの酸化による N-オキシドの生成があります9,10。 図 1 にクロザピンの構造およびその分解によるアーティファクト(クロザピン N-オキシドおよびその Z、E ニトロソ異性体不純物)を示します。

この調査では、上述した 2 種のカラムテクノロジーでの酸化分子種生成と比較するため、Myers らが記載したクロマトグラフィー条件を採用しました。0.05%(w/v)水酸化アンモニウム水/アセトニトリル溶液を移動相として使用した場合の分離を、新品で未使用の従来のステンレススチール製 ACQUITY UPLC BEH C18、1.7 µm、2.1 × 50 mm カラムまたは新品で未使用の ACQUITY Premier BEH C18、1.7 µm、2.1 × 50 mm カラムで行いました。UV または TIC ピーク面積のモニタリングにより酸化クロザピン分子種の生成の時間変化を測定し、MS による質量分析で確認しました。実験は ACQUITY UPLC I-Class システムに Vion IMS QTof を組み合わせて行いました。
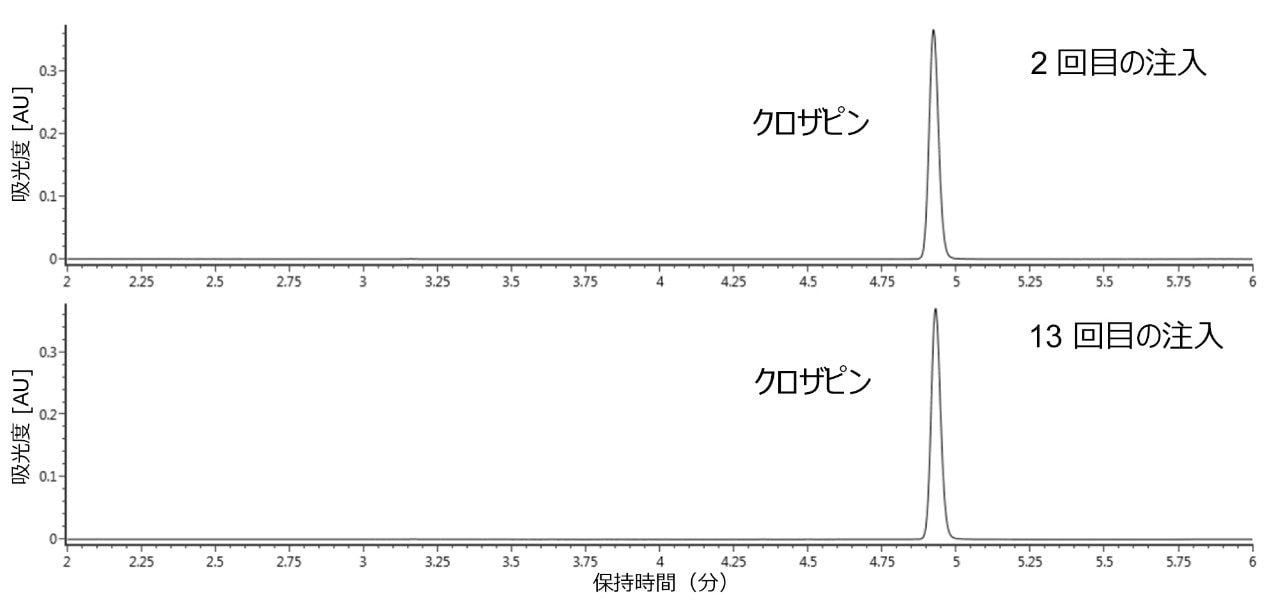
34 回の連続注入を、ステンレススチール製 ACQUITY UPLC BEH C18 カラムと ACQUITY Premier BEH C18 カラムの両方で行いました。酸化クロザピンの比率の時間変化を、各カラムでの UV ピーク面積の相関からモニターしました。図 2 に、従来のスチール製カラムへのクロザピンの 2 回目から 13 回目の注入の UV クロマトグラムを示します。ここでは、時間の経過とともにクロザピンの N-オキシド生成が増加していることがはっきり分かります。

2 回目から 13 回目の注入で、第 3 級アミンの酸化が 2 倍を越えて増加しています。このことは先述の文献の知見を反映しています。結果から分かった興味深い点として、第 2 級アミンのニトロソ化により生じた不純物よりも、クロザピン N-オキシドが主な酸化アーティファクトであった点が挙げられます。この点は、ニトロソ化による不純物の経時的な生成について主に議論している Myers らが発表した論文とは対照的です6。 これはシステム設定の違い、あるいは変数の組み合わせが原因である可能性があり、試験ごとの違いについて調べる更なる調査が必要となります。同一の条件および注入数で ACQUITY Premier BEH C18 カラムも評価しました。このカラムでの 2 回目から 13 回目の注入の UV クロマトグラムを図 3 に示します。ステンレススチール製 ACQUITY UPLC BEH C18 カラムとは対照的に、ACQUITY Premier BEH C18 カラムの UV クロマトグラムでは N-オキシド分解物は見られませんでした。これらの結果は、MaxPeak HPS の有機/無機ハイブリッドテクノロジーを用いた ACQUITY Premier により、酸化などのオンカラム反応が発生する可能性のある金属と分析種の相互作用に対するバリアが得られることを示唆しています。このような酸化は、特にフリットなどの金属表面の腐食により発生する可能性があります6。 この場合、MaxPeak HPS テクノロジーにより形成されたバリアが、直接的な触媒的相互作用を妨げることで、酸化を受けやすいアミンを保護していると考えられます。また、MaxPeak HPS テクノロジーにより、金属表面自体に対して一定の耐腐食性が付与される可能性があります。このことは、クロザピンの正確な分析を行う上での更なるメリットとなります。
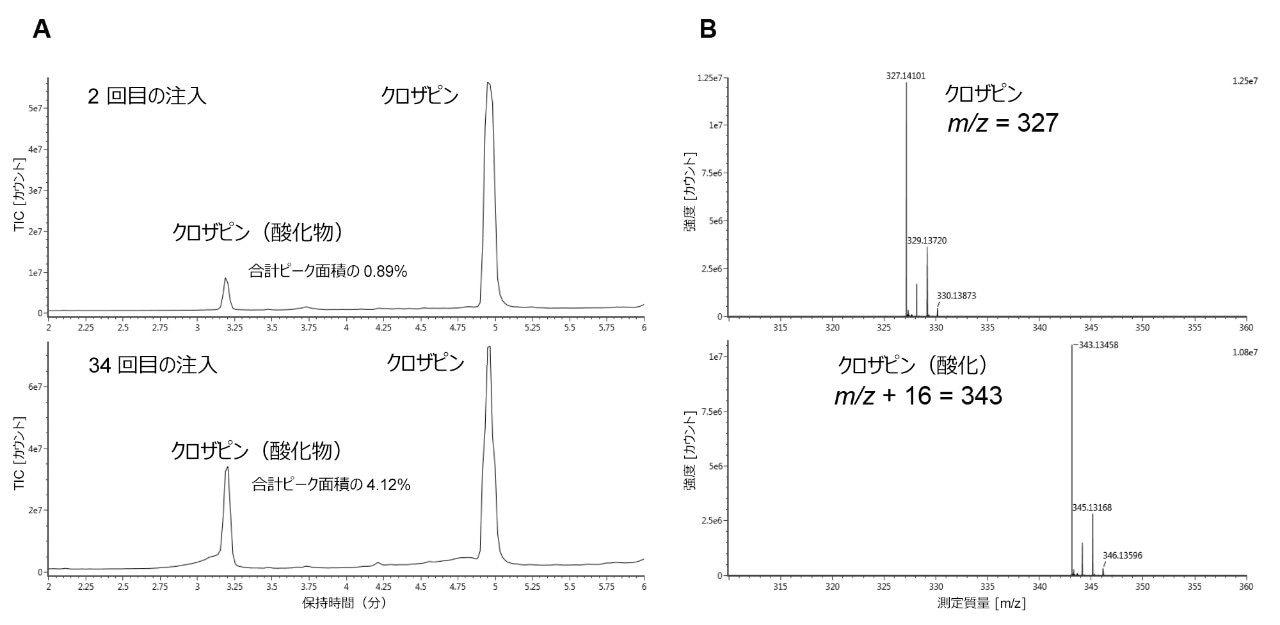
この不純物ピークが正しく同定されるように、質量分析を使用して N-オキシド分子種を確認しました。ステンレススチール製 ACQUITY UPLC BEH C18 カラムでのクロザピンの分離で収集した質量スペクトルを、図 4B に示します。図 4A は 2 回目と 34 回目の注入を比較した TIC クロマトグラムを示し、クロザピン N-オキシドの比率が合計ピーク面積の 4.12% まで上昇しています。
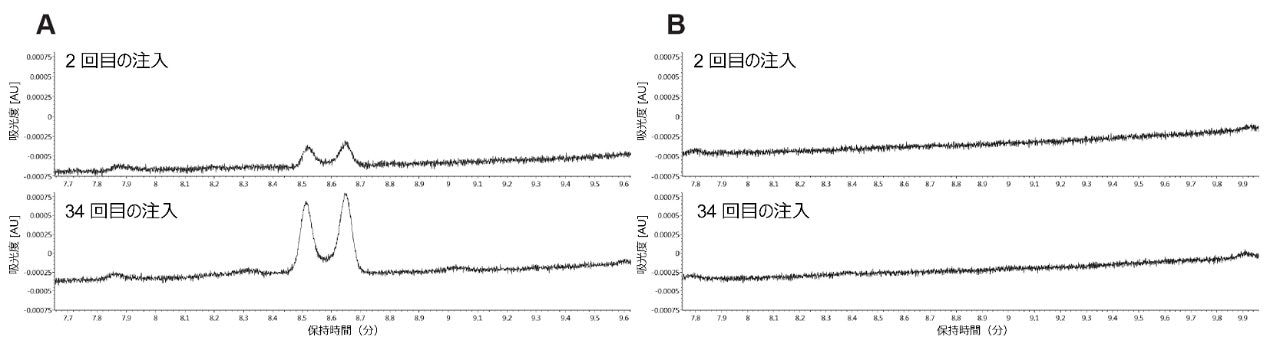
クロザピンの主なオンカラム分解は N-酸化でしたが、Z および E 異性体の増加という形で、微量のニトロソ化も観察されました。これらの分子種はクロザピン N-オキシドよりも低レベルで、ステンレススチール製カラムでのみ検出されました。クロザピン N-オキシドの経時的生成の増加と同様に、2 回目から 34 回目の注入の間にニトロソ分子種も増加していました(図 5)。ACQUITY Premier カラムでは 34 回目の注入でも Z および E のニトロソ異性体は見られず、これらの分解物もステンレススチール製のカラムを使用した場合にのみ観察されました。
連続 34 回の注入を通じた N-酸化の割合が、時間の経過とともに、注入回数に応じてほぼ直線的に増加していることが注目されます。この直線的な関係をモデリングすることで、ステンレススチール製カラムを使用し続けることで、更に多くの N-オキシドが検出されることが示唆されました。この関係を正しく評価するためには、実証的研究が必要となります。更に、ニトロソ不純物の生成についても十分な解明が必要となります。
このアプリケーションノートでは、MaxPeak High Performance Surfaces を採用した ACQUITY Premier BEH C18 カラムで、クロザピンのオンカラム分解を軽減できることを実証しています。この独自の MaxPeak HPS の有機/無機ハイブリッドのバリアが、ステンレススチール製カラムではオンカラム反応が発生する金属と分析種の相互作用を防いだと思われます。本研究により、ステンレススチール製カラムを使用した場合、特に連続注入および長期にわたる使用時に、第 3 級アミンの酸化と第 2 級アミンのニトロソ化の両方が発生する可能性があることが確認されました。ACQUITY Premier カラムを使用した場合は、このような分解物は観察されませんでした。
これらの結果は、ACQUITY Premier カラムにより、クロマトグラフィーデータの再現性および信頼性が改善され、多大なメリットがもたらされることを示しています。このことは、オンカラム分解物により不純物の検出が難しくなっていた品質管理を含む多くの分野で特に有望と考えられます。更に、ペプチドやタンパク質中のアミノ酸残基の酸化や、一部の種類のオリゴヌクレオチドの酸化など、その他の分析種のオンカラム反応の軽減にも、このテクノロジーを適用できると想定されます。
720007160JA、2021 年 2 月