ACQUITY Premier LC プラットホームによる複数のバイオ医薬品ラボにわたる一貫性の向上
要約
新しいテクノロジーの評価は、医薬品のライフサイクル管理で頻繁に行われています。これらの評価の一環として、データの継続性を確保するために、性能と結果が従来の分析法と同等であることを確認する試験が通常実施されます。MaxPeak High Performance Surfaces を採用した ACQUITY Premier LC システムは、開発および製造の活動をサポートする柔軟な LC プラットホームとして最近導入されました。この試験では、ACQUITY Premier システム、およびこのシステムが、従来の HILIC ベースの分析法を使用してさまざまな LC プラットホームにわたって結果を再現する能力を評価します。遊離糖鎖解析の結果により、2 つの ACQUITY Premier LC システムの間で移行した場合、従来のデータと同等の結果が示されました。ピーク面積 % を観察し、複数の LC プラットホーム間での糖鎖分子種の相対ピーク面積の差は 0.5 % 未満で同等であり、グルコース単位(GU)の計算値は、waters_connect 内のサイエンスライブラリーの従来の値と比較すると、互いに 0.1 単位以内と判定されました。複数の LC プラットホーム間、および従来の分析法との間で、結果が同等であることにより、ACQUITY Premier LC システムは、バイオ医薬品の開発および製造での分析ニーズをサポートするのに適切であり、従来の分析法と互換性があることが実証されます。
アプリケーションのメリット
MaxPeak High Performance Surfaces(HPS)テクノロジーを採用した ACQUITY Premier により、以下が提供されます。
- さまざまなプラットホーム間で同等の結果を取得する能力
- 従来の分析法およびサイエンスライブラリーとの互換性
- 上流および下流のラボ活動をサポートする柔軟性
はじめに
薬物候補が開発および製造の初期段階から後期段階に進むにつれて、異なる LC プラットホーム間での分析法の移管が、バイオ医薬品業界で一般に行われます。これは一部では、サポートするラボの装置に対するニーズが組織にわたって異なるため、ある程度意図的なことです。薬物候補がパイプラインを通過する際、重要品質特性(CQA)が特定およびモニターされて製造プロセスの一貫性が確保され、医薬品は安全で有効であることが保証されます。この点で、バリデーション後は判定基準を容易に変更できないため、複数のラボにわたって一貫した正確な結果が得られる分析法に対するニーズは、極めて重要です。
最近ウォーターズは、MaxPeak High Performance Surfaces(HPS)テクノロジーを採用した ACQUITY Premier LC システムを、柔軟な LC プラットホームとして導入しました。このシステムは、複数のラボにわたって容易に導入でき、金属に吸着しやすい分析種に対するクロマトグラフィー性能の向上によって、開発および製造の活動がサポートされます。これを実現するために、LC 流路内で起こる金属に吸着しやすい分析種の分析種/表面間相互作用を最小限に抑えるように設計された革新的な MaxPeak HPS テクノロジーが導入されています1-3。 この試験の目的は、ACQUITY Premier LC テクノロジーが、頑健で、LC プラットホーム間で一貫した結果を生成でき、組織全体にわたるラボの分析ニーズのサポートに適していることを実証することです。この評価の一環として、参加ラボにわたって移管する分析法の代表として、2 つの ACQUITY Premier LC プラットホームの間で HILIC ベースの分析法を比較します。
結果および考察
バイオ医薬品のグリコシル化は、薬剤の安全性、有効性、安定性に影響を及ぼす可能性があるため、分析法を製品パイプラインにわたって移管する際に、CQA として指定される特定の分子種を用いて、通常糖鎖プロファイルをモニターします4。 グリコシル化の評価は一般に、蛍光標識遊離 N 型糖鎖の、蛍光(FLR)および/または MS 検出と組み合わせた親水性相互作用クロマトグラフィー(HILIC)を用いる分析によって行われ、これによって、糖鎖分子種のアイデンティティーや相対含有量などの包括的な情報が得られます5,6。
これらの分析法は、糖鎖の同定において、ある程度サイエンスライブラリーまたはオンラインデータベースに依存します。この点で、比較を容易にし、従来の分析法とのデータの継続性を確保するため、結果が複数の LC プラットホームにわたって一貫している必要があります。このことから、確立された Waters GU ライブラリーに基づく HILIC ベースの分析法を使用して、複数の LC プラットホームにわたって一貫した結果を生成する能力について ACQUITY Premier LC システムを評価します。
簡潔に説明すると、RapiFluor-MS 糖鎖性能試験標準試料(製品番号 186007983)を、ACQUITY Premier Glycan BEH Amide カラム、1.7 μm、130 Å、2.1 × 150 mm(製品番号 186009524)を用いて、2 つの異なる ACQUITY Premier LC システムで 0.6% B/分 35 分のグラジエントを使用して分離しました。遊離糖鎖分析法の開発で、ACQUITY Premier LC を搭載した BioAccord システムを LC プラットホームとして用いました。BioAccord システムをコントロールする waters_connect インフォマティクスプラットホームの一部として、統合された糖鎖ワークフローおよびデータベースを、個々の糖鎖分子種の同定に容易に適用できます(実験の詳細についてはアプリケーションノート 720007261JA を参照)。同じ分析法を、分析法の移管先である参加ラボのシステムの代表として、Empower 3 によってコントロールされる ACQUITY Premier LC システムで実行しました。このシステムでは、直交的な検出手法として蛍光検出器の後ろにインラインで配置した ACQUITY QDa 質量検出器を使用して、補完的な質量データを取り込みました。グリコシル化プロファイル、相対存在量、RT、GU の値を、システム間の適合性を評価するための指標として使用しました。
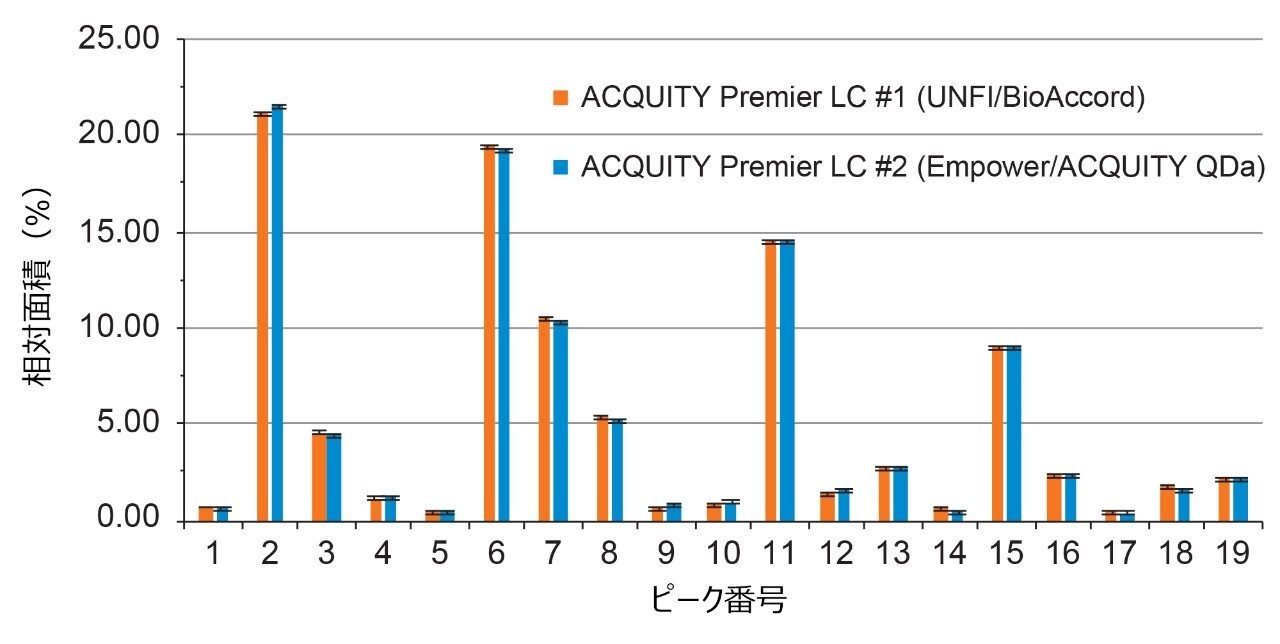
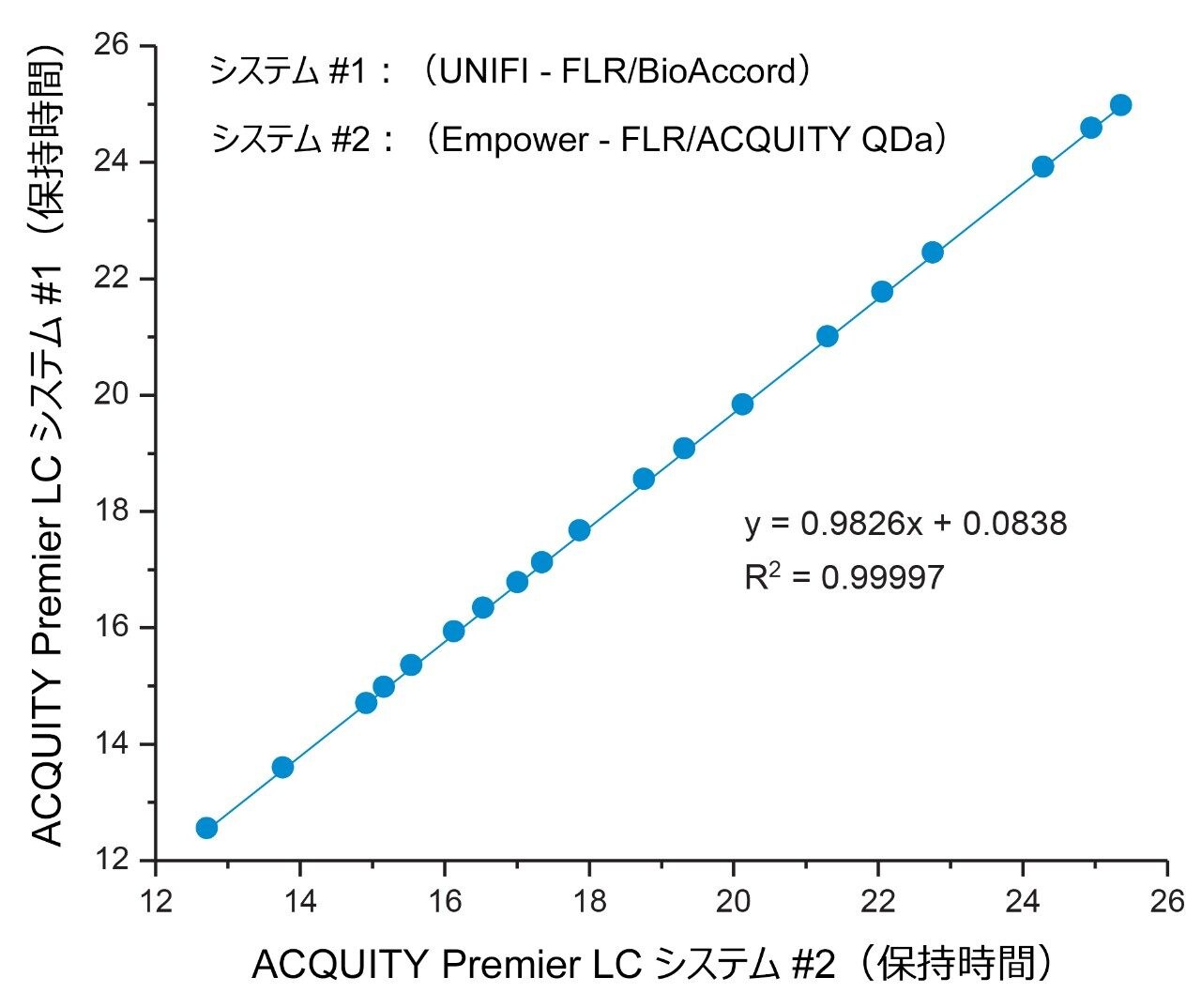
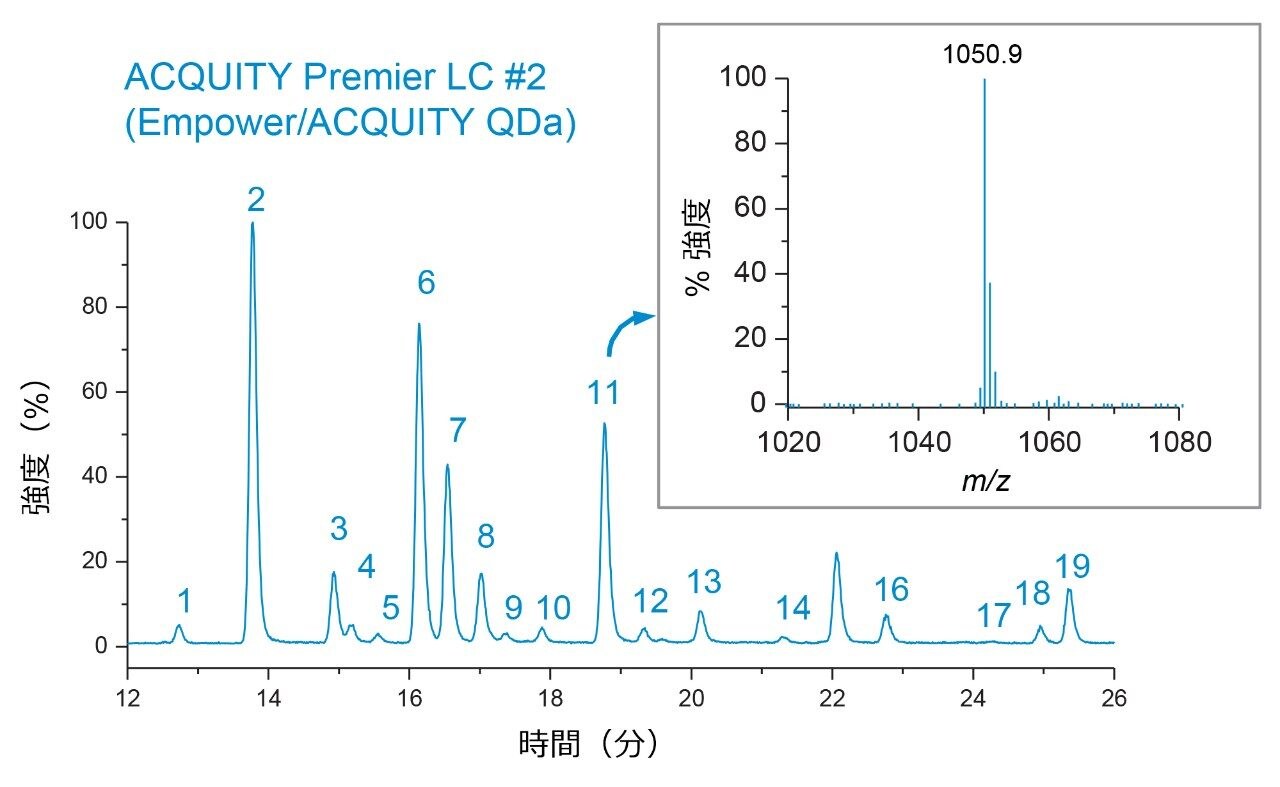
図 1 に示されているように、グリコシル化プロファイルの定性的評価によって両方のプラットホームにわたって比較すると、ピーク強度、保持時間、および検出された分子種に関して、高度の同等性が示されました。詳細に調べると、ピーク面積が LC プラットホーム間で良く保持されており、ピーク面積 % の差は、同じ糖鎖分子種について、複数のプラットホームにわたって 0.5 % 未満と算出されました(図 2)。両プラットホームの間でピーク面積に非常に高い同等性が観察されたことは、ACQUITY Premier LC システムにより、異なる LC プラットホームで実施した所定の分析法で一貫した結果を得ることができることを示しています。これは、分析法が頑健かつ正確である必要があり、異なるラボにしばしば導入される規制対象ラボにおいて、非常に重要な品質です。さらにデータを調べたところ、分析法を Empower/ACQUITY QDa システムで実行した場合の系統的な保持のシフトは、保持時間をプラットホーム間で比較した場合の y 切片オフセットで示されているように、0.08 分であることが示されました(図 3)。この観察結果は、システムのデュエルボリュームや移動相組成などの分析法の相違による軽微なばらつきに起因する可能性があります。これらの相違は、軽微ではあるものの、レファレンス標準試料を使用して補正することで、レスポンスをノーマライズすることができ、プラットホームや履歴データにわたる直接比較が容易になります。
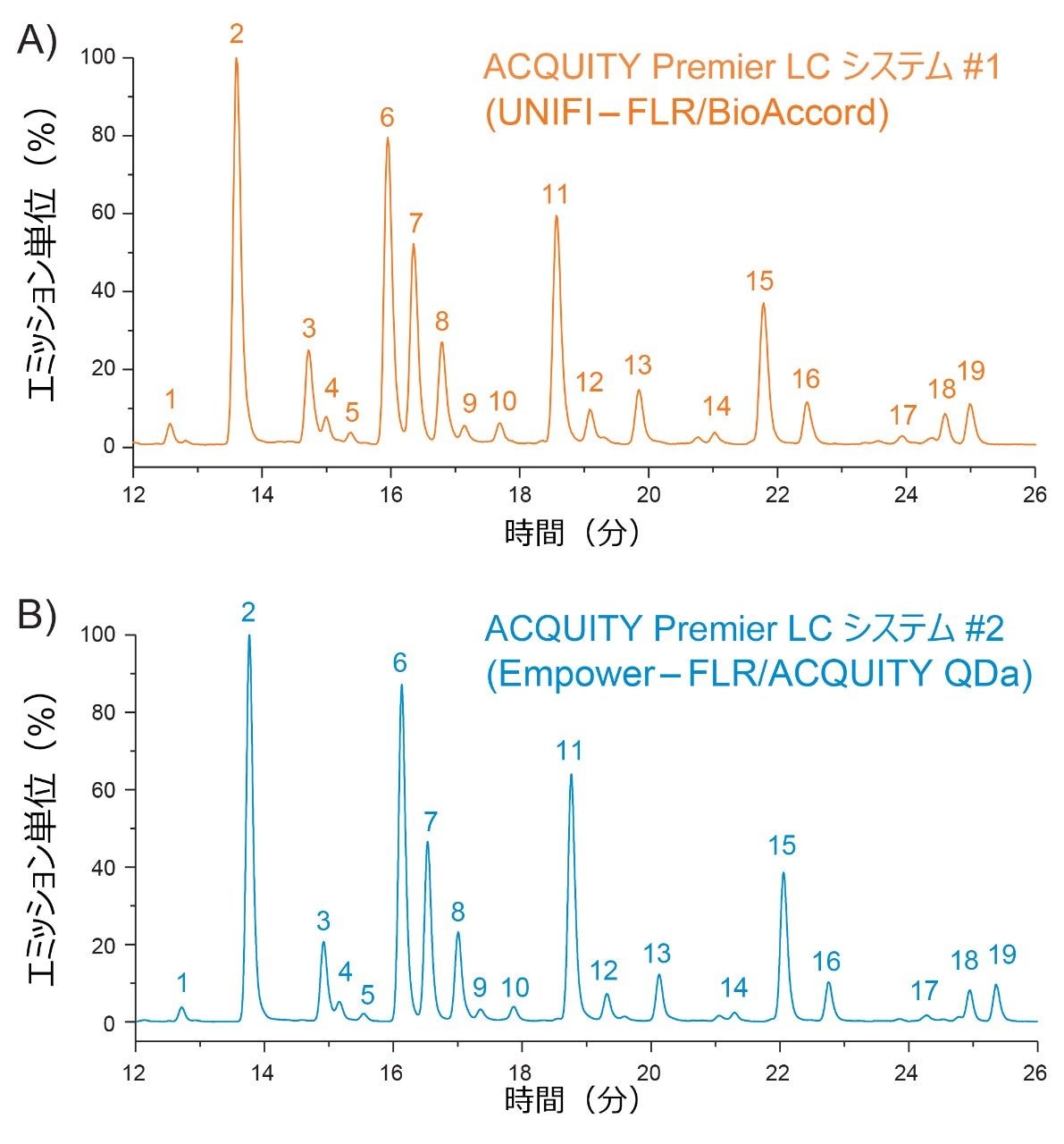
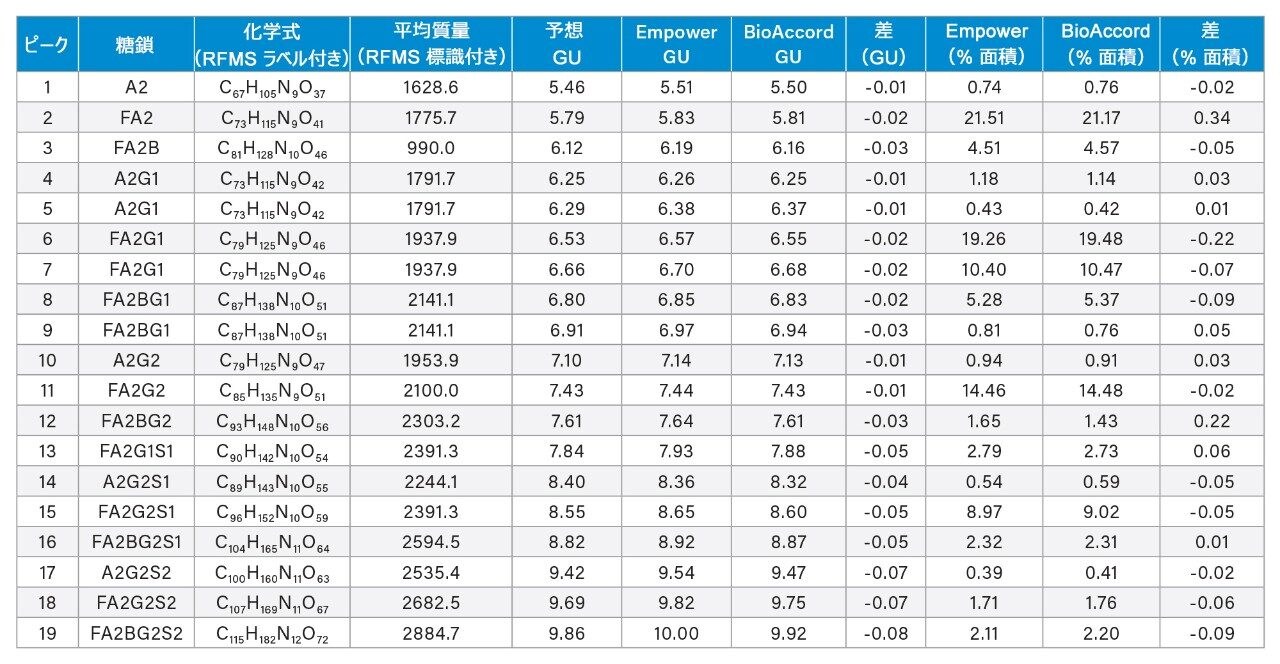
この原理を実証するため、デキストランキャリブレーションラダーを使用して、Waters GU ライブラリーメソッドを用いて保持時間(データは表示していません)に基づいてグルコース単位(GU)値を生成しました。表 1 に示されているように、両プラットホームで生成された GU 値は高度に同等で、システムでの測定値と Waters GU ライブラリーからの予測値との間に認められた差は 0.1 未満でした。GU 値は Waters GU ライブラリーの不可欠な部分であり、質量情報と組み合わせて糖鎖ピークの同定が容易になるように設計されています7。 例として、ACQUITY QDa 質量検出器によって取り込んだ MS スペクトルに観察される m/z 1051 のチャージ状態を持つピーク 11(GU = 7.44)が示されています(図 4 の挿入図)。表 1 を参照して、これは Waters GU ライブラリーの質量情報とよく一致しており、FA2G2 糖鎖分子種(平均質量 = 2,100 Da)の [M]+2H チャージ状態に対応します。さらに、ACQUITY Premier LC テクノロジーにより従来の分析法と同等の結果が得られ、製品のライフサイクル全体にわたるデータの継続性が確認されます。まとめると、これらの結果により、ACQUITY Premier LC テクノロジーは頑健で、複数の LC プラットホームにわたって一貫した結果を提供し、ラボにおける開発および製造活動を支援できることが実証されています。
結論
一般に、バイオ医薬品業界の LC 装置ラインナップは、性能や仕様が多様な幅広い設定に対応しています。ライフサイクル管理の一環として、複数の LC プラットホームにわたって一貫性のある同等の結果を提供する能力について、装置を評価する必要があります。この試験により、ACQUITY Premier LC システムでは、HILIC ベースの分析法に対して 2 つの異なる ACQUITY Premier LC システムの間で結果を再現しながら、従来の分析法と同等の性能が提供されることが実証されています。ピーク面積 %、保持時間、GU 計算値で高度の一貫性が観察されることは、ACQUITY Premier システムが、バイオ医薬品の開発および製造活動をサポートするのに適していることを示しています。
参考文献
- Delano, et al.Using Hybrid Organic-Inorganic Surface Technology to Mitigate Analyte Interactions with Metal Surfaces in UHPLC.Anal.Chem. 2021, 93, 14, 5773–5781.
- Birdsall et al.Reducing Metal-Ion Mediated Adsorption of Acidic Peptides in RPLC-Based Assays using Hybrid Silica Chromatographic Surfaces.Journal of Chromatography B. 2021; 1179.
- Liu X., Lauber M. MaxPeak High Performance Surfaces Technology Improves HILIC Profiling of Released N-Glycans.Waters Application Note, 2021.720007263EN.
- Higel F, et al. N-glycans of Complex Glycosylated Biopharmaceuticals and Their Impact on Protein Clearance.European Journal of Pharmaceutics and Biopharmaceutics.2019; 139, 123–131.
- Yu, Y. Applying a Novel Glycan Tagging Reagent, RapiFluor-MS, and an Integrated UPLC-FLR/QTof MS System for Low Abundant N-Glycan Analysis.Waters Application Note, 2015.720005383EN.
- Zhang X, Reed C, Shion H, Alley W, Birdsall R, Yu Y. Increasing Productivity and Confidence for N-linked Glycan Analysis of Biosimilars Using the BioAccord System.Waters Application Note, 2019.720006545EN.
- Zhang X, Kellett J, Birdsall R, Yu Y. Improving Released N-Glycan Analysis in Biotherapeutic Development Using the ACQUITY Premier Solution with MaxPeak High Performance Surfaces (HPS) Technology.Waters Application Note, 2021.720007261EN.
720007415JA、2021 年 11 月