前立腺がんおよび各種治療に対する反応の試験への LipidQuan の適用
研究目的のみに使用してください。診断用には使用できません。
要約
さまざまなステージの前立腺がん(PCa)の間の区別および治療が可能になる、脂質の頑健で再現性のある対象を定めた定量メソッドは、トランスレーショナル研究の主要な領域です。このアプリケーションノートでは、LipidQuan プラットホームがどのように簡単に導入できて対象を定めた分析法を開発できるか、および Quanpedia ライブラリーを使用すると分析法開発とトレーニングのコストが削減されることが示されています。このライブラリーには、同定と特異性が改善された 2000 を超える脂質が含まれています(例:2 つの脂肪酸鎖のフラグメントを使用することによる、リン脂質関連の MRM の特異性の向上)。TargetLynx およびサードパーティー製インフォマティクス(Skyline)を用いた高速データ解析および可視化により、最大限の柔軟性が実現しています。リニアダイナミックレンジ、正確度、精度などのパラメーターを評価して、メソッドの再現性と頑健性が示されています。重要な脂質を定量することにより、この分析法を使用して調査した PCa パイロット試験群間の差異が明らかになります。
アプリケーションのメリット
- さまざまなステージの前立腺がんの間の区別および治療が可能になる、対象を定めた脂質の定量メソッド
- 分析法開発およびトレーニングにかかるコストを削減する、Quanpedia を用いた頑健で導入しやすいプラットホーム
- 2 つの脂肪酸アシル鎖フラグメントからの MRM トランジションを使用する、リン脂質の同定および特異性の改善
- TargetLynx ソフトウェアおよびサードパーティー製インフォマティクス(Skyline)を用いた高速データ解析および可視化による、最大限の柔軟性
はじめに
前立腺がん(PCa)は比較的一般的な癌(世界中のすべての癌の 40%)であり、その診断および予測は、依然として困難な課題です1。 前立腺特異抗原(PSA)のレベルは、現在臨床診療で利用できる数少ない血液ベースのタンパク質バイオマーカーの中で最も一般的ですが、PCa の存在を示す明示的な指標である信頼性の高い PSA 範囲が存在しないため、PSA 単独では正確ではありません2。 適切な分析法の正確度、精度、感度は、確立する必要があるままです。疾患の、可能性のあるバイオマーカーおよび測定可能な徴候に関する試験は、依然としてトランスレーショナル研究の重要な領域です。
複数の試験にわたって、PCa の特性解析を行うための診断指標として、リゾホスファチジルコリン(LPC)、ホスファチジルコリン(PC)、リゾホスファチジルエタノールアミン(LPE)、ホスファチジルエタノールアミン、スフィンゴミエリン(SM)が特定されています4,5。 最近では、脂質およびタンパク質の測定をそれぞれ組み合わせたマルチオミックス試験により、前立腺がんに罹患する可能性のある男性の疾患状態の判定に関する有用性が向上したバイオマーカーも、特定されています6。
ここでは、LipidQuan Workflow7 を使用した、前立腺がんに関連する生体分子プロセスに関与する主要な脂質分子種、および治療に基づいて観察されるその変動を定量するための極性切り替えメソッドの開発について説明します。
実験方法
サンプル
42 名の患者からの血清ベースのサンプルをプールして、表現型群を作りました。これらのプールは、コントロール(PCa と診断された人)(n = 6)、積極的な監視(AS)(n = 6)、小線源治療(n = 6)、ホルモン療法のみ(n = 6)、健常対照(n = 6)、放射線療法とホルモン療法の併用(n = 6)、前立腺切除(n = 6)で構成されました。
Avanti Odd-Chained LIPIDOMIX を使用して、IPA 中に 10 倍、20 倍、50 倍に希釈した 3 種類のスパイク溶液を調製しました。入手可能なすべての脂質標準試料について、純標準混合溶液およびスパイク溶液を、プールした「コントロール血清」(抗凝固剤、K2 EDTA)に 5% v/v 未満の濃度になるように直接スパイクし(マトリックスへのスパイクの影響を最小限に抑える)、10 点検量線、および 3 QC レベル(LQC、MQC、HQC)のサンプルを、ガラスバイアル中に 5 ng/mL ~ 423,750 ng/mL の濃度で生成しました。7 つのプールしたサンプルすべての試験レファレンス(SR)プール、および凍結ヒト血漿中の NIST SRM 1950–代謝物(Sigma Aldrich(Gillingham、Dorset、UK)から入手)も QC 目的で使用しました。
サンプル前処理
まず、25 μL アリコートのキャリブラント、QC 試料、サンプルを LoBind マイクロチューブ(Eppendorf、Hamburg, Germany)に移しました。これに対し、500 倍希釈した純重水素化セラミド LIPIDOMIX および内部標準試料としての SPLASH LIPIDOMIX が含まれている IPA/ACN(1:2、v/v) 125 μL を、各ウェルプレートに加えました(ダブルブランク試料を除く)。内部標準混合物は、重同位体(d7 ~ d9)で構成され、複数の脂質クラスをカバーしています。内部標準試料が含まれていない IPA/ACN(1:2、v/v)を使用して、ダブルブランク試料を調製しました。サンプルは、30 秒間ボルテックス混合した後、5 ℃ で 2 時間振とうしてインキュベートし、完全な除タンパクを確認しました。抽出したサンプルは、10 ℃、3000 g で 20 分間遠心分離してから、上清を LC-MS 分析用にトータルリカバリー UPLC バイアル(Waters、製品番号 186005669CV)に移しました。
LC 条件
|
LC システム: |
ACQUITY Premier I-Class フロースルーニードル(FTN) |
|
カラム: |
ACQUITY Premier UPLC BEH Amide 2.1 × 100 mm、1.7 µm、製品番号:186009505 |
|
カラム温度: |
45 ℃ |
|
流速: |
0.6 mL/分 |
|
移動相: |
95:5 アセトニトリル/水 + 10 mM 酢酸アンモニウム(A)および 50:50 アセトニトリル/水 + 10 mM 酢酸アンモニウム(B) |
|
グラジエント: |
2 分間で B を 0.1% から 20%、その後 3 分間で B を 20% から 80% に変更、その後 3 分間で再平衡化 |
|
分析時間: |
8 分 |
|
注入量: |
1 µL |
MS 条件
|
MS システム: |
Xevo TQ-XS |
|
イオン化モード: |
ESI(+/-) – (極性切り替え) |
|
キャピラリー電圧: |
2.8 kV(+) 1.9 kV (-) |
|
取り込みモード: |
MRM |
|
イオン源温度: |
120 ℃ |
|
脱溶媒温度: |
500 ℃ |
|
コーンガス流量: |
150 L/時間 |
|
脱溶媒流量: |
1,000 L/時間 |
|
ネブライザーガス: |
7 bar |
|
イオンガイドオフセット 1: |
3 V |
|
イオンガイドオフセット 2: |
0.3 V |
インフォマティクス
これらの分析法を作成するため、LC 条件、MS メソッド、および関連する TargetLynx 解析メソッド(保持時間および MRM トランジションを含む)が含まれている Waters ターゲットオミクス分析法ライブラリー(TOML)を使用しました。結果データは TargetLynx または Skyline(MacCoss Lab、University of Washington)のいずれかを用いて解析しました。
結果および考察
前立腺がんと診断された患者、さまざまな治療を受けている患者、健常被験者から採取した血清サンプルのターゲット脂質分析を、LipidQuan プラットホームを使用して実施しました。これらのサンプルは、前のセクションで説明したサンプル前処理メソッドを使用して LC-MS 分析用に調製しました。LipidQuan メソッドパッケージは、Waters ターゲットオミクス分析法ライブラリー(TOML、www.waters.com/targetedomics)からダウンロード し、MassLynx にインポートしました。
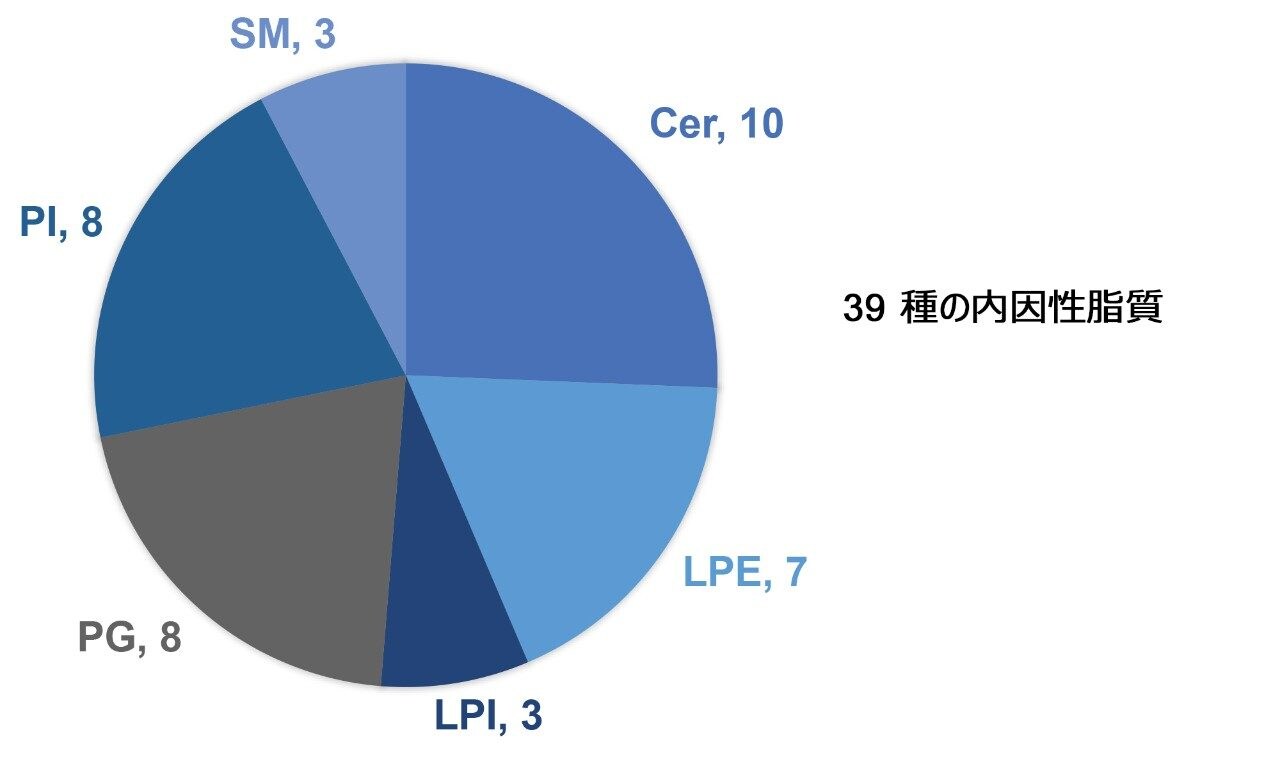
このメソッドパッケージに含まれている Quanpedia メソッドファイルには、2000 を超える脂質に対するクロマトグラフィー設定と MRM トランジションが含まれていました。Quanpedia ファイルを使用して事前に入力されたメソッドファイルをインポートすることで、LC-MS/MS 設定の手動入力や転記ミスを回避しました。この試験では、対象を定めた極性切り替え LC-MS メソッドを生成し、Quanpedia ライブラリーを使用して、Cer、LPE、LPI、PG、PI、SM のクラス(図 1)にわたる 39 種の内因性脂質をモニターしました。このメソッドにより、両方の極性モードで 4 種の LPE 分子種が測定および定量されます。
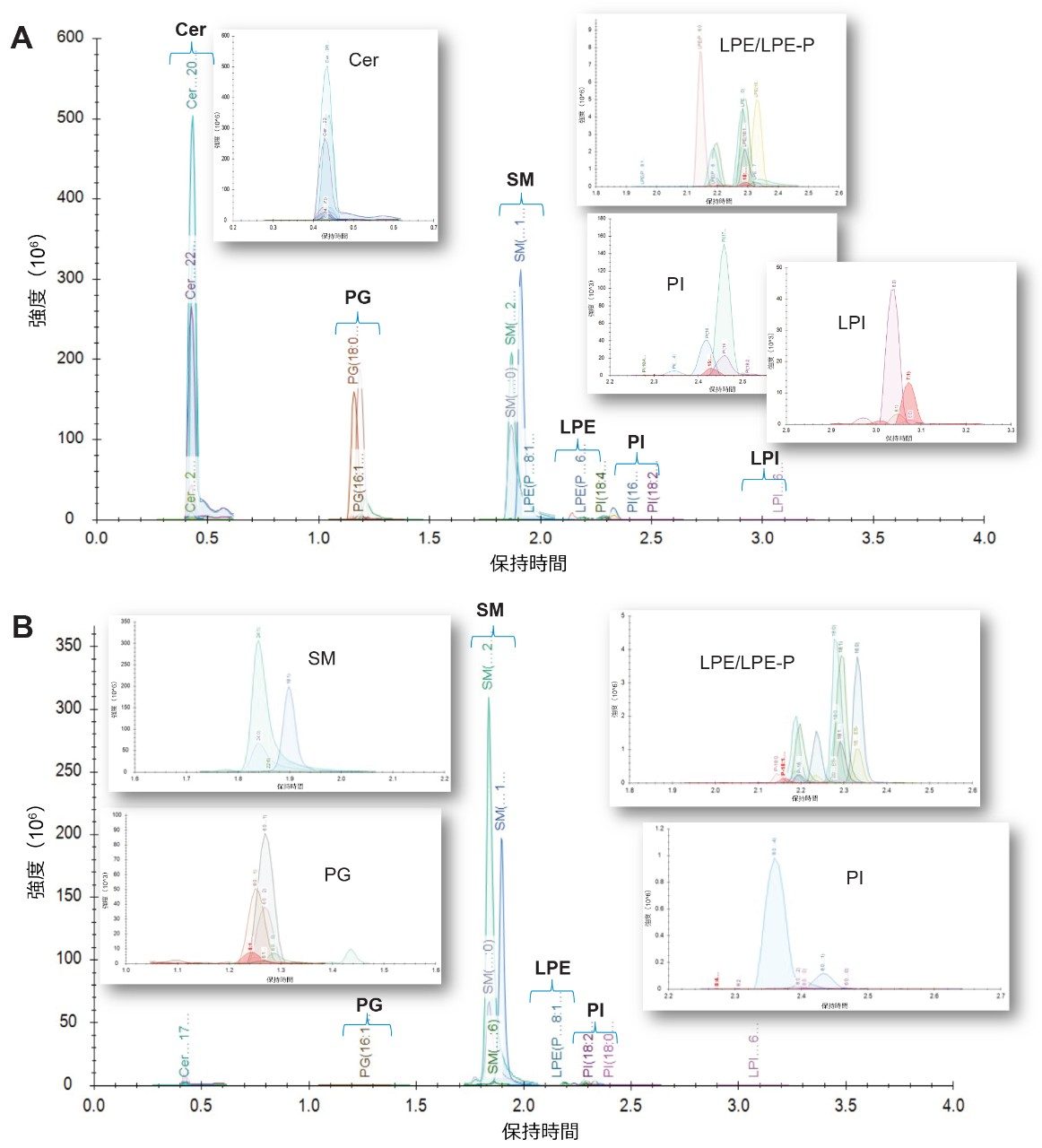
可能な場合、主要な分析種をカバーする 32 種類の標準試料の溶液、および対象のクラスの他の溶液を使用して、脂質の同定結果、保持時間、MRM トランジションをメソッド開発時に確認しました。クロマトグラムの例が図 2A に示されています。 プールしたサンプルの繰り返しをランダンに注入した後、3 濃度レベルの奇数鎖標準試料(SR および NIST サンプル)をスパイクした QC サンプルを注入しました。検量線サンプルを、分析開始時および分析終了時に分析しました。試験サンプルの代表的なクロマトグラムが図 2B に示されています。
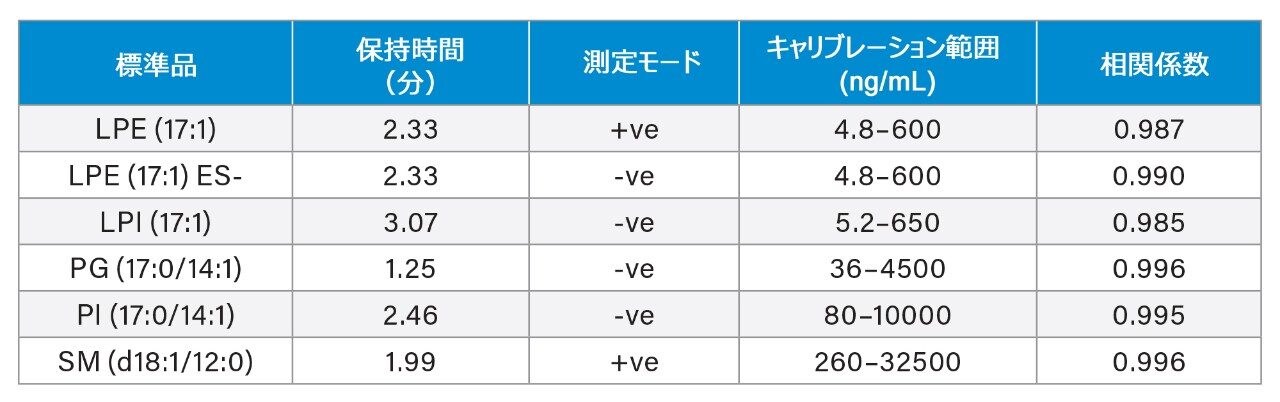
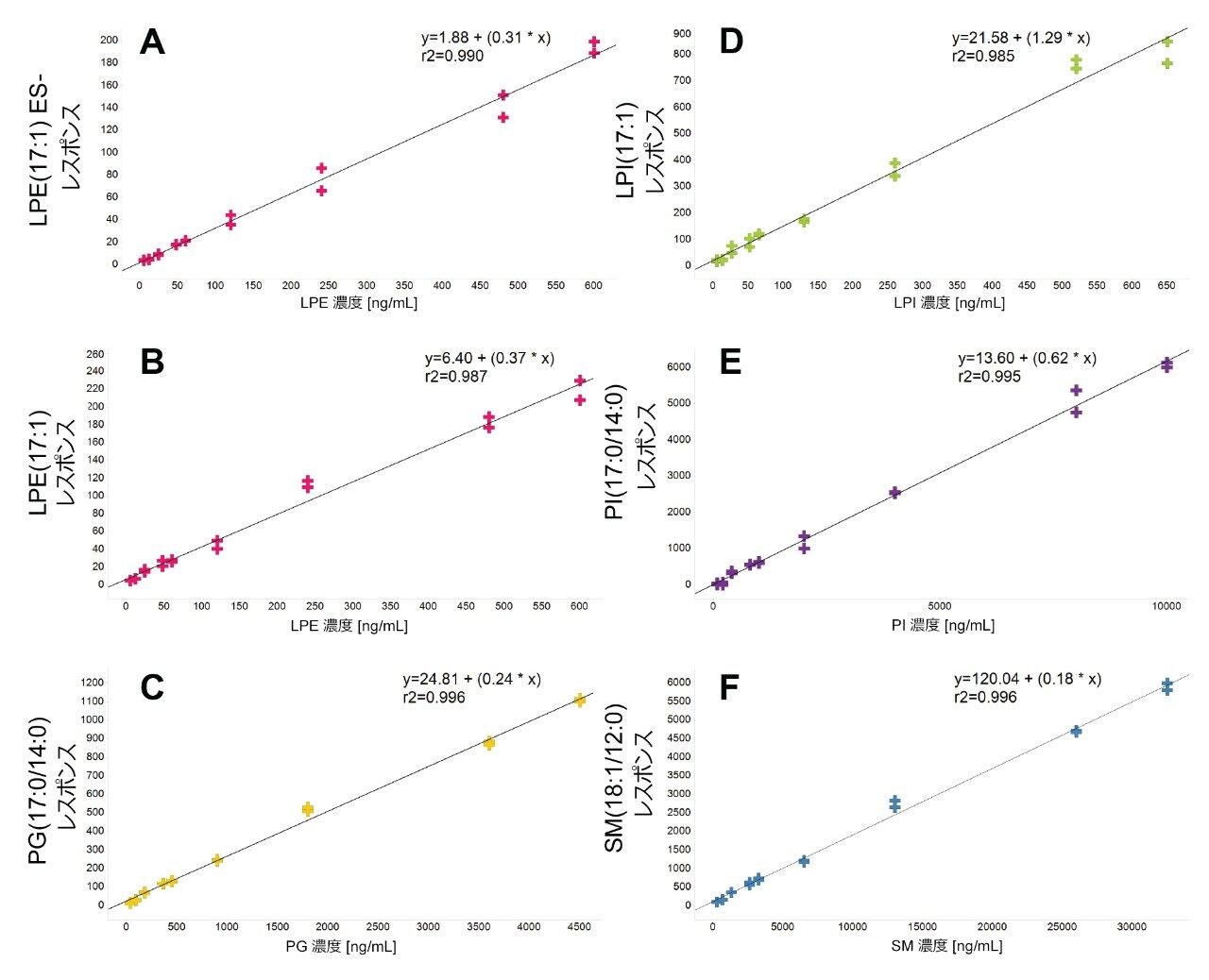
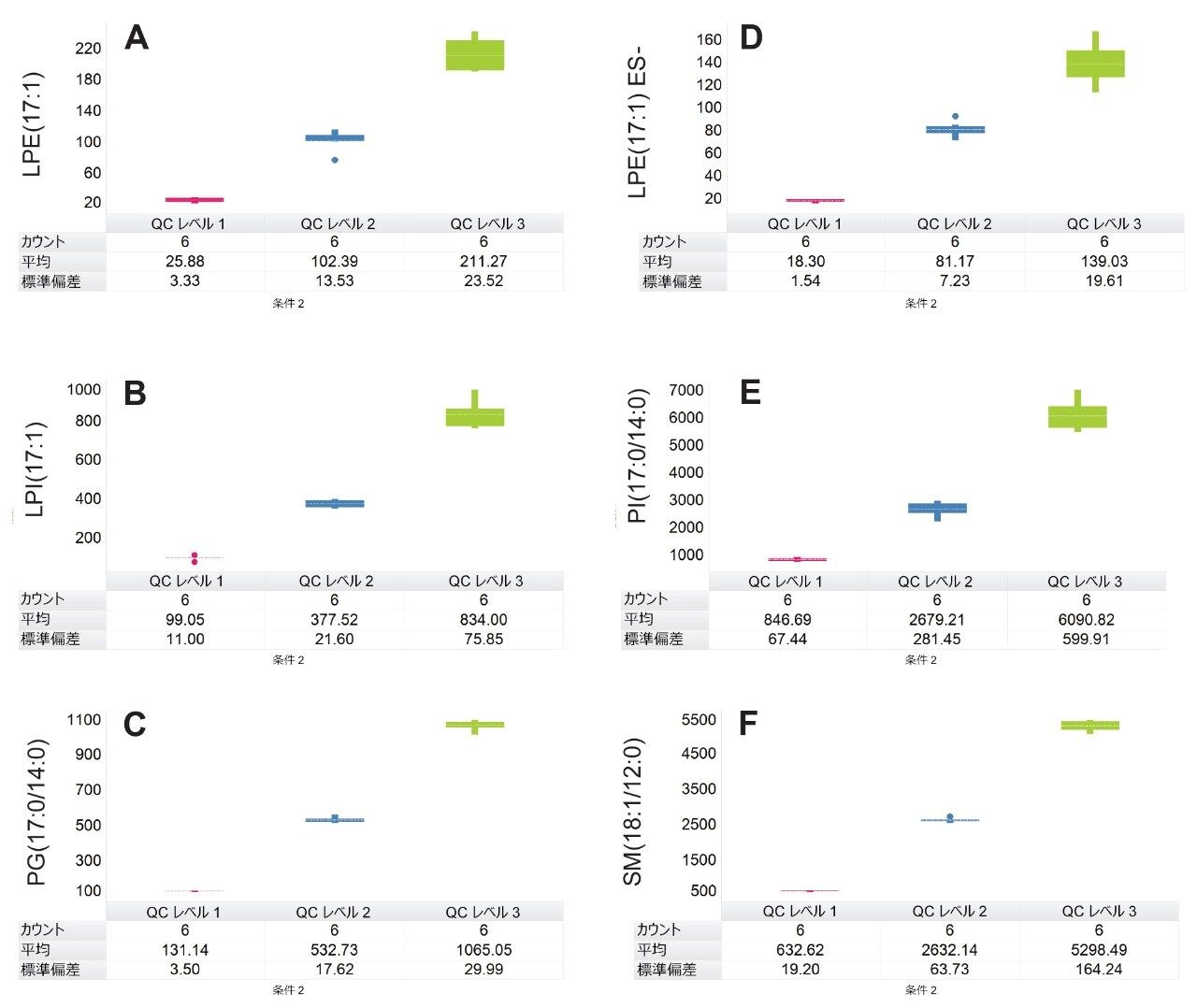
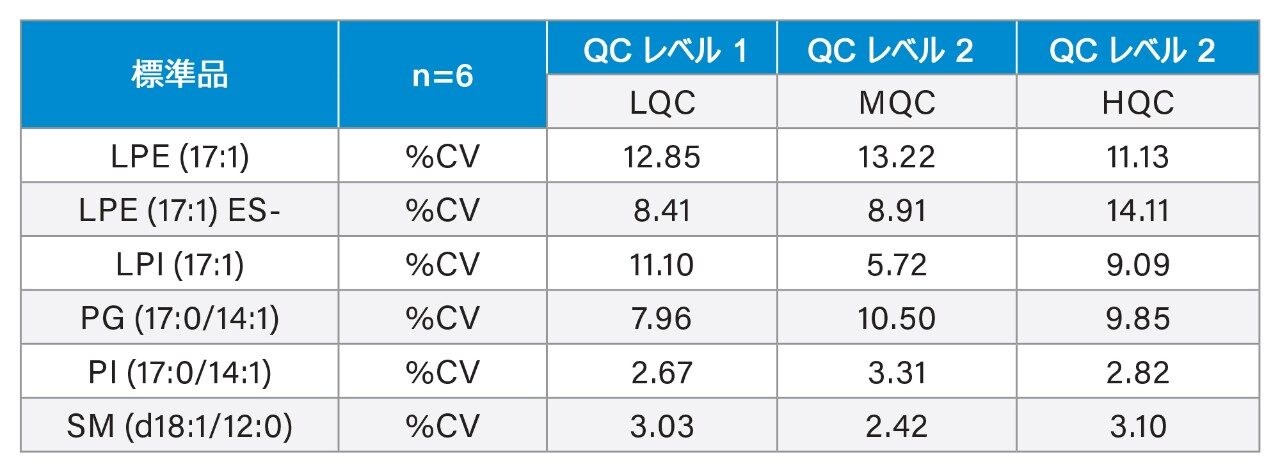
定量は、抽出前に既知濃度の標準試料をスパイクした血漿の検量線を用いて、行いました。キャリブラントおよび内因性脂質の面積レスポンスは、内部標準試料として使用した重水素化 SIL のレスポンスに対してノーマライズしました。奇数鎖脂質標準試料を使用して、表 1 に記載されている範囲にわたるさまざまな対象脂質クラスについて、濃度に対する直線性レスポンスを評価しました。通常の R2 値の範囲は 0.985 ~ 0.996 であり、図 3 に検量線の例が示されています。奇数鎖脂質標準試料を 3 濃度でスパイクした QC サンプルを用いて、分析法の精度をモニターしました。これらの QC サンプルの箱ひげ図が図 4 に示されています。表 2 の結果に、取り込み全体にわたる変動係数(CV)はすべて 15% 未満であることが示されています。これらの結果から、分析の過程にわたる対象の内因性脂質の測定の、正確度および精度に対する、データの品質に対する確信が得られます。
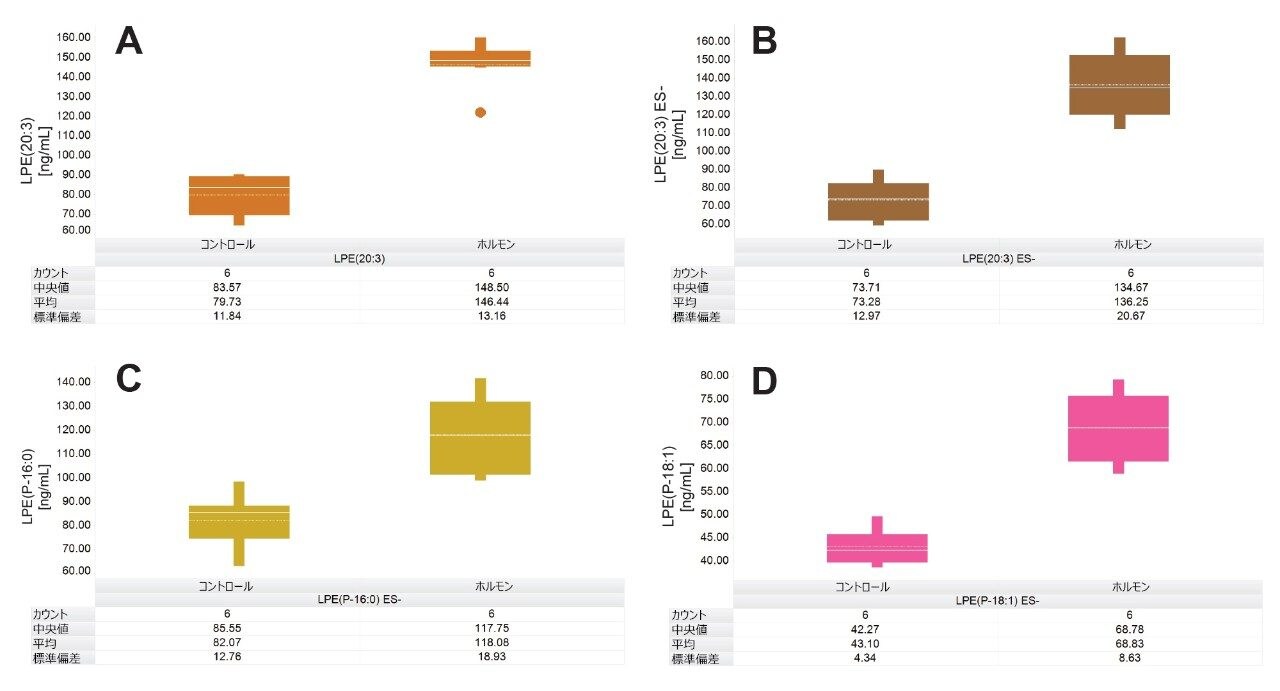
脂質分析により、SM、Cer、LPE 分子種などの、多くの重要な分析種が強調されました。たとえば、LPE(20:3)、LPE(P-16:0)、LPE(P-18:1) は、コントロール(PCa と診断された患者)およびホルモン療法を受けている患者に分類された患者を区別するのに主要な脂質でした。これらの LPE 分子種の計算濃度レベルを比較する箱ひげ図が図 5 に示されています。LPE(20:3) の濃度を、ポジティブイオンモードとネガティブイオンモード(図 5A および 5B)の両方で測定した結果、コントロール(PCa)の患者に関連する濃度は、ポジティブモードとネガティブモードでそれぞれ 79.7 ng/mL および 73.3 ng/mL と定量されました。これに比べて、ホルモン療法患者のプールサンプルでの LPE(20:3) の濃度は、ポジティブモードで 146.5 ng/mL、ネガティブモードで 136.3 ng/mL と報告されました。LPE(P-16:0) および LPE(P-18:1) はネガティブモードでのみ測定しましたが、この場合もホルモン治療群の方が多く発現していることが示されています。
結論
- 迅速で定量的なリピドミクス分析法(LipidQuan)が開発され、前立腺がん関連の試験での血清の分析に導入されました。
- この分析法により、3 桁の大きさを超える直線性と、ヒト血漿中の内因性レベルの脂質の分析が可能な感度があることが得られました。
- HILIC ベースのクロマトグラフィーを使用し、脂質クラス別に溶出することで、異性体および同重体による干渉の可能性を低減できました。また、定量に必要なキャリブラントおよび内部標準試料の数を減らすことで、コスト削減を達成しました。
- この分析法により、統合リピドミクスおよびプロテオミクスの試験によって同定される主要な脂質分子種を定量できます。
- LPE、Cer、SM は、コントロールサンプルと比較して前立腺がんサンプルでより多く発現していることがわかりました。
参考文献
- Worldwide cancer statistics | Cancer Research UK.Available at: https://www.cancerresearchuk.org/health-professional/cancer-statistics/worldwide-cancer#heading-Zero.(Accessed: 17th July 2021).
- Drabovich, A. P. et al.マルチオミクスバイオマーカーのパイプラインにより、前立腺癌患者の精液血漿中のタンパク質-グルタミンγ-グルタミルトランスフェラーゼ4濃度の上昇が明らかになる *[S]。 Mol.Cell.Proteomics 18, 1807–1823, 2019.
- Lloyd-Price, J. et al.Multi-Omics of the Gut Microbial Ecosystem in Inflammatory Bowel Diseases.Nat.2019 5697758 569, 655–662, 2019.
- Zhou, X., Mao, J., Ai, J., Deng, Y., Roth, M.R., Pound, C., Henegar, J., Welti, R., Bigler, S.A., Identification of Plasma Lipid Biomarkers for Prostate Cancer by Lipidomics and Bioinformatics, PLoS One, vol.7, no.11, 2012.
- Perrotti.F., Rosa.C., Cicalini.I., Sacchetta.P., Del Boccio., P., Genovesi., D., Pieragostino.D., Advances in Lipidomics for Cancer Biomarkers Discovery, Int.J. Mol.Sci., vol.17, no.12, 2016.
- Isaac, G., Munjoma, N., Gethings, L., Plumb, R., LipidQuan for Comprehensive and High-Throughput HILIC-Based LC-MS/MS Targeted Lipid Quantitation, Waters Application Note: 720006402EN, 2018.
- Chong, J., Wishart, D.S., Xia, J. Using MetaboAnalyst 4.0 for Comprehensive and Integrative Metabolomics Data Analysis.Current Protocols in Bioinformatics 68, e86 (128 pages), 2019.
- Koivusalo, M., Haimi, P., Heikinheimo, L., Kostiainen, R., Somerharju, P. Quantitative Determination of Phospholipid Compositions by ESI-MS: Effects of Acyl Chain Length, Unsaturation, and Lipid Concentration on Instrument Response. Journal of Lipid Research, 42(4), 663–72.Retrieved from http://www.ncbi.nlm.nih.gov/pubmed/11290839, 2001.
謝辞
Ammara Muazzam, Anthony D. Whetton - Faculty of Biology, Medicine and Health, University of Manchester, Manchester, United Kingdom.
Olivier Cexus, Hardev Pandha, Paul A. Townsend, Nophar Geifman - Faculty of Health and Medical Sciences, University of Surrey, Guildford, Surrey, United Kingdom.
Fowz Azhar - Salford Royal NHS Foundation Trust, Salford Royal Hospital, Salford, Manchester, United Kingdom
Nyasha Munjoma, Chris Hughes, Giorgis Isaac, Lee A. Gethings, Robert S. Plumb - Waters Corporation
720007419JA、2021 年 11 月