臨床研究のための血漿中抗生物質の分析
研究目的のみに使用してください。診断用には使用できません。
要約
このアプリケーションノートでは、内部標準を含む血漿サンプルの除タンパクを使用する臨床研究分析法について説明します。
アプリケーションのメリット
- 少量でシンプルなサンプル前処理
- 幅広い極性にまたがる 16 種類の抗生物質を定量するための単一の前処理メソッド
はじめに
挙動がまだよく理解されていない抗生物質を投与する際の薬物動態学的および薬力学的効果を理解する上で、単一サンプル中の多数の抗生物質を分析するための信頼性の高い臨床研究法が、重要な役割を果たす可能性があります。
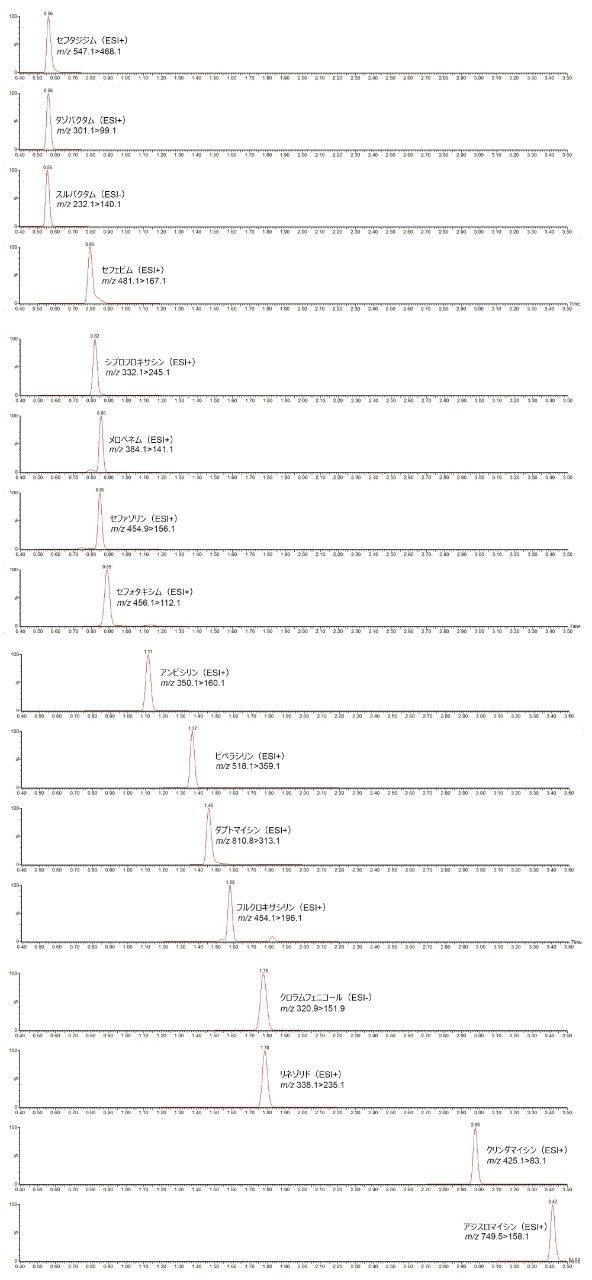
ここでは、内部標準を含む血漿サンプルの除タンパクを使用する臨床研究分析法について説明します。クロマトグラフィー溶出は 5 分以内に完了し、Waters ACQUITY UPLC I-Class 上で Waters ACQUITY UPLC BEH C18 カラムを用いてパネルを 2 回分析した後、極性切り替えを利用して Xevo TQD 質量分析計で検出を行いました(図 1)。

実験方法
サンプル前処理
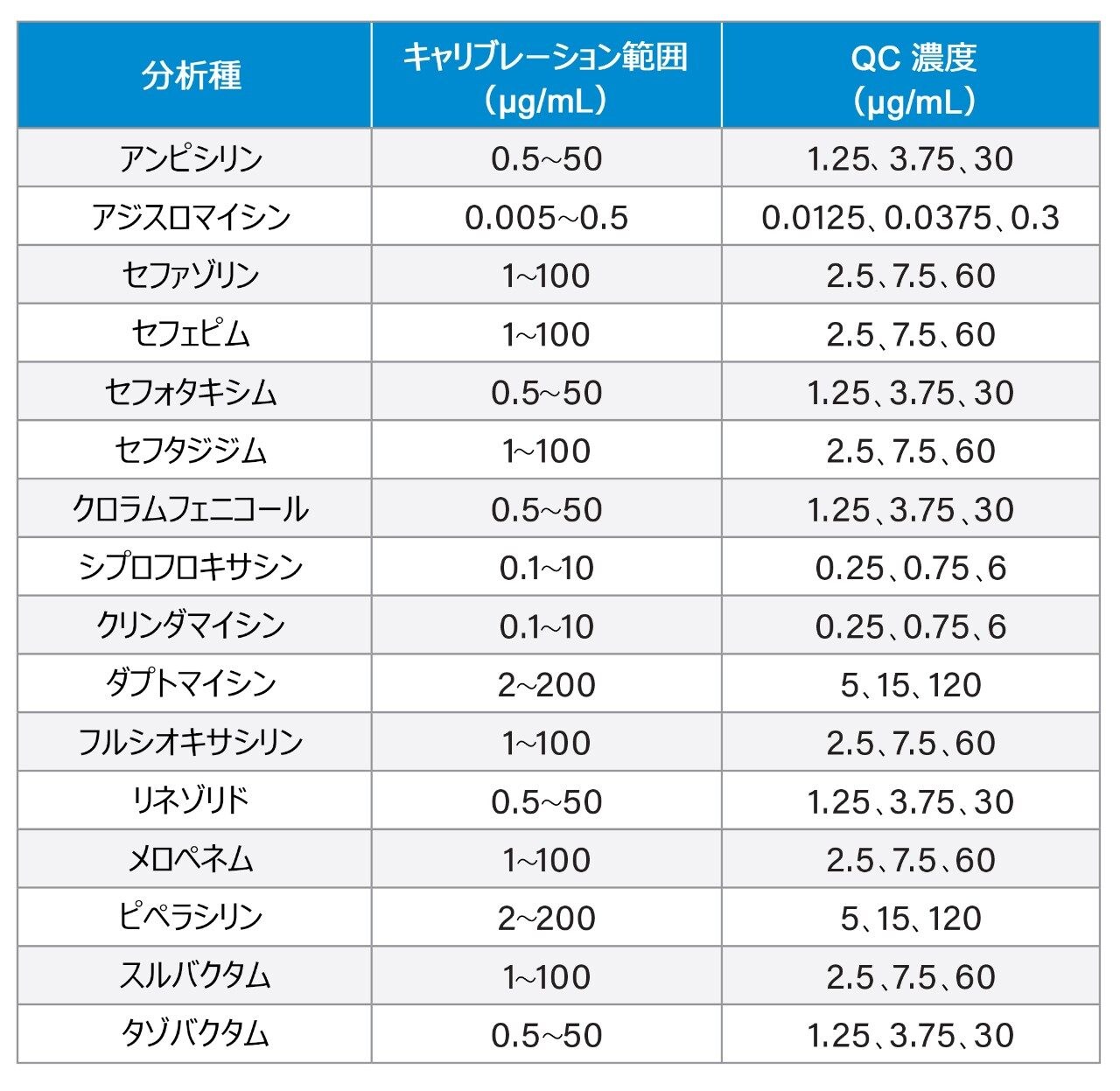
血漿キャリブレーターと品質管理物質は、BioIVT(英国、ウェストサセックス)から供給されたプールしたヒト血漿を使用して社内で調製しました。濃縮原液は、Cambridge Bioscience(英国、ケンブリッジシャー)、Fisher(英国、ラフバラー)、Merck Life Science(英国、ドーセット)、Toronto Research Chemicals(カナダ、オンタリオ)から供給された認証済み粉末および溶液から調製しました。安定標識内部標準は、Alsachim(フランス、ストラスブール)、Cambridge Bioscience(英国、ケンブリッジシャー)、Toronto Research Chemicals(カナダ、オンタリオ)から提供を受けました。キャリブレーション濃度と QC 濃度(低、中、高濃度)の詳細を表 1 に示します。
サンプル抽出
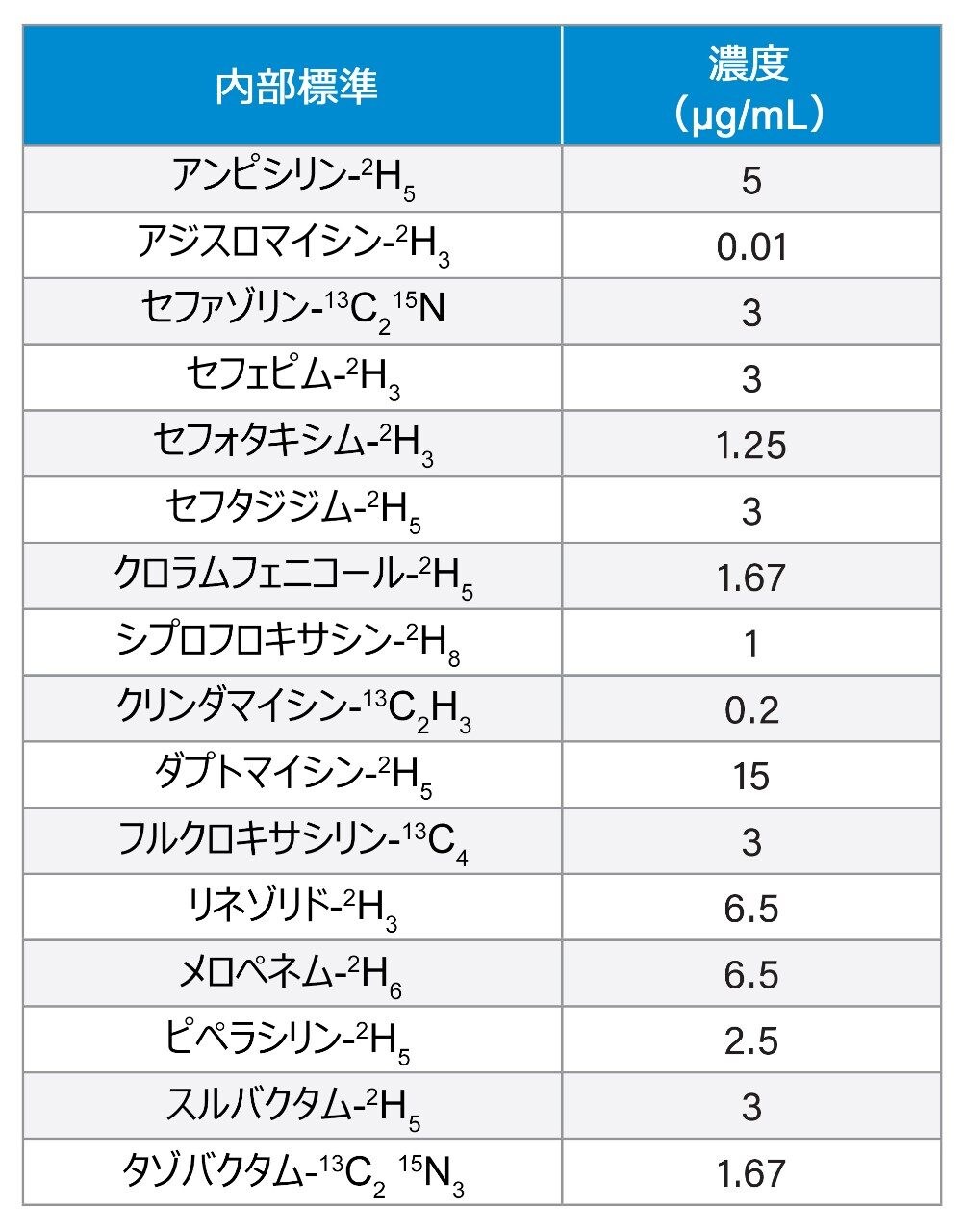
微量遠心チューブ内の 50 µL のサンプルに、150 µL の内部標準メタノール溶液を加えました。内部標準の濃度は表 2 に示します。
マルチチューブボルテックスミキサーにチューブを配置し、2,500 rpm で 30 秒間ボルテックス混合してから、16,100 g で 2 分間遠心分離しました。上清 100 µL を 1 mL の 96 ウェルプレートに移し、1% ギ酸を含む水を 300 µL 加えました。次に、プレートを 4,696 g で 2 分間遠心分離してから分析しました。抽出物は 2 回(セット 1 およびセット 2)分析しました。抽出物が不安定であるため、メロペネムのサンプルを最初に分析する必要があります。分析は 8 時間以内に完了することを推奨します。
UPLC 条件
|
システム: |
ACQUITY UPLC I-Class、FTN 搭載 |
|
ニードル: |
30 μL |
|
カラム: |
ACQUITY UPLC BEH C18 カラム、1.7 μm、2.1 × 100 mm(製品番号:186002352) |
|
移動相 A: |
水 + 0.1% アンモニア |
|
移動相 B: |
メタノール |
|
ニードル洗浄溶媒: |
80% メタノール水溶液 + 0.1% ギ酸 |
|
パージ溶媒: |
10% メタノール水溶液 |
|
シール洗浄溶媒: |
20% メタノール水溶液 |
|
カラム温度: |
60 ℃(プレカラムヒーターアクティブ) |
|
注入量: |
2 µL*/10 µL** |
|
流速: |
0.50 mL/分 |
|
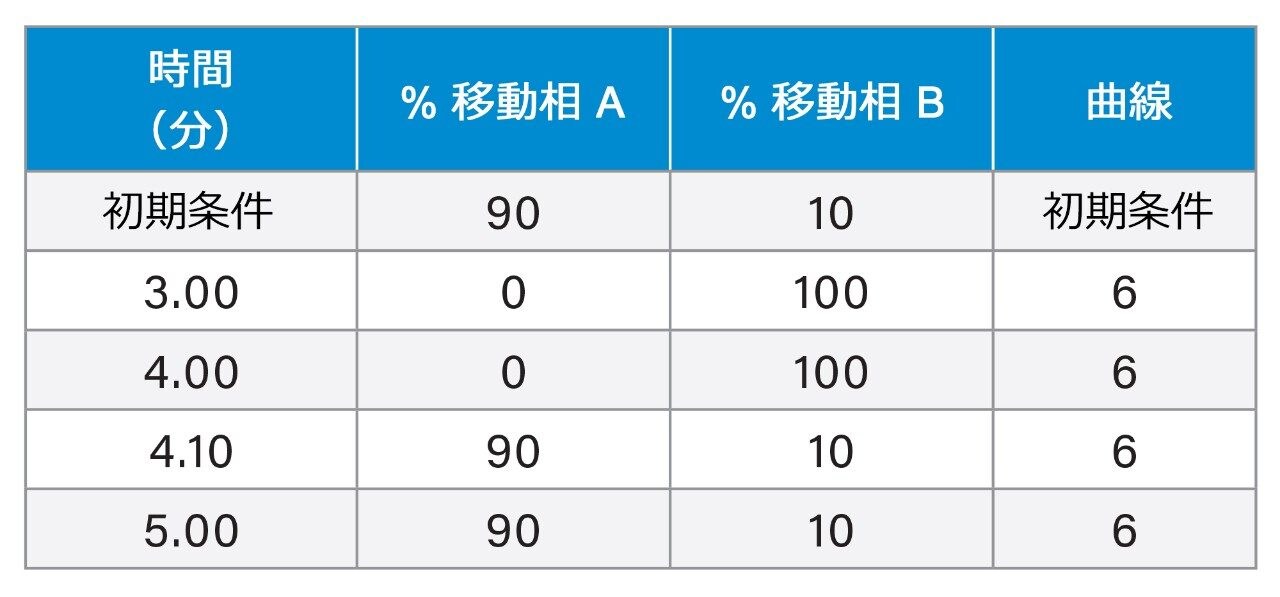
グラジエント溶出: |
表 3 |
|
分析時間: |
5.0 分(注入間時間 5.5 分) |
*セット 1:セファゾリン、セフェピム、シプロフロキサシン、クリンダマイシン、フルクロキサシリン、リネゾリド、メロペネム、ピペラシリン。
**セット 2:アンピシリン、アジスロマイシン、セフォタキシム、セフタジジム、クロラムフェニコール、ダプトマイシン、スルバクタム、タゾバクタム。
Gradient Elution
MS 条件
|
システム: |
Xevo TQD |
|
|
分解能: |
MS1(0.7 FWHM)、MS2(0.7 FWHM) |
|
|
取り込みモード: |
マルチプルリアクションモニタリング(MRM)(詳細は表 4 を参照) |
|
|
極性: |
ESI ポジティブイオン化/ESI ネガティブイオン化(ESI +/ESI -) |
|
|
キャピラリー電圧: |
3.0 kV(ESI+)/3.0(ESI-) |
|
|
イオン源温度: |
150 ℃ |
|
|
脱溶媒温度: |
500 ℃ |
|
|
コーンガス: |
100 L/時間 |
|
|
スキャン間遅延: |
0.003 秒 |
|
|
極性/モード切り替えのスキャン間遅延: |
0.020 秒 |
|
|
チャンネル間遅延: |
0.003 秒 |
データ管理
|
ソフトウェア: |
MassLynx v4.2(TargetLynx XS アプリケーションマネージャー搭載) |
Method Conditions
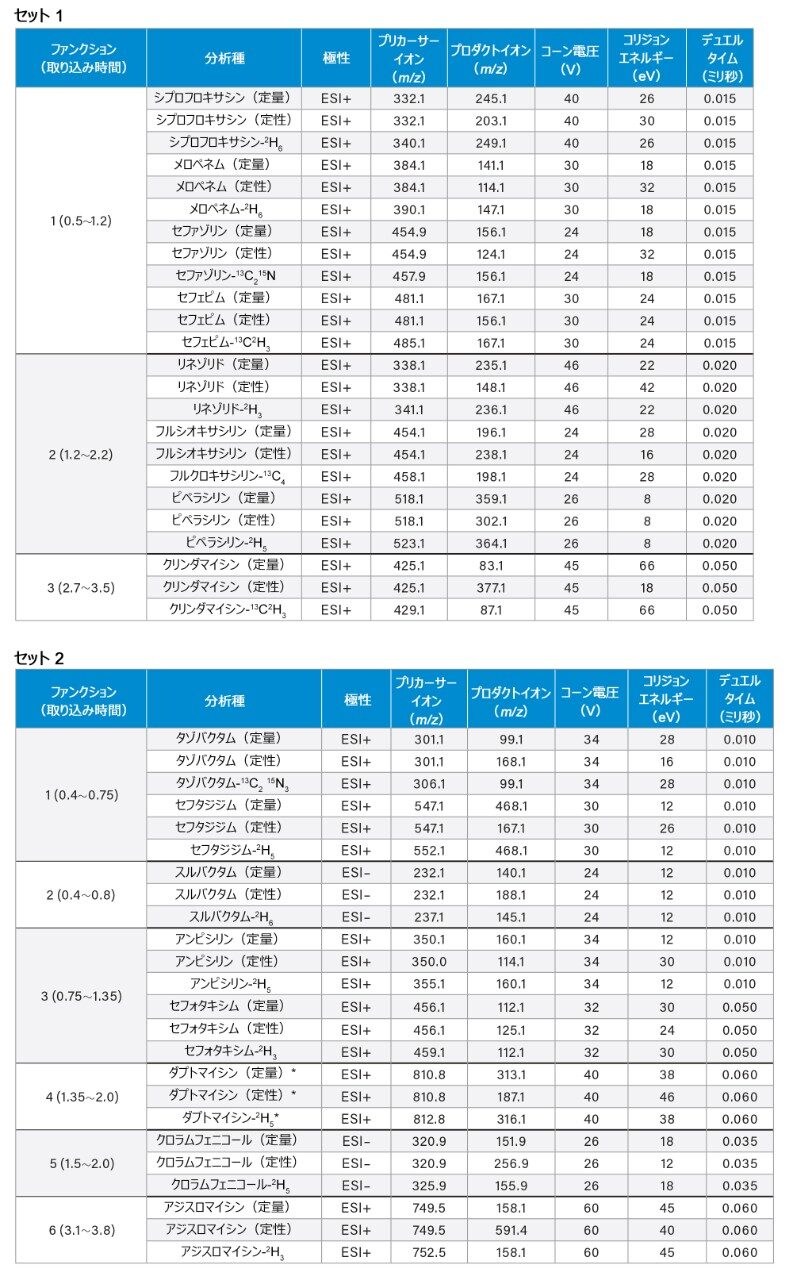
*注:ダプトマイシンの分子量は 1,620.7 g/mol で、2 価 [M2H]2+ イオンが最も多く存在します。
結果および考察
表 1 に示す各分析種に対応する最高キャリブレーター濃度の抗生物質を含む血漿サンプルを分析した後に、システムキャリーオーバーは認められませんでした。
図 2 に、16 種類の抗生物質の分析のクロマトグラムの例を示します。
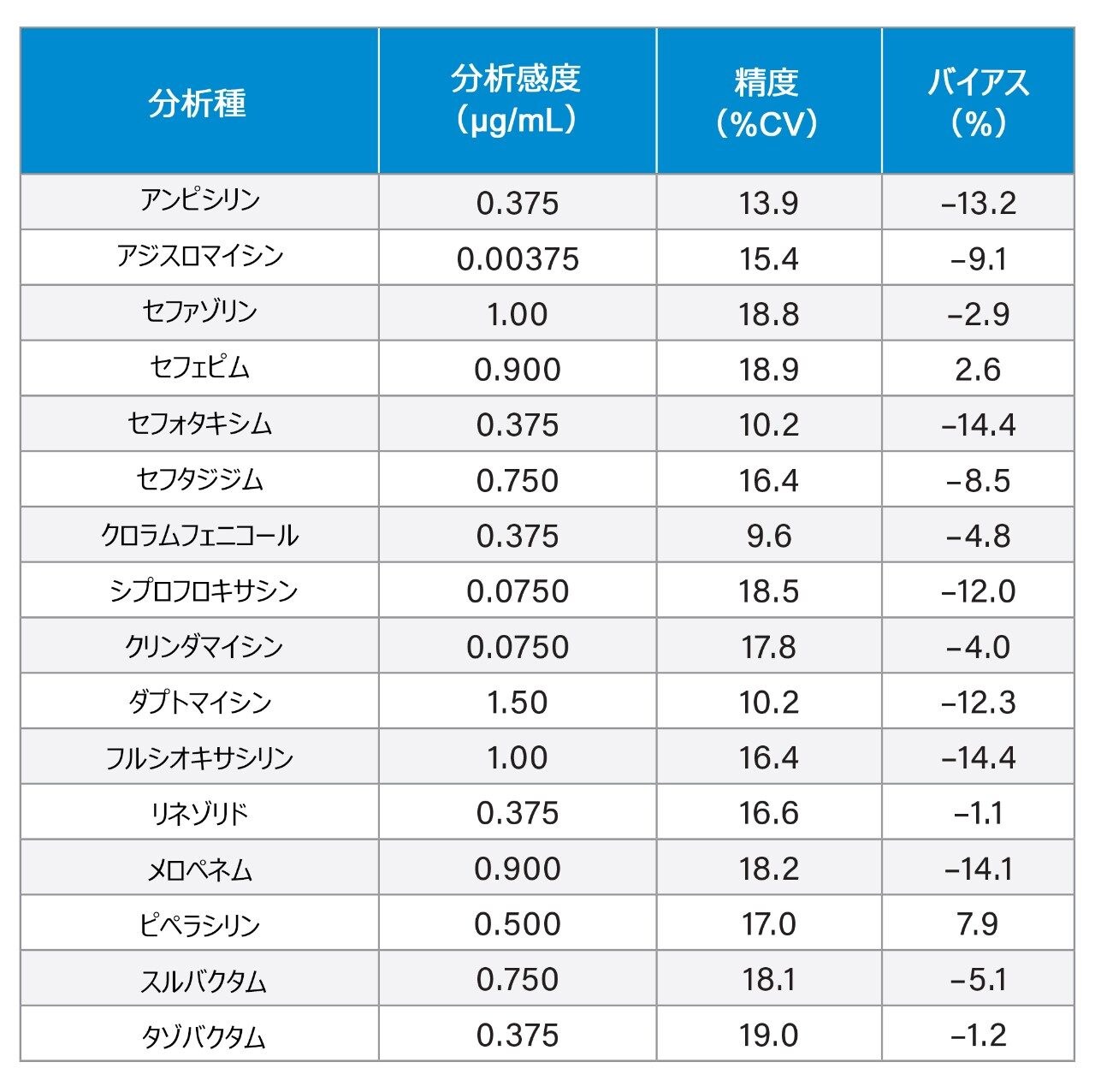
5 日間にわたって血漿中に調製した低濃度サンプルを 10 回繰り返し抽出・定量することで、分析感度を評価しました(n = 50)。調査の結果、この分析法では、表 5 に示す濃度で正確な定量(≤ 20% CV、≤15% バイアス)が可能であることが示されました。
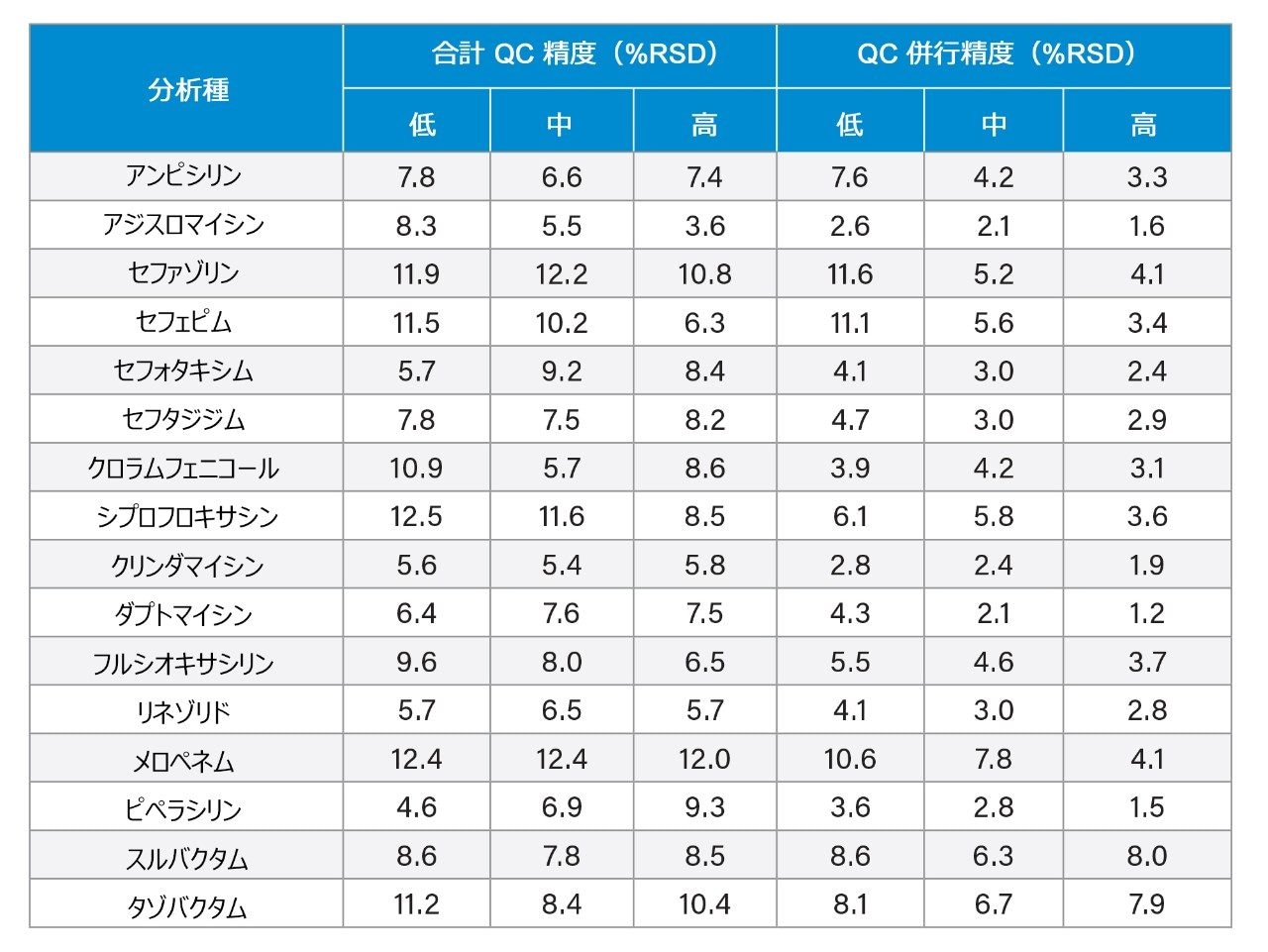
総合精度は、連続しない 5 日間にわたって 3 濃度の血漿プールを 5 回繰り返しで抽出・定量することによって決定しました(n = 25)。各レベルで QC 試料を 5 回繰り返し分析することによって再現性を評価しました。表 6 にこれらの実験の結果を示しています。評価した 3 濃度での総合精度と再現性は ≤12.5% RSD でした。
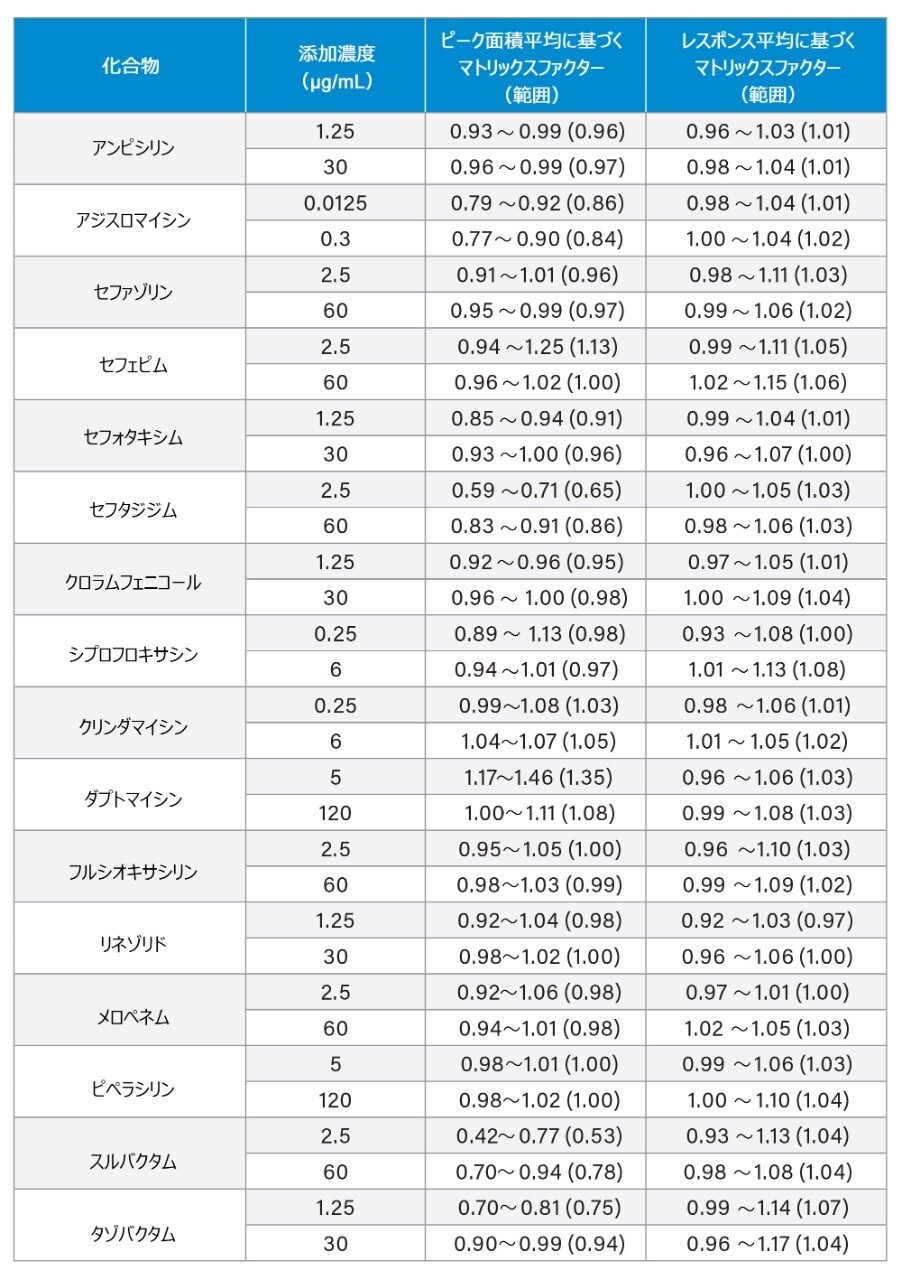
この分析法では、低濃度のプールと高濃度のプールを一定の範囲にわたって既知の比率で混合した場合、セフェピム、ダプトマイシン、ピペラシリン、スルバクタムについて表 1 に示した範囲にわたって直線性があることが分かりました。アンピシリン、アジスロマイシン、セファゾリン、セフォタキシム、セフタジジム、クロラムフェニコール、シプロフロキサシン、クリンダマイシン、フルクロキサシリン、リネゾリド、メロペネムは、表 1 に示す範囲にわたって二次適合と判定されました。
マトリックス効果は、血漿中の低 QC 濃度および高 QC 濃度(n = 6)で、同等の濃度になるように添加した抽出溶媒サンプルの割合として評価しました。分析種対内部標準のレスポンス比を用いる計算を、内部標準によるシグナルの増強または抑制の補正の指標としました(表 7)。
高濃度で添加した内因性化合物(アルブミン、ビリルビン、コレステロール、クレアチニン、トリグリセリド、尿酸)からの潜在的な干渉を、低濃度および高濃度のプールした血漿サンプル(QC1 濃度および QC3 濃度)からの回収率を決定することによって評価しました(n=3)。回収率は 85.7 ~ 115.5% の範囲でした。
結論
この分析法は臨床研究のために開発されたものであり、単一のサンプル前処理手順と 2 回の分析を使用して、サンプル前処理の性能および血漿中の 16 種類の抗生物質を定量する UPLC-MS/MS システムの性能が実証されています。この分析法では、試験範囲にわたってシステムキャリーオーバーが認められず、選択した安定標識内部標準を用いることで、各分析種について認められたマトリックス効果が非常に効果的に補正されました。
720007388JA、2021 年 10 月