
このアプリケーションノートでは、ペプチド医薬品の簡単かつ高感度で、頑健な LC-MS/MS 同時定量法の開発に焦点を当てます。
医薬品の安全性を確保するため、医薬品メーカーは製造工程を慎重にコントロールする必要があります。これには、医薬品有効成分(API)、不純物、および多くの場合その前の製造工程からの二次汚染の結果として発生するその他の可能性のある汚染物質のモニタリングが含まれます。可能性のある二次汚染を最小限に抑えるため、製造工程後の装置のクリーニング手順が完全に採用されます。
実際、クリーニングおよびクリーニングのバリデーションの 2 つの作業には、バッチ製造後ごとに二次汚染が確実に発生しないようにすることによる、患者に対するリスクを防止する最大の機会があります。クリーニングのバリデーションは、システムまたは装置の一部を、事前定義された許容限度または確立された許容残留レベル(ARL)まで一貫してクリーニングできることの、高度な保証付きで文書化された証拠です1,2。 効果のないクリーニングは、以前の製品バッチ、洗浄剤、またはその他の異物に起因する粗悪製品の原因になる可能性があります。そのため、クリーニングプロセスをバリデーションする主な目的は、現行の医薬品製造管理および品質管理基準(CGMP)による規制、その他の連邦規制やその他の標準規制に準拠しながら、製造された医薬品の安全性、有効性、または品質を確保することです3,4。
規制査察時に医薬品メーカーは特に、反応チャンバーおよび多用途精製システムのクリーニングおよびクリーニングのバリデーションに、焦点を合わせます。医薬品製造では、最大限の安全性を確保することが優先されますが、製造のダウンタイムを最小限に抑えることも、効率を維持し、装置のアイドル時間による経済的な悪影響を回避するために重要です。これにより、医薬品の ARL やその他の疑わしい汚染物質を検出するために、迅速で高感度で選択性が高く、頑健な分析クリーニングメソッドを素早く開発することが求められています。紫外線(UV)検出と組み合わせた高性能液体クロマトグラフィー(HPLC)は ARL 測定の最も一般的な分析ツールですが、感度と選択性がより高い検出を達成できる分析法に対するニーズが増大しています5-8。
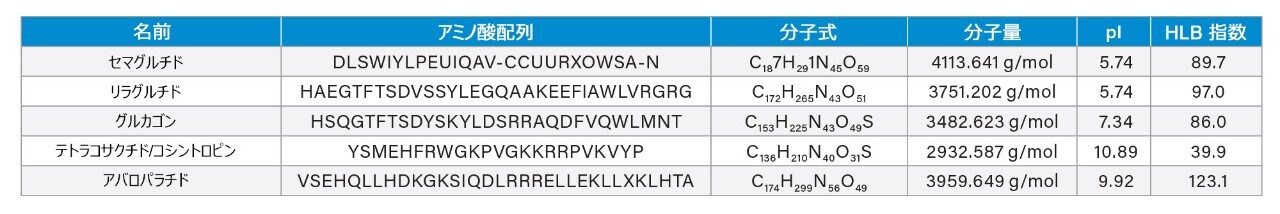
実際、ペプチドのように低用量で高い効能を持つ生物学的治療薬の製造の増加に伴い、ng/mL レベルの検出が可能なクリーニングバリデーションメソッドが、多くの場合に必要です。分析法開発時間が短いこと、および選択的マルチプルリアクションモニタリング(MRM)フラグメントによる高い特異性により、生物学的治療薬の液体クロマトグラフィー質量分析(LC-MS)ARL 定量が増加しています。ただし、バイオ医薬品の研究では、低分子の場合より多くの分析課題が存在します。バイオ医薬品はサイズが大きく、感度が低く、MS/MS フラグメンテーションが不十分であること、および主に非特異的結合(NSB)やキャリーオーバーの問題によって、吸着による損失が大きくなる傾向があることが原因です。これらの課題により、分析法開発に長時間かかり、定量の理想限界に届かず、分析法の頑健性の悪化につながります。今回説明する研究では、サンプル前処理戦略を使用してペプチドの溶解性を維持し、LC-MS 対応の高性能表面のサンプル保存バイアルを使用することで、NSB によるペプチド損失を軽減します。さらにこの分析法では、5 種類のペプチド(セマグルチド、リラグルチド、グルカゴン、テトラコサクチド、アバロパラチド)を同時に高感度で正確に定量するために、高感度のタンデム四重極型質量分析計と組み合わせた低拡散 UHPLC および逆相 BEH フェニルカラムケミストリーによるクロマトグラフィー分離に焦点が当てられています。これらのペプチドのアミノ酸配列、分子式、分子量、等電点(pI)、HLB 指数などの生理化学的特性が表 1 に記載されています。上記の分析法では、5 µL の前処理済みサンプルの注入で、1 ng/mL の定量下限値 (LLOQ) が達成されます。
5 種類のペプチド(表 1)それぞれのストック溶液 1,000 µg/mL を 100% メタノール中に調製しました。中間混合ストック溶液(10 µg/mL)は、1,000 µg/mL の個々のペプチド溶液の均等な一定分量を混合し、2% ギ酸含有 50:50 水:アセトニトリルで希釈して、調製しました。1 ~ 1,000 ng/mL のサンプルを、上記と同じ希釈液で連続希釈して調製しました。すべての検量線用標準試料およびブランク(スパイクなし)サンプルは n=2 で調製しました。移動相添加剤として、MS グレードのジフルオロ酢酸(DFA)とギ酸(FA)を使用しました。
|
LC-MS ソフトウェア: |
MassLynx v4.2 |
|
定量ソフトウェア: |
TargetLynx |
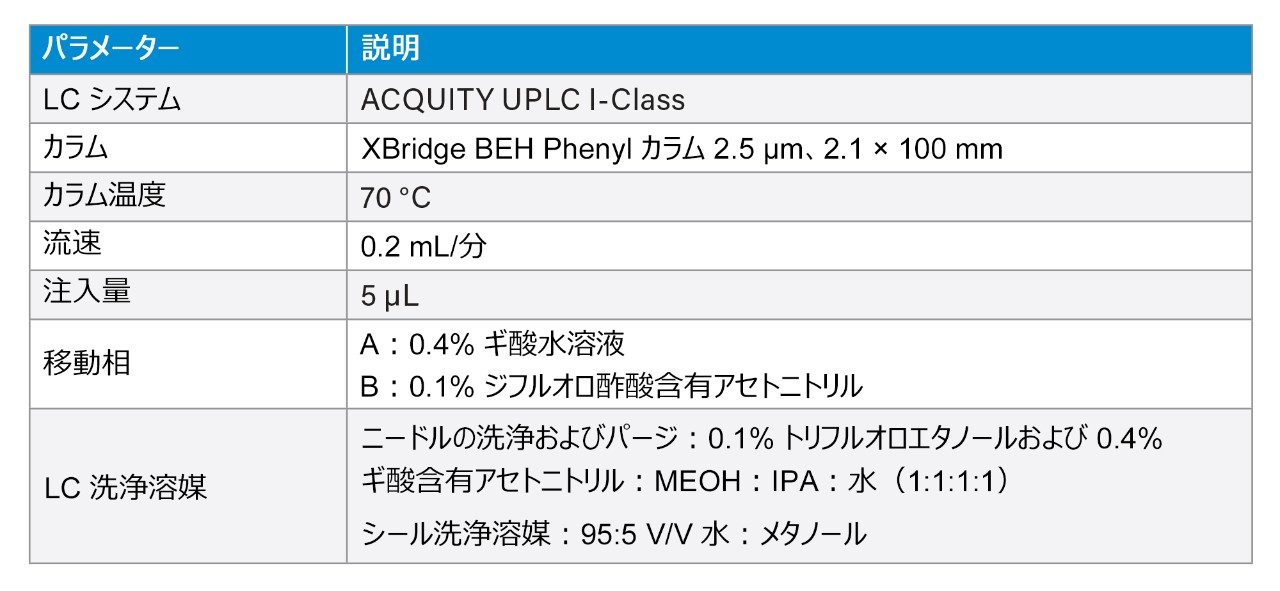
サンプル前処理、LC メソッド、MS メソッドのすべてのステップをメソッド開発時に最適化し、溶解性、NSB、ピークテーリング、キャリーオーバーの問題を解決しました。
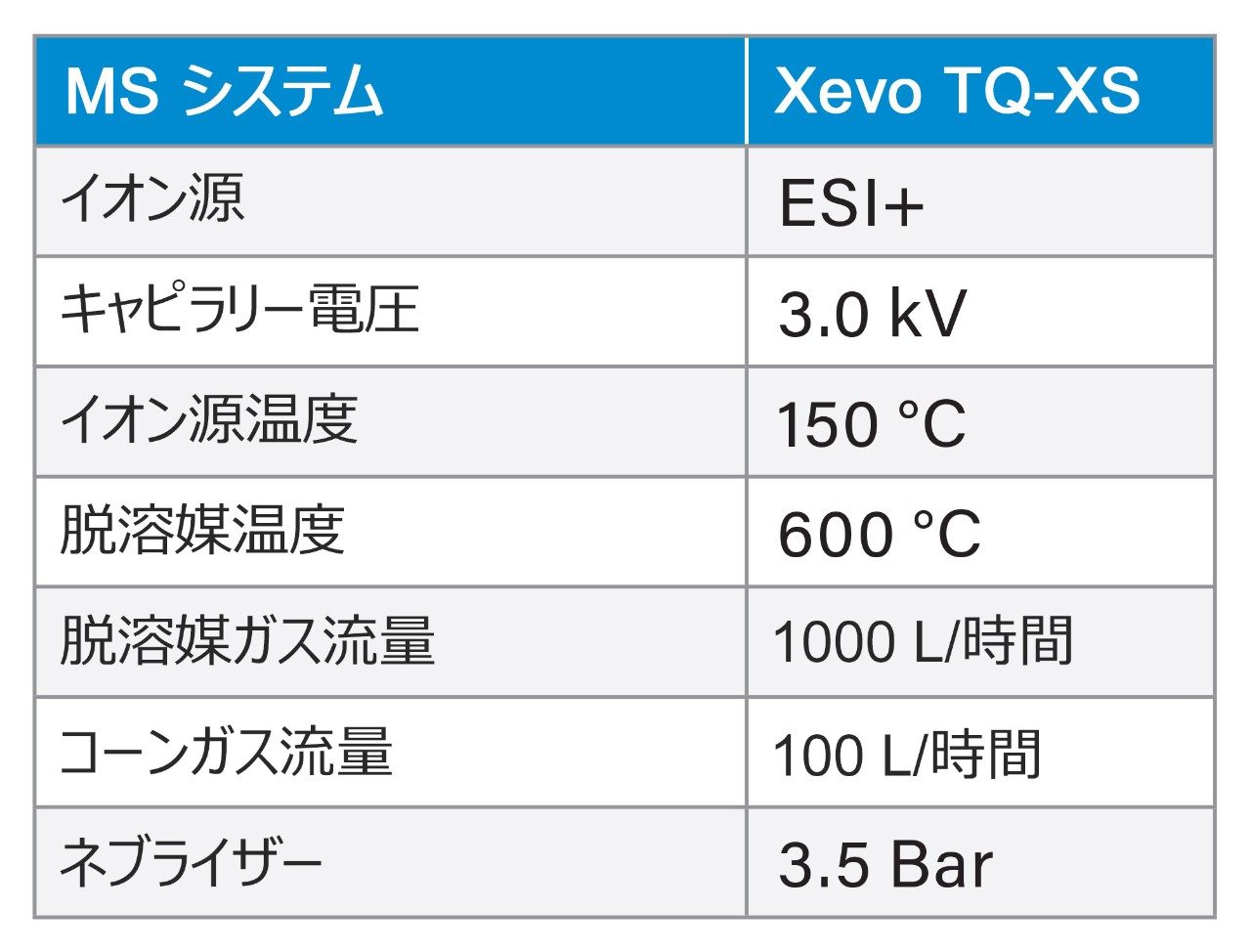
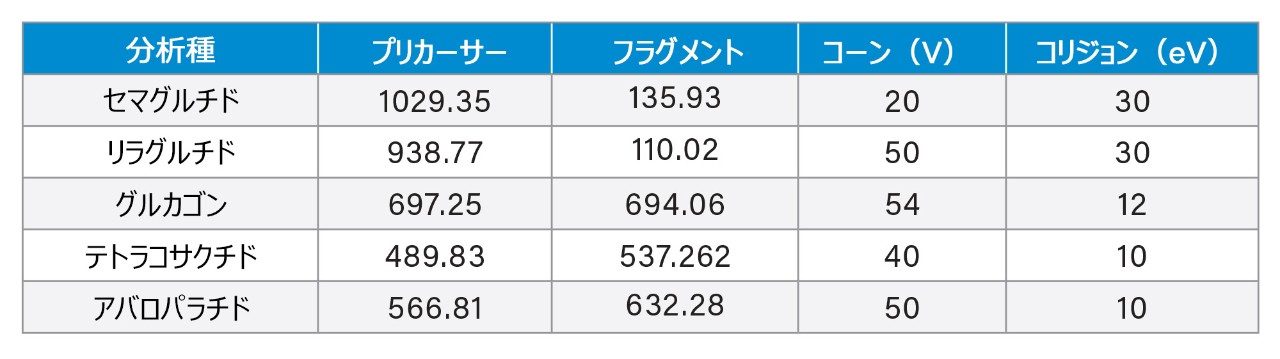
LC-MS/MS 定量は、Xevo TQ-XS タンデム四重極型 MS(ESI+)を使用して行いました。分析法開発時に、さまざまなペプチドに対していくつかの多価プリカーサーが観察されました。各ペプチドについて最も強いプリカーサーチャージ状態を、MRM 分析用に選択しました。これは、セマグルチドの場合 4+、リラグルチドの場合 4+、グルカゴンの場合 5+、テトラコサクチドの場合 6+、アバロパラチドの場合 7+ に対応します。さらに、特異性の高い b/y イオンフラグメントを使用することで、特異性が大幅に向上しました。最適化された MS 条件は「実験方法」セクションに、MRM トランジション設定は表 3 に記載されています。
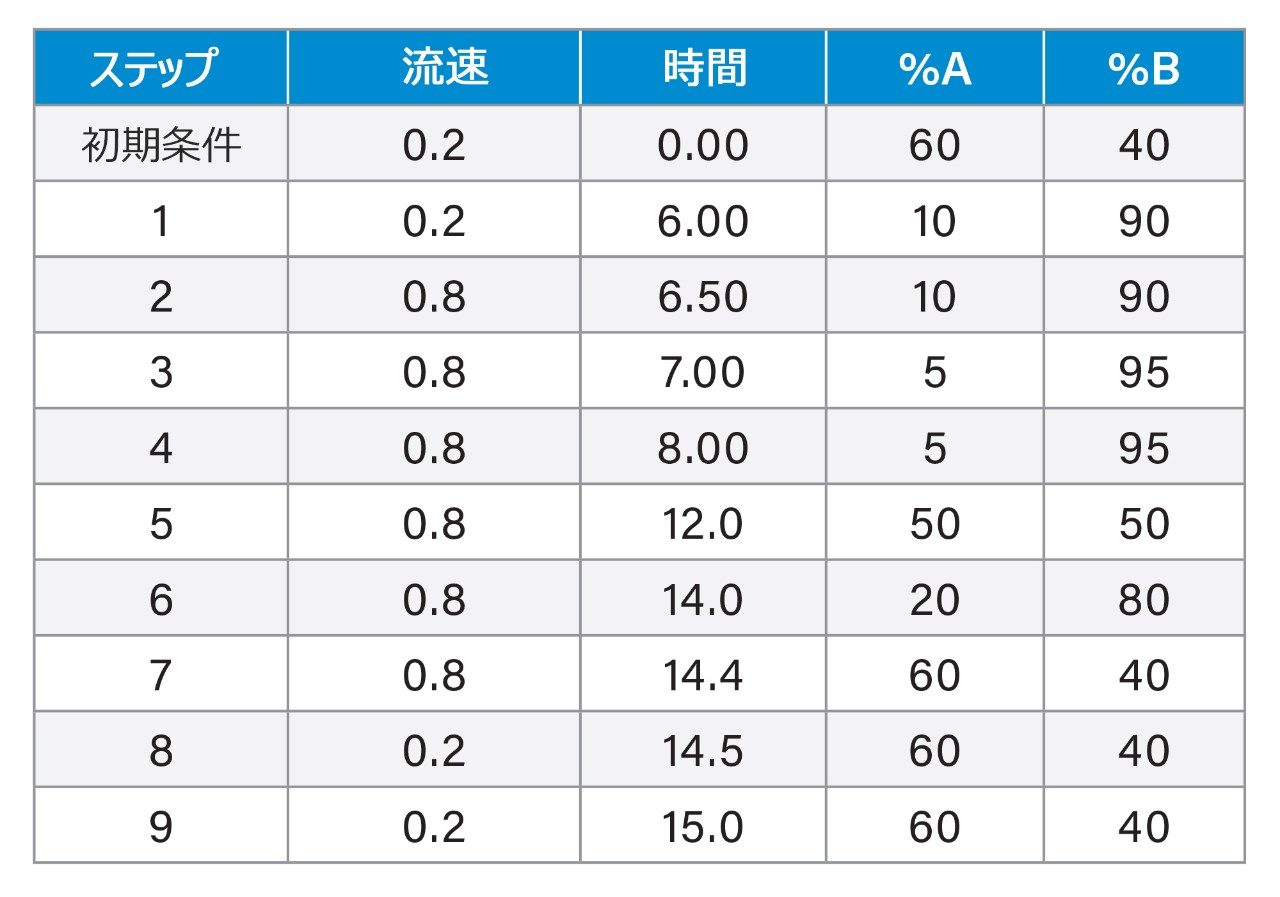
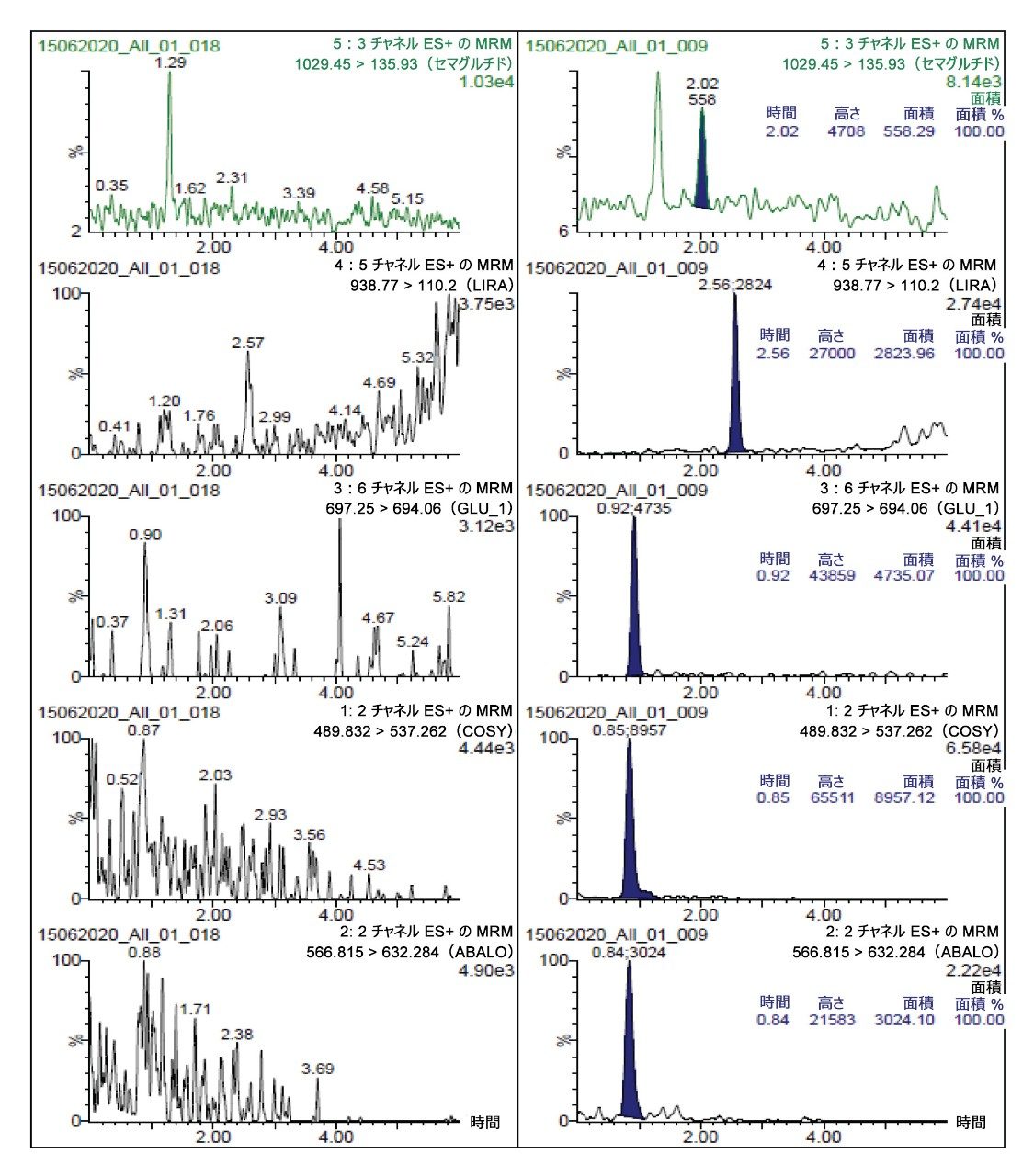
クロマトグラフィー分離は、XBridge BEH フェニル 2.5 μm、2.1 × 100 mm カラムを使用して行いました。0.4% FA が含まれている水と 0.1% DFA が含まれているアセトニトリルを、移動相として使用しました。分析には、6 分間のグラジエントを使用しました。最も問題となるペプチドであるリラグルチドのオンカラムペプチドキャリーオーバーを緩和するために、ペプチド分離後に移動相組成を交互に変えながら流速を増加しました。逆相フェニルカラムと DFA 移動相を使用することで、分析感度が向上し、優れたピーク形状が得られ、この分析に含まれる多様なペプチドがクロマトグラフィー分離されました。この LLOQ(1 ng/mL)のクロマトグラフィー性能が、ブランクサンプルと比較して図 1 に示されています。すべてのペプチドについて、この LLOQ でのシグナル対ノイズ比(S/N)は 10 以上でした。
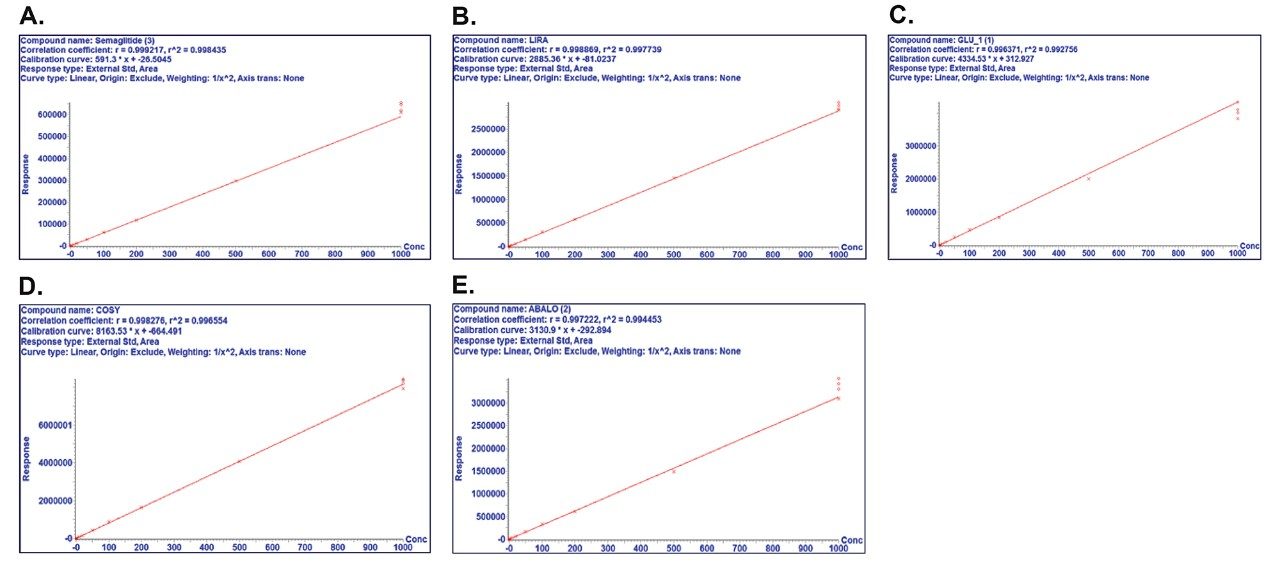
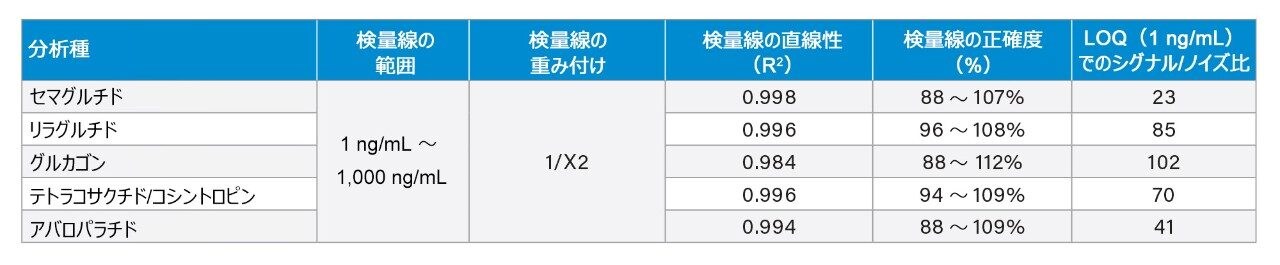
わずか 5 µL のサンプルおよび記載されている LC-MS メソッドを使用して、ペプチドの定量限界 1 ng/mL が達成されました。検量線のダイナミックレンジは 1 ~ 1000 ng/mL で、R2 値は 0.99 (1/x2 重みづけ)を超えました。すべてのキャリブレーションポイントの正確度は 88 ~ 112% で、推奨性能 85 ~ 115% に適合しました。この性能は表 4 に強調表示され、図 2 に示されています。
このアプリケーションノートでは、ペプチド医薬品(セマグルチド、リラグルチド、グルカゴン、テトラコサクチド、アバロパラチド)の簡単かつ高感度で、頑健な LC-MS/MS 同時定量法の開発に焦点を合わせます。この分析法は、医薬品製造時に必要なクリーニングのバリデーション作業をサポートする目的に適合していることが明らかです。今回開発された分析法では、5 種のペプチドすべてについて、リニアダイナミックレンジ 1 ~ 1000 ng/mL、および LLOQ 1 ng/mL が達成されています。この分析法の感度と定量性能は、慎重なサンプル前処理と LC-MS メソッドの最適化によるものでした。慎重に選択したサンプル希釈液を使用してペプチドの溶解性を維持しつつ、NSB によるペプチド損失を低減するために MaxPeak テクノロジーを採用した QuanRecovery サンプルバイアルを使用することで、すべてのペプチドの回収率を高めることが容易になりました。ACQUITY UPLC I-Class システムおよび XBridge BEH フェニルカラムに Xevo TQ-XS タンデム四重極型質量分析計を組み合わせた、低拡散で高分離能の UPLC クロマトグラフィー分離を使用することで、10 秒未満のシャープなピークと優れたピーク形状が確保され、標準試料での 1 ng/mL の検出が容易に達成されました。開発されたこの分析法は、医薬品の研究および製造をサポートする目的に適していることが明らかになっています。
720007035JA、2020 年 10 月