法中毒学目的のみに使用してください。
過去 10 年間にわたり、法中毒学の生体マトリックスとしての毛髪の使用の人気が高まっており、ラボでは、毛髪試験協会(SoHT)や欧州職場薬物試験協会(EWDTS)などの団体の推奨事項に従って、薬物パネルの試験が行われています1,2。 これらのガイドラインを満たして毛髪中の乱用薬物のそのようなパネルを定量することができるようにする、頑健なサンプル前処理ワークフローと高感度の UPLC-MS/MS 分析法が開発されています。このワークフローにより、アヘン類、アンフェタミン類、コカイン、ケタミン、ブプレノルフィン、ベンゾジアゼピン類、およびそれらの代謝物、ならびにテトラヒドロカンナビノール(THC)とその代謝物であるカルボキシ-THC(cTHC)などの複数のクラスの薬物を、1 本の毛髪サンプルから測定できます。市販の抽出バッファー中でインキュベーションした後、OASIS PRiME MCX 96 ウェルプレートを使用した単一の固相抽出(SPE)メソッドを用いて、分析種を残留毛髪マトリックスから分離しました。ACQUITY UPLC I-Class システム/Xevo TQ-S micro システムを用いた 2 つの LC-MS/MS 分析法が開発されました。1 つは 29 種の「塩基性薬物」、もう 1 つは THC、カンナビジオール、カンナビノールを定量するためです。THC の存在を確認するためにカルボキシ- THC を測定するには、残留インキュベーション混合物を使用する別のサンプル前処理法と、新しい LC-MS/MS 分析法が必要です3。 このワークフローにより、すべての分析種をこの 2 つの団体が推奨する確認カットオフ値より低い濃度で、1 サンプルあたり 10 分未満で定量することができ、多数のサンプルを短時間で分析できます。
以前に、法中毒学試験の生物学的マトリックスとしての毛髪の利点について説明し、大麻の能動的な使用を明確に証明するために使用できる、THC の代謝物であるカルボキシ-THC のための、高感度な分析法について説明しました3。 この手順では 20 mg の毛髪を使用し、M3 試薬を使用して毛髪マトリックスから薬物が抽出され、続いて OASIS PRiME HLB を使用してサンプルをクリーンアップし、ACQUITY UPLC I-Class システム/Xevo TQ-S micro 質量分析計を用いた LC-MS/MS 分析法で分析しました。
ただし、通常の業務では、cTHC は日常的に分析する必要がある薬物の大きなパネルに含まれ、SoHT や EWDTS などの学会が推奨するガイドラインに含まれている、唯一の化合物です(表 1 を参照)。このより大きなパネルには、アヘン類、アンフェタミン類、コカイン、ケタミン、ブプレノルフィン、ベンゾジアゼピン類、およびそれらの代謝物、ならびにテトラヒドロカンナビノール(THC)も含まれています。推奨カットオフ値は薬物クラスそれぞれで異なり、一部の分析種では非常に低くなっています。その結果、一部のラボでは、このパネル内のすべての分析種を確実に対象範囲に含めるために、いくつかの異なる手順を適用しています。実際に、これにはさまざまな薬物クラスに対して適切な感度を確保するために、さまざまな抽出手順、個別のサンプルクリーンアッププロトコル、さらには異なる分析法を、同じ試料に続けて適用することがあります。複数のプロトコルを適用する不便さに加えて、これにより必要なサンプルの量が増加し、利用可能な毛髪の量は通常限られているため問題を生じる場合があります。そこで、より合理化されたアプローチが必要です。好ましくは、ラボの効率を向上させることができ、これらの分析種を迅速、頑健、高感度で分析する方法により、毛髪中で定量できる簡素化されたサンプル前処理ワークフローです。ワークフローは、SoHT や EWDTS などの学会が推奨するガイドラインに準拠して、大量の試験を実施できる必要があります。

対照群毛髪はボランティアから収集され、ジクロロメタン、メタノール、ジエチルエーテルで逐次除染した後、ハサミで刻んで 1 ~ 2 mm の切片にしました。M3 試薬は、イタリア、トレントの Comedical http://www.comedical.biz/ から供給されました。
対照群の毛髪(10 ~ 20 mg)を密閉キャップ付きガラス製遠心分離管に量り取り、乱用薬物のパネルがカットオフ値の 0.5 倍からカットオフ値の 200 倍の範囲の濃度になるようにスパイクしました。M3 試薬とともに、内部標準試料(ISTD)混合液を、1 ng/mg になるように添加しました。サンプルをインキュベーター内で 100 ℃ で 60 分間加熱し、冷やした後、100 µL のサンプルをリン酸で希釈してから OASIS PRiME MCX 30 mg 96 ウェルプレート(製品番号:186008916)にロードしました。サンプルを 2% ギ酸、続いて 50% メタノールで洗浄しました。分析種は、アンモニアが含まれているアセトニトリル/メタノール(9:1 v/v)で溶出しました。SPE 溶出液の 25µL アリコートを「塩基性薬物」分析用に採取し、もう 1 つの 25 µL アリコートを THC 分析用に採取しました。
FTN(フロースルーニードル)を装着した ACQUITY UPLC I-Class システムには 30 µL のニードルが取り付けられており、これによって 15 µL のサンプルを分析できました。2 つの再溶解したサンプルを、ACQUITY UPLC BEH C18 カラム(製品番号:186002350)で、ギ酸アンモニウム/アセトニトリルグラジエントを使用し、移動相は同じですが 2 つの異なるインレット方法によって分離しました。1 分析種について、2 つの MRM トランジションを、各 ISTD の MRM トランジションとともにモニターしました。2 つの LC-MS/MS 分析法の合計の分析時間は 10 分でした。
SoHT および EWDTS が推奨する確認カットオフで 10 mg の毛髪にスパイクした「塩基性薬物」の分離を示すクロマトグラムが図 1 に示されており、29 種の分析種の定量 MRM トレースが示されています。このパネルでは、ブプレノルフィンとノルブプレノルフィンの推奨カットオフレベルが特に困難です。20 mg の毛髪に 0.005 ng/mg から 2 ng/mg の範囲の濃度でスパイクしたブプレノルフィンの検量線と残差プロットを、図2 に示しています。

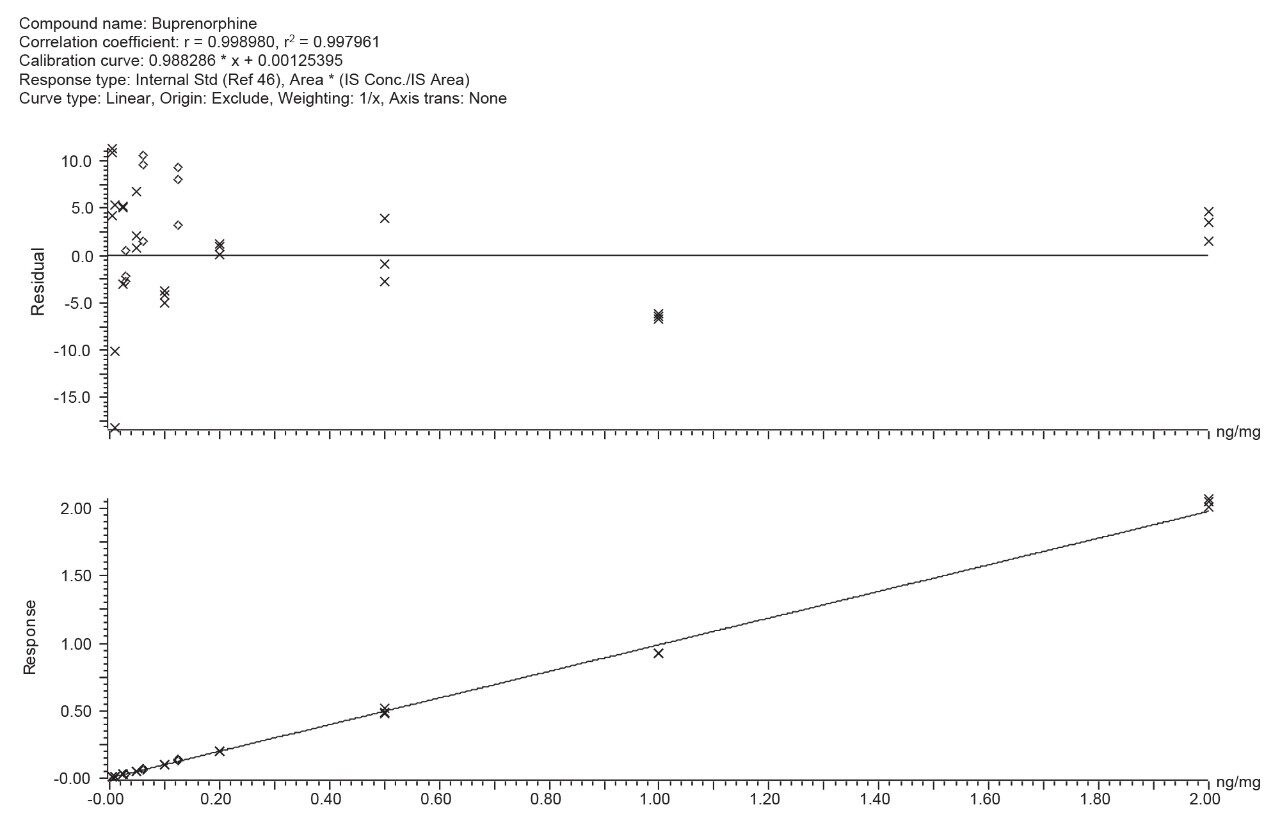
図 3 に、毛髪に 0.05 ng/mg でスパイクした THC、カンナビジオール、カンナビノールの定量 MRM トレースが示されています。サンプル中の THC の存在を確認するために、残留インキュベーション混合物を使用して、以前に報告した別の分析法によって cTHC を検出しました。アルコールのバイオマーカーであるエチルグルクロニドは、Joya 他+が記載した方法に従って、M3 のインキュベーション混合物から定量することができます4。 可能性のある完全な分析ワークフローの概略図が図 4 に示されています。


薬物検査での毛髪の使用の増加により、非常に低い濃度で乱用薬物を定量するための、迅速で、正確で、信頼性が高く、頑健な分析法の必要性が強調されています。このノートでは、市販の抽出バッファーと OASIS PRiME MCX 96 ウェルプレートを用いた、SoHT と EWDTS の両方が推奨する 1 本の毛髪試料からカットオフ濃度の薬物パネルを定量するワークフローについて、詳しく説明しています。ACQUITY UPLC I-Class システムを Xevo TQ-S micro 質量分析計と組み合わせることで、低濃度で多数の化合物を定量し、高いサンプルスループットを確保できます。
720006989JA、2020 年 10 月 改訂