BioResolve SCX mAb カラムの設計と性能に加え、新しいレベルの分離、ローダビリティ、そして比類なき再現性を提供できる能力について説明します。
BioResolve SCX mAb カラムの導入により、LC ベースのチャージバリアント分析が改善され、信頼性のあるより優れた分離をより容易に実現できます。ウォーターズの弛まぬ研究開発によって生み出されたこの新しいカラムは、表面ケミストリーを最適化した非多孔性のパーティクルテクノロジーにより、堅牢性の高い mAb の高分離を実現できるように設計されています。
イオン交換クロマトグラフィー(IEX)は、タンパク質の電荷不均一性(チャージ バリアント)の分析において一般的に使用される手法です。特にバイオ医薬品業界では、モノクローナル抗体(mAb)などのタンパク質医薬品の有効性に影響する重要品質特性である、チャージバリアントの解析およびモニタリングに、IEX が日常的に使用されています。1。
これまで、電荷不均一性を評価できる分析法の選択肢は十分ではありませんでした。キャピラリー電気泳動や、イオン交換固定相での LC 分離を用いてチャージバリアントを分析する手段が提供されてきましたが、両方のアプローチにおいて、分離能の限界と、分析法の導入および堅牢性に関する課題がありました。容易なフラクション回収や二次元など多次元の分析が可能であることにより、LC ベースのアプローチでは、特に構造機能研究と詳細な二次分析が可能 であるため、さらなる開発が期待できます。
BioResolve SCX mAb カラムの導入により、LC ベースのチャージバリアント分析が改善され、信頼性のあるより優れた分離をより容易に実現できます。ウォーターズの弛まぬ研究開発によって生み出されたこの新しいカラムは、表面ケミストリーを最適化した非多孔性のパーティクルテクノロジーにより、堅牢性の高い mAb の高分離を実現できるように設計されています。本アプリケーションノートでは、BioResolve SCX mAb カラムの設計と性能に加え、新しいレベルの分離、ローダビリティ、そして比類なき再現性を提供できる能力について説明します。
NIST mAb(標準物質 8671)、adalimumab、trastuzumab、infliximabを 18.2 MΩ 水で希釈し、5 または 2.5 mg/mL のいずれかの濃度に調製しました(分析条件に記載)。
|
装置: |
ACQUITY UPLC H-Class Bio およびチタン製(5 mm、1,500 nL)フローセル |
|
データ管理: |
Empower 3 |
|
カラム: |
Waters プロトタイプ BioResolve SCX mAb、3 µm (4.6 × 50 mm を含む) 他社製 SCX、3 µm |
|
移動相 A: |
100 mM MES 水和物水溶液 |
|
移動相 B: |
100 mM MES ナトリウム塩水溶液 |
|
移動相 C: |
1 M 塩化ナトリウム |
|
移動相 D: |
18.2 MΩ 水 |
|
流量: |
0.72 mL/分(内径 4.6 mm) 0.54 mL/分(内径 4.0 mm) 0.15 mL/分(内径 2.1 mm) |
|
カラム温度: |
30 ℃ |
|
検出 (UV): |
20 Hz、280 nm |
|
注入量: |
5 µL(5 mg/mL mAb サンプル) |
|
サンプルマネージャ洗浄 |
18.2 MΩ 水 |
|
シール洗浄溶媒: |
10%メタノール(HPLC グレード)/90% 18.2 MΩ 水 v/v (間隔を 0.5 分に設定) |
|
時間 |
%A |
%B |
%C |
%D |
カーブ |
|---|---|---|---|---|---|
|
初期条件 |
2.2 |
17.8 |
1.0 |
79.0 |
初期条件 |
|
10.0 |
2.2 |
17.8 |
20.0 |
60.0 |
6 |
|
10.5 |
2.2 |
17.8 |
70.0 |
10.0 |
11 |
|
12.5 |
2.2 |
17.8 |
1.0 |
79.0 |
11 |
|
20.0 |
2.2 |
17.8 |
1.0 |
79.0 |
6 |
pH 7 のバッファーシステムの送液には、グラジエントをプログラムし、Auto•Blend Plus を使用しました。
|
装置: |
ACQUITY UPLC H-Class Bio およびチタン製(5 mm、1,500 nL)フローセル |
|
データ管理: |
Empower 3 |
|
カラム: |
BioResolve SCX mAb、3 µm、 4.6 × 50 mm |
|
移動相 A: |
20 mM MES pH 6.0 |
|
移動相 B: |
20 mM MES pH 6.0、1 M NaCl |
|
流量: |
0.96 mL/分 |
|
カラム温度: |
30 ℃ |
|
検出 (UV): |
20 Hz、280 nm |
|
注入量: |
4.8 µL(2.5 mg/mL NIST mAb) |
|
サンプルマネージャ洗浄 |
18.2 MΩ 水 |
|
シール洗浄溶媒: |
70%2-プロパノール(HPLC グレード)/30% 18.2 MΩ 水(間隔を 0.5 分に設定) |
|
時間 |
%A |
%B |
%C |
%D |
カーブ |
|---|---|---|---|---|---|
|
初期条件 |
99.0 |
1.0 |
0.0 |
0.0 |
初期条件 |
|
7.5 |
80.0 |
20.0 |
0.0 |
0.0 |
6 |
|
7.5 |
70.0 |
30.0 |
0.0 |
0.0 |
11 |
|
8.5 |
99.0 |
1.0 |
0.0 |
0.0 |
11 |
|
13.0 |
99.0 |
1.0 |
0.0 |
0.0 |
11 |
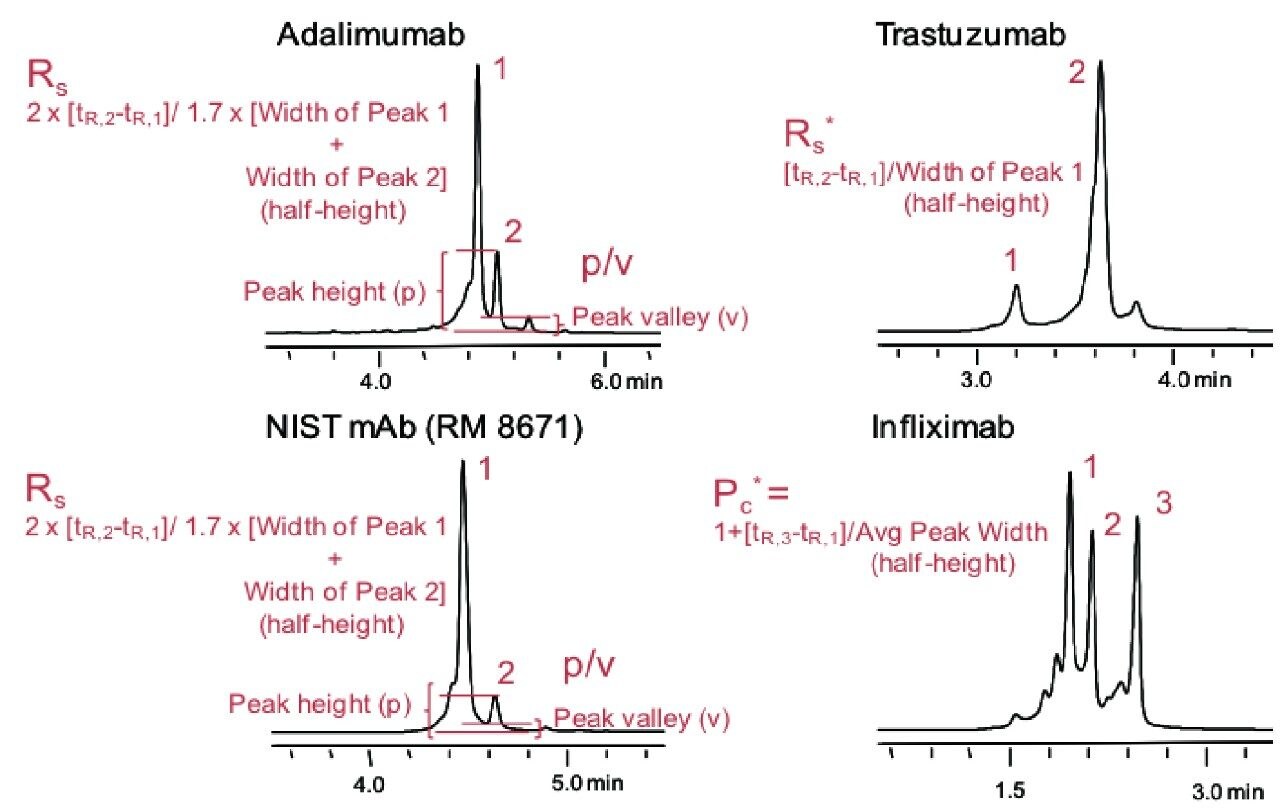
4 種の mAb(adalimumab、NIST mAb [RM 8671]、trastuzumab、infliximab)は、等電点(pI )が異なり、異なる保持挙動を示すため、本研究に使用しました。これらの mAb のそれぞれに、明確なチャージバリアントプロファイルがあり、分離の評価には、異なるパラメーターを用いました。Adalimumab と NIST mAb については、ピークバレー比(p/v) または USP 半値幅(HH)測定(Rs)により、最も強く検出される塩基性バリアントのモニタリングを行いました。Trastuzumab の分離では、かなり均一であることを示すピーク形状の比較的大きな酸性バリアントピークが観察されました。そのため、擬似的な分離能測定(Rs*)を行いました。完全 分離されていない前方ピーク/ショルダーのために、ピーク幅 測定を行うことができないメインピークに対して、この方法を用いました。最後に、infliximab では、イオン交換により、多数のピークが観察されました。この中でも最も大きなものがメインピークであり、この次に大きな 2 つの塩基性バリアントは、等モルのリシンバリアントに対応していました。infliximabのこの 3 つのピークを使用してピークキャパシティ(Pc*)を算出し、クロマトグラフィーの分離能を評価しました。以下の図は、3 種の測定方法の詳細を示しています(tR は保持時間を示しています)。
モノクローナル抗体の分析および特性解析のためのクロマトグラフィーツールは、目的に合った、堅牢で再現性の高い性能を実現できるよう、厳密に開発する必要があります。チャージバリアント分析のための新規固定相の研究においては、イオン交換吸着剤の最適化が、数多く行われてきました。
市販されているタンパク質分離用のイオン交換カラムの多くで、その性能の良さから、非多孔性のポリマーベースパーティクルが使用されています。非多孔性の粒子は、粒子内における拡散を排除し、高分子のバンド拡散を最小限に抑えます。明確な負荷容量を有する特殊なイオン交換リガンドの出現により、他の技術研究に対するニーズは減少したかのように思われました。30 年 前には、イオン交換固定相として 3 µm の非多孔性ポリマーパーティクルを使用する方法が有効である可能性が明らかになり、2 最近では、タンパク質のチャージバリアント分離の最適化をさらに進め、粒子径を 3 µm 未満に小型化することで利点が得られるか どうかの検討が課題となっています。
そこで、イオン交換容量が同等で、粒子径のみが異なる 2 種類のプロトタイプ固定相(粒子径 3.1 µm と 1.7 µm)を作成しました。adalimumab の分離にそれぞれのカラムを使用して得られたクロマトグラムを、図 1 に示しています。
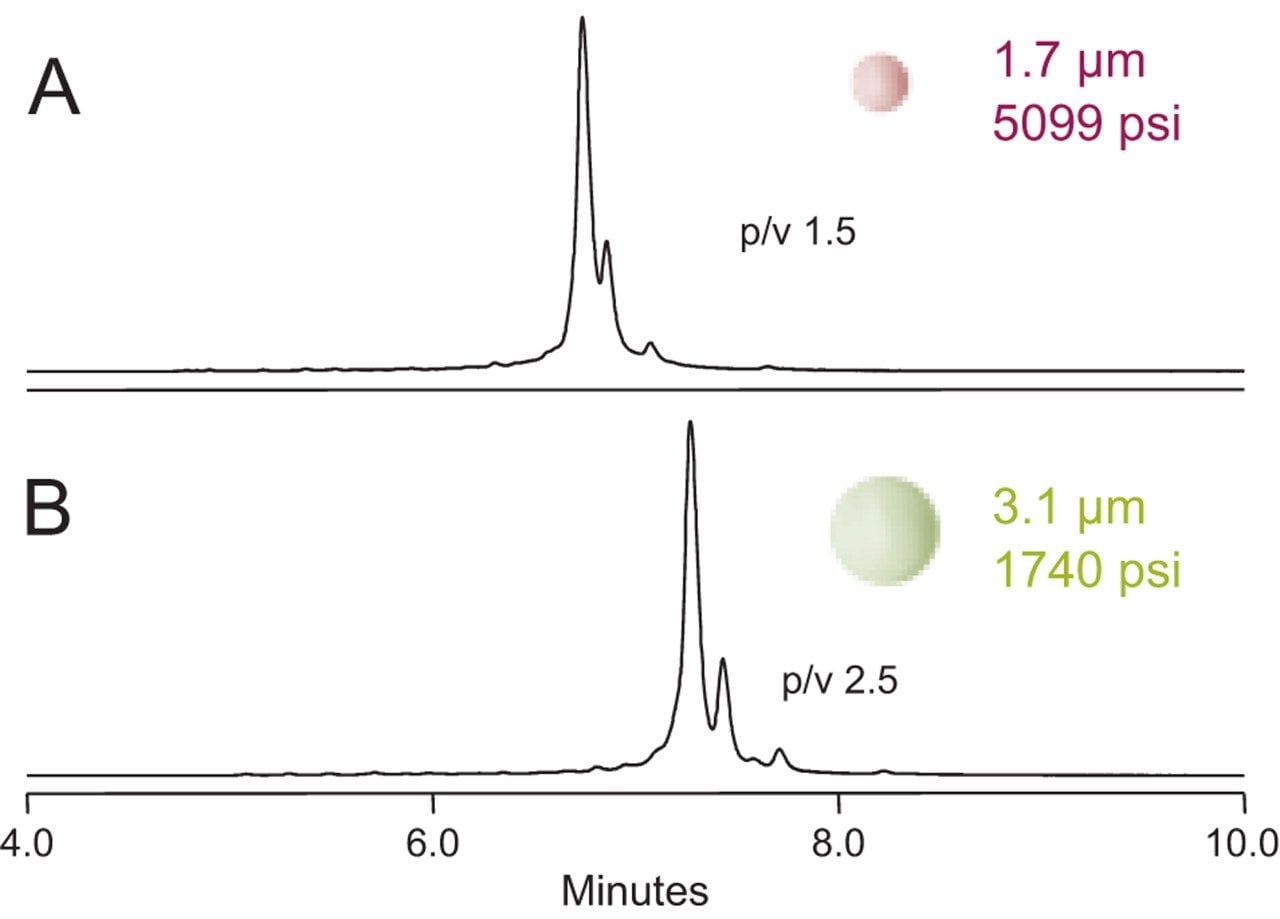
低拡散 LC システム(バンド拡散 <12 µL)で使用した場合、3.1 µm 固定相は 1.7 µm 固定相と比較して分離が良好でした。結論として、mAb は拡散係数の極めて低い 150 kDa のタンパク質であるにも関わらず、非多孔性パーティクルが既にその形態から想定される物質移動の限界値を達成しており、粒子をさらに小型化することの利点はほとんど得られませんでした。さらに、カラム圧に大きな差が観察されました。3.1 µm の粒子を充塡した2.1 × 50 mm カラムでは、最大圧力 1,740 psi が観測され、一方、1.7 µm のカラムでは 5,099 psi でした。この圧力差が分離に何らかの影響を与えたと考えられます。infliximab の分離において、流速制限部品を取り付けた別の実験では、確かに圧力を加えると、ピーク幅の広がりがわずかに観察されました(データは示していません)。タンパク質にもよりますが、加圧により内部のタンパク質ドメインが強制的に水和され、立体構造が一時的に変化する場合があります3。 そのため、約 3 µm の非多孔性 固定相が、mAb の分離に最適であると考えられ、圧力制限を気にせず様々な LC プラットホームの利用も可能であることから、この粒子径に基づいて開発を進めることが好ましいと考えました。
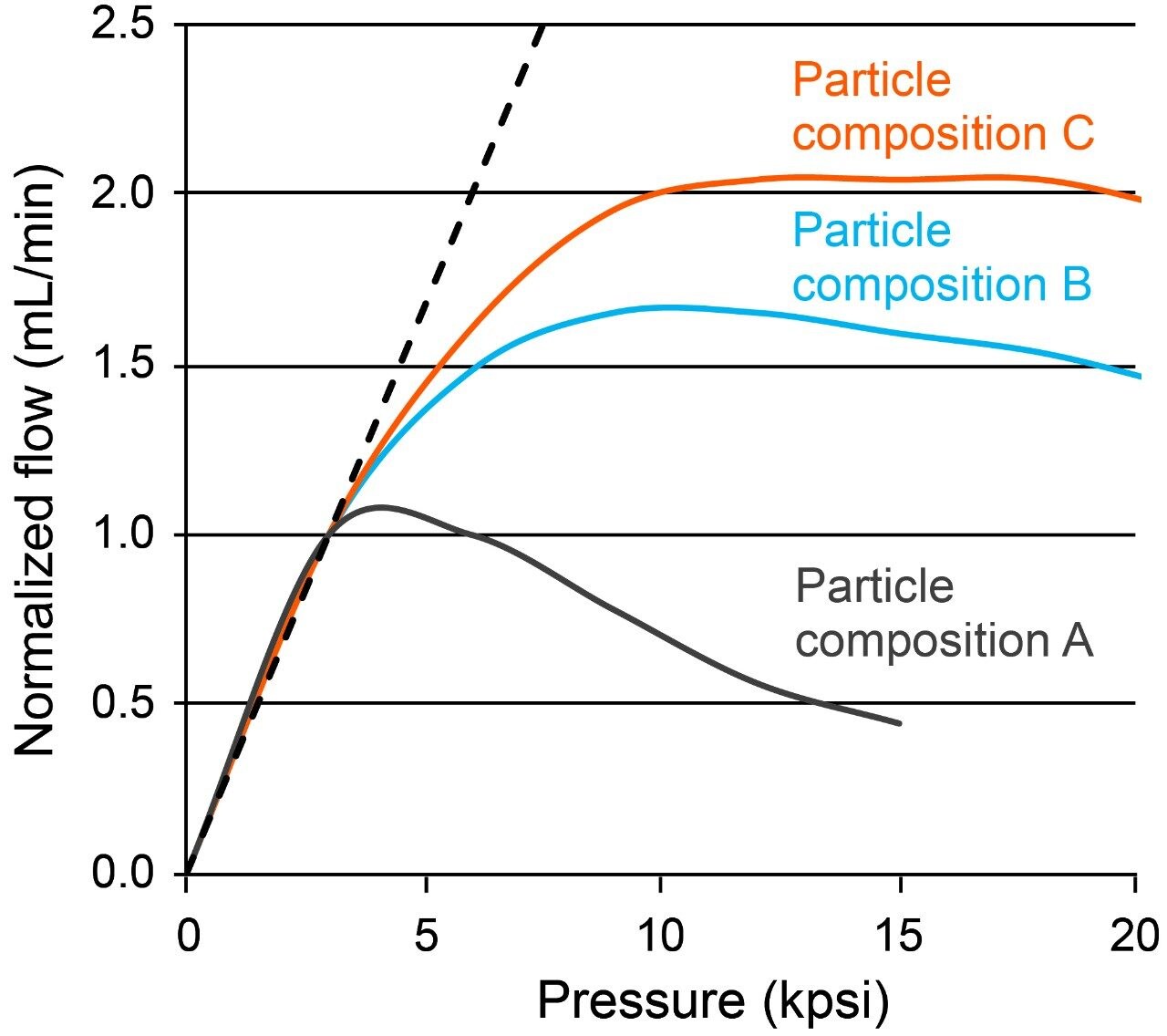
この 3 µm の非多孔性固定相は、1,000 ~ 9,000 psi の範囲の圧力下で最も頻繁に使用されることが予測されます。一方、過剰な圧力に耐えられる能力が、カラムベッドの安定性を保つためには重要になります。粒子のポリマー組成が十分に最適化されていない場合、高い線速度によって粒子が破砕されたり、つぶれる場合があり、カラムに問題が発生する原因となります。この理由から、多数のベースパーティクルポリマー組成について調査を行い、機械強度試験を実施しました。この試験では、短いカラムにメタノールを最大 21,000 psi の一定圧力で送液しました。 これらの試験で測定された流速は図 2 に示しており、粒子の強度および機械的なベッド安定性の指標として解釈できます。理想的なカラムでは、圧力と流速の間に 1 対 1 の対応が見られます。
組成 A のような一部の組成では、流速の偏差 が 5,000 psi と小さく、組成 C など他の組成では、最大 10,000 psi(あるいは 10,000 psi 以上)という優れた機械的特性を示しました。この後者の結果は、新しく設計されたベースパーティクルを代表するもので、比較的高い線速度および高い流速の分析条件においても使用できることが分かります。
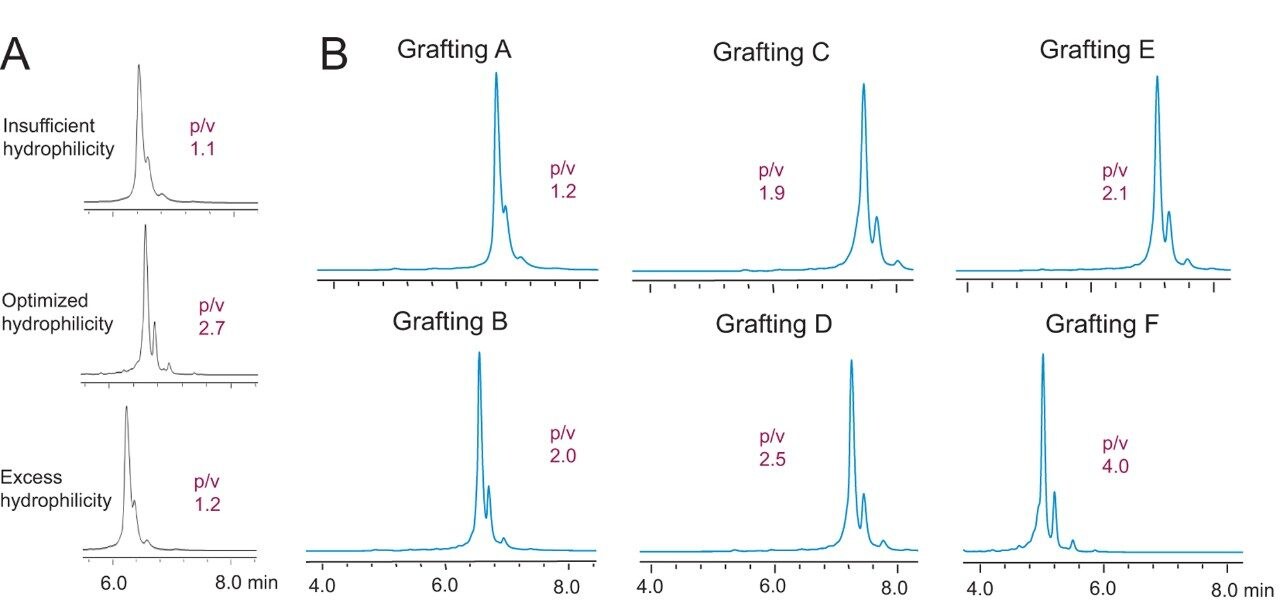
タンパク質の相互作用は複雑であり、様々なファクターの影響を受けます。イオン交換におけるクロマトグラフィー的吸着においては、吸着剤の表面ケミストリーを調節することが重要です。mAb のチャージバリアント分析のために最適化したケミストリーを開発する場合、疎水性の二次相互作用のない、ネイティブな水系での分離であることをまず考慮しなければなりません。このため、新しいベースパーティクルの表面を改良し、その親水性を向上させ最適化しました。この点に関しては、3 種の異なる親水性度でベースパーティクルを修飾し、その後、同一 のイオン交換リガンドを結合し、3 種類の独自のプロトタイプを作成しました。
これらのプロトタイプを用いて adalimumab を分離した結果のクロマトグラムを、図 3A に示しました。中程度の親水性度で修飾した 粒子で、最適な分解能が得られました。親水性修飾が少なすぎると、疎水性の二次相互作用によって分離能が低下していると考えられます。親水性修飾が多すぎると、分離能が低下するだけでなく、背圧が異常に高くなります。最適な親水性の範囲を知ることにより、新規の BioResolve パーティクルを堅牢に製造するための正確なガイドラインを得ることができます。
同様に、イオン交換リガンド結合の最適化についても慎重な検討がなされました。実験アプローチの設計および、様々なプロトタイプで測定された性能をもとに、種々の合成の最適化を行いました。まず最も重要な点は、陽イオン交換体の開発でした。これは、mAb の大半が塩基性の pI 値を示すためです4。 次に、最適なイオン交換容量、有効なリガンド分布、そして、電荷間の反発による膨張を制御 し最適化するため、イオン交換基の化学特性を考慮しました。予備実験の結果、スルホン酸ベースの強陽イオン交換リガンドが、最も有望であることが分かりました。そして、スルホン酸リガンドは、pH グラジエントクロマトグラフィーに使用した場合、幾つかの理由によって、カルボン酸リガンドよりも平衡化にかかる時間が短いことも分かりました。そのため、様々な化学組成を持つスルホン酸結合相によって調製されたプロトタイプの有効性を調べる実験にフォーカスしました。数多くの幅広いプロトタイプを代表して、6 つのクロマトグラムを例として図 3B に示しました。adalimumab の分離におけるピークの形状、ピークの鋭さ、そして分離能が、これらの異なる化学組成によって影響を受けることが分かります。例えば結合相 C では、adalimumab は顕著に保持され、比較的分離能の低いプロファイルが得られました。一方、結合相 F では、相対的な保持が最も弱く、分離能の最も高い、多くの微量成分を分離したクロマトグラムが得られました。後者のプロトタイプが、イオン交換リガンドとして望ましい化学組成であると考えられます。上記の最適化により、BioResolve SCX mAb 固定相の基礎が形成され、結果的に、特殊な重合反応と最適化されたスルホン酸結合相によって作成した、3 µm 非多孔性吸着剤が最適であると結論付けました(図 4)。
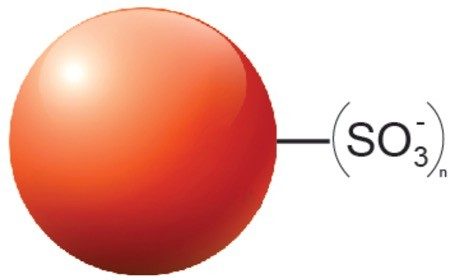
バイオ医薬品における創薬、開発、そしてQC のための新しい分析ツールの全てに、優れた性能と堅牢性が求められます。そのため、pH 7 の MES バッファーを用いた高速塩グラジエントと、4 種の異なるモノクローナル抗体(infliximab、trastuzumab、NIST mAb、adalimumab)を用いて、BioResolve SCX mAb カラムの試験を定期的に行いました。分離能力を評価するために、それぞれの分離パターンに合わせた分離能の測定基準を考案しました。各計算の詳細は実験セクションに示しています。固定相の開発およびこのフィードバックにより、高性能分離をユニバーサルに実現することが可能となり、限定的な mAb の分離における性能のみを最適化するといったことを回避しています。図 5A は、異なるバッチのパーティクルを充填した 2 本の BioResolve SCX mAb カラムにより取得したクロマトグラムと、業界をリードする他社のカラムテクノロジーによって得られたクロマトグラムを示しており、BioResolve SCX mAb カラムがユニバーサルな性能を発揮できることが分かります。BioResolve SCX mAb カラムは、ピークキャパシティ(Pc)、分離度(Rs)またはピークバレー比(p/v)のいずれかのパラメーターで示したように、高い分離能を示しています。分離の改善が一目で分かる例が、NIST mAb のチャージバリアントのクロマトグラムに示されています。BioResolve SCX mAb カラムのデータのみで、NIST mAb の酸性バリアントのフロントショルダーがメインピークからわずかに分離しています。使いやすさの点でも、BioResolve カラムはキャリーオーバーが低く、圧力が同等以下を示していることが分かりました(図 5B および C)。
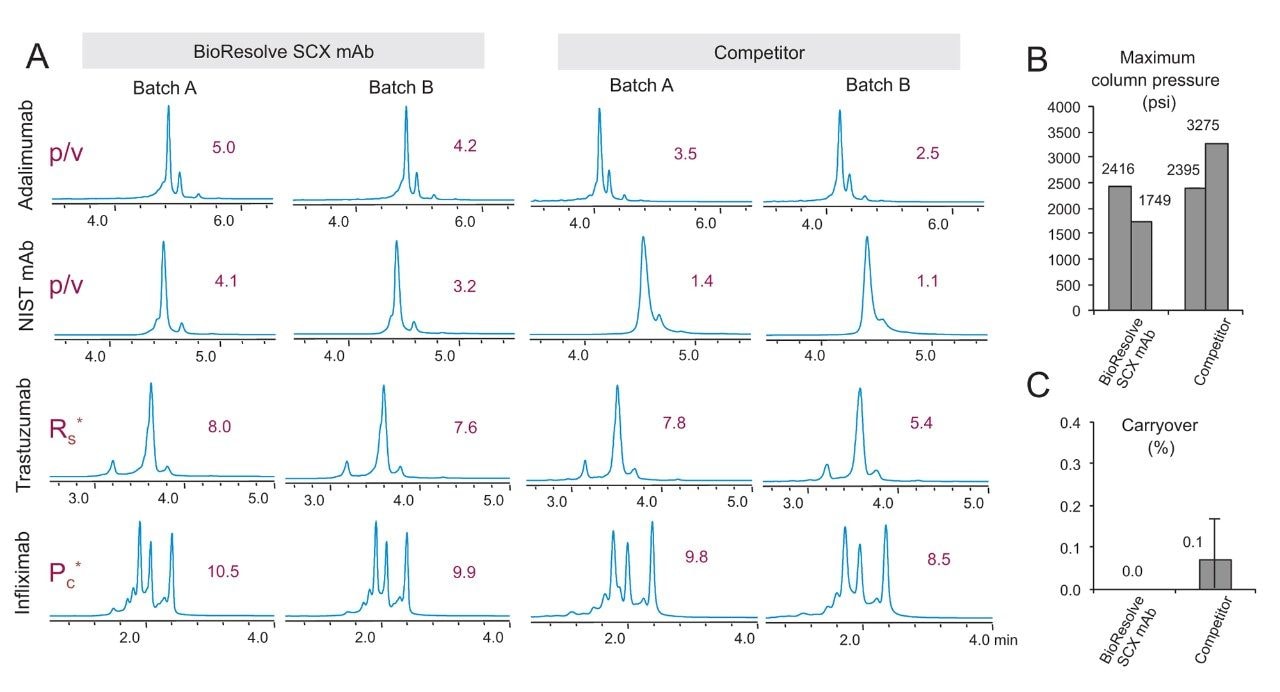
同様の試験によって、BioResolve SCX mAb 固定相の 7 種の異なるバッチの再現性を、さらに幅広いスケールで評価しました。図 6 は、この分析で得られたクロマトグラムを示しています。保持時間および分離能に関するパラメーターの平均値を右側に示したチャートにまとめています。チャートに示した値のそれぞれについて、再現性を示す 2 つのエラーバーを表示しています。一つ目のエラーバーは、測定したカラム間の相対標準偏差(RSD)を示しています。これは、同一バッチの固定相を充塡した 7 本のカラムによる試験に基づくものです。上付き文字 C で示したのが、カラム間の再現性に対応する RSD 値であり、保持時間では 0.9% 以下、分離能では 2.4% 以下の結果となりました。さらに、二つ目のエラーバーは、7 種の別々の固定相バッチに基づく、バッチ間の再現性を示しています。バッチ間再現性の RSD 値を上付き文字 B で示しました。保持時間では3.0% 以下、分離能では 4.9% 以下の結果が得られました。分析法の適格性評価と、分析法開発を手軽に行うために必要な、高い分離能と再現性の点で、BioResolve SCX mAb カラムにおける高い信頼性が示されました。
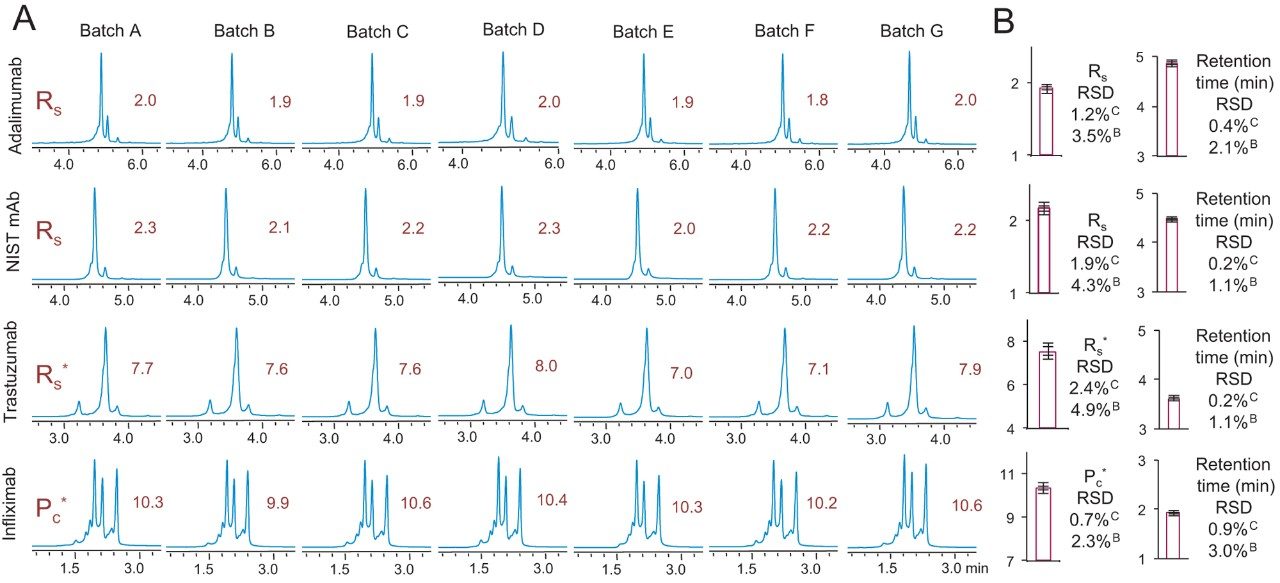
IEX カラムテクノロジーの導入において重要となるもう一つの点は、ローダビリティであり、これは、規制においても重要である構造機能研究のために、チャージバリアントを分離した後に、フラクションの分取が行われるためです。BioResolve SCX mAb、4.6 × 50 mm カラムにおいて、ロード量の増加関数を調べる目的で、1 ~ 500 g の NIST mAb の分離試験を行いました。NIST mAb 4、16、63、250 µg をロードして得られたクロマトグラムを図 7A に示しました。図 7 B–D はピーク面積のプロット、塩基性バリアントの分離の度合いを示すピークバレー比、そして相対レスポンスを示しています。このロード量の範囲において、ピーク面積は優れた直線性を示し(R2 = 0.9999)、250 および 500 µg の高いロード量でも分離能の減少はわずかでした。そのため、このカラムテクノロジーは、ロード量の増加や分取が必要なアプリケーションにも最適と言えます。これらのデータより、内径 4.6 mm のカラムでは、サンプル特性に応じて、1 または 2 mg までの少ないロード量においても、優れた分離能が維持されると考えられます。
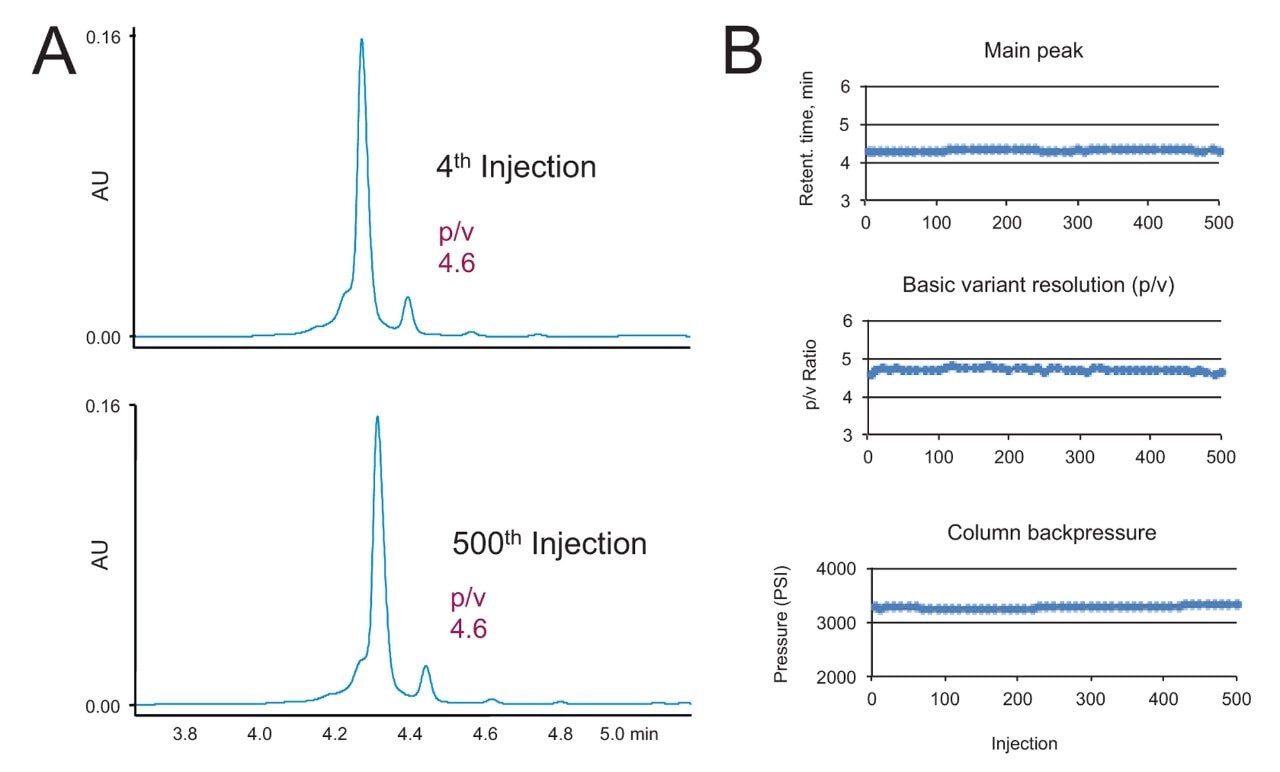
堅牢性を確認するため、BioResolve SCX mAb、4.6 × 50 mm カラムについてカラム寿命試験を行いました。妥当な高流速である 0.96 mL/分で NIST mAb の分離を 500 回繰り返しました。図 8A は、この試験における 4 回目と 500 回目の注入のクロマトグラムを示しています。分離の質が十分に保たれていることが分かります。両クロマトグラムにおいて、NIST mAb のチャージバリアントに特徴的なプロファイルである、酸性バリアントの前方ピークの部分的分離が観察されています。図 8B に示したように、カラム寿命試験の期間中に保持時間、分離能、圧力が基本的に変化しておらず、一貫したカラム性能が確認されました。
モノクローナル抗体のチャージバリアント分析を改善するため、特殊な重合反応と最適化されたスルホン酸結合相によって作成した、3 µm の非多孔性 パーティクルに基づく新規IEXカラムテクノロジーが開発されました。粒子サイズ、形態、表面ケミストリーを厳選し、最適化することにより、業界をリードするテクノロジーと比較して、さらに優れた特性を持つカラムが誕生しました。複数の mAb に対して幅広く適用可能な性能が確認されました。再現性が高く、堅牢であり、カラム間およびバッチ間の変動が最低限に抑えられ、カラム寿命についても良好な結果が得られています。さらに、このカラムは、特性解 析および構造機能研究のためのチャージバリアント精製に使用できる、高いローダビリティを提供します。再現性とともに性能を向上させることにより、この次世代型イオン交換カラムテクノロジーは、mAb チャージバリアントの複雑な研究や非常に厳密な QC モニタリングにおいても、バイオ医薬品開発に携わる科学者をサポートしていきます。
720006475JA、2019 年 1 月