
このアプリケーションノートでは、2D-LC-MS/MS を用いた尿中のミクロシスチンのキャプティブ固相抽出プロセスの有効性について説明します。
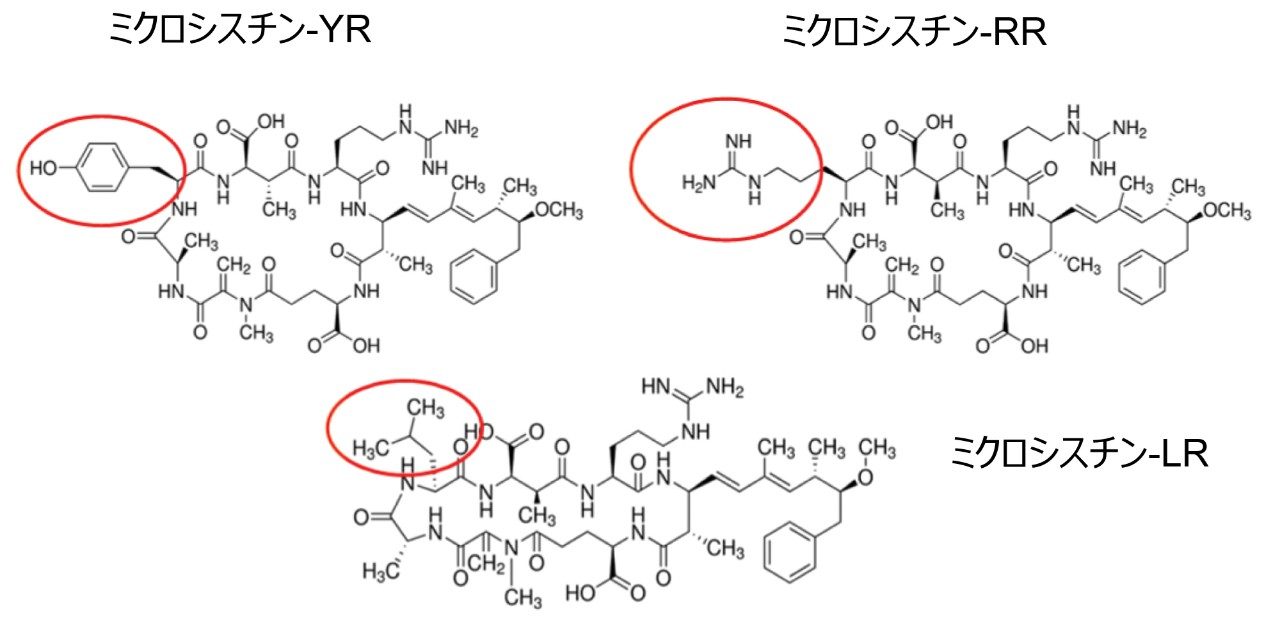
シアノバクテリアの増殖によって発生する藻類の「スーパーブルーム」は、淡水環境でよく見られる問題です。その発生は、表面流去水からの栄養素(肥料)が過剰になることが主な原因です。よく見られるシアノバクテリアの多くは、地元の野生生物や人に対する深刻な健康上の脅威になり、さらには致死性を持つ強力なシアノトキシンを産生します。ミクロシスチンは、最も有名で広く知られているシアノバクテリア 1,2「Microcystis aeruginosa」によって産生されるもので、毒素はこの菌に基づいて命名されました。ミクロシスチンは不揮発性で親水性が高く、日光下で安定し、広い温度/pH 範囲で安定するため、一旦放出されると、数週間から数ヶ月残留することがあります。化学的には、ミクロシスチンは、非リボソームペプチド合成酵素によって産生される環状ヘプタペプチドです。ミクロシスチンは、5 つの非タンパク質性アミノ酸と 2 つのタンパク質性アミノ酸で構成される 7 員の環状ペプチドで構成されています。種類の異なるミクロシスチンでは、これら 2 つのタンパク質性アミノ酸が異なっていますが、他のアミノ酸は種類の異なるミクロシスチンの間でもほぼ不変です。各ミクロシスチンは、構造に含まれている可変アミノ酸に応じて、アミノ酸の一文字コードによる命名法を用いて名前が付けられています。ミクロシスチン-LR は、可変アミノ酸であるロイシン(L)およびアルギニン(R)を含むことから名付けられました。ミクロシスチン-LR は一番最初に同定されたミクロシスチンで、これまで最もよく研究されていす。他の一般的なミクロシスチンとしては、RR、チロシン(Y) が含まれる YR、アラニン(A) が含まれる LA があります。
飲料水中のミクロシスチンは US EPA によって規制されていませんが、US EPA 汚染物質候補リスト(CCL) 1 および 2 にシアノバクテリアおよびその毒素としてリストされている規制対象外の飲料水汚染微生物です。特定のシアノトキシン、特にアナトキシン-A、ミクロシスチン-LR、およびシリンドロスペルモプシンは、US EPA CCL3 にリストされています。世界保健機関 3(WHO)は、非発がんをエンドポイントにして、耐容一日摂取量(TDI)レベルの評価を実施しました。得られた 1 日あたり体重 1 キログラムあたり 0.04 マイクログラム(μg/kg/日)という値は、マウスの肝臓毒性試験の結果に基づいています。TDI は、安全と見なされるミクロシスチンの 1 日最大摂取量です。この TDI を使用して、WHO もミクロシスチン LR の飲料水中の濃度限界を 1.5 µg/L に設定しました。この研究では、体重 60 kg(132 ポンド)の人が毎日 2 リットルの水を飲み、そのうち 80% が汚染源に由来するとの仮定に基づいています。さらに、ミクロシスチンに汚染された淡水が海に排出されると、汚染地域の海洋生物に致命的な影響を与えることも分かっています。
汚染された海洋生物を人が食べると、ミクロシスチン曝露が起こり、死に至ることもあります。ミクロシスチンの分析のために開発された分析テクノロジーとしては、マウス・バイオアッセイ4、ホスファターゼ阻害5アッセイ、酵素結合免疫吸着測定法(ELISA)6、逆相高速液体クロマトグラフィー(RP-HPLC)7-8 などが挙げられます。多次元クロマトグラフィーを使用した研究はほとんど行われていないため、2 次元(2D)液体クロマトグラフィー質量分析(LC-MS/MS)を用いた体液中のミクロシスチン RR、LR、YR の法医学的分析のための分析法を開発しました9-11。
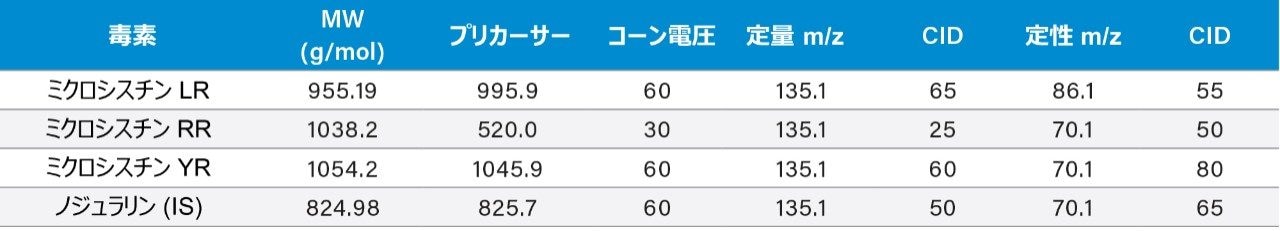
各ミクロシスチンについて、定量および同定の 2 つの MRM トランジションを選択し、最適化しました。MRM 条件は、表 1 に示しています。このアプリケーションでは、この多成分一斉分析に最適な抽出条件とクロマトグラフィー条件を見つけることが、大きな課題となりました。クロマトグラフィー条件は、ウォーターズコーポレーション(米国マサチューセッツ州ミルフォード)の複数のトラップカラム(Oasis HLB、XBridge C18、XBridge C8)および 1 つの分離カラム(BEH C18)でテストしました。サンプル負荷(低 pH、高 pH、中性 pH)および移動相(低 pHおよび高 pHのメタノールまたはアセトニトリル)も、自動 6 × 6 プロセスを使用して最適化しました。ミクロシスチン標準試料はすべて Enzo Lifesciences から購入しました(図 1)。すべての溶媒は LC グレード以上で、Fisher Scientific(米国ニュージャージー州フェアローン)から入手しました。ギ酸および水酸化アンモニウムは Sigma Aldrich(米国ミズーリ州セントルイス)から購入しました。抽出プロセスは、スクリーニング抽出用のキャプティブ抽出のために、事前条件設定した逆相吸着剤(Oasis HLB SPE 3 cc 60 mg バレル、ウォーターズコーポレーション、米国マサチューセッツ州ミルフォード)を用いて行いました。
|
カラム: |
Oasis HLB 20 µm~80 mg、2.1×30 mm |
|
サンプル負荷: |
MilliQ 水(pH 7、添加剤なし) |
|
流量: |
2 mL/min |
|
At-Column Dilution: |
5%(0.1 mL/分のサンプル負荷ポンプと 2 mL/分の希釈ポンプ) |
|
システム: |
At-Column Dilution でトラップおよび溶出するように設定されている 2D テクノロジーを搭載した ACQUITY UPLC |
|
分析時間: |
10 min |
|
カラム: |
ACQUITY UPLC BEH C18、1.7 µm、2.1 × 50 mm(製品番号:186002350) |
|
カラム温度: |
60 ℃ |
|
移動相 A: |
水(0.5% のギ酸を含む) |
|
移動相 B: |
アセトニトリル(0.5% のギ酸を含む) |
|
溶出: |
5%(B)~95%(B)の 5 分間の直線的グラジエント |
|
流量: |
0.500 mL/分(溶出ポンプ) |
|
注入量: |
100 µL |
|
システム: |
Xevo TQ-S |
|
イオン化モード: |
ESI+ |
|
キャピラリー電圧: |
3.0 kV |
|
コーン電圧: |
90.0 V |
|
ソース温度: |
150 ℃ |
|
脱溶媒温度: |
550 °C |
|
脱溶媒ガス: |
1100 L/時間 |
|
コーンガス: |
50 L/時間 |
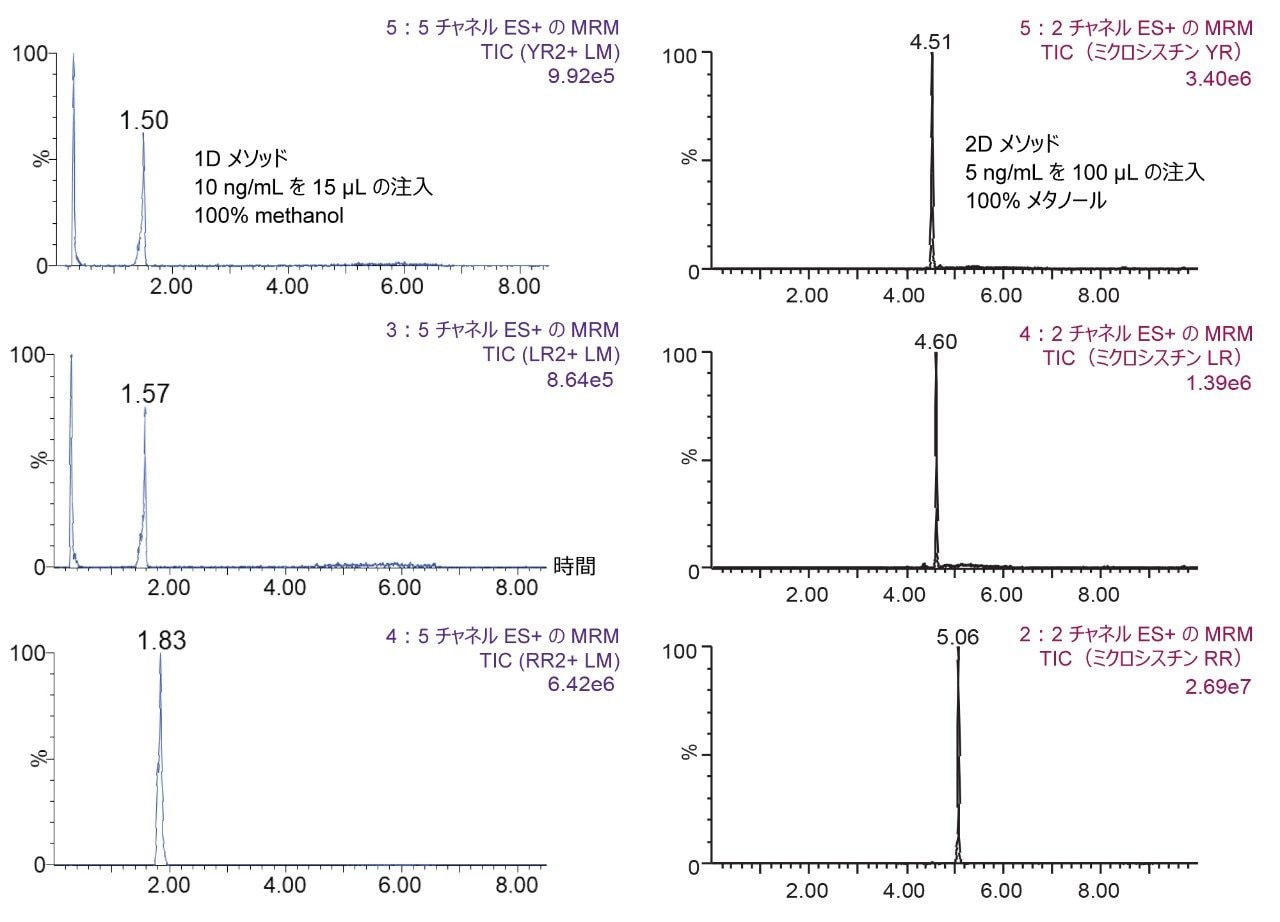
分離条件は、水系および有機系の両方の標準溶液について、2D-LC 6×6 溶出スキーム(図 2)に従って、各ミクロシスチンに対して最適化しました。ミクロシスチンはヘプタペプチドであり、これらの分子種は両性イオン性の挙動を示す場合があり、吸着や溶解性の問題を引き起こす可能性があります。多次元クロマトグラフィーを使用すると、1 次元の分離では見られない幅広いオプションが利用できるようになります。At-Column Dilution(ACD)により、100% 有機抽出液を注入するオプションが可能になり、50% のサンプル前処理作業が不要になります。図 3 のように、1D での 15 µL のアセトニトリル注入と 2D での 100 µL のアセトニトリル注入を並べて比較すると、多次元クロマトグラフィー技術の汎用性がはっきりと分かります。1D での有機抽出液の画期的な効果は既知の事実であり、長年にわたって十分に実証されています。そのため、トラップして溶出する ACD 構成の 2D システムの 100% 有機抽出液機能による大容量注入は、サンプル前処理プロトコルに大きなメリットがあります。
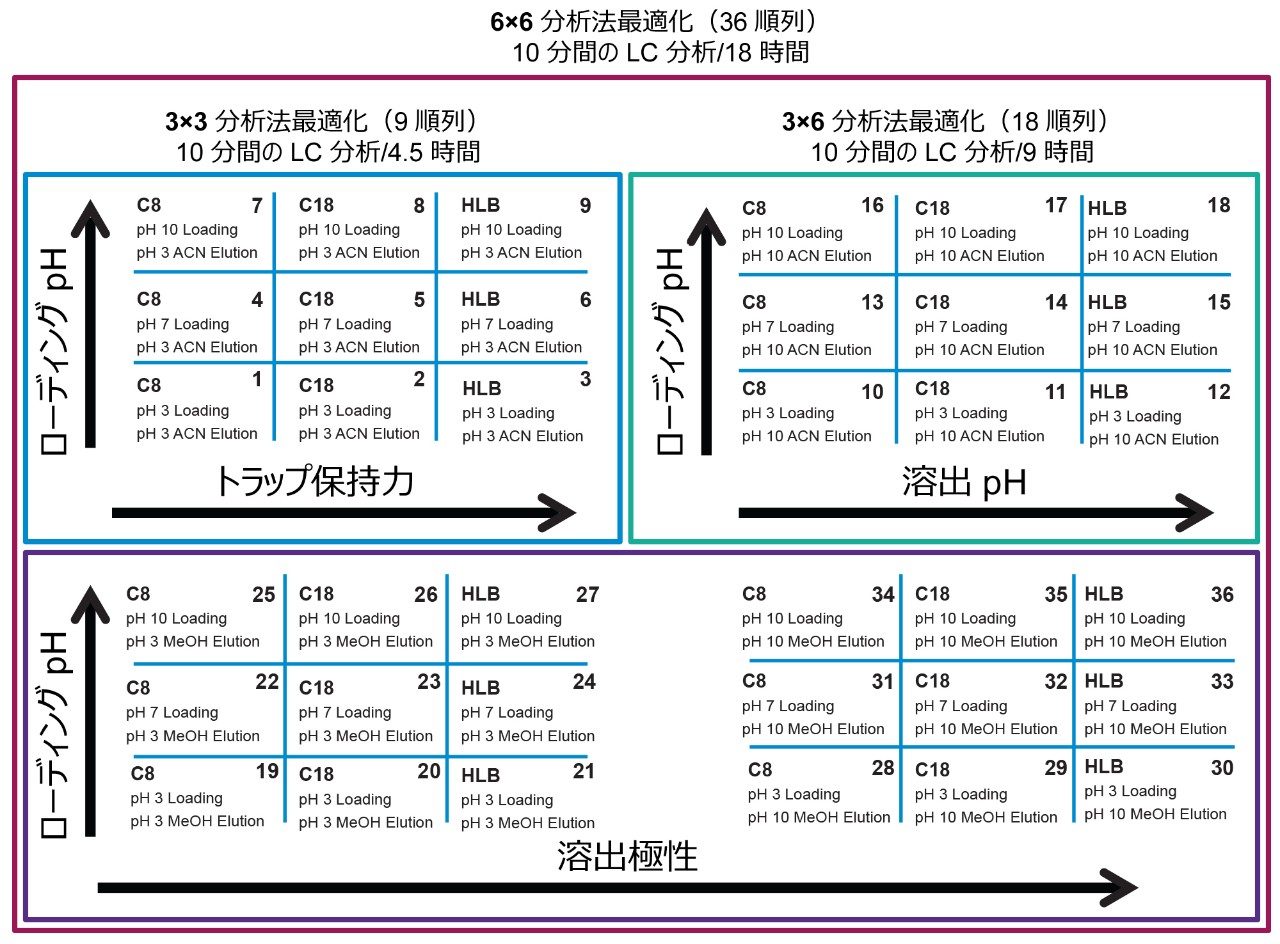
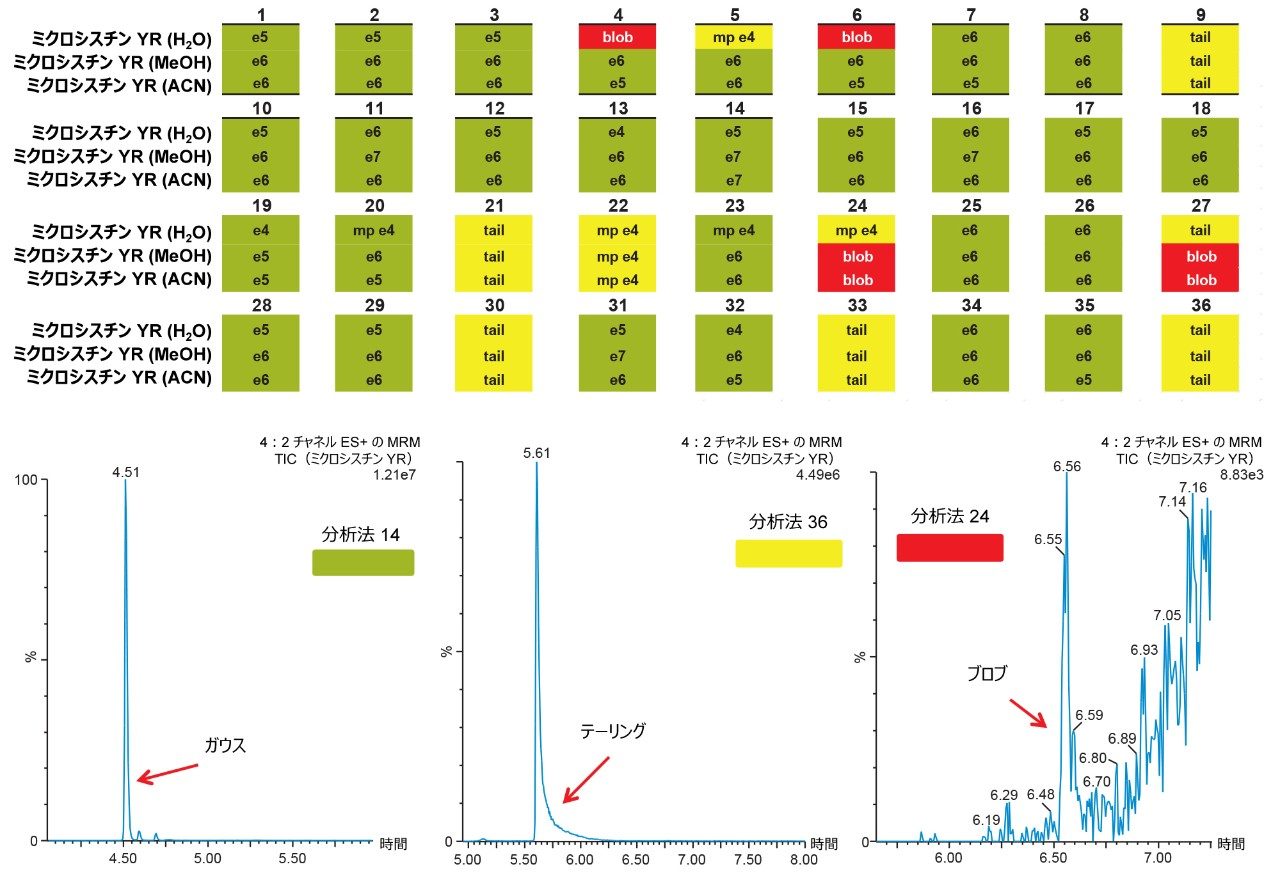
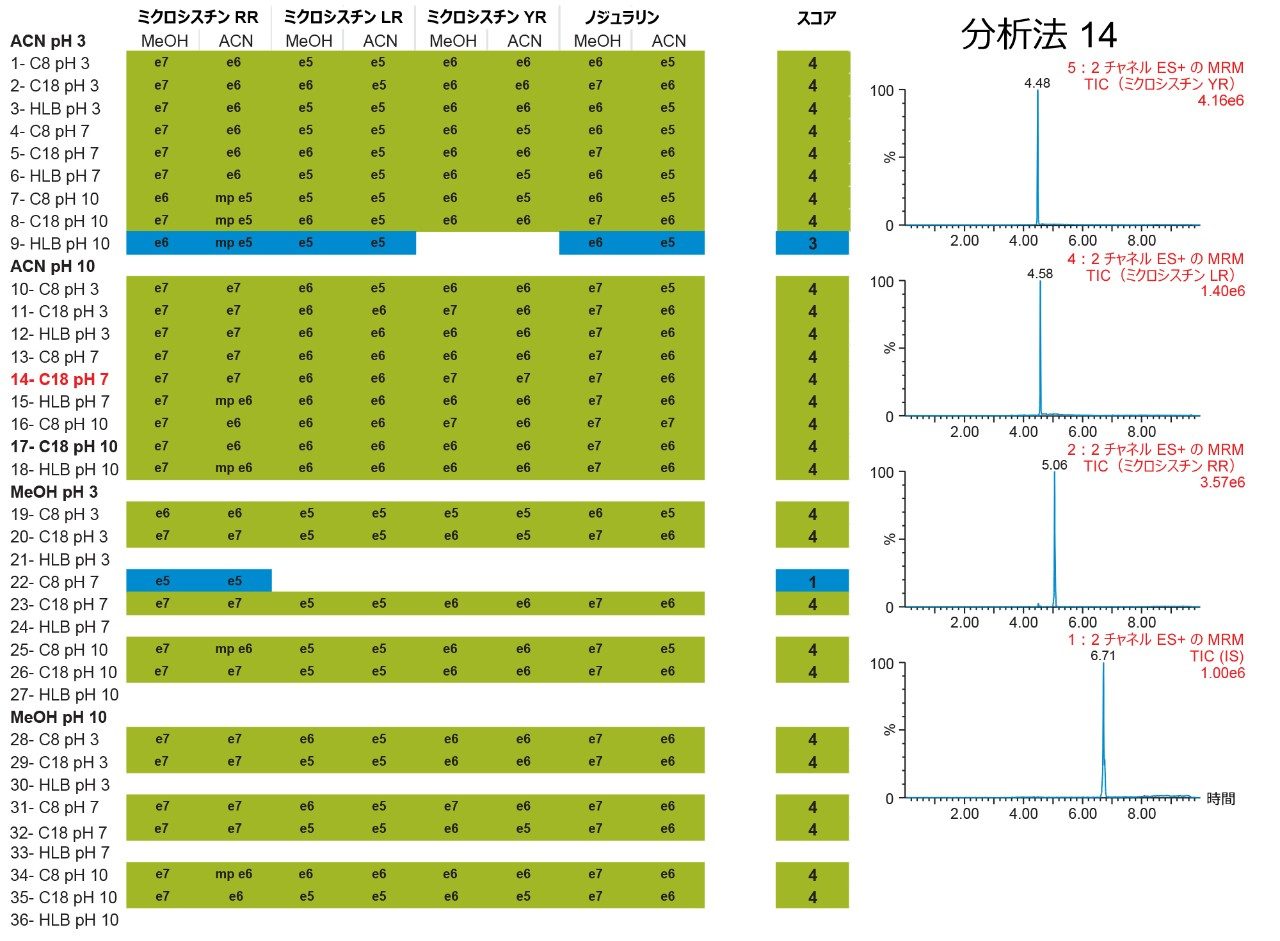
6×6 グリッドの結果は図 4 に示しています。4 つの主要パラメーターを最適化することで、ターゲット化合物を 1 次元目の狭いバンドに集中させ、そしてガウス分布の 2 次元目に移すことができます。36 種の分析法をまとめることにより、ターゲット化合物の分離の挙動を詳細に理解することができました。グリッドは色分けされているため、分かりやすい視覚化効果が得られ、どの条件によってガウス分布が生成されるのかが特定できます(緑色のボックス)。条件のセットによって、クロマトグラフィーピークに異常(リーディング、スプリット、テーリング、ショルダー)があるシグナルが生じる場合も、対応する結果に黄色のボックスでフラグが付けられます。シグナルがない場合はすべて、赤いボックスで強調表示されます。全体として、ミクロシスチン YR は、計 36 種の分析法のうち最大 25 種(水系および有機溶媒系標準試料)または 29 種(有機溶媒系標準試料のみ)がガウス分布を示すことが分かりました。水性標準溶液とメタノールまたはアセトニトリルの標準溶液とを比較する理由は、標準試料がガラスバイアルに水性条件下で保存されている場合に、ガラス表面に吸着または非特異的結合する可能性について調べるためです。各ミクロシスチンについて 36 種の分析法の結果をすべてまとめ、次の段階では、3 つのターゲット化合物すべてに使用できる分析法がどれであるかを特定します。この例では、3 つの化合物と内部標準のみがあるため、図 5 では、36 種の分析法すべてについて、各ミクロシスチンのメタノールおよびアセトニトリル標準溶液に対してクロスリファレンスしています。このまとめにより、黄色と赤色の結果がすべて除去され、ガウス分布(緑色のボックス)および最高強度のみになりました。各分析法はスコアリングされ、最大スコアを得る各分析法について、結果が右端の列に強調表示され、アプリケーションで使用できる分析法が一覧表示されます。この例では、内部標準のノジュラリンを含め、ミクロシスチン YR、LR、RR の分析に 28種 の分析法を選択できます。このアプリケーションでは、メタノール標準溶液とアセトニトリル標準溶液の両方について、4 つの化合物すべてで最も高いシグナル強度が得られる第 14 の分析法を選択しました。
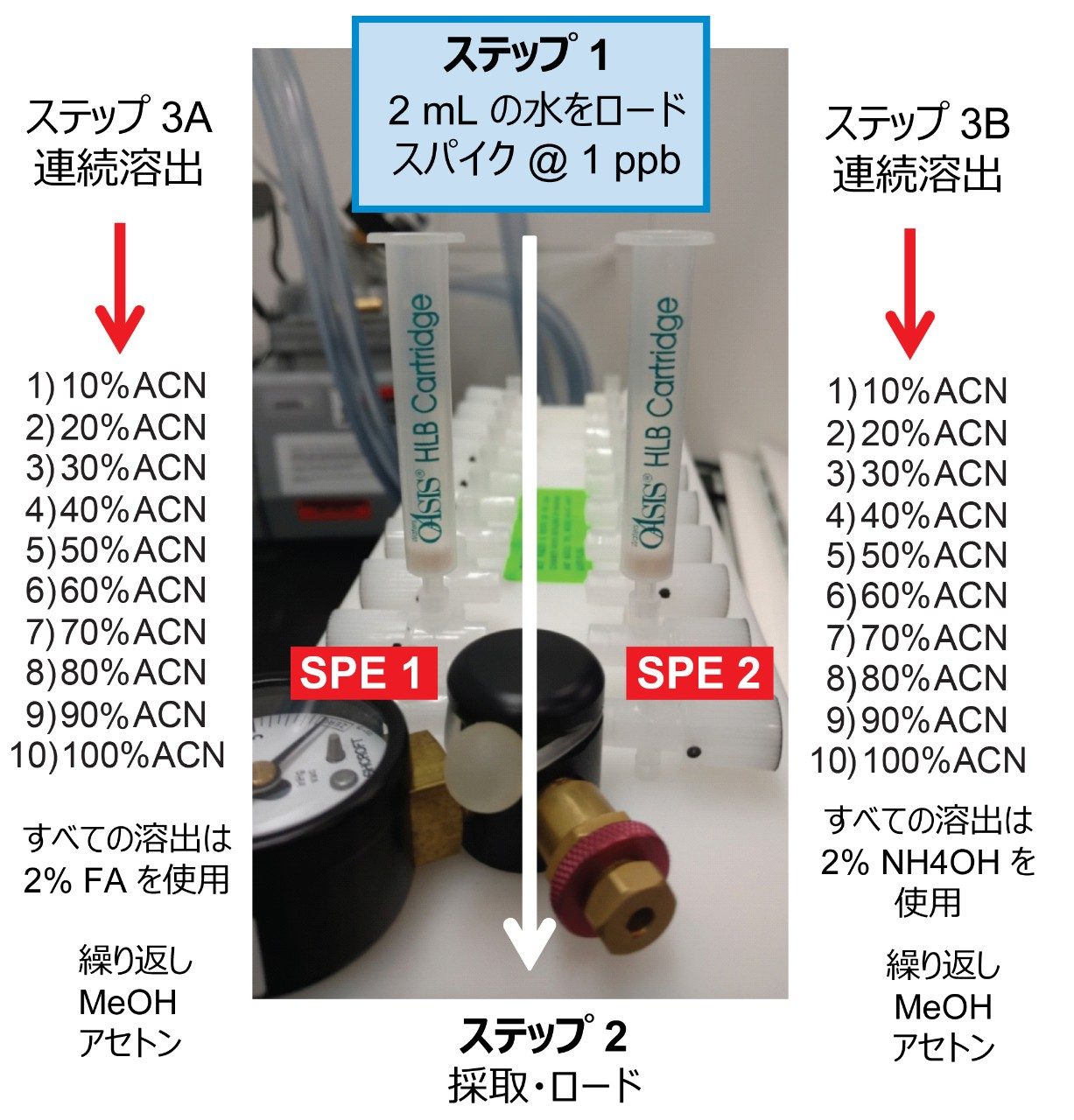
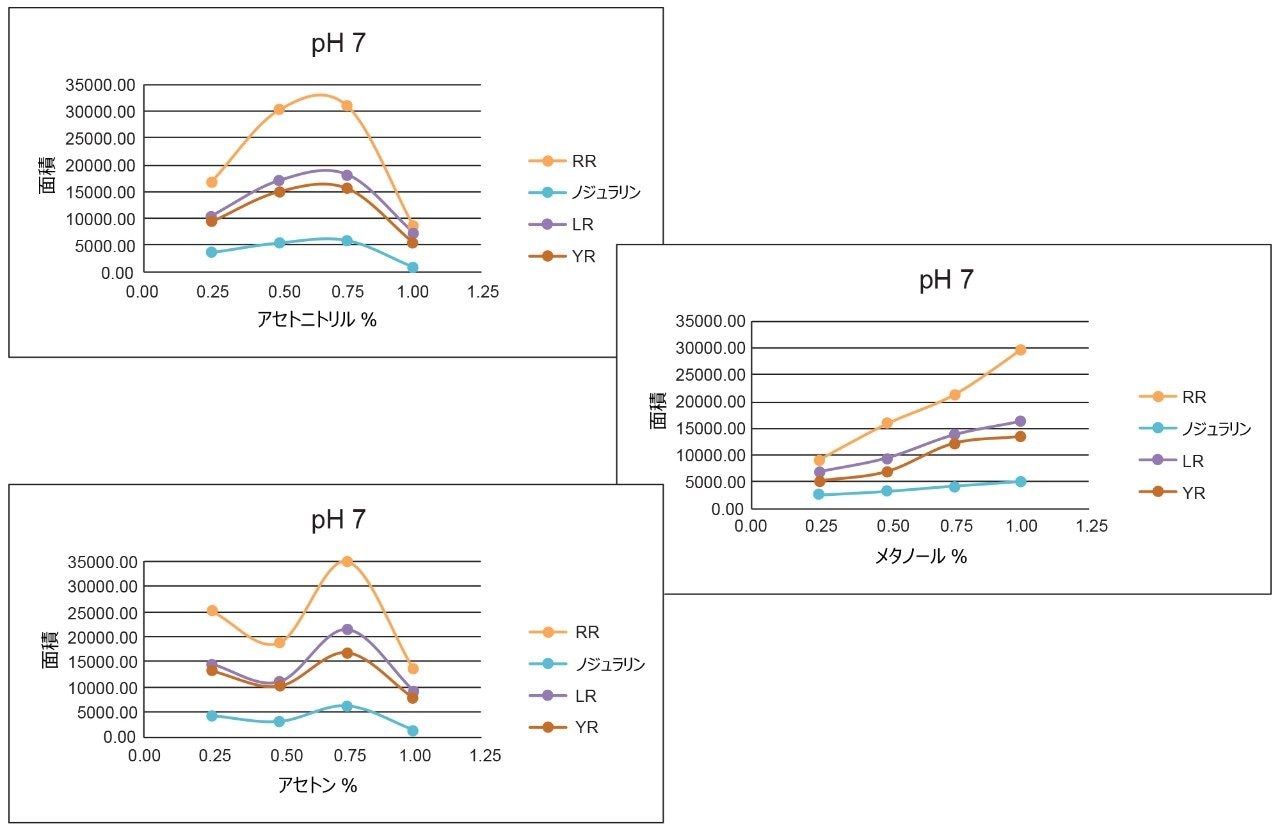
LC および MS の最適化の段階が完了した後、次のステップとして、サンプルのクリーンアップ、濃縮、保持に注目しました。この場合、サンプル前処理レベルで保持をマッピングすると、よりクリーンな抽出物が得られます。この戦略は、ターゲット化合物の pKa および溶解度に対する主要な溶出ポイント(0~100% 回収率)を特定することに依存しています。図 6 は、3 種の溶出強度と 2 つの pH 値による 3 ステップの連続溶出を示しています。実験ワークフローでは、3 種の溶出溶媒(メタノール、アセトニトリル、アセトン)に対して 2 種の固定抽出カートリッジを使用し、pH 3 および 10 で 0~100% の範囲で 10% ずつ溶出溶媒を増加させました。各溶出カットを 2D-LC トラップで分析し、ACD システムで溶出しました。溶媒の蒸発や再溶解は不要でした。結果は表 2 にまとめられています。pH 3 および 10 を使用した理由は、pKa 値によってミクロシスチンの保持の違いを理解するためでした。例えば、中性の溶出条件では、高い k’ 値が得られることが予想されるため、イオン化条件で抽出吸着剤からターゲット化合物をすべて遊離させるには、有機溶液の割合を高くする必要があり、逆もまた同様です。ターゲット化合物が塩基性成分で構成されている場合、この分離挙動が適合します。アセトニトリルを使用する pH 3 でのミクロシスチン RR の分析では、化合物は 20%~40% で完全に溶出し、30% で大部分が溶出します。一方、pH 10 では、RR は 20%~30% のより狭い溶出カットで溶出します。この結果は、RR が酸性物質であることを示唆しています(pH 3では低 k’、pH 10 では高 k’)。ミクロシスチン LR および YR は、低 pH および高 pH での溶出では類似したプロファイルを示しますが、溶出プロファイルは異なります。アセトンおよびメタノールでは pH プロファイルがはっきり見られ(高い溶出率で)、ミクロシスチンの溶解性に関する情報が得られます。
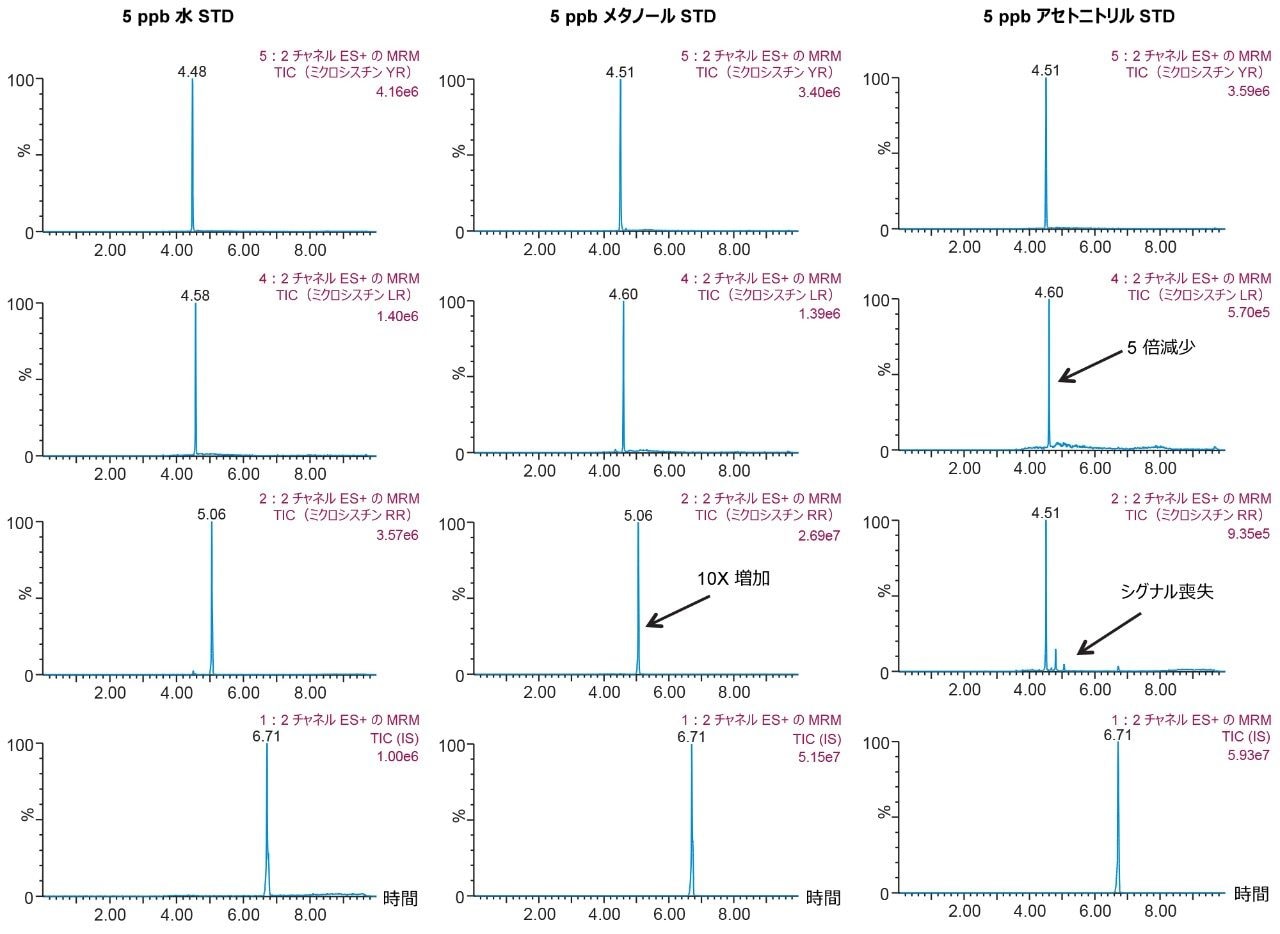
量が増加するにつれて、抽出プロトコルの最適化の間に矛盾が認められました。図 8 には、100% 水、メタノールおよびアセトニトリルで調製した YR、LR、RR の 3 つの標準溶液の結果が示されています。ミクロシスチンは本来ペプチドであるため、水性標準溶液は優れたシグナルを示します。しかし、アセトニトリル標準溶液では、RR のシグナルが完全に失われ、LR のシグナルが 50% 減少しました。ペプチドの持つ性質により、図 7 に示すように、ミクロシスチンは独特の溶解度の傾向12を示します。アセトニトリルおよびアセトンの場合、有機溶媒の割合が低い(<50%)および高い(>75%)場合、YR、LR、および RR のレスポンスファクターは低下し、ピーク面積で最大 50% 減少することがあります。これらの結果は、抽出段階の最終プロトコルに影響を与えました。そこで、表 2 に示す溶出プロファイルを再評価し、この時点で 3 つ目の溶媒(アセトン)を追加して分析を完了しました。表 3 の図は、YR、LR、RR の最新の溶出チャートを示しています。これらの結果から、新しい抽出プロトコルも特定されました。
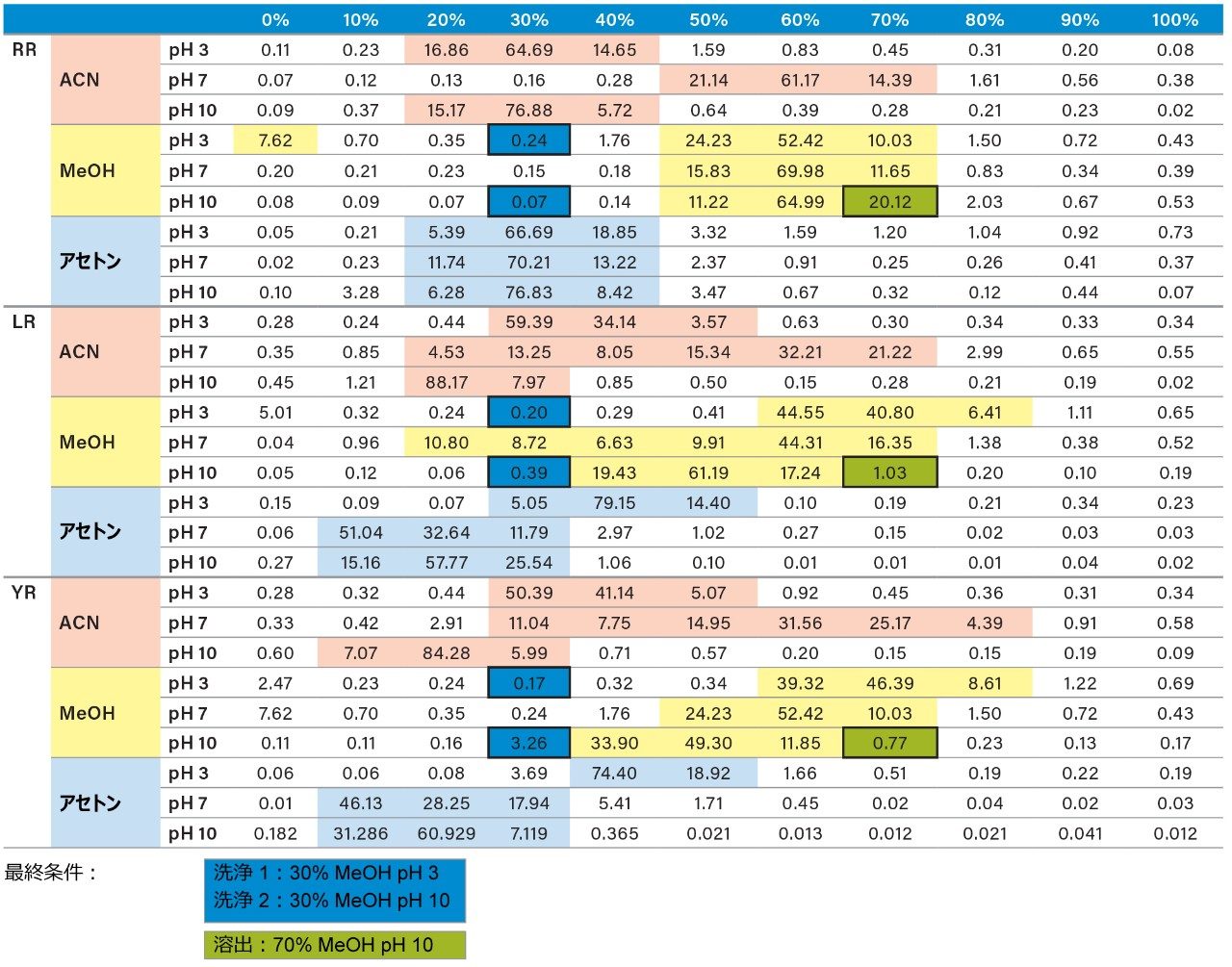
pH 3 の 30% メタノールで洗浄した後、pH 10 の 40% アセトニトリルで溶出する最初の抽出法の結果(図 9)は、尿から抽出したときの RR および LR の回収率が著しく低いことを示しています。これにより、図 8 に見られる傾向が確認されました。したがって、抽出の間の溶解性の問題を回避するために、溶出溶媒としてメタノールを用いる最新の分析法を選択しました。選択した最終固相抽出条件は、pH 3 および pH 8 の 40% メタノールでの 2 回の洗浄ステップ、pH 10 の 70% メタノールでの溶出ステップで構成され、これにより尿中の YR、RR、LR について優れた回収率が得られました(図 10)。
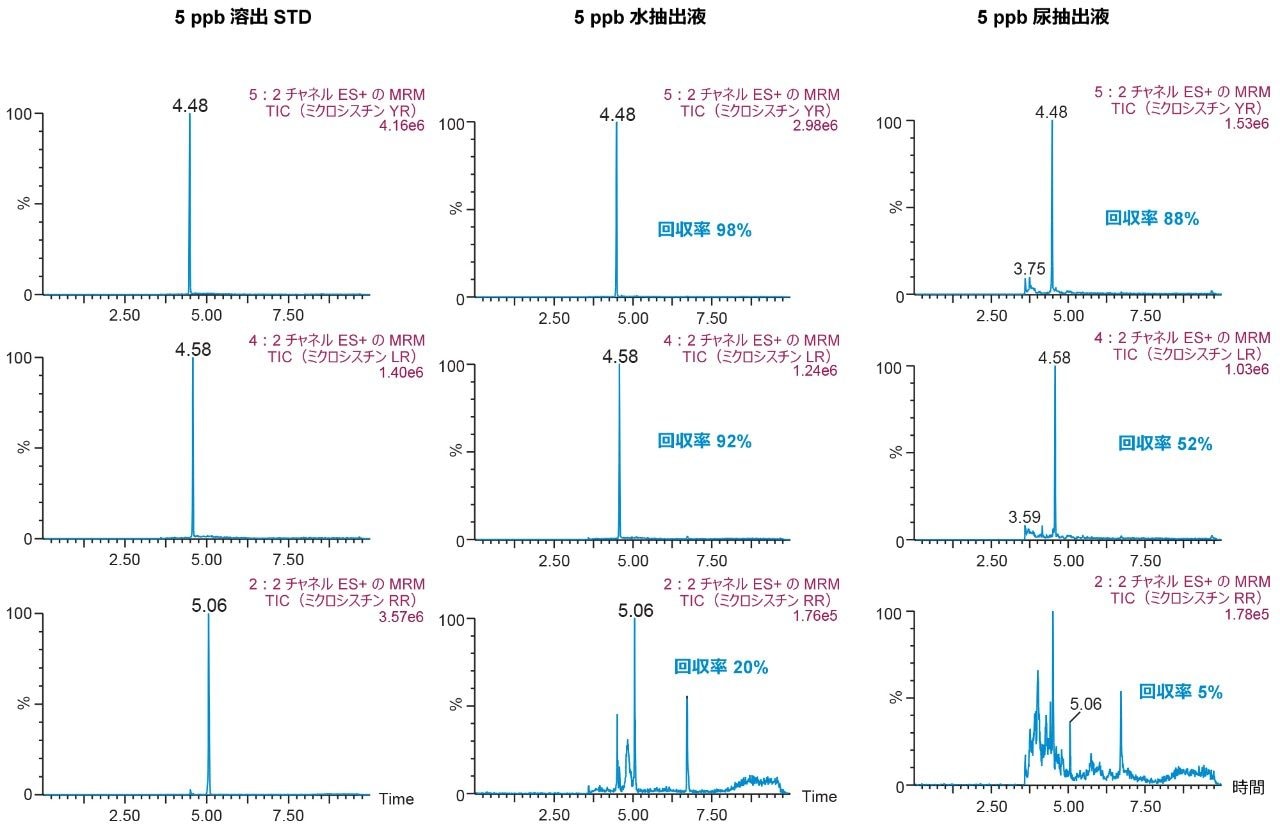
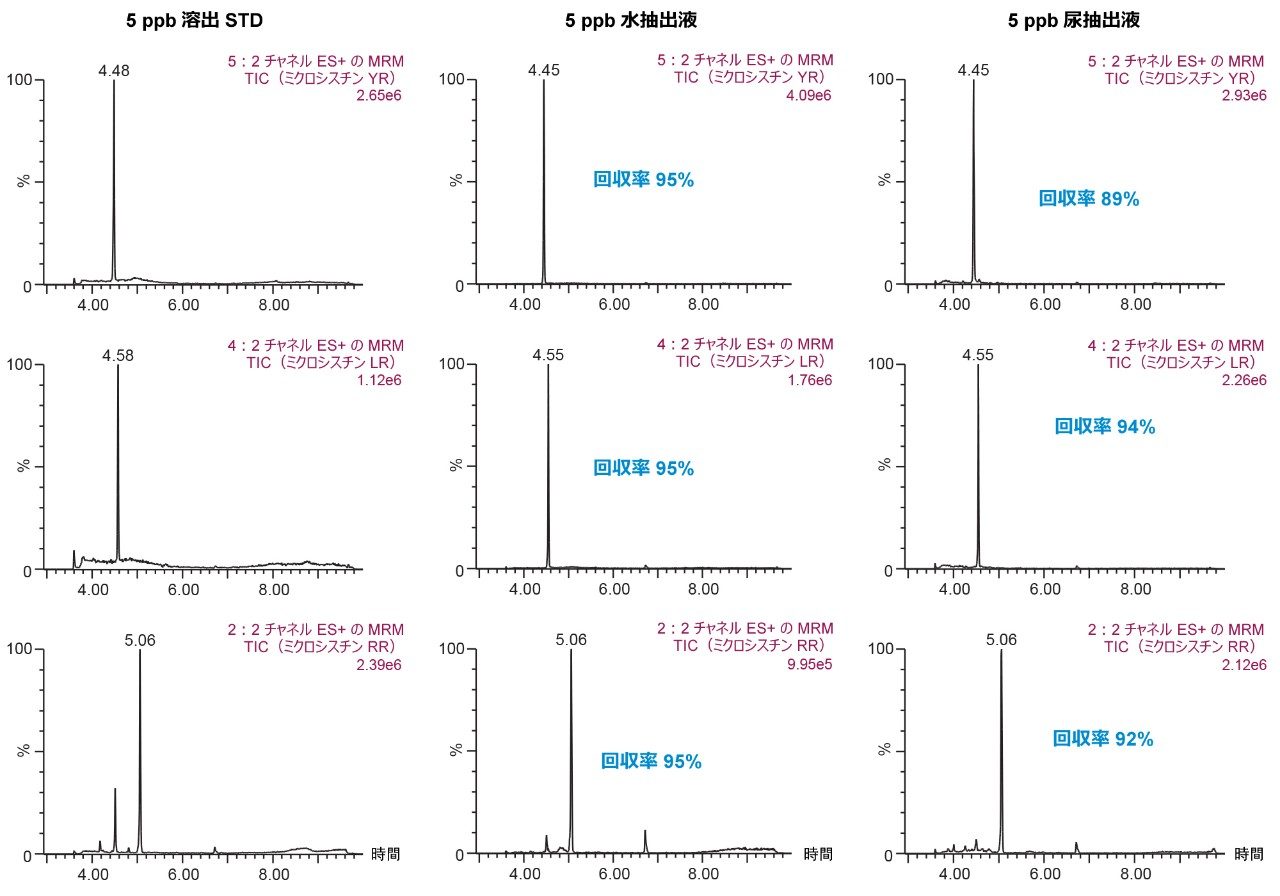
このアプリケーションノートでは、2D-LC-MS/MS を用いた尿中のミクロシスチンのキャプティブ固相抽出プロセスの有効性について説明します。6×6 クロマトグラフィー分析法の最適化は約 18 時間で完了しました。最大 100% の有機抽出液を直接大量に注入するオプションにより、計 30 分未満の作業時間で抽出プロトコルを最適化することが可能になりました。このように、2D-LC-MS/MS の利点が増えたことにより、水および有機抽出液をさまざまな割合で直接注入できるため、時間のかかる蒸発および再溶解のステップの必要性がなくなります。キャプティブ抽出プロトコルにより、尿中のミクロシスチン YR、LR、RR の回収率が 90% に到達ました。
720006684JA、2019 年 10 月