本アプリケーションノートの目的は、MassLynxとProMassおよび、合成ペプチドの質量確認と不純物モニタリングのためのインラインの直交型検出器としてACQUITY QDa 検出器を使用した費用対効果の高いLC-UV-MSベースのワークフローを実証することです。
ペプチドは広範に及ぶ活性を有し、毒性が低いため、ペプチドベースの医薬品の市場は拡大を続けています1 。ペプチド医薬品の大部分の製造に用いられる固相合成法では、脱保護が不十分なペプチドや副反応生成物などのプロセス関連不純物が度々生じます2,3。 また、酸化や脱アミドなど、製造製品に関連する不純物も生じるため、医薬品の不純物プロファイルの複雑さが増します2,3。医薬品の有効性と安全性を確保するために、医薬品規制調和国際会議(ICH)のガイドラインでは新規医薬品の毒性と投与量に基づいた不純物の同定が求められています4。不純物レベルの判断には、一般的に LC-UV による光学検出の閾値が使用されます。しかし、光学検出は既知または特性が明らかなサンプル以外には使用できず、通常は分取と濃縮を行い、さらに MS ベースの分析法で同定する必要があります。ペプチドベースの医薬品が成長を続けるなかで、製品の品質を保ちながら、時機を逸することなく医薬品を上市できる効率的なワークフローが求められています。質量分析法 (MS) などの直交的な検出法を併用すると、合成ペプチド製造時の不純物プロファイリングにおける課題に対処することができます。
ACQUITY QDa 検出器を導入すると、LC-UV ベースのワークフローに MS 検出を組み込むことができ、効率的で費用対効果に優れたソリューションとなります5。また、以前に示したとおり、MassLynx と ProMass ソフトウェア(Novatia 社)の併用により、ACQUITY QDa 検出器で得られる MS データの自動解析が可能になるため、合成ペプチドのスクリーニングをハイスループットで行うことができます6。本アプリケーションノートでは費用対効果に優れた LC-UV-MS ベースのワークフローを示します。このワークフローでは MassLynx と ProMass を併用して質量確認を行い、ACQUITY QDa 検出器をインラインの直交的な検出器として使用して合成ペプチドの不純物モニタリングを行います。このワークフローを説明するために、臨床的に意義のある合成ペプチドの Eledoisin の解析を行いました。
合成ペプチドの Eledoisin(pGlu-Pro-Ser-Lys-Asp-Ala-Phe-Ile-Gly-Leu-Met-NH2)は New England Peptide 社より購入しました。HPLC グレードの水、アセトニトリル、ギ酸は Fisher Scientific 社より購入し、そのまま使用しました。ペプチドのストック液は水に 2 mg/mL の濃度で溶解したのち、必要な濃度に希釈しました。分析の最適化は、注入量を 5 µL に保ったまま、ペプチドの質量負荷を 0.05 µg から 5.00 µg まで変動させて行いました。サンプル負荷 2 µg が最適な質量負荷と判明したため、別途記載している場合を除き、すべての分析でサンプル負荷 2 µg としました。
|
LC システム: |
ACQUITY UPLC H-Class Bio |
|
検出器 |
ACQUITY UPLC TUV 検出器、 5 mm フローセル、λ = 215 nm ACQUITY QDa 検出器(パフォーマンスモデル) |
|
LC カラム |
ACQUITY UPLC CSH C18、1.7 μm、130 Å、2.1 mm x 100 mm |
|
カラム温度 |
60 ℃ |
|
サンプルバイアル |
12 mm × 32 mm ガラスバイアル、トータルリカバリー |
|
注入量 |
5 µL |
|
移動相 A |
0.1% ギ酸含有水溶液 |
|
移動相 B |
0.1% ギ酸含有アセトニトリル |
|
時間(分) |
流速(分) |
%A |
%B |
|---|---|---|---|
|
初期値 |
0.2 |
82 |
18 |
|
2 |
0.2 |
82 |
18 |
|
2.01 |
0.2 |
82 |
18 |
|
22.01 |
0.2 |
72 |
28 |
|
22.02 |
0.2 |
20 |
80 |
|
24.02 |
0.2 |
20 |
80 |
|
24.03 |
0.2 |
82 |
18 |
|
30 |
0.2 |
82 |
18 |
|
質量範囲: |
m/z 350~1,250 |
|
イオン化モード: |
ESI+ |
|
分取モード: |
コンティナム |
|
サンプリングレート: |
2 ポイント/秒 |
|
コーン電圧: |
10 V |
|
プローブ温度: |
500 ℃ |
|
キャピラリー電圧: |
1.5 kV |
|
データ管理: |
MassLynx v 4.1 ProMass for MassLynx |
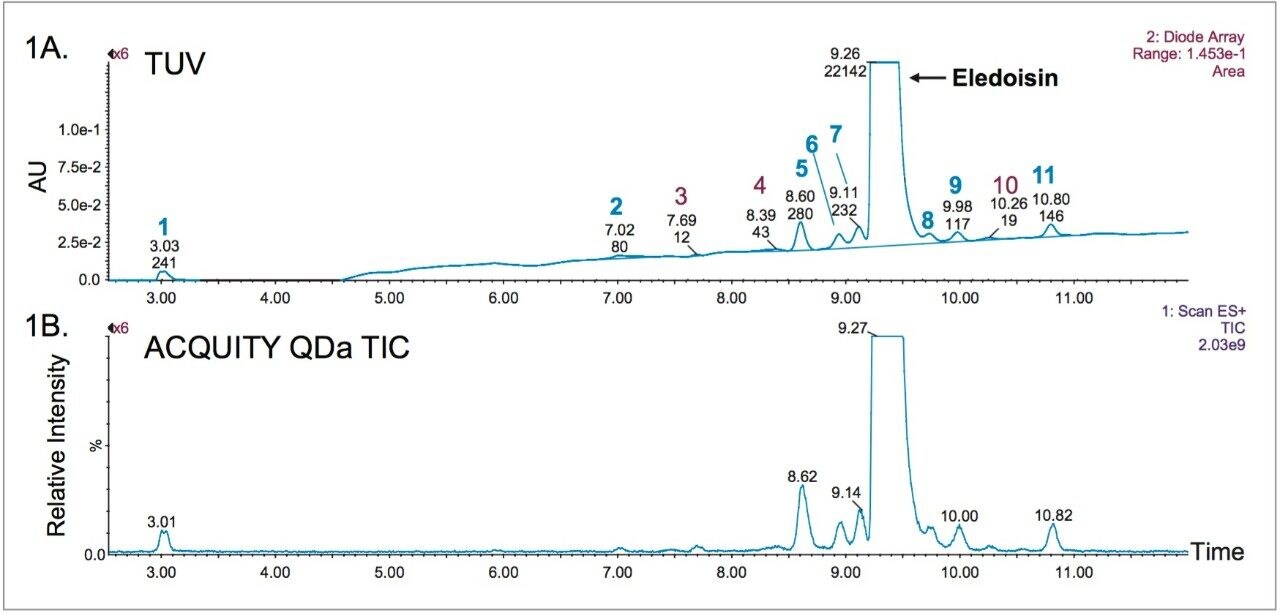
LC-UV ベースの手法による合成ペプチドの不純物プロファイリングでは、ピーク分離能と検出器感度の最適化が必要です。この実験では、図 1 に示すように、20 分のグラジエントで主要ピークと 11 の不純物ピークを分離できることがわかりました。ICH ガイドラインでは 1 日摂取量に基づいた不純物の同定が推奨されています。この実験では、メソッドの広範な適用性を判断するためのカットオフ値を S/N 比 10 以上、相対存在比 0.2% としました。図 1 の 11 のピーク中 8 つは、MassLynx による自動ピーク積分でこの基準を満たすピークと判明したもので、青字の番号で示されています。光学検出の S/N 比のカットオフ値を上回っていたピークはすべてマススペクトルでも認められました(図 1B)。
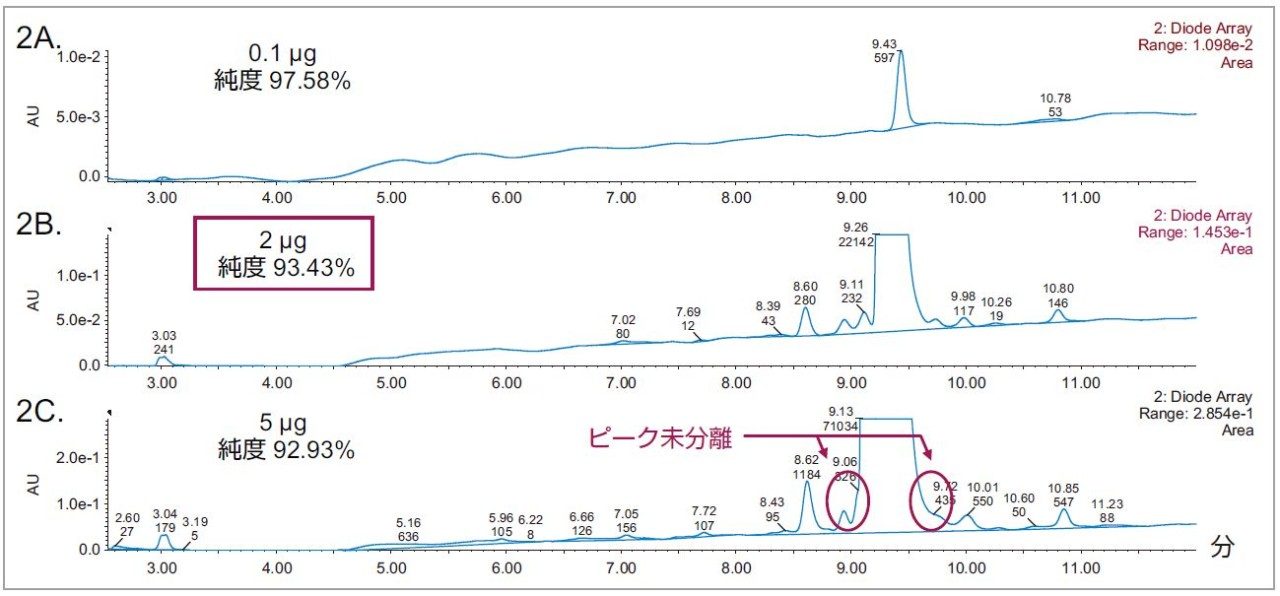
添加試験を行う代わりに、質量負荷による純度(%)を用いて、分析の適用範囲を求めました。濃度を段階的に高めた 10 種類のサンプル(0.01 mg/mL から 1.0 mg/mL まで)を調製し、最適なグラジエントで評価しました。光学検出で得られた結果の総ピーク面積に基づく純度評価で、質量負荷 0.5 µg を上回る場合に 92.74 % ± 0.45% で安定であることがわかりました。分析の正確さを評価するために、3 回の繰り返し測定を行い、純度の %RSD を求めました。その結果、すべての質量負荷で %RSD は 5% を下回りました。これらのデータを総合的に判断し、Eledoisin とその不純物の S/N 比を 10 以上に保ち、最適なクロマトグラフィー性能を得られる質量負荷を 2 µg と判断しました(図 2)。
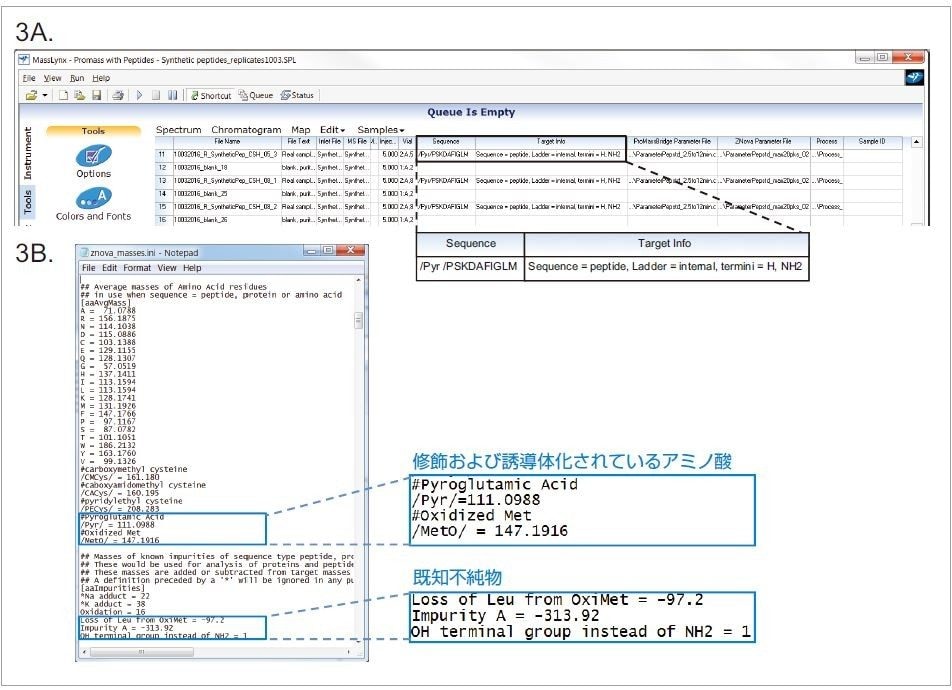
メソッドを最適化すると、質量検出のメリットを活用することができるようになります。ACQUITY QDa 検出器の使用により、不純物と標的ペプチドの質量差をソフトウェアで求めて、不純物を同定できます。MassLynx と ProMass を併用すると、合成ペプチドの自動データ取得と解析が可能です。図 3A は MassLynx のサンプルリストの例で、データ取り込み用の装置メソッド、標的質量の計算で必要となる情報、ProMass での合成ペプチドのデータデコンボリューション用パラメーターファイルが表示されています。ペプチドの不純物プロファイリングでは、図 3A の拡大図に示されているように、標的ペプチドの情報を Sequence 列と Target Info 列に入力する必要があります。この例では、「Ladder = internal」という情報を指定して、どちらの末端を有するフラグメントもすべて検出されるようにしました。標的合成ペプチドの Eledoisin の C 末端には OH ではなく一級アミノ基(NH2)があるため、質量を正確に決定するには末端をこのように指定する必要があります。MS スペクトル解析用パラメーターは、ProMassBridge Parameter File 列と Znova Parameter File 列で指定するファイルを使って定義します。ProMassBridge Parameter File は ProMass と MassLynx とのやり取りを可能にするファイルで、解析対象とする保持時間ウィンドウ、スムージング、ベースライン減算などのユーザー定義パラメーターが含まれています。ProMass ソフトウェアで使用する Znova™ Parameter File には、スペクトルデコンボリューション用パラメーターと、レポートを簡素化するための閾値が記録されています。
Znova 解析ファイルは、図 3B に示されているように、標的の同定と不純物プロファイリングに使用するカスタマイズ可能なデータベースを指定します。標的質量の計算用の「構成要素」として、天然に存在するアミノ酸とともに、修飾および誘導体化されているアミノ酸を指定することができます。Eledoisin の例では、合成ペプチド末端のアミノ酸誘導体を示すために Pyroglutamic Acid(ピログルタミン酸)(/Pyr/=111.1)を指定しました。同様に、既知不純物については、標的ピークとの質量差の計算値を手動で指定できます。図 3B の青色の四角形で囲まれている部分に示されているように、酸化した標的ペプチドからのロイシンの欠損(Loss of Leu from OxiMet = -97.2)、想定されるペプチドフラグメント(Impurity A = -313.9)、C 末端の置換(OH terminal group instead of NH2 = 1)は、この実験の前の高分解能質量分析ですでに判明していました。デコンボリューションレポートでは、一致している質量差と、それに対応する不純物が示されます。
上記のメソッドを使用して Eledoisin を分析し、標的質量の確認と不純物スクリーニングを行いました。レポートで示されたサンプルの純度は 88.87% で、この数値はマススペクトル中の標的質量(付加イオンを含む)の存在比(%)に基づいて推定し、クロマトグラムのピーク面積比(%)で標準化したものです。純度(%)は、質量誤差や存在比(%)などの標的ペプチドに関する情報とともに、Target Mass Summary 表に示されています(図 4)。Sequence Ladder Summary 表には同定されたペプチドフラグメント配列が示されています。Chromatogram Summary 表には、クロマトグラム上の閾値(0.2%)を上回った検出ピークがすべて示されています。この表の Spectral Quality は、存在比と検出された電荷状態の数に基づいて判定されており、カットオフ値(スコアが 4 以上)を下回ったピーク番号 4 および 5 以外の不純物については「ok」と示されました。この例で、保持時間 8.40 分(ピーク番号 4)がスコア不足(low score)となった原因はスペクトルのノイズが高かったこと、保持時間 8.62 分(ピーク番号 5)がスコア不足となった原因はスペクトルで認められた電荷状態が 1 つのみであったためにベースピークの電荷が誤同定されたことにあります。Spectrum Quality の閾値はユーザーが設定することができ、デコンボリューションの入力および出力スペクトル両方の品質を指定して、不純物同定結果の信頼性を高められます。
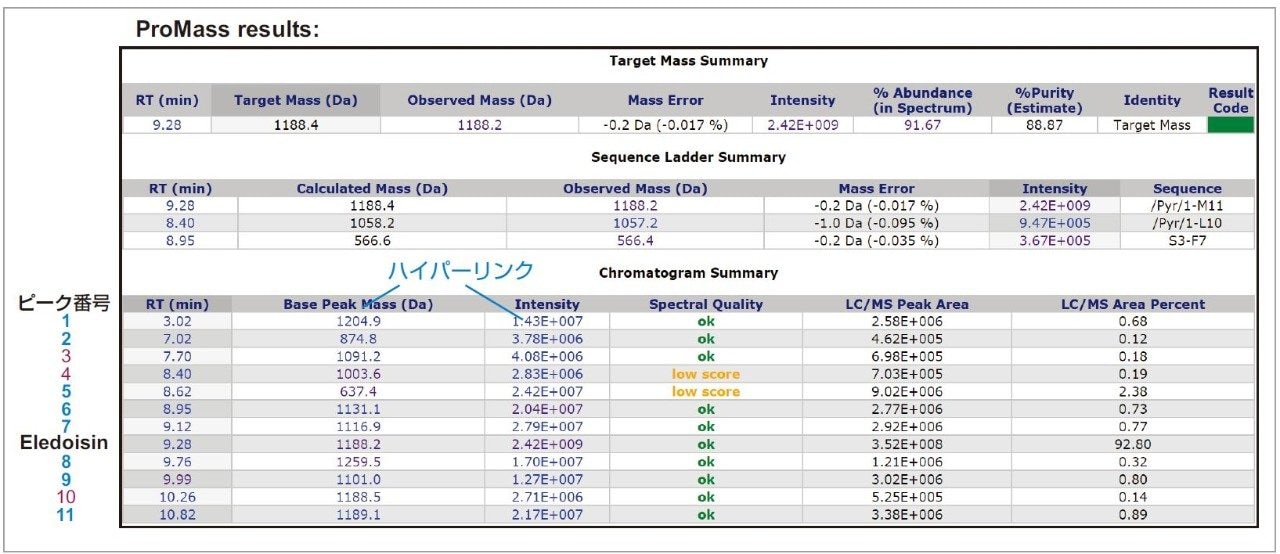
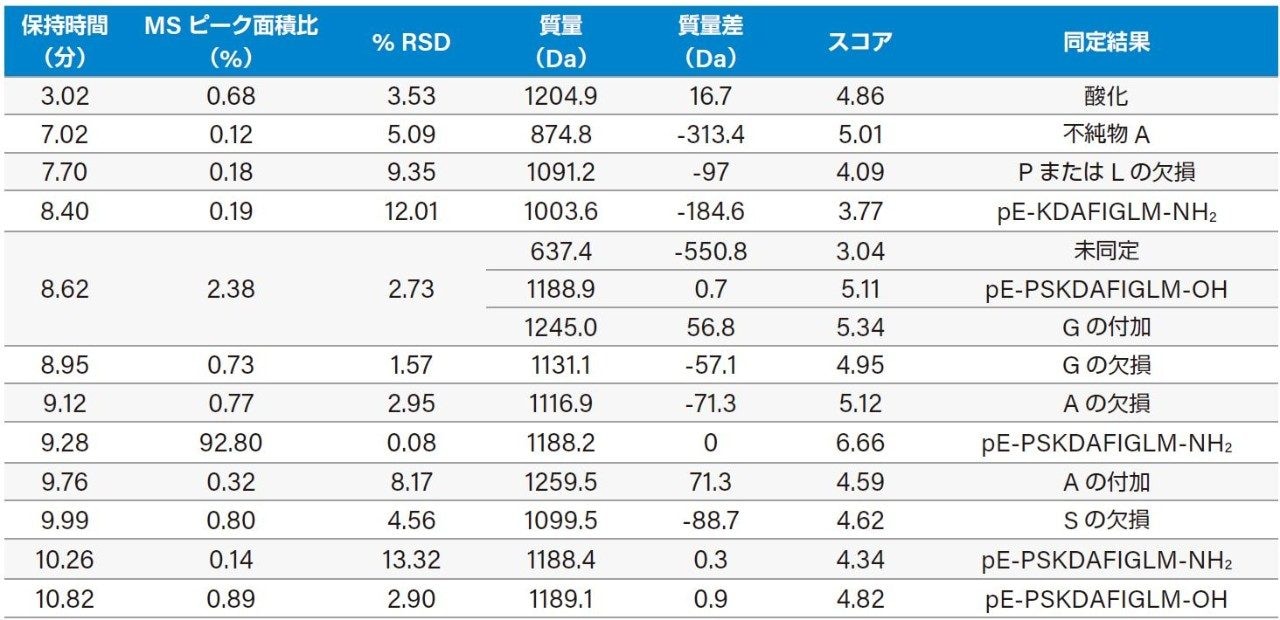
ProMass ソフトウェアには、Chromatogram Summary 表のハイパーリンクをクリックして、分析結果それぞれの詳細情報を表示する機能があります。保持時間 9.99 分のピークの表示例を図 5 に示します。上側の枠内には、ピークのリストとそのスコアおよび推定結果が示されています。下側の枠内には、9.99 分に検出されたすべてのピークのデコンボリューション後のマススペクトルが示されています。このリストでは、質量 1101.0 Da のピークは標的ペプチドからセリン(S)が欠損したものである可能性が示されています。保持時間、ピーク面積比(%)とその %RSD、質量、不純物と標的ペプチドの質量差、検出された不純物の推定結果など、ProMass で得られたデータ解析結果を表 1 に示します。3 回の繰り返し測定で対象としたすべての不純物について同定結果の再現性は良好だったため、LC-MS ベースのワークフローによる合成ペプチドの不純物プロファイリングの信頼性が高いと言えます。

合成ペプチドの質量確認および不純物プロファイリングの自動ワークフローを、ACQUITY QDa 検出器、MassLynx、ProMass の併用により開発しました。Eledoisin の質量負荷 2 µg で、光学検出の閾値 0.2% を上回る不純物の検出と同定に成功しました。標的ペプチドと不純物の両方の保持時間、質量、推定結果は、ProMass のデコンボリューションに関するサマリーに示されています。デコンボリューションの信頼性は各ピークのスコアとして示されています。光学検出ワークフローに ACQUITY QDa 検出器を追加することで、不純物解析の時間が大幅に短縮されます。また、MassLynx と ProMass を併用することで自動ワークフローによるハイスループットスクリーニングが実現し、開発や品質管理における合成ペプチドの不純物プロファイリングの生産性が向上します。
720005921JA、2017 年 2 月