栄養補助食品中のイソフラボン類の標準的な分析法はUSP(米国薬局方)1 やAOAC(association of analytical communities)2 などの機関によって確立されました。 この分析法は分離と定量のために C18カラムを使用した逆相 LC 法と紫外可視光 (UV/Vis) 分光法を用いています。イソフラボン類は互いの構造が非常に類似しているため、この分析法によるクロマトグラフィー分析時間は、70分を超えるのが一般的です。このため、より高速なイソフラボン分析法の開発が強く望まれています。
本アプリケーションノートでは、USPメソッドの WatersR ACQUITY Arc UHPLC システムへの移管についてご紹介します。ACQUITY Arc システムによる分析時間は、カラム洗浄と平衡化を含めわずか18分でした。本研究では分析法移管を迅速化するために、ACQUITY QDa 質量検出器を使用しました。この分析法により以下のメリットが得られました。
本分析法によるメリット:
イソフラボン類は主に大豆(Glycine max)、アカツメクサ(Trifolium pretense)およびクズ(Pueraria lobata)などの植物中に含まれます。これらの植物にみられる 12 種の主要なイソフラボン類は、ダイゼイン、グリシテイン、ゲニステインや、それらの配糖体、マロニル配糖体およびアセチル配糖体の誘導体です。12 種のイソフラボン類および内部標準物質であるアピゲニンの構造式を図 1 に示します。このようなホルモン様化合物は、更年期および更年期後の症状を緩和する医薬品に使用されることが多く、また、アジアにおいて乳癌発症の割合が低いことや、アルツハイマー病の進行を遅らせることとも関連しています。
栄養補助食品中のイソフラボン類の標準的な分析法は USP(米国薬局方)1 や AOAC(association of analytical communities)2 などの機関によって確立されました。この分析法は分離と定量のために C18 カラムを使用した逆相 LC 法と紫外可視光(UV/Vis)分光法を用いています。イソフラボン類は互いの構造が非常に類似しているため、この分析法によるクロマトグラフィー分析時間は、70 分を超えるのが一般的です。このため、より高速なイソフラボン分析法の開発が強く望まれています。
本アプリケーションノートでは、USP メソッドの Waters ACQUITY Arc UHPLC システムへの分析法移管についてご紹介します。ACQUITY Arc システムによる分析時間は、カラム洗浄と平衡化を含めわずか 18 分でした。本試験では分析法移管を迅速化するために、ウォーターズの ACQUITY QDa 質量検出器を使用しました。ここでは、ピークの同定と分析法の最適化に対する質量検出の利点についても重点をおいて説明します。

サンプル前処理
標準物質、ダイジン、グリシチン、ゲニスチン、ダイゼイン、グリシテイン、ゲニステイン、およびアピゲニンは ChromaDex 社(アーバイン、カリフォルニア州)および INDOFINE Chemical 社(ヒルスボロタウンシップ、ニュージャージー州)より購入しました。脱脂粉末大豆 RS は US Pharmacopeia(ロックビル、メリーランド州)、NIST SRM 3238 は NIST(ゲイザースバーグ、メリーランド州)、また有名ブランドのイソフラボンを含む栄養補助食品試料は、通信販売で購入しました。
標準溶液と試料溶液は USP のイソフラボン分析法と同じ手順で調製しました1。 試料溶液はさらに検量線範囲に合わせてアセトニトリル水溶液(アセトニトリル:水 = 2:3) で多段階に希釈しました。内部標準の濃度は常に 4 ppm の一定にしました。
|
UHPLC システム |
ACQUITY Arc |
|
検出器 |
2998 PDA |
|
ソフトウェア |
Empower 3 |
|
カラム |
CORTECS C18、2.7 µm、3.0×100 mm |
|
カラム温度 |
30 ℃ |
|
移動相 A |
0.1% ギ酸水溶液 |
|
移動相 B |
0.1% ギ酸含有アセトニトリル |
|
注入量 |
2.0 µL |
|
流速 |
1.08 mL/分 |
|
分析時間 |
18.0 分 |
|
UV 検出 |
260 nm |
|
UV 分解能 |
1.2 nm |
|
|
時間(分) |
流量(mL/分) |
%A |
曲線 |
|---|---|---|---|---|
|
1 |
初期値 |
1.08 |
90 |
6 |
|
2 |
14.40 |
1.08 |
70 |
6 |
|
3 |
14.50 |
1.08 |
10 |
6 |
|
4 |
15.20 |
1.08 |
10 |
6 |
|
5 |
15.40 |
1.08 |
90 |
6 |
|
6 |
18.00 |
1.08 |
90 |
6 |
|
MS システム |
ACQUITY QDa(パフォーマンス) |
|
イオン化モード |
ESI+ |
|
キャピラリー電圧 |
0.8 kV |
|
コーン電圧 |
15 V |
|
プローブ温度 |
600 ℃ |
|
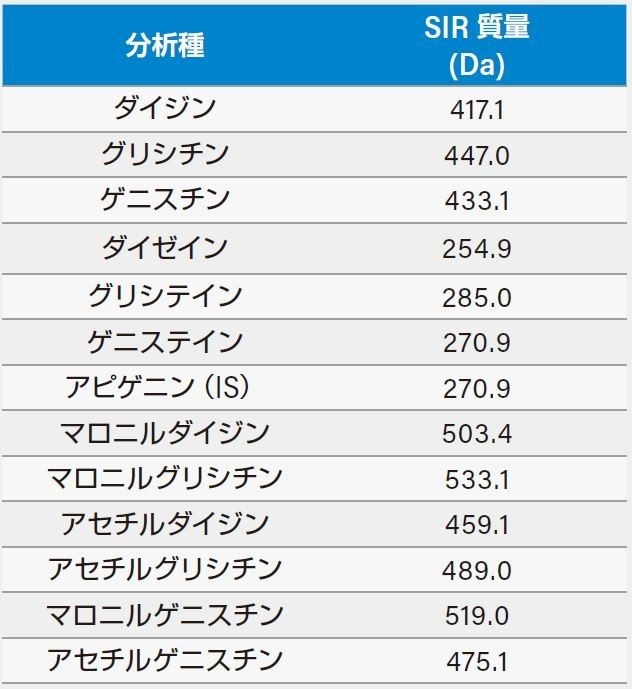
SIR 質量 |
(下記参照) |
USP メソッド(イソフラボン粉末抽出物)1 を CORTECS C18 カラム(2.7 µm、3×100 mm、製品番号 186007372)を使用して ACQUITY Arc UHPLC システムに移管しました。CORTECS カラムの 2.7 µm の充塡剤はソリッドコアパーティクルであり、同じ粒子径の全多孔性パーティクルと比べて低い背圧で高い分離効率が得られます。ウォーターズの ACQUITY UPLC カラムカリキュレーターを使用して、USP メソッドのグラジエント溶出条件を新しいグラジエント溶出条件に変換しました3。USP メソッドのカラムパラメーター(5 µm、3.0×250 mm)と CORTECS C18 カラムパラメーター(2.7 µm、3.0×100 mm)、および USP メソッドの 74 分のグラジエント溶出条件をカラムカリキュレーターに入力し、USP メソッドと同等の 18 分のグラジエント溶出条件を算出しました。移動相の添加剤は、0.05% リン酸を MS と相性の良い 0.1% ギ酸に変更しました。
工場出荷時に設定された ACQUITY QDa 検出器の装置パラメーターは変更することなく使用しました。カラム温度は 40℃で試験しましたが、USP のピーク分解能の適合基準を満たすように最適化して 30℃としました。図 2 は、USP 準拠の脱脂大豆粉 RS(非加熱と加熱)のクロマトグラム、および ACQUITY QDa 質量検出器を用いて得られた選択イオンレコーディング(SIR)のクロマトグラムです。質量検出を使用してピークの同定をしました。
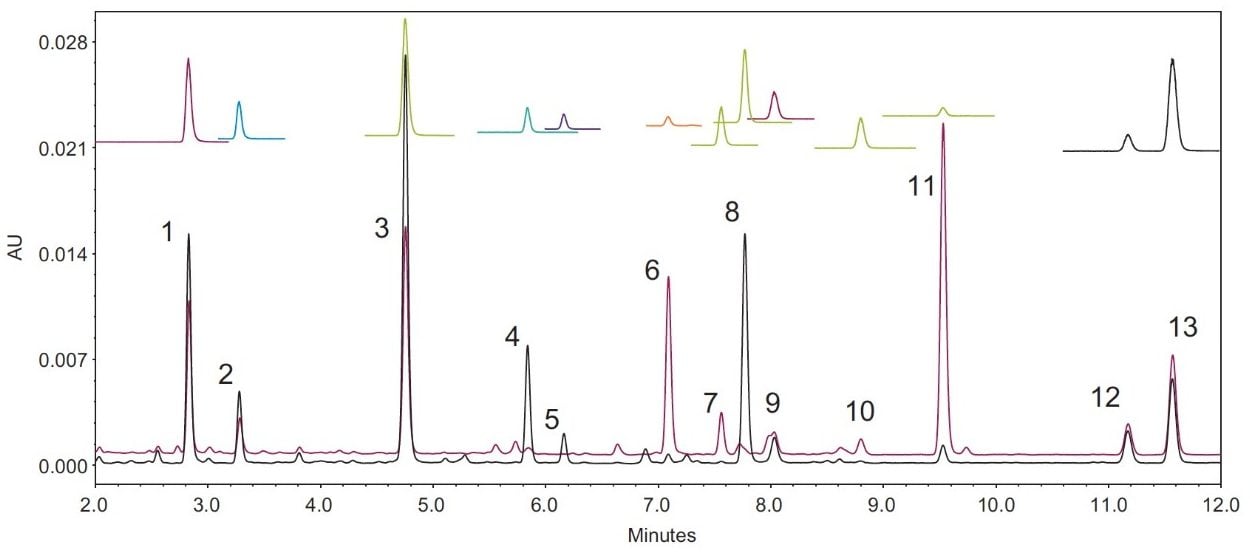
アセチルおよびマロニルイソフラボンの標準物質は市販されていないため、これらの化合物のピーク同定は、参照物質および USP 基準に説明されたパターンマッチング法を用いて実施しました。脱脂大豆(DFS)の熱処理により、マロニル体はアセチル体に変換できます。非加熱および加熱 DFS のクロマトグラムと参照クロマトグラムとを比較することで、これらのアセチルおよびマロニルイソフラボンのピークの同定ができます。しかし、カラム、移動相の添加剤または LC システムなどの LC 条件を変更した場合は特に、このパターンマッチング手法は信頼できなくなります。ACQUITY QDa はエレクトロスプレーイオン化(ESI)で生成したイオンをユニットマス分解能(0.7 Da)で検出します。表 1 はこれらのイソフラボン類の分子イオンの一覧です。質量検出を用いることで、これらの化合物を選択的に検出し、溶出位置が近接した化合物からのあらゆる干渉を排除できました。
ゲニステインとアピゲニンは同一質量を持ちますが、これらのピークはクロマトグラフィーによって十分に分離されていました(図 2)。さらに質量検出(ACQUITY QDa 検出器)を追加したことで、個別の標準物質に頼ることなく、ピーク ID をアセチルおよびマロニルイソフラボンと正確にアサインすることが可能になりました。
また、ACQUITY QDa 検出器により分析法の迅速な最適化も可能でした。これは各化合物の選択的な検出により、すべての化合物の保持時間(RT)の変動を高い信頼性で同時モニタリングすることが可能になったためです。これにより、分析法を最適化する際の注入回数が大幅に抑えられました。ACQUITY QDa 検出器が分析法移管にもたらす利点についての詳細は、他のアプリケーションノートでもご紹介しています4。
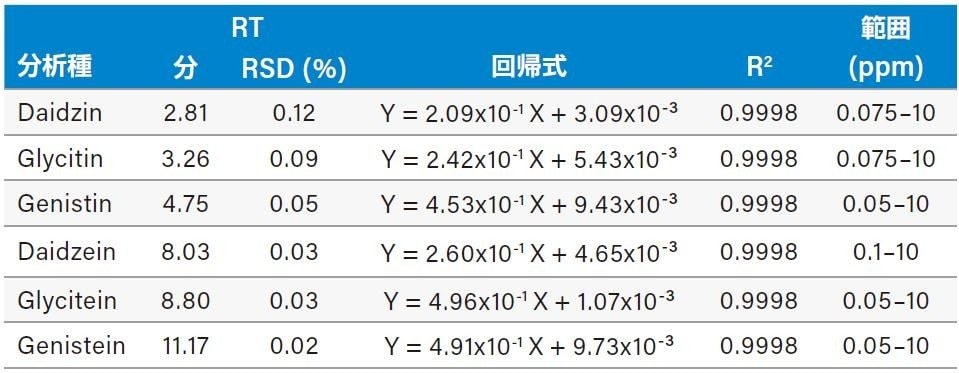
表 2 は標準物質の UV 検量線の結果を示します。すべての化合物の検量線作成および定量用の内部標準として、アピゲニンを使用しました。すべての化合物において、相対感度(ピーク面積比)と溶液中の標準物質濃度(ppm)との間の決定係数(R2)は 0.999 以上、保持時間の相対標準偏差は 0.12% 未満でした。
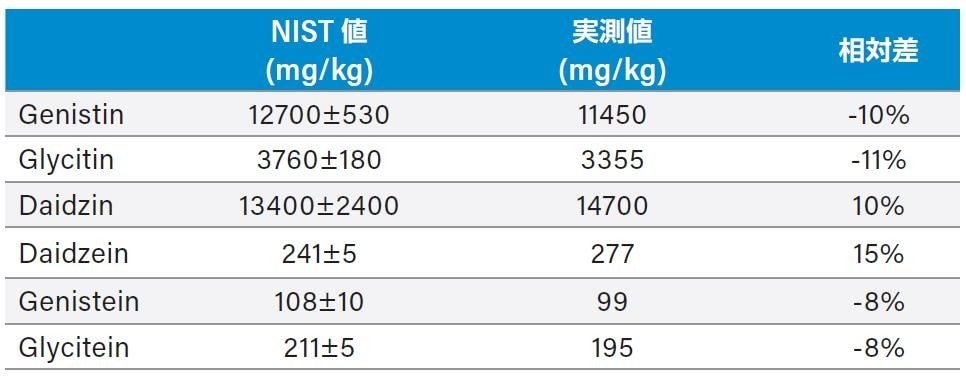
表 3 は NIST 3238 SRM のイソフラボンの結果、および認証値・参照値との比較を示します。ゲニスチン、グリシチン、ダイジン、ゲニステイン、およびグリシテインの相対差は 11% 未満でしたが、ダイゼインの場合は NIST 値よりも 15% 高くなりました。文献検索により、ダイゼインの高値は他にも報告されていることが分かりました5。 ダイゼイン、ゲニステイン、グリシテインの精度をスパイク試験にて評価した結果、これらの回収率は 98% ~ 101% でした(表 4)。
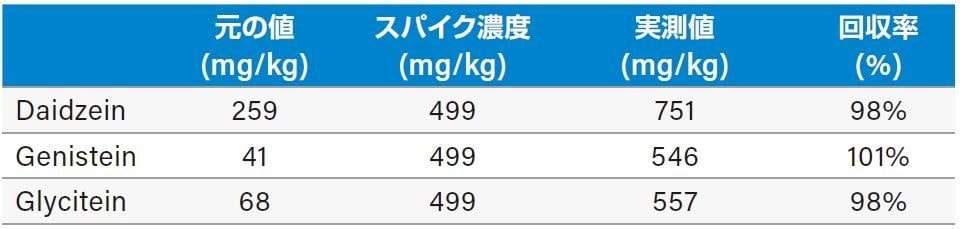
イソフラボンを含む 4 種類の栄養補助食品試料中のイソフラボン含有量は、上述した 18 分の高速な UHPLC-UV 法によって測定しました。試料の種類は錠剤、カプセル剤、および大豆粉でした。データ処理は、USP に準拠した検量および定量プロトコール 1 に従いました。
本分析では、USP の HPLC-UV 法に規定されたアセチル体およびマロニル体の誘導体に関する換算係数を使用しました。表 5 は個々の実測値、総イソフラボン含有量の他、ラベルに表示されていた総イソフラボン含有量を示しています。比較を容易にするため、ラベル表示値を濃度(mg/kg)に変換しました。3 つの試料のうち 2 つ(C と D)は実測値とラベル表示値の間に良好な相関が認められたものの、1 つ(B)はラベルに表示された総イソフラボン含有量よりもかなり低い測定値となりました。この理由については不明です。
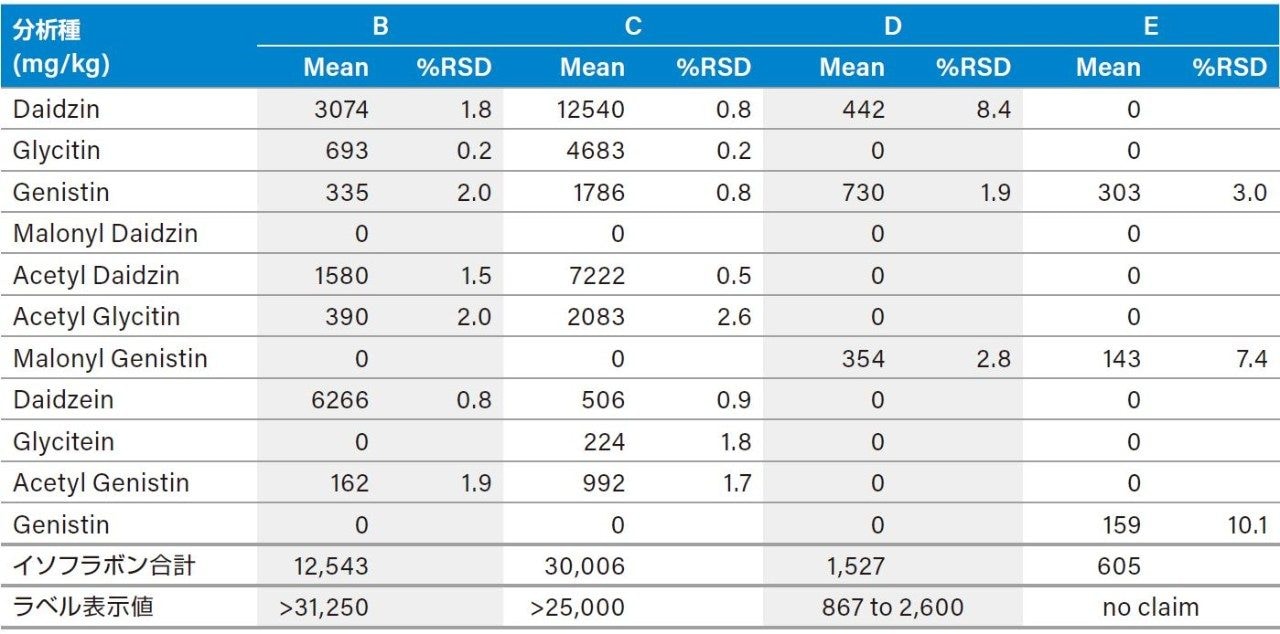
USP のイソフラボン分析法は 2998 PDA 検出器を備えた ACQUITY Arc UHPLC システムに移管できました。UHPLC システム上の注入 1 回あたりの分析時間全体は 18 分であり、74 分の USP メソッドよりも大幅に短縮しました。これは分析のスループットの 3 倍向上、および使用溶媒にかかる費用の 75% 削減に相当します。ACQUITY QDa 質量検出器は、検出において優れた選択性を備えており、分析法移管や分析法開発のみならず、干渉リスクが高いと考えられる未知の試料や分析の難しい試料中のイソフラボン分析に対する強力なツールとなります。3 種類の栄養補助食品中のイソフラボン分析では、2 種類の試料でラベル表示値との適合が見られ、その一方、理由は不明ながら 1 つの試料でイソフラボン含有量の低値が見つかりました。
720005858JA、2016 年 12 月