本アプリケーションノートでは、標識された糖鎖をモニターするための RapiFluor-MS と UPLC-FLR-MS の組み合わせの有用性を、特性、質量、存在比に関して示しています。
グリコシル化(糖鎖付加)は、ほとんどのタンパク質医薬品で複雑かつ重要な特徴で、十分に特性解析する必要があります。多くの場合、N 型糖鎖のプロファイルは重要品質特性として同定され、結果として、製品のライフサイクル全体にわたってモニターされます。GlycoWorks RapiFluor-MS N-Glycan キットは、劇的にサンプル調製時間と複雑さを低減します。
加えて、RapiFluor-MS の使用は蛍光感度を改善し、劇的に MS 感度を向上させます。RapiFluor-MS 標識による糖鎖の MS 感度の改善は ACQUITY QDa MS 検出器による質量検出を可能にし、それによってバイオ医薬品の開発中に発生する構造の変化に対するピークモニタリングにおいて高い信頼性が得られます。
RapiFluor-MS 標識と ACQUITY UPLC H-Class Bio システムおよび ACQUITY QDa MS 検出器による HILIC-FLR-MS は、バイオ医薬品の N 型糖鎖プロファイルをモニターするための比類のないソリューションを提供します。
グリコシル化(糖鎖付加)は、タンパク質ベースのバイオ医薬品の中で最も複雑な翻訳後修飾の一つです。グリコシル化されたバイオ医薬品の有効性は直接糖プロファイルと関連しています。望ましくない構造の存在は、正または負のいずれかの PK / PD(薬物動態学 / 薬力学)プロファイルの変化をもたらし、そしてそれは免疫原性応答に関連しています。これらの理由のために、グリコシル化は、多くの場合重要品質特性(CQA; critical quality attributes)として指定されています。開発プロセスの間に、バイオ医薬品候補分子の糖プロファイルが広く研究され、特性解析が行われます。特性のプロファイルは、その後もプロセス開発を通じてモニターされます。そして、商業化および承認後の研究では、製品の有効性と安全性を維持します。
本アプリケーションノートでは、RapiFluor-MS で遊離 N 型糖鎖を標識し、蛍光(FLR)および ACQUITY QDa MS 検出器と ACQUITY UPLC H-Class Bio システムの組み合わせにより分析するための効率的なアプローチを提案します。この新しいモニタリングワークフローでは、糖タンパク質から 30 分で UPLC-FLR/MS 分析のための試料を調製することが可能です。 さらに 2-AB と比較した場合、サンプル前処理の時間を短縮することに加えて、RapiFluor-MS は 14 倍の蛍光応答と 160 倍の MS 応答を実現します。これらの改善によって、日常の分析での蛍光と ACQUITY QDa MS 検出器の使用が可能になります。本アプリケーションノートでは、標識された糖鎖をモニターするための RapiFluor-MS と UPLC-FLR-MS の組み合わせの有用性を、特性、質量、存在比に関して示しています。
|
LC システム: |
ACQUITY UPLC H-Class Bio |
|
検出器: |
ACQUITY UPLC 蛍光検出器、ACQUITY QDa MS 検出器 |
|
カラム: |
ACQUITY UPLC Glycan BEH Amide、130Å、1.7 µm、2.1×150 mm |
|
カラム温度: |
60 ℃ |
|
サンプル温度: |
10 ℃ |
|
注入量: |
2 µL |
|
データ管理: |
Empower 3 FR2 CDS |
|
サンプリングレート: |
5 ポイント/秒 |
|
励起波長: |
265 nm |
|
蛍光波長: |
425 nm |
|
サンプリングレート: |
5 ポイント/秒 |
|
質量範囲: |
500~1250 Da |
|
コーン電圧: |
15 V |
|
キャピラリー電圧: |
1.5 kV |
|
プローブ温度: |
500 ℃ |
|
イオン化モード: |
ESI+ |
|
移動相 A: |
アセトニトリル(Pierce、LC-MS グレード) |
|
移動相 B: |
50 mM ギ酸アンモニウム、pH 4.4 (LC-MS グレード、Waters ギ酸アンモニウム濃縮液) |
|
移動相 C: |
アセトニトリル(LC/MS グレード) |
|
移動相 D: |
アセトニトリル(LC/MS グレード) |
|
時間 |
流量(mL/分) |
%A |
%B |
%C |
%D |
|---|---|---|---|---|---|
|
Initial |
0.4 |
75 |
25 |
0 |
0 |
|
35 |
0.4 |
54 |
46 |
0 |
0 |
|
36.5 |
0.2 |
0 |
100 |
0 |
0 |
|
39.5 |
0.2 |
0 |
100 |
0 |
0 |
|
42.5 |
0.2 |
75 |
25 |
0 |
0 |
|
47.4 |
0.4 |
75 |
25 |
0 |
0 |
|
55 |
0.4 |
75 |
25 |
0 |
0 |
マウス IgG1 モノクローナル抗体 N 型糖鎖は GlycoWorks RapiFluor-MS N-Glycan キット(製品番号 176003606)に含まれている Waters Intact mAb Mass Check スタンダード(製品番号 186006552)から調製しました。RNase B とウシ fetuin(Sigma Aldrich)からも N 型糖鎖を調製しました。標識遊離 N 型糖鎖のプールサンプルは GlycoWorks RapiFluor-MS N-Glycan キットを使用して、取り扱い説明書(製品番号 715004793)に従って作製しました。遊離、標識後のサンプルは CentriVap を用いて乾固し、アセトニトリル / 水/ DMF = 22.5%:55.5%:22% 混合液 25 µL に希釈再溶解しました。それぞれの分析では遊離糖鎖 30 pmol を使用しました。移動相のギ酸アンモニウムは Waters ギ酸アンモニウム濃縮液(製品番号 186007081)から調製しました。
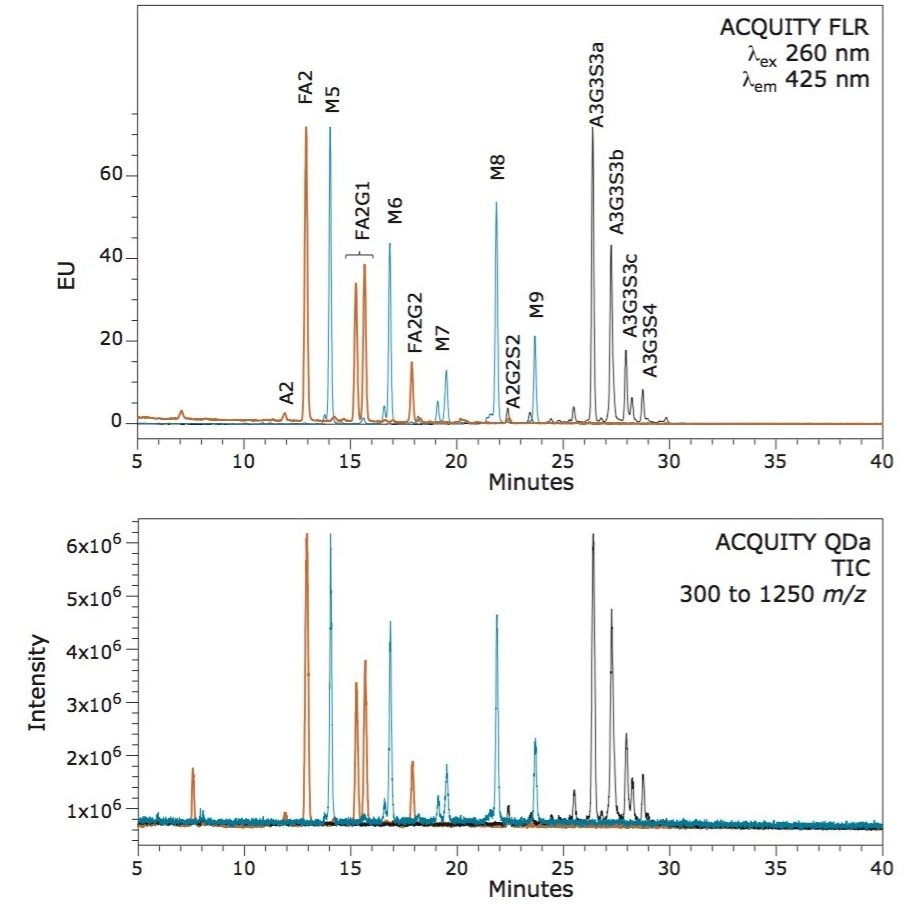
N-グリコシル化は、タンパク質や発現系によって、サイズ、電化糖鎖の分岐程度が異なる数多くの糖鎖構造を生成するテンプレートに依存しない翻訳後修飾です。質量範囲内および質量範囲を超えて糖鎖を検出可能な ACQUITY QDa MS 検出器の能力を評価するために、3 種類の糖タンパク質(ヒト IgG、RNase B およびウシ fetuin)を中性二分岐構造からテトラシアル化構造まで一般的に観察される糖鎖をもつタンパク質として選択しました。それぞれのタンパク質から N 型糖鎖を Rapid PNGase F を用いて遊離し、サンプル調製プロトコールに従って RapiFluor-MS を用いて標識しました。標識糖鎖を UPLC-HILIC で分離し、ACQUITY 蛍光検出器と ACQUITY QDa MS 検出器の両方を用いて検出しました。
図 1 から明らかなように、それぞれの糖鎖構造は、同一の LC 条件でクロマトグラフィー分離されます。さらに、蛍光(上図)で観察されたそれぞれの糖鎖構造は、RapiFluor-MS で標識された結果、ACQUITY QDa MS 検出器(下図)でも検出されました。従来の標識技術では、イオン化効率が不十分なため検出が不可能でした。
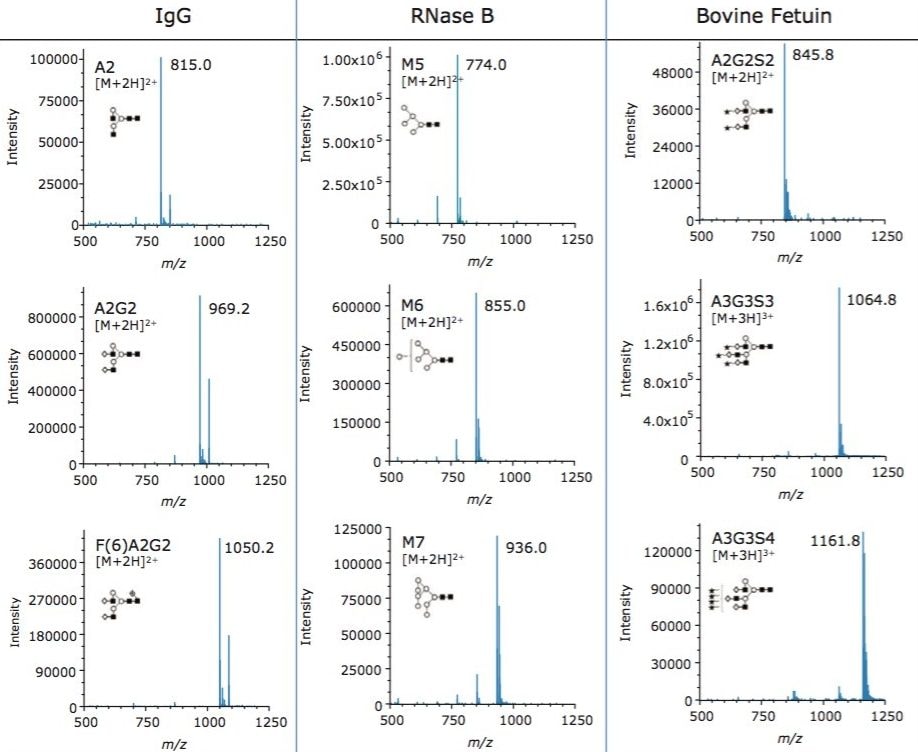
糖鎖構造が質量検出によって観察することができることは有用ですが、得られたスペクトルの品質とイオンの荷電状態を理解することも重要です。これを理解するために、幅広い糖鎖の特性にわたってピークを統合し、蛍光データを用いてそれぞれのサンプル中に存在する種の相対的存在量を測定しました。図 2 に示すスペクトルは、幅広い特性および質量の糖鎖構造の高品質なスペクトルを生成する ACQUITY QDa MS 検出器の能力を実証しました。このデータは存在量の多い糖鎖構造と存在量の少ない糖鎖構造の両方を容易に検出できることを示しています。RapiFluor-MS によって向上されたイオン化効率と ACQUITY QDa MS 検出器を組み合わせることで、蛍光プロファイルで 0.5% 程度と存在量の少ない糖鎖構造でも高品質のマススペクトルが得られます。また、RapiFluor-MS の使用による荷電状態の改善により、A2 などの小さな糖鎖構造だけでなく、テトラシアル化 A3G3S4 などの非常に大規模な糖鎖構造も QDa で検出可能となっています。
グリコシル化(糖鎖付加)は、ほとんどのタンパク質医薬品で複雑かつ重要な特徴で、十分に特性解析する必要があります。多くの場合、N 型糖鎖のプロファイルは重要品質特性として同定され、結果として、製品のライフサイクル全体にわたってモニターされます。GlycoWorks RapiFluor-MS N-Glycan キットは、劇的にサンプル調製時間と複雑さを低減します。加えて、RapiFluor-MS の使用は蛍光感度を改善し、劇的に MS 感度を向上させます。RapiFluor-MS 標識による糖鎖の MS 感度の改善は ACQUITY QDa MS 検出器による質量検出を可能にし、それによってバイオ医薬品の開発中に発生する構造の変化に対するピークモニタリングにおいて高い信頼性が得られます。RapiFluor-MS 標識と ACQUITY UPLC H-Class Bio システムおよび ACQUITY QDa MS 検出器による HILIC-FLR-MS は、バイオ医薬品の N 型糖鎖プロファイルをモニターするための比類のないソリューションを提供します。
720005353JA、2015 年 3 月