本研究では、シーフード組織サンプル中の広範な残留動物用医薬品をタンデム LC-MS 分析するための、サンプル調製、クリーンアップ、分析プロトコールを開発しました。本クリーンアップ手法は、中性脂質とリン脂質、両方の除去に効果的でした。エビ(クルマエビ)とサーモンの 2 種類の組織を用いて本メソッドの適合性を試験しました。サンプルは、酸添加したアセトニトリル / 水溶液を用いてタンパク質沈殿を行い、目的の動物用医薬品を抽出しました。その後、新たに開発された Oasis PRiME HLB を用いてシンプルなクリーンアップを行いました。テトラサイクリン、フルオロキノロン、サルファ剤、マクロライド、βラクタム剤、NSAIDS、ステロイド、βアドレナリン作動薬を含む動物用医薬品の主要な群から代表的な化合物を選択し、抽出とクリーンアップの前に、シーフードサンプルにスパイクしました。
公共の健康や安全を守るために、魚や貝など食用組織サンプル中の動物用医薬品の残留濃度を測定するための信頼性ある分析法が必要です。目的化合物は、高極性の水溶性化合物から非極性の脂溶性化合物まで幅広く、最大のスループットと最小のコストを実現するためには、ひとつの分析法で組織サンプル中の可能な限り幅広い残留動物用医薬品を測定することが要求されます。食用のシーフードと肉組織は、一般的に最大 20% の中性脂質と 3% のリン脂質を含有します。
一般的な肉サンプルは、水分(最大 70%)、タンパク質(15 ~ 25%)、中性脂質(5 ~ 25%)、リン脂質(1 ~ 3%)で主に構成されています。サンプル調製において、タンパク質は有機溶媒による沈降と遠心分離により除去されます。しかしながら、多量の中性脂質とリン脂質が目的の動物用医薬品と共抽出されてしまいます。このように共抽出された中性脂質とリン脂質は、分析カラムや UPLC システムの構成部品、質量分析計を汚染し、LC-MS 分析を妨害します。中性脂質は一般的に、煩雑なヘキサン脱脂ステップや C18 シリカゲルのような逆相固相を用いて組織抽出物から除去されます。前述した手法は中性脂質除去には効果的でも、リン脂質を除去することはできません。本研究では、シーフード組織サンプル中の広範囲な残留動物用医薬品をタンデム LC-MS 分析するための、サンプル調製、クリーンアップ、分析プロトコールを開発しました。本クリーンアップ手法は、中性脂質とリン脂質、両方の除去に効果的でした。エビ(クルマエビ)とサーモンの 2 種類の組織を用いて本メソッドの適合性を試験しました。サンプルは、酸添加したアセトニトリル / 水溶液を用いてタンパク質沈殿を行い、目的の動物用医薬品を抽出しました。その後、新たに開発された Oasis PRiME HLB を用いてシンプルなクリーンアップを行いました。テトラサイクリン、フルオロキノロン、サルファ剤、マクロライド、βラクタム剤、NSAIDS、ステロイド、βアドレナリン作動薬を含む動物用医薬品の主要な群から代表的な化合物を選択し、抽出とクリーンアップの前に、シーフードサンプルにスパイクしました。
|
LC システム: |
ACQUITY UPLC I-Class |
|
カラム: |
ACQUITY UPLC CSH C18、1.7 μm、100 mm x 2.1 mm 内径 |
|
移動相 A: |
0.1% ギ酸水溶液 |
|
移動相 B: |
0.1% ギ酸アセトニトリル溶液 |
|
注入量: |
5 µL |
|
注入モード: |
パーシャルループ |
|
カラム温度: |
30 ℃ |
|
弱ニードル洗浄液: |
10:90 アセトニトリル:水 (600 μL) |
|
強ニードル洗浄液: |
50:30:40 水:セトニトリル:ソプロパノール (200 μL) |
|
シール洗浄液: |
10:90 アセトニトリル:水 |
|
時間(分) |
流量(mL/分) |
%A |
%B |
Curve |
|---|---|---|---|---|
|
Initial |
0.4 |
85 |
15 |
Initial |
|
2.5 |
0.4 |
60 |
40 |
6 |
|
3.9 |
0.4 |
5 |
95 |
6 |
|
4.9 |
0.4 |
5 |
95 |
6 |
|
5 |
0.4 |
85 |
15 |
6 |
|
7 |
0.4 |
85 |
15 |
6 |
|
MS システム: |
Xevo TQ-S 質量分析計 |
|
ESI ポジティブ(クロラムフェ二コールのみ ESI ネガティブ) |
|
|
ソース温度: |
150 ℃ |
|
脱溶媒温度: |
500 ℃ |
|
脱溶媒ガス流量: |
1000 L/時間 |
|
コーンガス流量: |
30 L/時間 |
|
コリジョンガス流量: |
0.15 mL/分 |
|
データ管理: |
MassLynxv4.1 |
表 1 に本研究で用いたMRM トランジション及び装置パラメーターを示します。他に、各化合物の典型的なマトリックス検量線(エビマトリックス中の定量用トランジションを用いて計算しました;サーモンのデータは類似していました)及び保持時間(RT)を示します。
ホモジナイズした 2.5 g のサンプル組織を 50 mL の遠沈管に入れます。標準物質および QC 試料は、目的化合物を適量スパイクします。10 mL の 0.2%(v/v)ギ酸を添加した 80% アセトニトリル水溶液を加えます。30 秒間ボルテックスし、30 分間振とう器で撹拌します。12000 rpm にて 5 分間遠心分離を行います。
注記:上記の抽出及びタンパク質沈殿処理は多くの目的化合物を良く回収しますが、同時に多くの中性脂質とリン脂質も抽出されます。
バキュームマニホールドに Oasis PRiME HLB カートリッジ(3 cc、60 mg)を設置します。カートリッジのコンディショニングは必要なく、行いませんでした。1 ~ 2 psi で減圧吸引を行いました。約 0.5 mL の上清を Oasis PRiME HLB カートリッジにロードし、素通り画分を回収しました。0.3 mL の素通り画分の溶出液を分取し、10 mM ギ酸アンモニウム緩衝液(pH 4.5)で 3 倍に希釈した後、UPLC-MS/MS 分析に供しました。
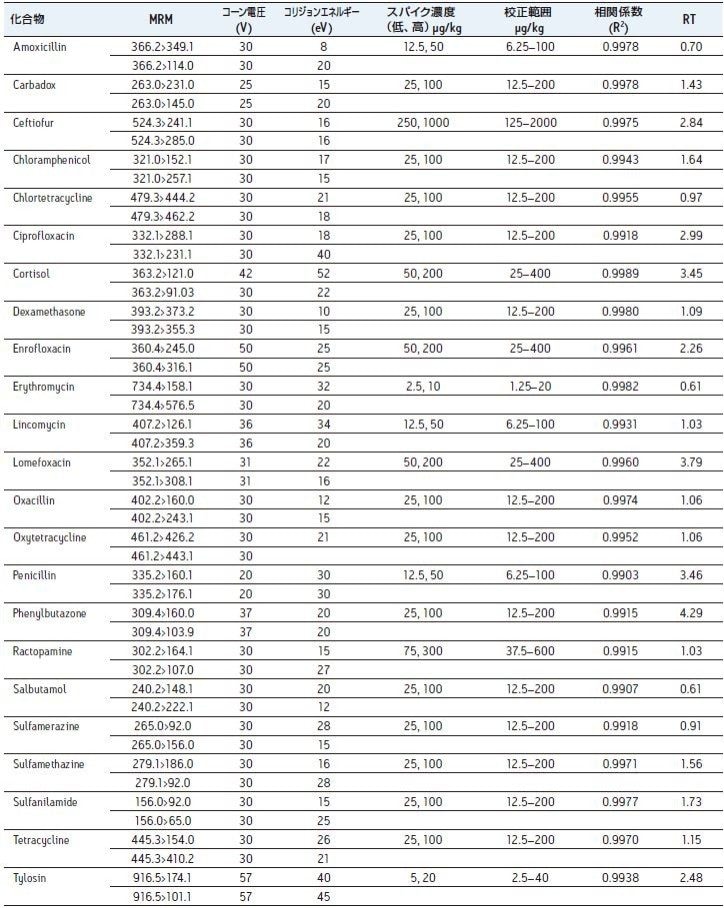
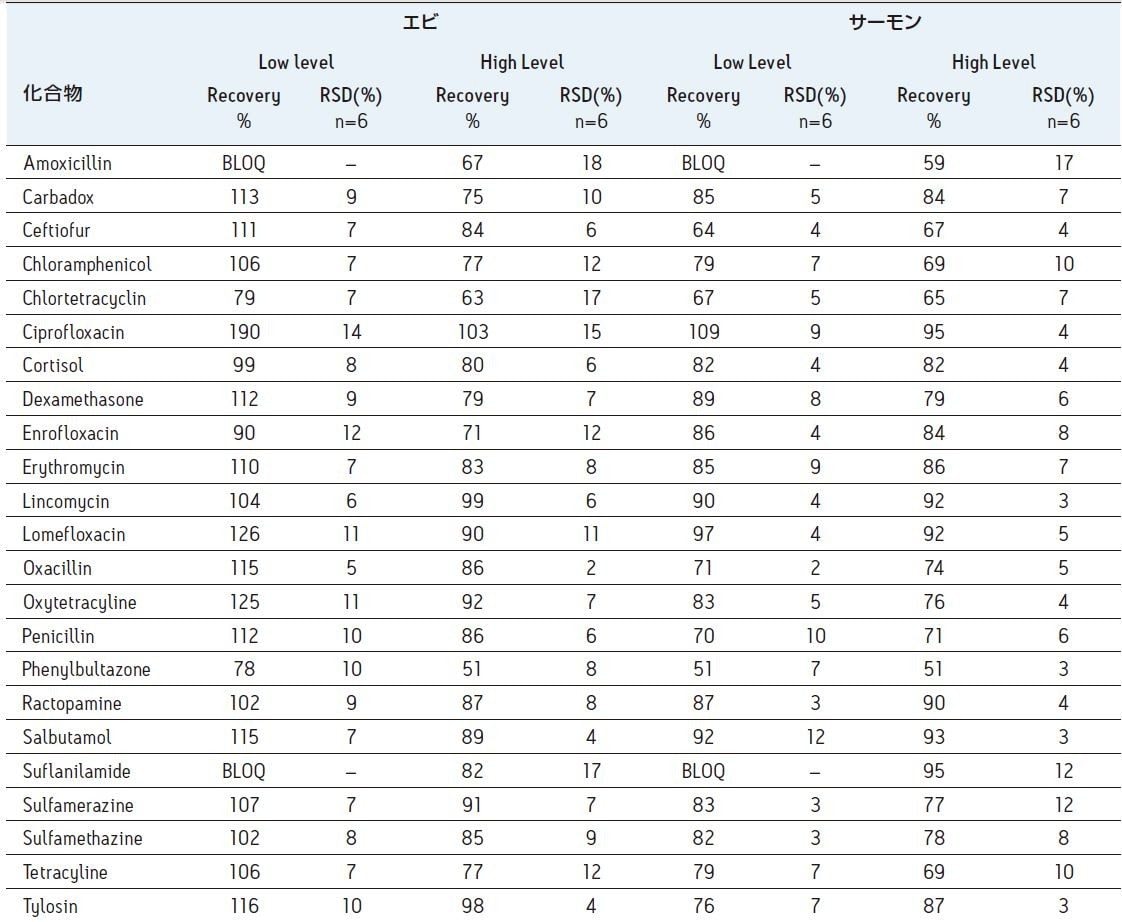
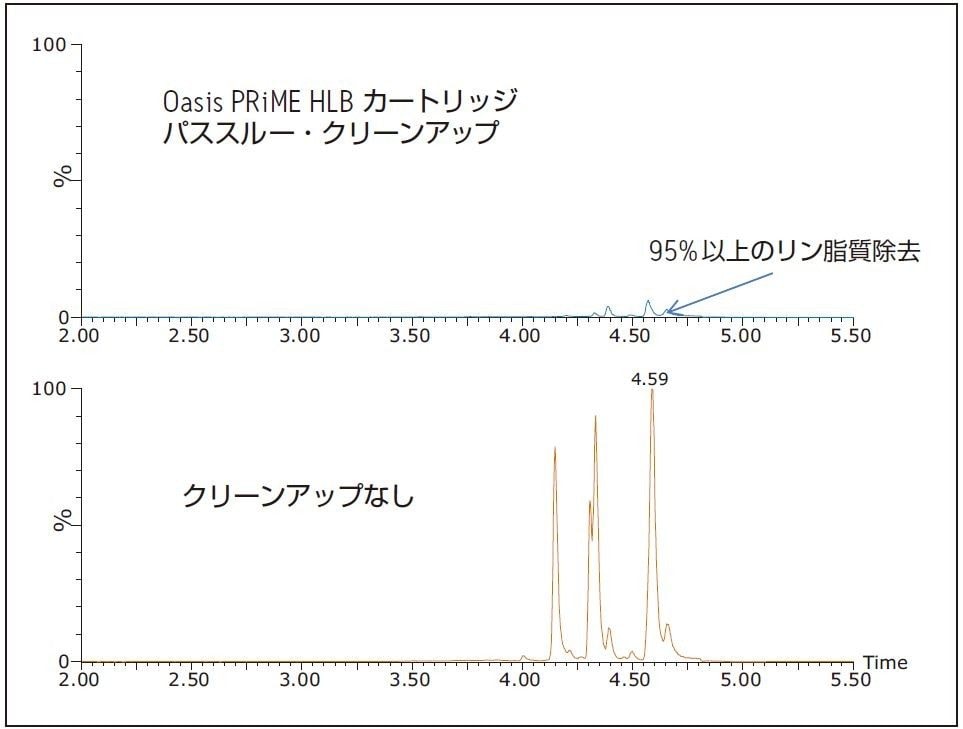
表 2 は、動物用医薬品をスパイクした組織サンプルを繰り返し分析した結果を示します。マトリックス効果は、エビ及びサーモンのどちらでも平均約 40% でした。図 1 のクロマトグラムは、エビ抽出物から Oasis PRiME HLB カートリッジが 95% 以上のリン脂質を除去したことを示します。また、Oasis PRiME HLB カートリッジは、ヘキサンで抽出可能な中性脂質の 90% 以上を除去します1。
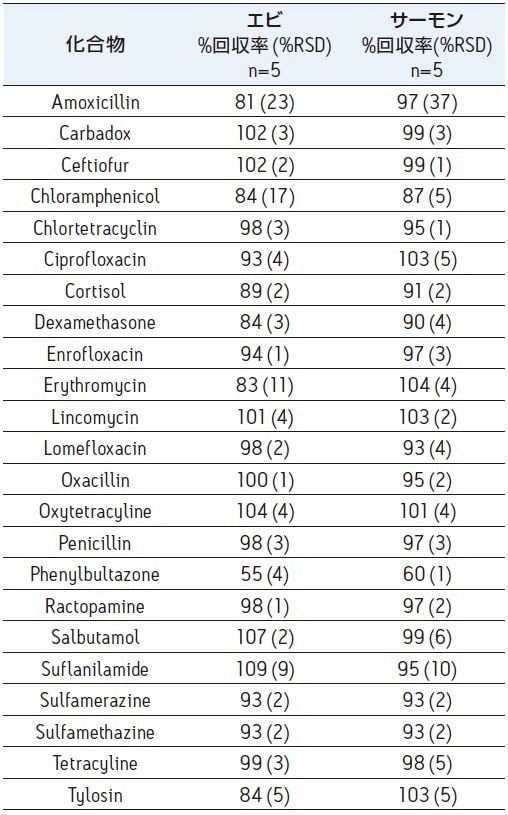
本研究で用いた手法は、Lehotay2 によって発表されたメソッドと、Tran ら3 によって改良されたメソッドを元に開発しました。本メソッドにおける全体的な回収率は一般的に 70% 以上でした。テトラサイクリンのような高極性化合物群においては、低い回収率を示しましたが、Oasis PRiME HLB カートリッジを用いたクリーンアップ法は、回収率の低下への寄与は最小限です。表 3 より、phenylbutazone 以外の化合物は、SPE クリーンアップの段階におけるエビでの回収率が 80% 以上、サーモンでは 90% 以上の回収率でした。
簡単で効果的な抽出 / タンパク質沈殿法をエビ及びサーモン組織の分析に応用しました。
Oasis PRiME HLB カートリッジを用いたワンステップのパススルー・クリーンアップ法は、初期の抽出物から 90% 以上の中性脂質及びリン脂質を除去します。
本サンプル前処理法では、抽出液に微粒子が含まれていないため、LC-MS 分析の前にろ過をする必要がありません。
Oasis PRiME HLB カートリッジを用いたシンプルなワンステップ、パススルー・クリーンアップ法により、広範囲の動物用医薬品において高い一貫性のある回収率が得られました。
720005488JA、2015 年 9 月