使用ACQUITY QDa质谱检测器对单克隆抗体亚基进行工艺监测以快速监测关键质量属性
摘要
本研究展示了ACQUITY QDa质谱检测器在蛋白类治疗药物的亚基分析过程中可靠地测定质量数的适用性。亚基数据的常规监测有助于及时检测生产过程的变化,并可用于筛查批次间一致性。
优势
- 获取补充质谱数据,使用MassLynx软件中的MaxEnt去卷积算法进行亚基分析软件
- 对亚基数据进行常规监测可及时检测生产过程中的变化,从而更有效地节省成本
- 进行亚基糖型分析,以快速筛查批次间一致性
简介
蛋白类治疗药物是一类快速发展的药物。由于它们的生产工艺复杂,在开发和生产过程中,我们需要通过各种检测手段来监测其关键质量属性(CQA),以确保产品质量和安全性。蛋白质糖基化修饰已成为一项重要的品质属性,因为研究表明半乳糖基化修饰与某些市售重组单克隆抗体(mAb)的细胞毒性有关1。相关分析方法包括基于荧光和MS技术的释放-标记技术,以及分别用于监测单个游离寡糖或糖蛋白的“自下而上”方法。此外,还可采用“自中而下”策略来评估mAb亚基的主要糖型。后一种方法在生产环境中尤其有用,在这种环境下,该方法能够以经济有效的方式及时报告糖基化分布的变化并进行纠正。
ACQUITY QDa质谱检测器是一款经济有效的工具,可用作正交检测技术,为现有LC工作流程增加获取质谱数据的功能。本研究旨在评估将ACQUITY QDa 质谱检测器应用于亚基分析的适用性。曲妥珠单抗是一种IgG1抗体,可以被二硫苏糖醇(DTT)部分还原为大约25 kDa的轻链和大约50 kDa的重链肽段(图1A)。采用MassLynx软件进行数据采集,能够通过MaxEnt1去卷积算法解析复杂的谱图,以便测定各个亚基的分子量。IdeS酶解和还原可产生三种肽段,每种肽段约25 kDa(图1B)。由于IdeS酶解会使得抗体铰链区的单个位点处发生特异性的高效裂解,因此它成为了治疗性mAb的常用表征工具之一,而在本例中,我们将其作为监测主要糖型的一种替代方法。
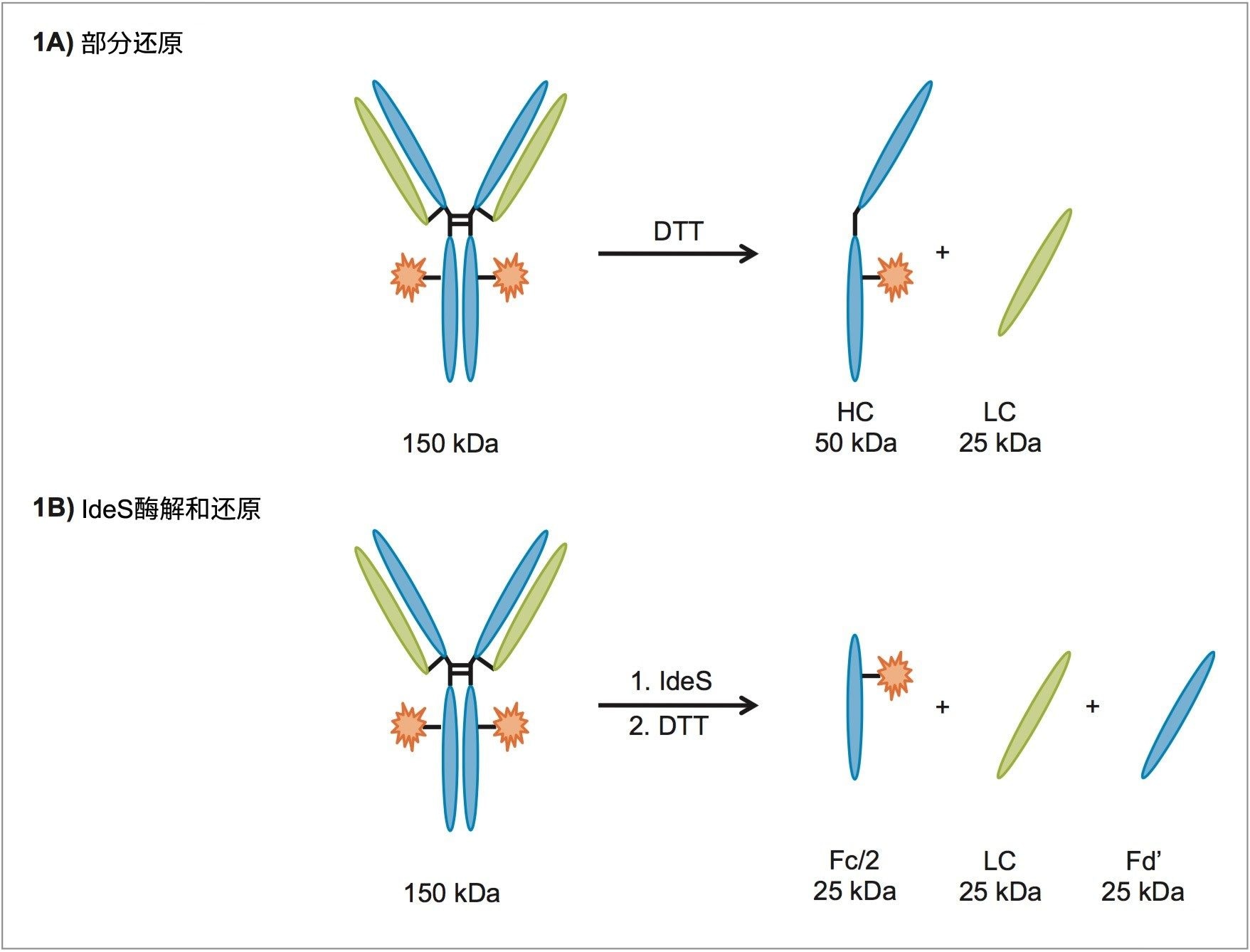
实验
LC条件
|
液相色谱系统: |
ACQUITY UPLC H-Class 系统* |
|
吸收波长: |
214 nm |
|
采集速率: |
5 Hz |
|
色谱柱: |
ACQUITY UPLC BEH C4蛋白分析专用柱, 1.7 µm, 2.1 mm × 50 mm(P/N:186004495) |
|
柱温: |
80 °C |
|
流动相A: |
0.1% (v/v)甲酸的水溶液 |
|
流动相B: |
0.1% (v/v)甲酸的乙腈溶液 |
|
样品温度: |
10 °C |
|
进样体积: |
3 µL |
ACQUITY Premier系统可以实现更好的分离
梯度:
|
时间(min) |
流速(mL/min) |
%A |
%B |
%C |
%D |
|
初始 |
0.4 |
95 |
5 |
0 |
0 |
|
15 |
0.4 |
40 |
60 |
0 |
0 |
|
20 |
0.4 |
20 |
80 |
0 |
0 |
|
23 |
0.4 |
20 |
80 |
0 |
0 |
|
27 |
0.4 |
95 |
5 |
0 |
0 |
|
30 |
0.4 |
95 |
5 |
0 |
0 |
QDa设置
|
采样速率: |
5 Hz |
|
质量范围: |
350–1250 Da |
|
电离模式: |
ESI+,连续 |
|
锥孔电压: |
15 V |
|
毛细管电压: |
1.5 kV |
|
探头温度: |
600 °C |
数据管理
带有MaxEnt1的MassLynx软件4.1版
曲妥珠单抗的部分还原:
将10 µL 21 mg/mL的曲妥珠单抗加入190 µL 25 mM的Tris-HCl (pH 7.5)中,得到蛋白质浓度约为1 mg/mL的样品。将浓缩DTT加入此样品中,使溶液中的最终DTT浓度达到1.0 mM。接下来,将样品置于37 °C下温育20 min。加入等体积的3%乙腈和0.1%甲酸水溶液,使蛋白质的最终浓度达到约0.5 mg/mL。立即进样分析,因为该样品不宜长期储存。
曲妥珠单抗的IdeS酶解和还原:
将溶于25 mM Tris缓冲液中的1 mg/mL曲妥珠单抗样品与IdeS蛋白酶(FabRICATOR;Genovis,美国马萨诸塞州剑桥)一起置于37 °C下温育30 min。向经过IdeS酶解的样品中加入浓缩DTT,使溶液中DTT的最终浓度达到1.0 mM。将所得的样品置于37 °C下温育20 min。在进样前,向样品中加入等体积的3%乙腈和0.1%甲酸水溶液,使蛋白质的最终浓度达到约0.5 mg/mL。
结果与讨论
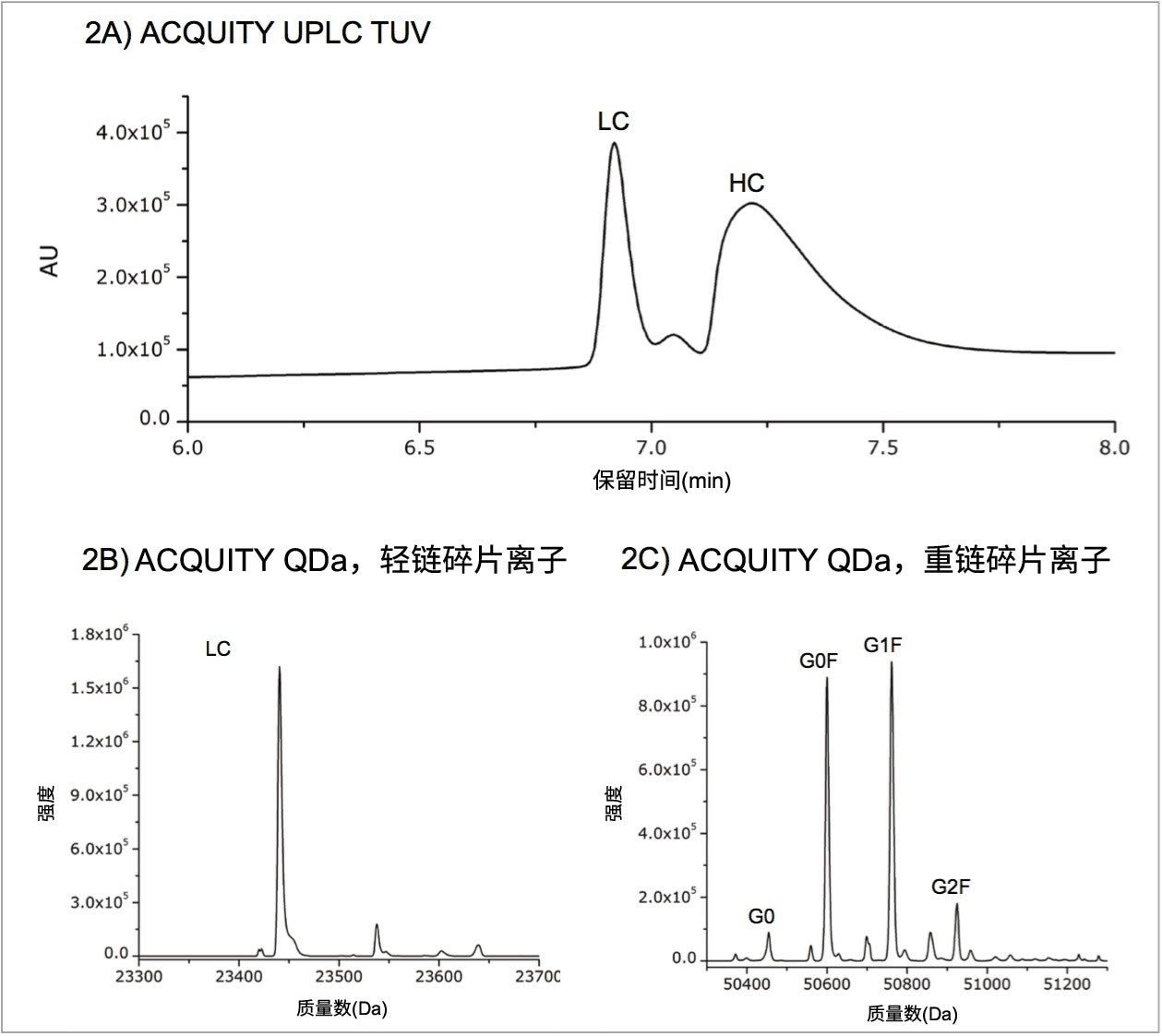
为了获得曲妥珠单抗的轻链和重链数据,按照前文所述的方法对抗体进行部分还原。光谱图如图2A所示。为了测定每种肽段的质量数,利用MassLynx软件的MaxEnt1算法将质谱数据去卷积为零电荷态。使用统一高斯模型将MaxEnt1分辨率设置为0.5 Da/通道,峰宽0.7 Da。从目标峰的中间到基线部分对谱图进行合并。所用的最大迭代次数为20,以避免过度处理数据。图2B和图2C分别为轻链和重链亚基的去卷积谱图。轻链去卷积使得电荷包络坍缩为单个峰,而重链去卷积鉴定出了四种主要糖型。
由于ACQUITY QDa质谱检测器的质量数范围为30~1250 m/z,轻链和重链的低电荷态均超出了这一检测窗口。图3叠加了根据ACQUITY QDa数据得到的轻链电荷包络与采用扫描范围更宽的高分辨率MS得到的模拟电荷包络。从叠加谱图中可以看到,ACQUITY QDa数据仅仅是高分辨率仪器产生的电荷包络的一部分。为了确定这种关系对质量数测定的影响,我们在表1中列出了由MaxEnt1生成的轻链和重链结果,将其报告为实验质量数,并与理论平均分子量进行了对比。
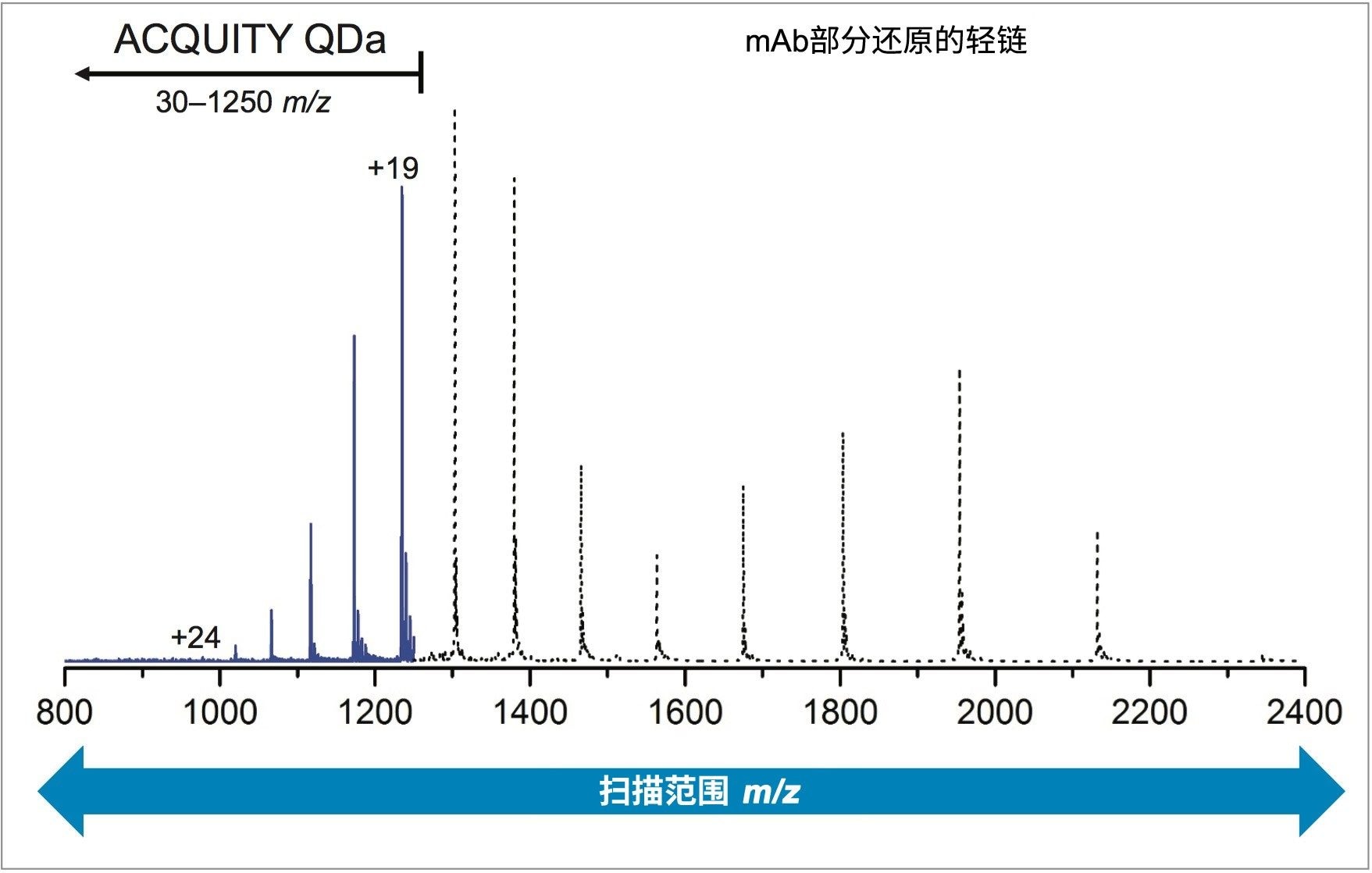
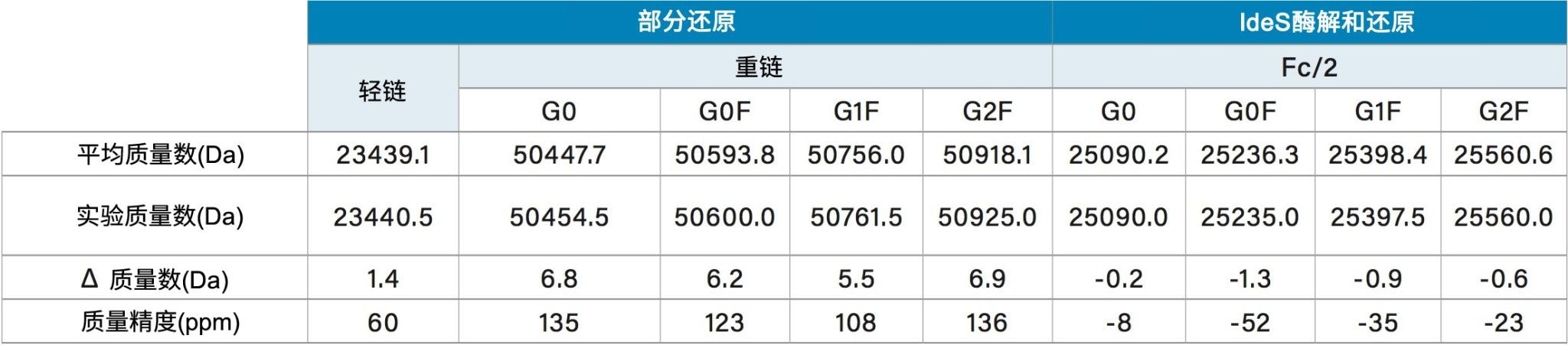
仪器造成的质量误差与电荷态成正比,较大的误差与较高的电荷态有关。以+19~+50的电荷态为例,这个范围涵盖了使用ACQUITY QDa质谱检测器采集到的轻链和重链电荷包络对应的电荷态范围,与这些电荷态相关的仪器质量数误差在±3.8 Da~±10 Da范围内(±0.2 × 电荷态)。如果考虑曲妥珠单抗的轻链,其电荷态在+19~+24范围内,预期质量精度为150~200 ppm。由于报告的轻链实验质量精度为60 ppm(表1),该值显然在仪器的预期范围内。同样地,重链的质量精度应在150~200 ppm范围内,而所有肽段都满足此标准(表1)。
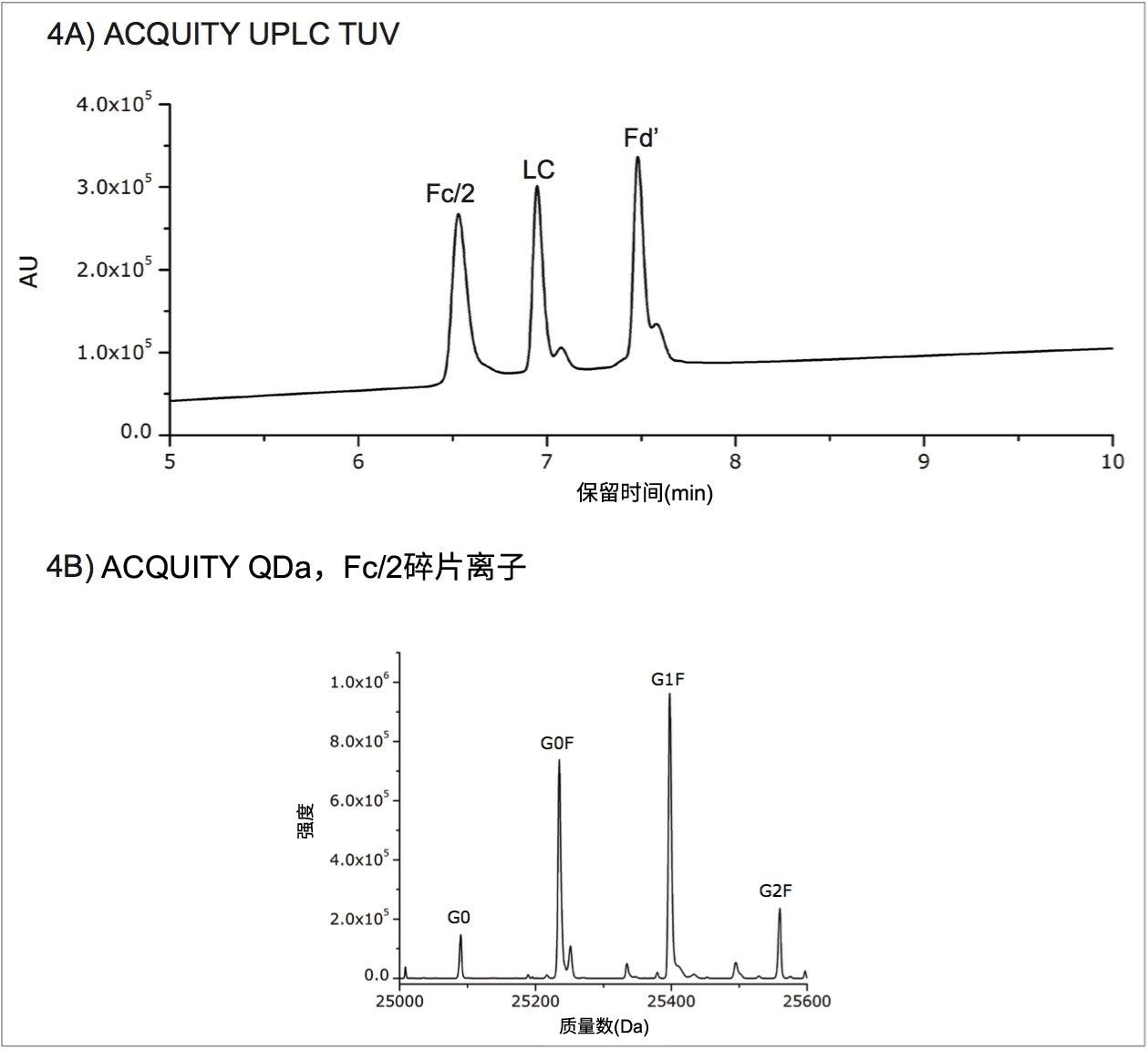
为了进一步测试ACQUITY QDa质谱检测器在亚基分析中的适用性,我们采用常用的IdeS酶,通过第二种方法生成亚基片段。通过IdeS酶解和还原,产生了三种肽段(Fc/2、LC和Fd’),每种肽段的大小约为25 kDa。图4A展示了经IdeS酶解和还原后的曲妥珠单抗样品的光谱图,三种肽段清晰地彼此分离。图4B展示了包含糖基化修饰位点的Fc/2肽段的去卷积质谱数据,图中展示了之前从重链数据中鉴定出的四种糖型。表1报告了来自Fc/2肽段的糖型的质量精度,结果均处于仪器的预期范围内。与部分还原类似,IdeS酶解和还原也能对目标产品进行确证,还能更轻松地确定生产过程中发生的变化。
结论
本研究证明,使用ACQUITY QDa质谱检测器,可通过两种不同的方法可靠地进行亚基水平的质量数测定。将曲妥珠单抗样品部分还原,得到完全处于仪器预期质量精度限以内的轻链和重链肽段。通过IdeS酶解和还原,获得具有较低电荷态的小分子抗体亚基片段。通过监测约50 kDa的重链肽段以及IdeS 酶解和还原所得的Fc/2肽段(约25 kDa)的主要糖型,我们对比了两种处理方法所得的结果,这两种方法均通过ACQUITY QDa质谱检测器进行了快速有效亚基数据采集,最终可应用于验证产品一致性和产品成分的筛查方案中。
参考资料
- Raju T.S. and Jordan R.E. Galactosylation variations in marketed therapeutic antibodies.mAbs.2012.4(3):385–391.
720005707ZH,2024年3月