使用Xevo™ G3 QTof分析动物产品中的全氟烷基和多氟烷基化合物(PFAS)的非靶向筛查工作流程(NTS)
摘要
21世纪00年代初,由于在人血清和野生动物组织中检测到有机含氟化合物,引起了人们对全氟烷基和多氟烷基化合物(PFAS)的广泛关注1-3。 目前已经确定了人类接触PFAS的多种途径,例如食用受污染的食物。欧洲食品安全局(EFSA)在一项历时九年的研究中指出,主要受污染的食物源是鱼类和蛋类4。自此,关于使用液相色谱-质谱联用法(LC-MS)检测不同基质中所含PFAS的指南层出不穷4–5。虽然这些指南同时提到了串联质谱仪和高分辨率质谱仪,但串联质谱是常用方法,因为它具有较高的选择性和灵敏度。尽管如此,使用串联四极杆的靶向方法仍然局限于每种方法只能分析一定数量的化合物6。在数据非依赖型采集实验中,Xevo G3 QTof为全面非靶向筛查(NTS)和发现工作流程提供了所需的灵敏度和分辨率7。
根据EURL POPs《关于食品和饲料中全氟烷基和多氟烷基化合物(PFAS)测定分析参数的指导文件》(Guidance Document on Analytical Parameters for the Determination of Per and Polyfluoroalkyl Substances (PFAS) in Food and Feed),从鱼类参比样品中提取PFAS8。 使用Xevo G3 QTof分析提取的样品,然后进行NTS和定量分析。使用waters_connect™平台采集和处理数据。在鱼类参比样品中鉴定出四种化合物,结果可信度高,并进行了定量。这些化合物分别是PFOA、PFNA、PFOS(直链和支链)和PFHxS(直链和支链)。鉴定结果和测得的含量与Fapas©(英国)的报告值一致。本研究证明了Xevo G3 QTof用于鉴定和定量分析食品基质中所含PFAS(含量水平符合EU要求)的适用性。
优势
- 使用保留时间和质量数亏损进行PFAS分析的非靶向筛查(NTS)工作流程
- 使用HRMS高灵敏度地鉴定和定量分析鱼类参比样品中低ng/kg浓度的PFAS,满足EURL POPS指南关于方法性能的要求
- 在没有可供从头鉴定的标准品的情况下,分析超出目标和管制范围的PFAS化合物
简介
D. Travis早在1968年就首次报告了人血清中存在含氟化合物,但直到21世纪00年代初,有两个研究团队在人血清和野生动物体内检测到有机含氟化合物,至此,全氟烷基和多氟烷基化合物(PFAS)才开始真正受到关注1–2,9。这些研究向人们敲响了警钟,提示人们关注PFAS的生物蓄积对人体健康的影响,及其在环境中广泛存在的情况1–2。当人体暴露于高浓度的PFAS时,脂质代谢、生殖和发育功能会受到影响3,10。全氟辛酸(PFOA)和全氟辛烷磺酸(PFOS)的毒性对动物和人类的直接影响已被广泛证实11。
业界目前提出了不同的暴露途径,包括摄入受污染的食品、环境暴露,以及较小程度上暴露于各种含PFAS的消费品(例如室内灰尘或阻燃地毯)12-13。 人类暴露的主要来源仍然是食物摄入。与其他食品类别相比,鱼类和蛋类的PFAS污染水平最高4,14。
为了监测食品中的PFAS污染,监管机构(例如美国环境保护署(EPA)以及欧洲饲料和食品中卤代持久性有机污染物参考实验室(EURL POP))制定了一套针对不同基质中的PFAS分析的法规和指南5,15。 推荐的方法使用固相萃取步骤,然后使用LC-MS分析样品,可监测至多45种化合物5,15。 随着受管制化合物数量以及非管制PFAS的监测需求不断增进,HRMS由于能够同时对样品进行定性和定量分析,因此成为理想选择。
本研究使用EURL POP指南规定的样品前处理和鉴定方法,通过非靶向筛查(NTS)工作流程鉴定和定量分析鱼类参比样品(Fapas®,英国)所含的PFAS。使用ACQUITY™ Premier与Xevo G3 QTof的联用系统分析提取物。NTS工作流程能够鉴定出四种化合物:PFHxS、PFNA、PFOA和PFOS。使用校准标准品(浓度介于0.025 µg/Kg~125 µg/Kg,分别相当于5 ng/L和25,000 ng/L)进行定量分析。
本研究证明,在对食品基质中的PFAS进行NTS筛查和定量分析时,Xevo G3 QTof是一种理想的工具。鉴定和定量分析按照EURL POP指南进行。此外,用户还可以回顾性挖掘生成的数据,以便使用UNIFI™发现工作流程对PFAS相关化合物进行从头鉴定。
实验
样品前处理
空白白鱼肉匀浆、鱼肉QC样品(T0696QC)和鱼类参比样品(TBK011RM)购自Fapas®(英国)。样品储存于-20 °C下,4 °C下过夜解冻后提取。所有标准品均购自Wellington Laboratories。该方法包含总共30种PFAS,具体如下;羧酸盐:C4-C14;磺酸盐:C4-C10;醚:GenX、ADONA、9Cl-PF3ONS、11Cl-PF3OUdS;前体:FBSA、FHxSA、FOSA、NMeFOSAA、NEtFOSAA、4:2 FTS、6:2 FTS、8:2 FTS。
样品前处理按照之前的应用纪要进行16。 在缺少不含PFAS的鱼类的情况下,使用0.025~125 µg/Kg(相当于5 ng/L~25,000 ng/L)范围内的溶剂校正曲线进行样品分析。
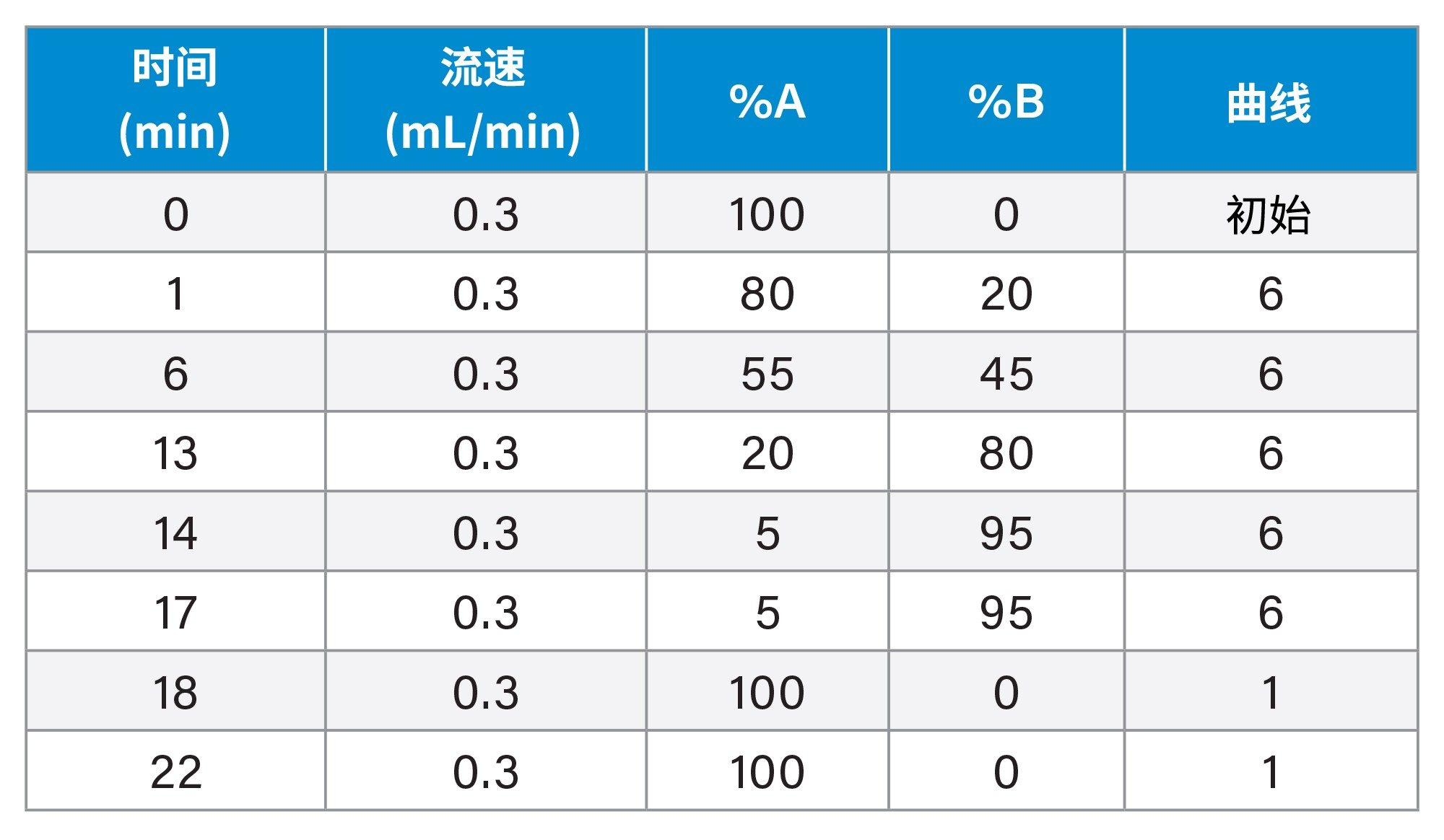
液相色谱条件
|
液相色谱系统: |
使用PFAS方法包(P/N:205000588和205000589)改良的Waters™ ACQUITY Premier系统 |
|
样品瓶: |
聚丙烯自动进样器样品瓶(P/N:186005219),带预开口隔垫盖(P/N:186000305) |
|
分析柱: |
ACQUITY Premier BEH™ C18, 1.7 µm, 2.1 x 100 mm, 90 Å色谱柱(P/N:186009453) |
|
隔离柱: |
Atlantis™ Premier BEH C18 AX隔离柱, 2.1 x 50 mm, 5 µm(P/N:186009452) |
|
柱温: |
35 °C |
|
样品温度: |
6 °C |
|
进样体积: |
10 µL |
|
流速: |
0.3 mL/min |
|
流动相A: |
95:5水:甲醇(含2 mM醋酸铵) |
|
流动相B: |
100%甲醇(含2 mM醋酸铵) |
梯度表
质谱条件
|
质谱系统: |
Xevo G3 QTof |
|
电离模式: |
ESI- |
|
质量范围: |
m/z 50–1200 |
|
采集速率: |
每秒4幅谱图(4 Hz) |
|
实时校正标准液: |
亮氨酸脑啡肽(m/z 554.2620) |
|
采集模式: |
MSE,一种数据非依赖型采集方法 |
离子源条件
|
毛细管电压: |
0.5 kV |
|
锥孔电压: |
10 V |
|
离子源温度: |
100 °C |
|
脱溶剂气温度: |
250 °C |
|
锥孔气流速: |
100 L/h |
|
脱溶剂气流速: |
600 L/h |
|
离子源补偿: |
30 V |
碰撞能量
|
低碰撞能量: |
4 V |
|
高碰撞能量: |
梯度20~70 V |
传输调谐设置
|
StepWave RF: |
100 V |
|
梯度主体: |
5 V |
软件工具
使用waters_connect软件平台和UNIFI应用程序进行数据采集和处理。
结果与讨论
使用waters_connect平台中的UNIFI应用程序处理MSE采集模式下生成的数据。完成峰提取和同位素簇步骤后,生成的列表中包含了每次进样检出的所有组分,并列出了保留时间和强度(图1A,数据处理)。使用沃特世PFAS谱库筛选这些组分,根据用户要求也可使用其他开源数据库17–19。基于精确质量数和碎片离子进行鉴定,接受母离子质量数测量精度≤3 ppm的推断性鉴定。考虑到目前所列出的PFAS化合物数量超过15,000种,为了提高鉴定可信度并去除假阳性,我们对组分列表应用了多个数据过滤步骤18。UNIFI应用程序提供灵活的NTS工作流程,支持不同的用户定义过滤步骤(图1B,数据过滤)。这些用户定义步骤有助于显示与研究相关性最高的组分。
本研究应用了PFAS专用工作流程对鱼类参比样品提取物进行非靶向筛查(NTS)。该工作流程的分步示意图如图1所示。该工作流程可分为两部分:数据处理(图1A)和数据过滤(图1B)。经过数据过滤处理后(图1B),将显示符合用户定义标准的组分列表。例如,用于查看在3~5分钟内洗脱,且m/z高于500 Da的组分的过滤条件。
为展示该工作流程中各步骤的作用,在相应的步骤下方展示了引用各步骤后保留的化合物数量。这些数量与鱼类样品TKB011RM相对应,本文以它们为例。
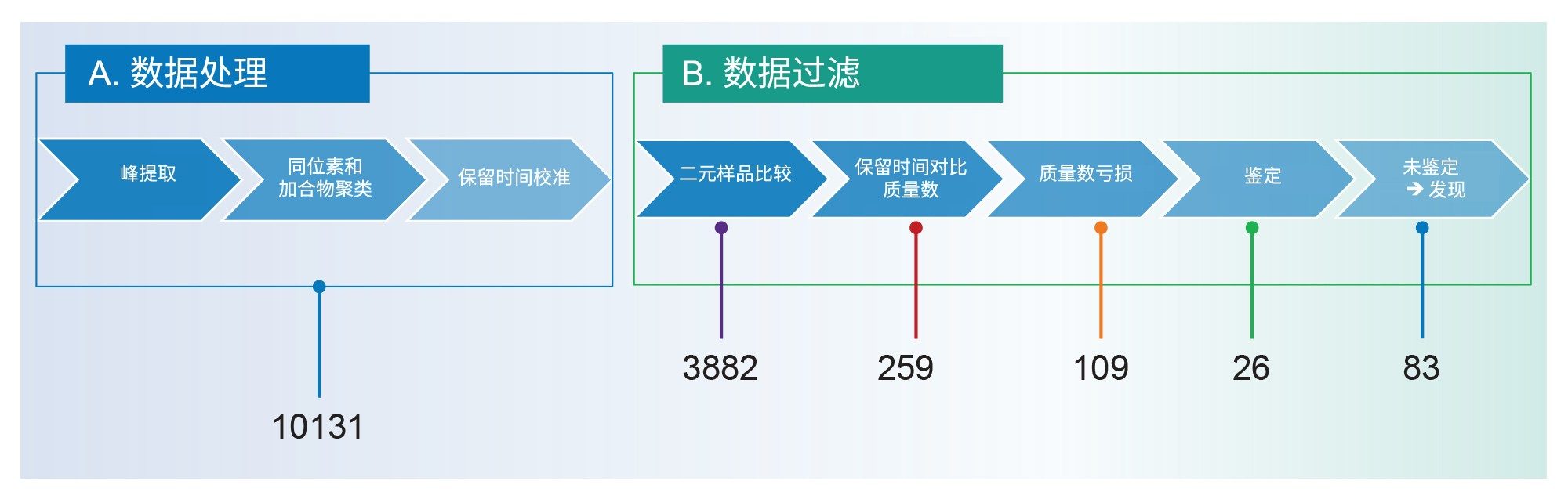
UNIFI应用程序中的NTS工作流程是专门为PFAS分析所制定的,完成峰提取步骤和同位素分组后,每次运行都会获得一份所检组分的列表。在所选的示例TKB011RM中,检出了10,131种组分(图1A),包括与基质相关的组分、背景组分以及PFAS。该工作流程的第一步是比较样品与空白样。在本例中,制备样品时,平行制备了萃取溶剂空白样。与溶剂空白样相比,仅保留了特有组分或响应提高15倍及以上的组分。选择该截止值的目的是去除提取过程中产生的噪音组分,具体强度增加或降低可根据需要调整。通过比较所检出组分与样品空白的强度,可帮助将鱼类样品TKB011RM的候选组分列表从10,131种组分减少到3882种。由于某些类别的PFAS可能会发生源内碎裂,且同系物PFAS系列的洗脱顺序是可以预测的,因此应用了保留时间/质量数过滤器20。 保留时间/质量数过滤器可定义PFAS同系物可能洗脱的色谱区域,并能够从候选物列表中去除潜在的源内碎裂离子。应用该过滤器后,TKB011RM样品的组分列表大幅减少至259种(图1B)。然后使用质量数亏损过滤器区分PFAS与非PFAS相关化合物。该过滤器将组分列表减少至109种潜在候选物。值得注意的是,单独使用质量数亏损过滤器而不使用保留时间过滤器时,效率不及按顺序应用这两种过滤器的效率。事实上,在二元比较过滤器之前或之后对组分列表应用质量数亏损过滤器时,组分数量分别减少至4854种和952种(数据未显示)。最后,使用沃特世PFAS谱库从109种组分中鉴定出26种17。
在两种鱼类参比样品中,除标记的提取标准品外,还鉴定出6种PFAS化合物:PFHxS(直链和支链)、PFOA、PFOS(直链和支链)、PFNA、PFDA和PFUnDA。其中四种化合物的鉴定水平为1a,两种化合物的鉴定水平为3d,鉴定水平的定义基于Charbonnet等人的定义21。 其余83种未鉴定的PFAS相关组分则使用UNIFI应用程序中的发现工作流程处理:生成分子式,然后从头鉴定。
本文所述的每个过滤步骤都是用户定义工作流程的一部分,这些步骤有助于在不更改原始组分列表的情况下实现数据可视化。本文证明了所有步骤在减少噪音、碎片离子、系统和样品前处理污染物方面的作用。将相同的方法应用于不同的鱼类参比样品和所有重复样。每个步骤在不同研究样品和重复样中观察到的组分数量与图1所报告样品的数量级相同。
表1汇总了在两种鱼类参比样品(T0696QC和TKB011RM)中鉴定的化合物。表中列出了母离子的质量精度、标识符碎片离子、碎片离子的质量精度和根据Charbonnet等人定义的置信水平21。
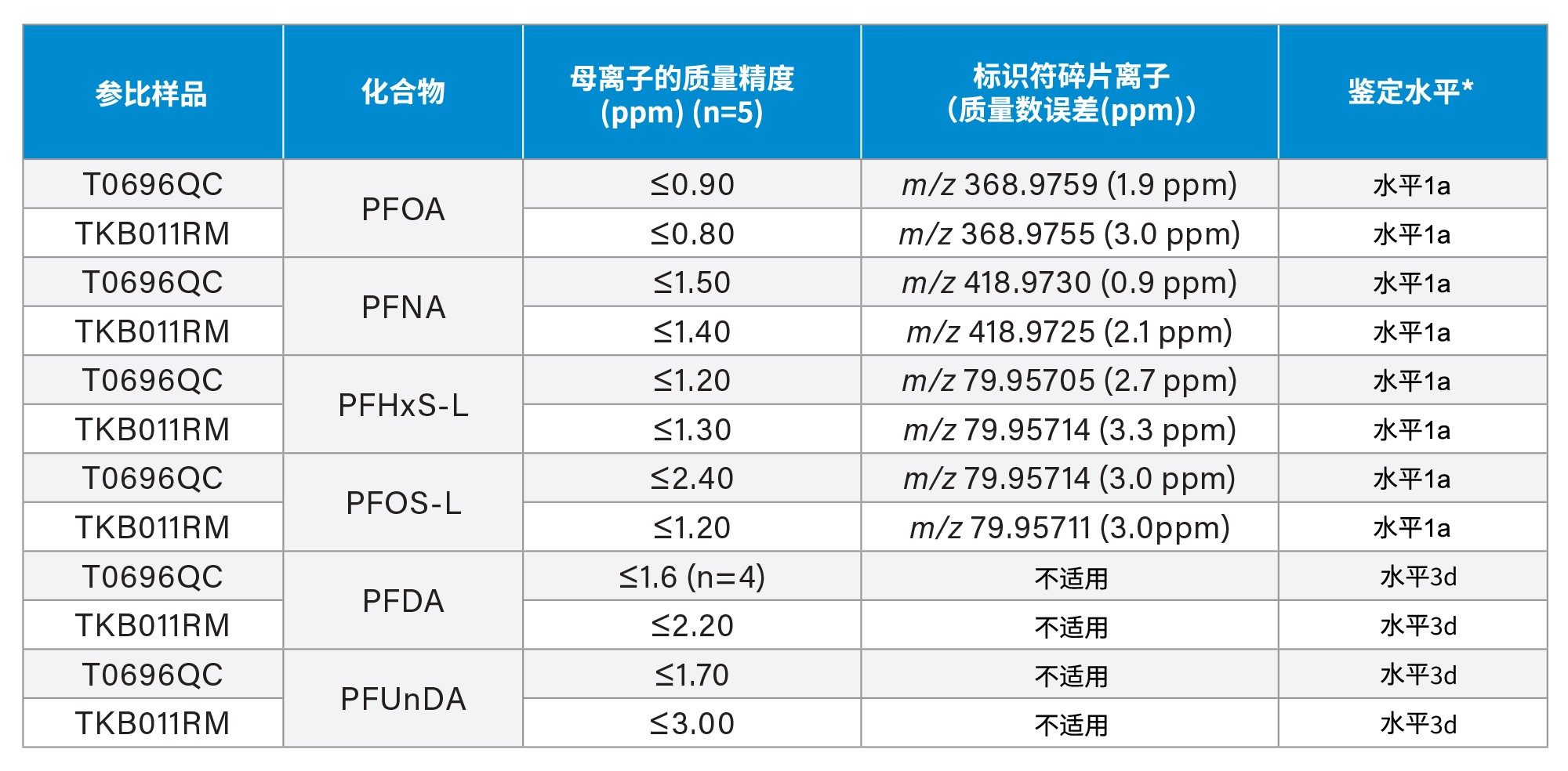
通过比较分析物的相对保留时间与校正标准品的相对保留时间,进一步确认PFAS分析物的鉴定结果,所有计算的偏差均小于1%。该结果符合EURL POPs PFAS指导文件中的所有鉴定标准15。
根据Charbonnet的PFAS鉴定置信水平标准,PFOA、PFNA、PFHxS和PFOS的鉴定水平为1a的依据是:精确质量数、质量数亏损、与标准品相比的保留时间,以及检测到至少一个碎片离子,其质量精度误差小于等于5 ppm。而PFDA和PFUnDA的注释是基于精确质量数测量结果以及与校准标准品比较的保留时间。PFDA和PFUnDA的峰强度较低,在鱼类参比样品中未检测到特定碎片离子,因此,PFDA和PFUnDA的鉴定水平为3d。
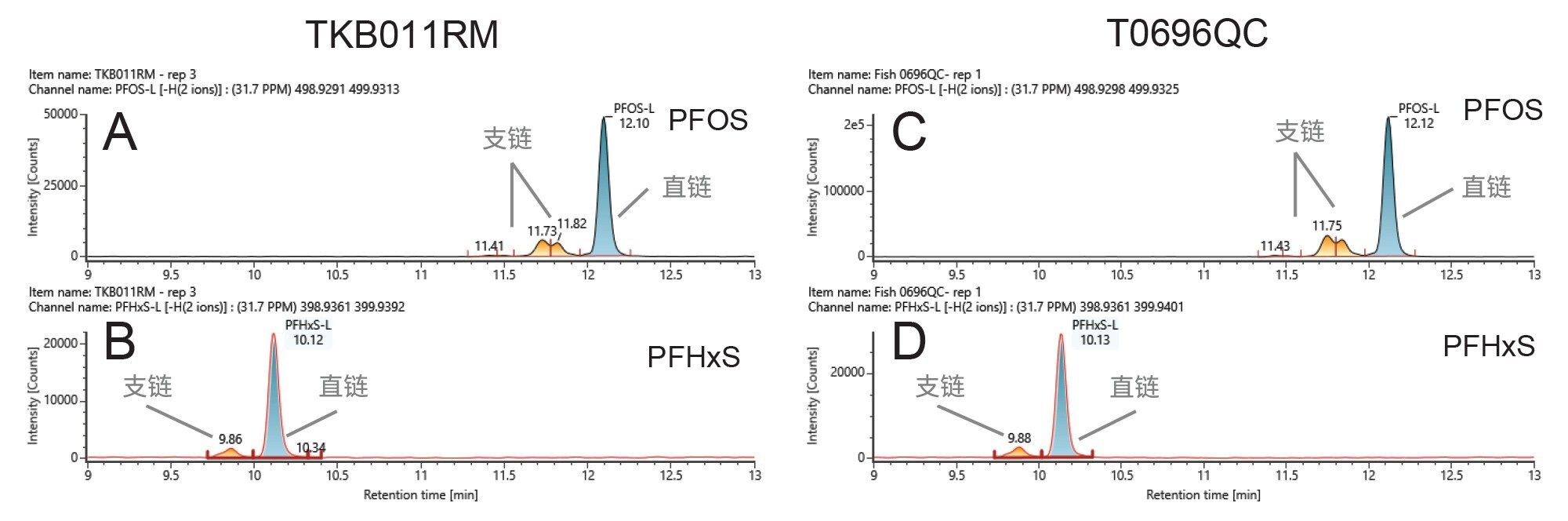
样品中检出的PFOS和PFHxS有直链和支链异构体形式。EURL指南建议比对直链异构体的标准曲线定量分析直链和支链异构体,并单独报告各自的结果,以及检出的所有异构体的总结果(EU指南2022)。图2展示了所研究的鱼类参比样品(TKB011RM和T069QC)中PFOS和PFHxS的提取离子流色谱图(XIC),其中直链和支链异构体均实现了色谱分离。图2展示了分别在TBB011RM和T0696QC中检出的PFOS(图2A和C)与PFHxS(图3B和D)的XIC,其中清楚地区分了直链和支链异构体。
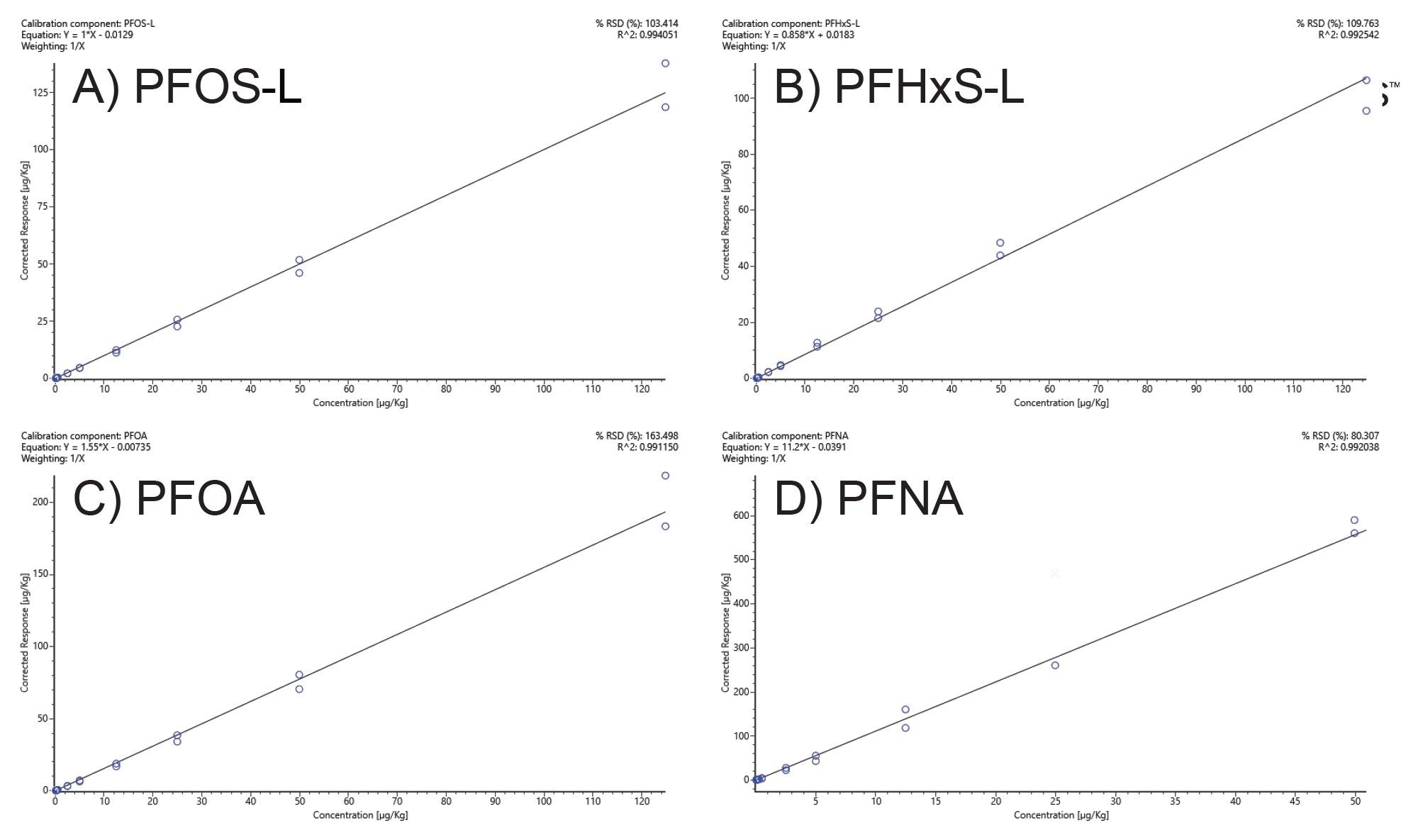
高分辨率质谱分析工作流程可通用于定性和定量分析。筛查程序提供了校准标准品,本研究在该程序中对参比样品中鉴定的四种PFAS进行了定量分析。在相同的NTS筛查过程中,纳入了浓度范围1 ng/L~25,000 ng/L(相当于样品中0.005 µg/Kg~125 µg/Kg)的LC-HRMS序列校准标准品,用于将样品夹在中间。对于本例中已鉴定的PFAS(PFHxS、PFNA、PFOA和PFOS),所有标准曲线的R2值均大于等于0.99,残差小于20%(图3)。PFOS、PFHxS和PFOA在0 µg/Kg~125 µg/Kg范围内呈线性(分别为图3A、B、C)。而PFNA在0.05 µg/Kg~50 µg/Kg范围内呈线性(图3D)。PFHxS和PFOS鉴定出支链形式和直链形式,按照EURL POPs指南的建议,通过比对直链形式的标准曲线对支链形式的浓度进行了定量分析15。
使用两种Fapas®样品评估正确度和重复性,并使用其参比值确定样品中PFAS的回收率。将可接受标准设定为80%~120%,两种参比样品均达到了这一标准。研究中还评估了中间精密度,在所有情况下均低于EURL POPs PFAS指导文件中规定的20%。图4展示了两种参比样品的分析结果与指定值的对比。

内标的回收率根据EURL POPs PFAS指导文件中的以下计算公式,使用进样标准品进行评估。所有内标的回收率均在80%~120%的范围内,但FOSA除外(未回收,在甲醇清洗阶段作为中性PFAS从SPE小柱上洗脱)。这一范围在EURL POPs PFAS指导文件规定的35%~140%范围内15。
本研究证明了Xevo G3 QTof在筛查、鉴定和定量分析食品基质所含PFAS方面的出色灵敏度。只要有分析标准品,就可以进行定量分析,并且符合EURL POPs指南的规定15。
结论
使用Xevo G3 QTof结合waters_connect软件平台中UNIFI应用程序的PFAS精简非靶向筛查(NTS)工作流程,对鱼类参比样品中的PFAS进行了鉴定和定量分析。UNIFI筛查和定量工作流程可提供丰富的选项,包括从质量数亏损过滤、质量数与保留时间过滤,以及在线数据库和谱库搜索。生成的数据集用于靶向定量方法,也可以通过发现工具集和数据库来源,对新型或之前未报告的PFAS进行回顾性挖掘。Xevo G3 QTof仪器的高灵敏度和非数据依赖型采集模式MSE帮助鉴定了PFOA、PFDA、PFOS(直链和支链)、PFHxS(直链和支链)的母离子和碎片离子。
参考资料
- Hansen K J, Clemen L A. Ellefson M E., Johnson H O. Compound-Specific Quantitative Characterisation of Organic Fluorochemicals in Biological Matrices.Environ.Sci.Technol. 35, 766–770, 2001.
- Giesy J P and Kannan K Global Distribution of Perfluorooctane Sulfonate in Wildlife.Environ.Sci.Technol. 35: 1339–1342, 2001.
- Kelly B C, Ikonomou M G, Blair J D, Surridge B, Hoover D, Grace R, Gobas F A P C. Perfluoroalkyl Contaminants in an Arctic Marine Food Web: Trophic Magnification and Wildlife Exposure.Environ.Sci.Technol. 43 (11), 4037–4043, 2009.
- EFSA report.Results of the Monitoring of Perfluoroalkylated Substances in Food in the Period 2000–2009.February 2011.
- United States Environmental Protection Agency.Analysis of Per and Polyfluoroalkyl Substances (PFAS) in Aqueous, Solid, Biosolids, and Tissue Samples by LC-MS/MS.4th Draft method 1633, July 2023.
- Organtini K, Rosnack K, Hancock P. 根据EPA 1633分析全氟烷基和多氟烷基化合物(PFAS) 第1部分:建⽴和评估⽅法.沃特世应用纪要. 720008117ZH, 2023年.
- Khoury-Hollins H., Reid L., Adams S. 使用高分辨率飞行时间质谱仪Xevo™ G3 QTof直接进样方法筛查饮用水中的全氟烷基和多氟烷基化合物(PFAS).沃特世应用纪要.720008198ZH, 2024年.
- Commission Recommendation (EU) 2022/1431, on the Monitoring of Perfluoroalkyl Substances in Food.L 221/105, 26.8.2022.
- Travis D Evidence That There are Two Forms of Fluoride in Human Serum.Nature 214: 1050–1051, 1968.
- Lau C, Perfluorinated Compounds: An Overview.In: DeWitt, J.C. (Ed.), Toxicological Effects of Perfluoroalkyl and Polyfluoroalkyl Substances.Springer, pp.1–21, 2015.
- Dickman R A, Aga D S. A Review of Recent Studies on Toxicity, Sequestration, and Degradation of Per- and Polyfluoroalkyl Substances (PFAS) Journal of Hazardous Material. 436: 129120, 2022.
- Trudel D, Horowitz L, Wormuth M, Scheringer M, Cousins IT, Hungerbühler K. Estimating Consumer Exposure to PFOS and PFOA.Risk Anal. 28:251–69, 2008.
- De Silva A O, Armitage J M, Bruton T A, Dassuncao C, Heiger-Bernays W, Hu X C, Kärrman A, Kelly B, Ng C, Robuck A, Sun M, Webster T F, Sunderland E M. PFAS Exposure Pathways for Humans and Wildlife: A Synthesis of Current Knowledge and Key Gaps in Understanding Environ Toxicol Chem. 40: 631–657, 2021.
- Schrenk D, Bignami M, et al, EFSA Panel on Contaminants in the Food Chain (EFSA CONTAM Panel), Risk to Human Health Related to the Presence of Perfluoroalkyl Substances in Food.EFS2;18(9) 2020.
- EURL for Halogenated POPs in Feed and Food (2022): Guidance Document on Analytical Parameters for the Determination of Per- and Polyfluoroalkyl Substances (PFAS) in Food and Feed, version 1.2 of 11 May 2022.在线获取(https://eurl-pops.eu/core-working-groups#_pfas)
- Adams S, Dreolin N, Organtini K L, Hancock P. 以鱼类参比样品作为案例研究,使用高灵敏度LC-MS/MS方法分析动物产品中的全氟烷基和多氟烷基化合物(PFAS).沃特世应用纪要.720008108ZH, 2023年.
- Twohig M, Fujimoto G, Mohan A, Organtini K L, Rosnack K J, Hird S. 环境样品中全氟烷基和多氟烷基化合物(PFAS)的非靶向分析方法.沃特世应用纪要.720007184ZH, 2021年.
- U.S. Environmental Protection Agency.CompTox Chemicals Dashboard.https://comptox.epa.gov/dashboard/chemical-lists/pfasmaster accessed November 2023.
- Suspect List of Possible Per- and Polyfluoroalkyl Substances (PFAS).https://data.nist.gov/od/id/mds2-2387 Accessed March 2023.
- Bugsel B, Zweigle J, Zwiener C. Nontarget Screening Strategies for PFAS Prioritization and Identification by High Resolution Mass Spectrometry: A Review.Trends in Environmental Analytical Chemistry. 40: e00216, 2023.
- Charbonnet J A, McDonough C A, Xiao F, Schwichtenberg T, Cao D, Kaserzon S, Thomas K V, Dewapriya P, Place B J, Schymanski E L, Field J A, Helbling D E, Higgins C P. Communicating Confidence of Per- and Polyfluoroalkyl Substance Identification via High-Resolution Mass Spectrometry.Environ Sci Technol Lett. 9: 473–481, 2022.
720008360ZH, 2024年6月