通过LC-MS监测氨基酸和双特异性抗体同型二聚体,加速Sartorius Ambr®15微型生物反应器的上游工艺开发
摘要
本应用纪要详细介绍了在上游开发中使用BioAccord™ LC-MS系统进行在线工艺分析技术(PAT),特别是针对错配双特异性抗体(BsAb)同型二聚体的监测。研究中采用实验设计(DoE)方法考察了一系列细胞培养条件,包括培养基、温度降低和补料策略。实验在Sartorius Ambr®15高通量微型生物反应器系统上进行,并于不同日期采集样品,用于氨基酸定量和完整质量数分析。waters_connect™平台提供了快速高效的工作流程,简化了样品分析,加速了工艺开发并加深了对细胞培养的了解。
优势
- 通过在一体化平台LC-MS系统中监测完整药物和氨基酸,简化并加快在高通量微型生物反应器系统中开发双特异性抗体细胞培养物的上游工艺
- 使用BioAccord LC-MS系统进行简单直接的LC-MS采集和数据处理,该系统操作简单,适合所有专业水平的分析人员使用
- 实验设计(DoE)和多元回归分析数据揭示了特定氨基酸与双特异性抗体细胞培养物中同型二聚体形成之间的相关性
简介
双特异性抗体(BsAb)可同时结合两个不同的靶标或表位,从而实现更好的治疗效果,在生物效应的精确调控上优于单克隆抗体。然而,由于会形成不需要的同型二聚体,BsAb的生产过程变得复杂,影响了纯度和产量。尽可能减少细胞培养物上清液中的同型二聚体对于大幅提高BsAb的表达水平和节约成本至关重要。本应用纪要全面探讨了在Sartorius Ambr®15高通量微型生物反应器系统上优化细胞同型二聚体含量的细胞培养条件,以及利用BioAccord LC-MS系统实现的高效同型二聚体监测。
实验
样品前处理
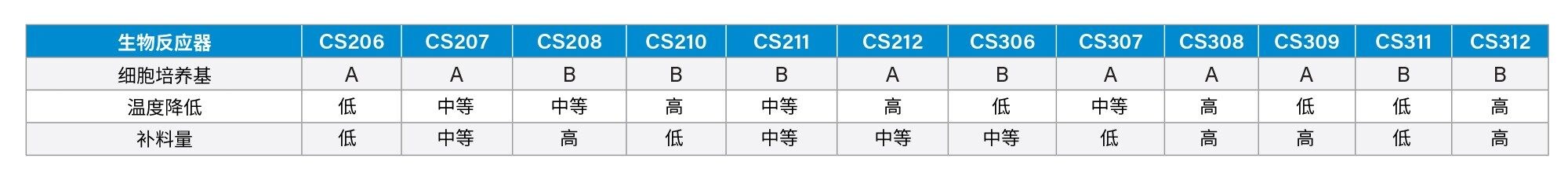
为了降低同型二聚体水平,我们设计了一项DoE实验,重点关注培养基、温度降低和补料策略(表1)。本实验采用CHO-K1分批补料工艺,在Ambr®15微型生物反应器系统上进行了12种培养条件的实验,持续14天。在第11、13和14天收集样品,经蛋白A纯化处理后,用PNGase F进行糖基释放,并在BioAccord LC-MS系统上分析完整质量数。在第9-12天和第14天采集氨基酸样品,使用之前描述的分析方法1,并对分析前的样品前处理方法进行了轻微修改1。简而言之,就是将培养基离心,并用乙腈沉淀蛋白质。取上清液,使用含有3-氯-L-酪氨酸0.1%甲酸(FA)作为内标,以1:2000的比例稀释上清液,在BioAccord系统上进行LC-MS分析。
完整蛋白质分析的LC-MS条件
|
LC-MS系统: |
配备ACQUITY™ Premier BSM的BioAccord LC-MS系统 |
|
电离模式: |
全扫描 |
|
质量范围: |
高(400~7000 m/z) |
|
极性: |
正离子 |
|
毛细管电压: |
1.5 kV |
|
锥孔电压: |
70 V |
|
脱溶剂气温度: |
550 ℃ |
|
智能数据捕获: |
关 |
|
锁定质量数校正模式: |
标准 |
|
LC-MS软件: |
waters_connect 3.1或更高版本 |
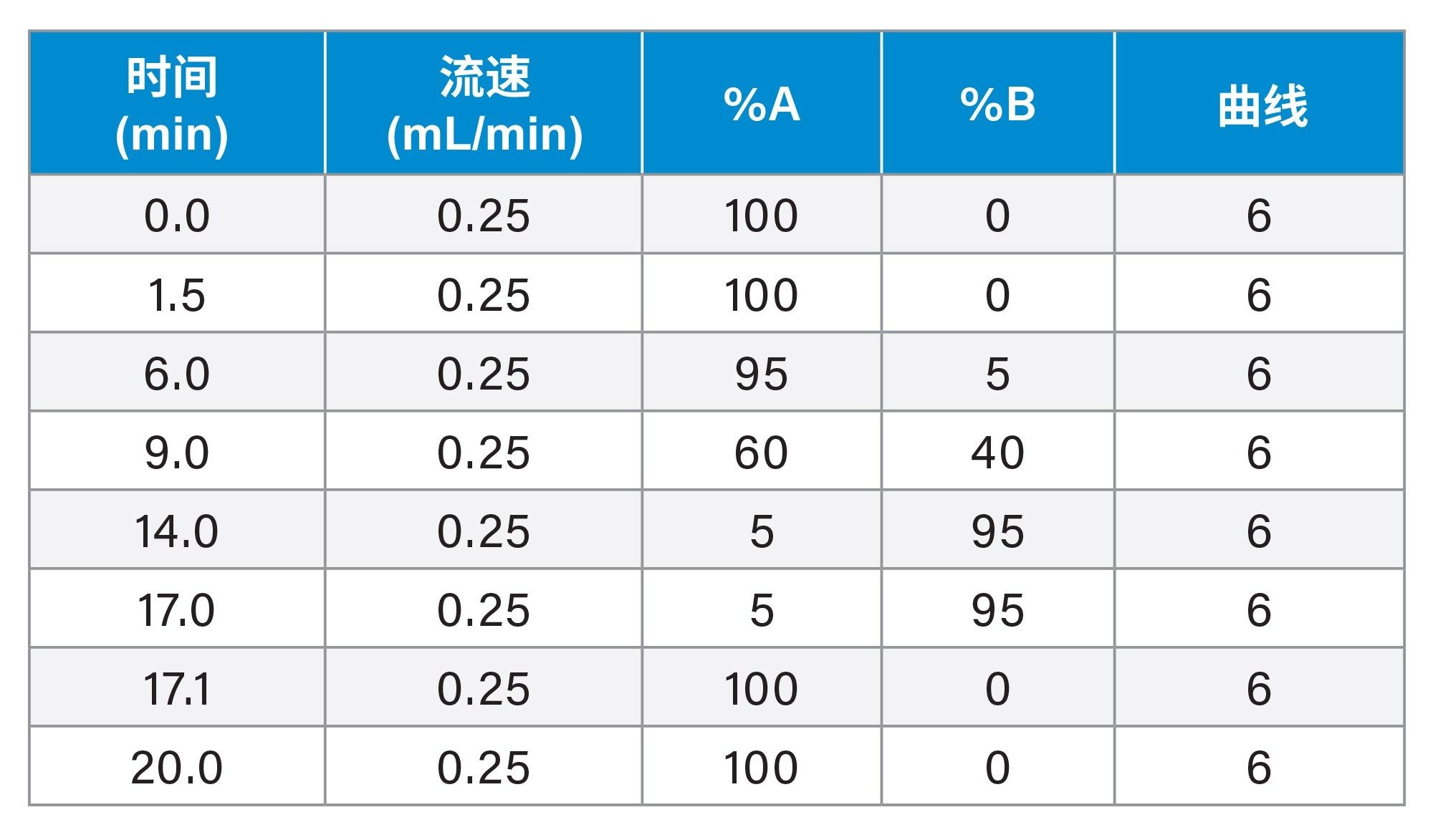
用于氨基酸定量的LC-MS条件
|
LC-MS系统: |
配备ACQUITY Premier BSM的BioAccord LC-MS系统 |
|
色谱柱 |
ACQUITY Premier HSS T3色谱柱, 1.8 µm, 2.1 mm × 150 mm(P/N:186009469) |
|
柱温: |
40 ℃ |
|
样品温度: |
8 ℃ |
|
进样体积: |
1 µL |
|
流速: |
0.25 mL/min |
|
流动相A: |
0.1%甲酸水溶液 |
|
流动相B: |
90% ACN/10% IPA/0.1% FA |
|
电离模式: |
碎裂模式下的全扫描 |
|
采集范围: |
小分子(50~800 m/z) |
|
极性: |
正离子 |
|
毛细管电压: |
1 kV |
|
锥孔电压: |
20 V |
|
碎裂锥孔电压: |
40-60 V |
|
扫描速率: |
5 Hz |
|
脱溶剂气温度: |
550 ℃ |
|
智能数据捕获: |
开 |
|
锁定质量数校正模式: |
标准 |
|
采集时间窗口: |
开始时间 = 0 min,结束时间 = 14 min |
|
MS事件表: |
0 min时切换至废液,0.8 min时切换至MS,14 min时切换至废液 |
|
LC-MS软件: |
3.1或更高版本 |
|
信息学软件: |
UNIFI™ - 使用细胞培养基筛选工作流程进行精确质量数筛查 |
梯度表
结果与讨论
测定蛋白A纯化后BsAb同源二聚体的相对含量
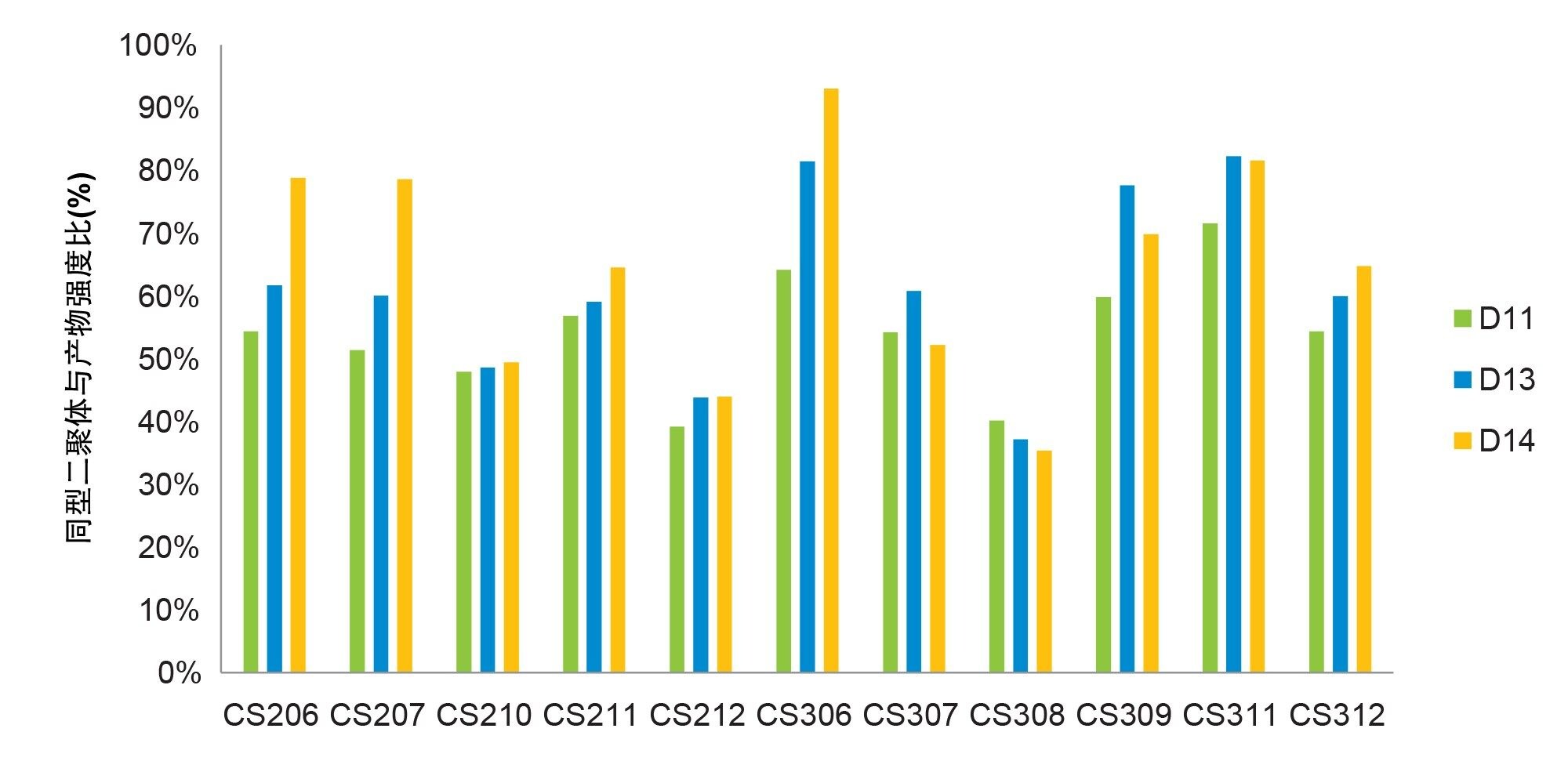
生物制药公司通常会采用一套分析方法来表征双特异性抗体,但在早期工艺开发中,很少有方法能够立即区分产物与同型二聚体。而平台LC-MS方法可以区分两者,且无需进行大量的方法开发。在本研究中,我们利用完整蛋白质量数分析方法评估了各种早期细胞培养条件下的同型二聚体水平。经蛋白A纯化后,样品使用BioAccord LC-MS系统进行分析,成功鉴定出了同型二聚体和产物。同型二聚体(148 kDa)和产物(145 kDa)之间的分子量仅相差3 kDa,且电离效率相似,因此可以公平地比较这两种物质的MS信号强度。因此,同型二聚体/产物强度比可用作同型二聚体含量的相对定量方法。图1展示了在各种细胞培养条件下,同型二聚体/产物强度比随时间推移的直方图,由图可见,在CS210、CS212和CS308中,同型二聚体水平降低,这些条件下的温度均有较大幅度的下降。
监测多种细胞培养条件下的氨基酸含量变化
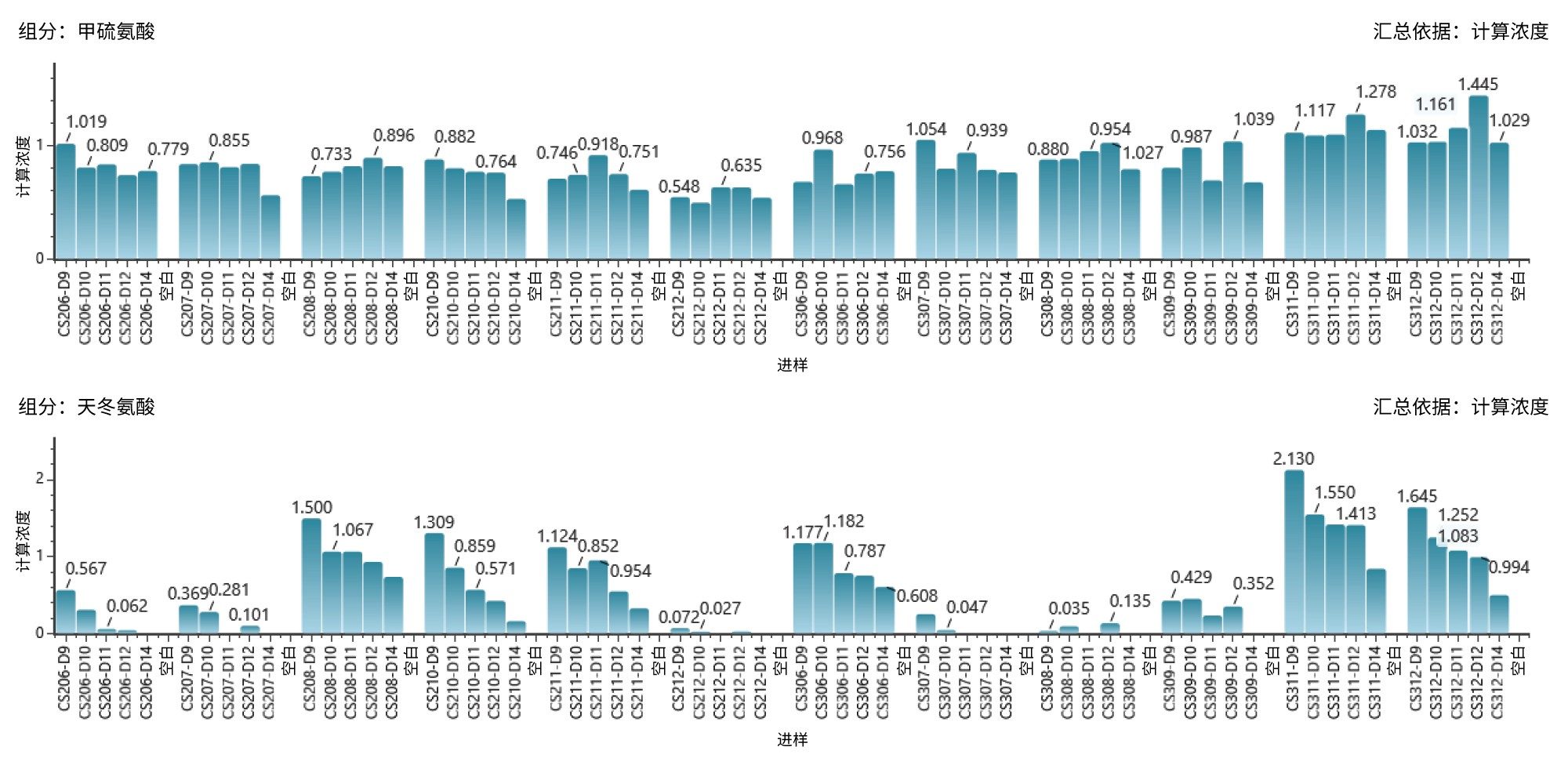
细胞培养基优化是上游工艺开发的一个关键方面,特别是关注氨基酸浓度的监测,因为氨基酸是蛋白质的组成部分和代谢中间体,显著影响着生物制品的质量。使用BioAccord LC-MS系统对20种氨基酸进行定量分析,详细方法见之前的出版物1。 图2展示了整个DOE研究中氨基酸浓度随时间的变化,突出显示了在各种培养条件下,某些氨基酸(例如蛋氨酸)的细微波动,以及另一些氨基酸(例如天冬氨酸)的显著变化。
多元回归分析
利用JMP进一步分析了第9~12天和第14天的所有氨基酸浓度、培养基类型、温度降低和补料策略,以确定这些因素与同型二聚体比例的相关性。某些氨基酸(此处称为AA1和AA2)与同型二聚体的含量呈负相关,而AA3则呈正相关(图3)。此外,温度下降表现出微弱的负相关性(图4)。同型二聚体含量与其他细胞培养条件之间未观察到显著的相关性(图4)。
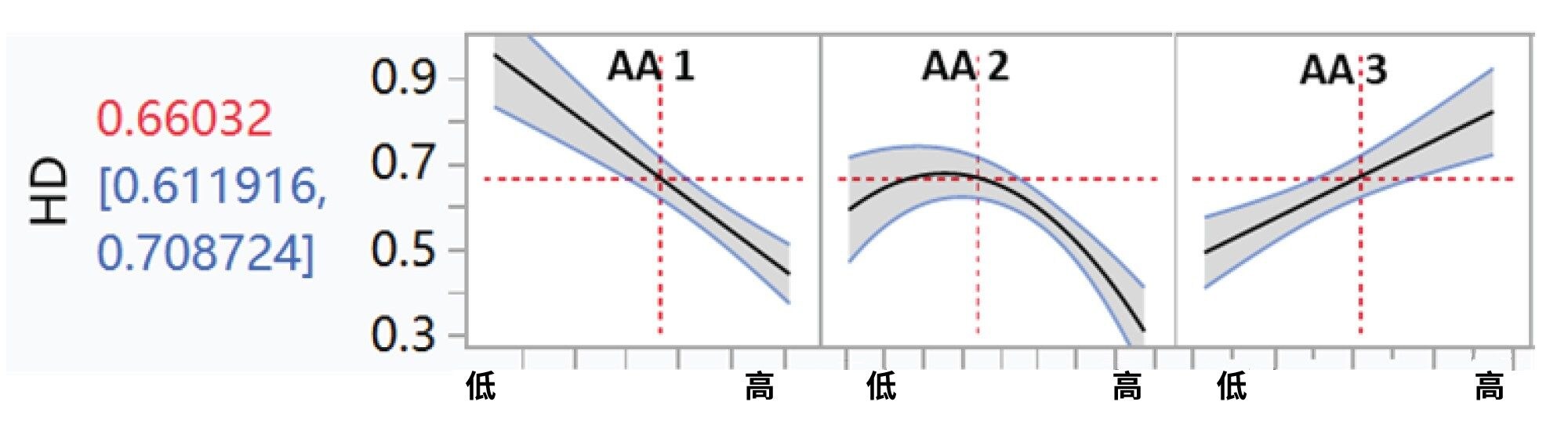
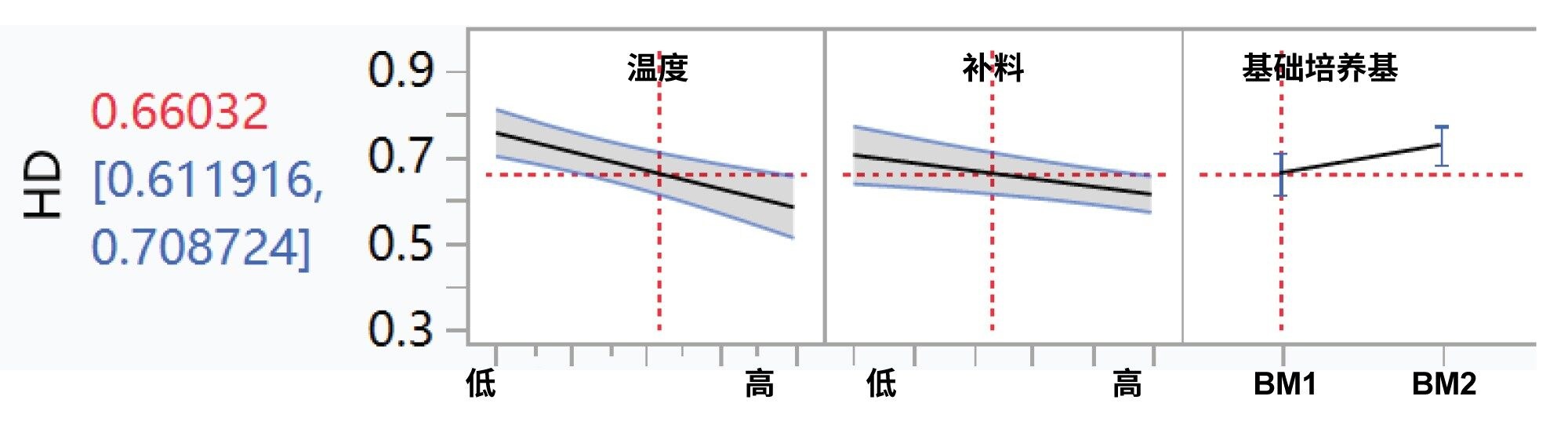
结论
使用Sartorius Ambr® 15微型生物反应器系统结合BioAccord LC-MS系统,根据DoE研究针对同型二聚体含量进行了上游双特异性抗体的工艺优化。BioAccord LC-MS系统实现了高通量分析,用于大规模样品的完整质量数分析和氨基酸定量分析,这些样品来自Ambr® 15的12种培养条件,培养历时14天。多元回归分析结果显示,有三种氨基酸与同型二聚体的含量强相关,而温度降低则表现出微弱的负相关性。总体而言,BioAccord LC-MS系统与Ambr®15生物反应器之间的协作显著提高了上游工艺开发的效率。
参考资料
- YW Alelyunas, MD Wrona, YQ Yu.使用BioAccord™ LC-MS系统定量细胞培养基中的未衍生化氨基酸, 720007766ZH, 2022年10月.
720008343ZH, 2024年5月