GTxResolve™ Premier SEC 1000 Å 3 µm色谱柱的动力学柱效和分离范围
摘要
本研究探讨了GTxResolve Premier SEC 1000 Å 3 µm色谱柱的动力学效率和分离范围。这些色谱柱是专为细胞和基因疗法原料药及其产品的分析而设计的先进分离工具。本文使用DNA和RNA ladder进行了一系列基础比较研究,利用更小的3 µm超宽孔径(1000 Å)填料,这类色谱柱在分离效果上显著优于传统的5 µm色谱柱。新色谱柱技术带来的优势可以应用于两种方式之一:在保持相同柱效的同时更快、更高通量的运行,或将分离度提高30%~40%。体积排阻色谱的这些进展恰逢市场对新型药物的SEC分析需求增加之际,尤其是对mRNA和其他核酸类治疗药物的聚集体和完整性分析需求增加的情况下。
优势
- 与传统5 µm色谱柱相比,分析速度更快、通量更高
- 由于减少了次级(非特异性)静电相互作用,在分析高分子量物质(HMWS)时更加可靠
- 在固定分析时间或操作压力时,新型GTxResolve Premier SEC 1000 Å 3 µm色谱柱的性能全面优于传统5 µm色谱柱
简介
体积排阻色谱(SEC)是一种历史悠久的生物药物大小异构体表征方法,现今在新型药物分析中变得越来越重要。高分子量物质的定量是许多新型基因治疗药物(包括核酸)的关键质量属性之一1。 对于mRNA疫苗,建议的纯度要求之一是通过SEC测量聚集体,预计这种色谱法将在其他类别的RNA和DNA治疗药物的质量评估中发挥关键作用2。
根据应用的不同,载荷遗传物质的大小也各不相同(从100个核苷酸的CRISPR向导RNA,到4700 bp的DNA病毒载体基因组)。更常用的核酸长度在500到5000个核苷酸之间。例如,用作疫苗的COVID-19 mRNA长度为4500 nt,其流体动力学半径约为25 nm3。 此类物质的SEC分离需要使用适当大孔径的色谱柱。但是,由于在溶液中的流体动力学半径与色谱柱柱长的相关性不明确,以及不同色谱柱制造商对在报告SEC色谱柱标示孔径上的差异,通常需要通过实验来确定合适的SEC色谱柱。目前已经确定,通常用于生物制药分析的色谱柱(填料孔径为125 Å和250 Å)可能仅适用于长度为30至150个残基的寡核苷酸4。 最近的一项研究比较了不同孔径的色谱柱,提示使用1000 Å的填料可以为这类大小的非复制RNA提供理想的分离效果5。
大孔径色谱柱(>500 Å,有时称为超宽孔径)通常仅提供大粒径(≥5 µm)填料,这样限制了分析通量,且为了达到预期的分离度,必须使用更长的色谱柱。这反过来又增加了分析所需的样品量,而样品量通常是常规分析这些新型治疗药物(尤其是新型个性化mRNA癌症疫苗)的限制因素6。
另一方面,核酸的多聚阴离子性质意味着它们容易受到吸附次级相互作用的影响,要想成功进行SEC分析,必须限制这种次级相互作用。除需要惰性(色谱)填料外,还需要使用低吸附色谱柱硬件,以获得理想结果和准确的筛分测量结果。
为了解决这些问题,我们研究了一种应用,将平均孔径为1000 Å的更小的PEO键合颗粒(3 µm)填充到低吸附性的MaxPeak™ HPS Premier硬件中,并使用大分子核酸ladder样品进行了测试。本应用纪要介绍了新型GTxResolve Premier SEC 1000 Å 3 µm色谱柱的分离范围及其在核酸分离中的应用。此外,我们还探讨了该色谱柱的动力学效率,并将它与具有相似孔径的传统5 µm色谱柱进行了比较。本文系统地比较了标准曲线、理论塔板数、分离阻抗和动力学性能限值,结果发现新型颗粒色谱柱和相关色谱柱技术更具优势。
实验
样品和流动相制备
将一份dsDNA 50~1350 Ladder(沃特世P/N:186010778)复溶于1000 µL无核酸酶水中,最终浓度为0.1 mg/mL,100 bp dsDNA Ladder(New England Biolabs, N3231S)、低范围ssRNA Ladder (New England Biolabs, N0364S)和ssRNA Ladder (New England Biolabs, N0362S)用无核酸酶水稀释10倍后,转移至样品瓶中,直接进样至SEC色谱柱。
注意:进样高度聚集的样品时应谨慎操作。建议在进样至SEC色谱柱之前对此类样品离心去除颗粒物和/或使用针式过滤器过滤。
液相色谱条件
|
液相色谱系统: |
ACQUITY™ H-Class Plus Bio系统,带二元溶剂管理器(BSM) |
|
检测: |
配备5 mm钛合金流通池的ACQUITY UPLC™ TUV检测,260 nm和230 nm;(2 pt/s) |
|
样品瓶: |
采用MaxPeak HPS技术的QuanRecovery™ 12 × 32 mm螺纹口样品瓶,300 µL,100个/包(P/N:186009186) |
|
色谱柱: |
分析级:GTxResolve Premier SEC 1000 Å 3 µm色谱柱, 150 × 4.6 mm(P/N:186010735) |
|
柱温: |
25 °C |
|
样品温度: |
6 °C |
|
进样体积: |
1.0~5.0 µL(根据流速调整) |
|
流速: |
0.05、0.1、0.175、0.25、0.40、0.50和0.60 mL/min |
|
流动相: |
2 × PBS缓冲液,经0.2 µm无菌过滤 (流动相只能使用2天,或者用叠氮化物制备流动相以阻止细菌生长)。 |
结果与讨论
改善液相色谱分离动力学性能(分离速度和柱效)的常用策略是使用填充更小粒径的色谱柱。填充亚2 µm多孔颗粒的反相(RP)色谱柱于2004年上市,而亚2 µm SEC色谱柱则在2011年推出。由此色谱柱引入了一个新术语,即“超高性能SEC”(UHP-SEC)。使用超细颗粒的原理是,通过降低填充柱中的涡流扩散(理论塔板高度公式中的A项)和溶质在SEC色谱柱孔隙中的静止液相与柱间体积中流动相之间分配的传质阻抗(C项),来提高分离效率。目前,市面上有各种150~300 Å SEC色谱柱,采用亚2 µm和亚3 µm规格7。 但是,小颗粒会产生高压,沿色谱柱产生的压力与粒径平方的倒数成正比。已知孔径非常大(超宽孔径)的SEC色谱柱的机械稳定性低于孔径较小的色谱柱。因此,生产能够承受更高压力的超宽孔径颗粒颇具挑战。目前市售的超宽孔径SEC色谱柱(即500 Å或1000 Å)大多由5 µm颗粒制成,这会影响动力学性能。GTxResolve Premier SEC色谱柱是首款兼具耐高压与出色动力学性能的3 µm, 1000 Å色谱柱。凭借其平衡的粒径和孔径大小,该色谱柱为不同类型的样品提供了一系列可行的操作条件。
标准曲线和分离范围
本研究比较了新款GTxResolve Premier SEC 1000 Å, 3 µm色谱柱与市售5 µm 1000 Å硅胶颗粒色谱柱的筛分范围。通过进样50 bp和100 bp DNA ladder以及ssRNA和低范围ssRNA ladder来测量获得标准曲线。将结果以各组分的碱基对数量(对数标度)vs.归一化洗脱体积(Ve,n)绘制关系图。SEC标准曲线本质上反映了色谱柱可进入孔的孔径分布(PSD)和平均孔径8。 因此,这种方法适合比较不同SEC色谱柱的孔结构(形态)。
比较两种色谱柱获得的标准曲线时,发现对于DNA和ssRNA同系物,它们表现出高度相似性。图1展示了DNA ladder的标准曲线。
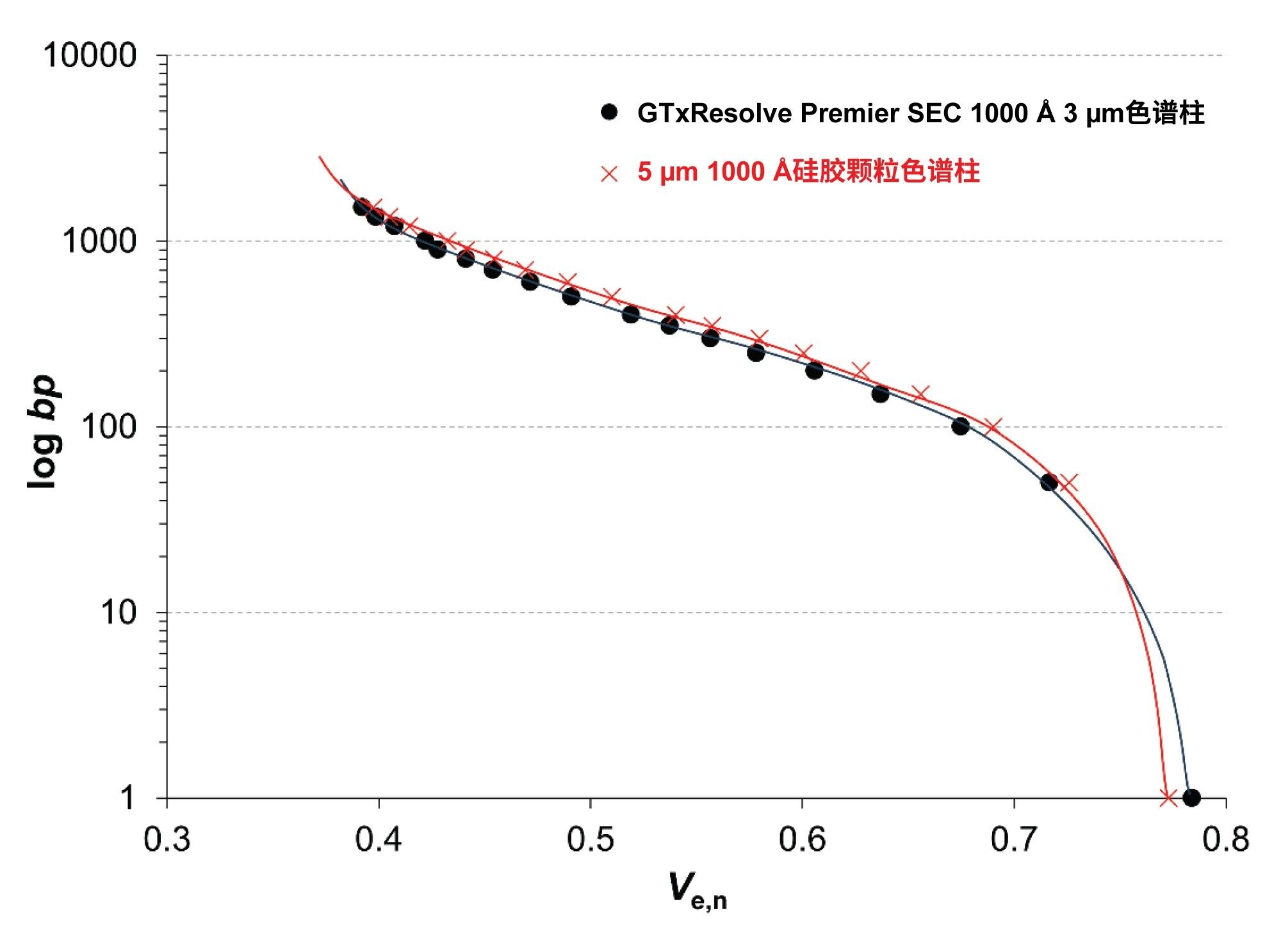
标准曲线的右端由填料的总孔隙率(或总渗透性)决定。观察到GTxResolve Premier SEC色谱柱的孔隙率略高(Ve,n = 0.784 vs. 0.773)。
排阻限(标准曲线左端)和渗透限之间的洗脱窗口通常被称为色谱柱的“分离范围”或“筛分范围”。比较结果表明,两种色谱柱的分离范围几乎相同。标准曲线的斜率是PSD的结果。由于斜率非常相似,两种材料的PSD也应相似。曲线的垂直位置由平均孔径决定。同样,由于位置非常相似,两种填料的平均孔径也非常相似。
总之,标准曲线的比较结果表明,两种色谱柱的筛分范围、平均可进入孔径和预期选择性均非常相似。拐点出现在约350~400 bp DNA和约3 kb ssRNA大小处。这些大小与洗脱窗口的中间位置相对应(分配系数KSEC约为0.5)。
可实现的理论塔板高度和理论塔板数
首先使用理论塔板高度曲线评估色谱柱的动力学效率。设定介于0.05~0.60 mL/min范围内的一系列流速,将获得的理论塔板高度(H)绘制为流动相线速度(u)的函数。为覆盖较宽的溶质大小范围,绘制了100、300、500和1350 bp DNA的H - u曲线。平均而言,使用GTxResolve Premier SEC 1000 Å, 3 µm色谱柱在给定流速下产生的H值比5 µm 1000 Å硅胶色谱柱低1.5到2倍。也就是说,在比较相同长度的色谱柱时,3 µm色谱柱的理论塔板数(N)是5 µm色谱柱的1.5~2倍,因此分离度约为1.2~1.4倍(考虑到Rs与√N成正比)。这也意味着长度比5 µm色谱柱短1.5至2倍的3 µm色谱柱可以保持相同的柱效和分离度。因此,分析时间也可以缩短1.5~2倍。
色谱柱渗透性和分离阻抗
比较色谱柱性能时,不仅要考虑理论塔板数,还要达到给定理论塔板数(N)所需的压力(Δp)。SEC分析尤其如此,为避免出现任何与压力和摩擦相关的伪峰,SEC首选条件为低压条件。常见的理论塔板高度曲线缺乏对渗透性的考虑,因此其他性能特征也值得研究。
在流动性研究过程中,记录了柱压并根据系统压力进行校准。然后计算了色谱柱渗透性。测得GTxResolve Premier SEC 1000 Å, 3 µm色谱柱的K = 1.22 × 10-10 cm2,5 µm硅胶色谱柱的K = 3.72 × 10-10 cm2。
色谱柱的总体性能取决于可实现的理论塔板高度、色谱柱渗透性和分析时间,后者与色谱柱的死时间(t0)有关。因此,H–u曲线仅提供可达到的峰宽信息,不能提供可达到的分离时间信息。分离阻抗(E,由Knox提出,有时称为有效柱阻抗)是一个综合指标,考虑了峰宽、分析时间和色谱柱渗透性9。 通常使用以下公式:
E = (t0∙∆p)/(N2∙η) = H2/K
(公式1)
其中,η是流动相粘度。请注意,E是无量纲的,其值越低,越有利于分离。图2显示了小分子DNA(100 bp)和大分子DNA(1350 bp)在不同线速度下获得的分离阻抗图。
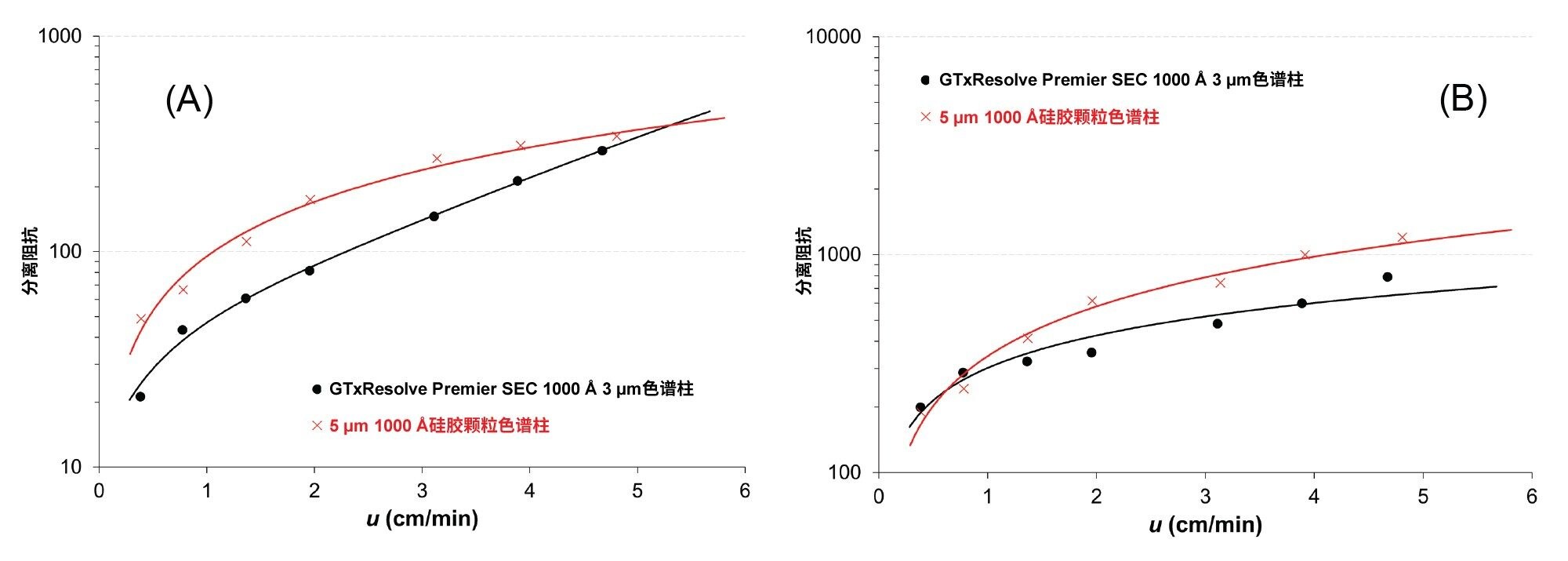
对于100 bp DNA,使用3 µm色谱柱时的阻抗值为E = 20~300,使用5 µm色谱柱时的阻抗值为E = 50~350。3 µm色谱柱的优势最大,在低流速条件下尤其如此。
对于大分子DNA,3 µm和5 µm色谱柱的阻抗值分别为E = 200~800和E = 200~1200。对于这种大分子DNA,3 µm色谱柱在较高流速下似乎表现出特别的优势。所有分析物的分析趋势相同(在整个分离范围内)。
动力学图比较
最后,还需要考虑固定柱压下的预期结果。此类分析可以帮助确定使用哪种类型的色谱柱,以便在特定的运行时间内实现特定的预期结果。
Poppe提出了“Poppe图”,根据理论塔板时间(t0/N)对理论塔板数(N)作图10。 这款便捷的工具可以显示分离速度和效率之间的权衡关系。后来Desmet引入了“动力学图”理论,作为一种通用工具来绘制固定柱压(Δp固定)下各种填料的动力学性能11。 我们建议使用以下公式估算可实现的理论塔板数和相应的分析时间(t0):
N = (∆p固定)/η (K/(u∙H))
(公式2)
t0 = (∆p固定)/η (K/u2)
(公式3)
代表性示例如图3所示,其中显示了100 bp和1350 bp DNA在Δp = 100 bar下运行色谱柱时的动力学性能限值图。
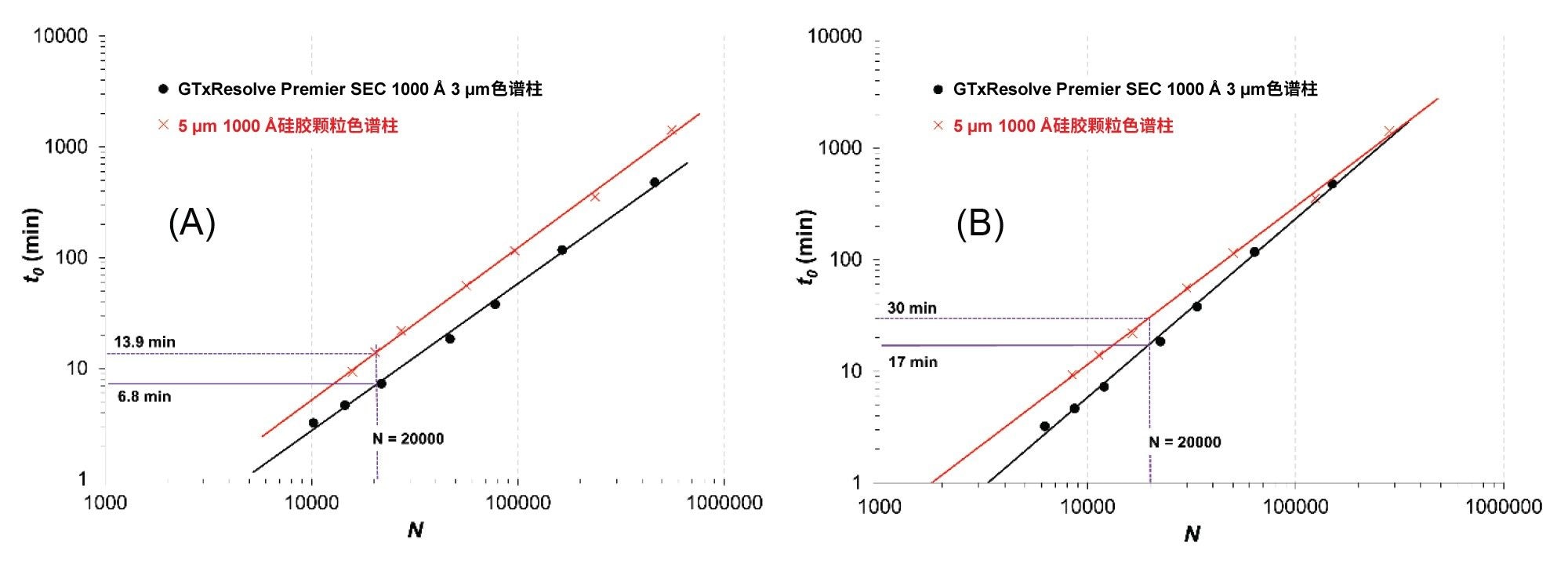
从图中可以看出,在分析时间方面,3 µm色谱柱始终优于5 µm 1000 Å硅胶颗粒色谱柱。黑色曲线始终低于红色曲线,这一点可以清晰看出。
对于小分子DNA (100 bp),使用3 µm色谱柱在6.8 min内即可达到N = 20000,而使用5 µm色谱柱则需要13.9 min才能达到相同的柱效。
对于大分子DNA (1350 bp),使用3 µm色谱柱可以在17 min内获得20000个理论塔板,而5 µm色谱柱则需要30 min。
示例:DNA ladder分离
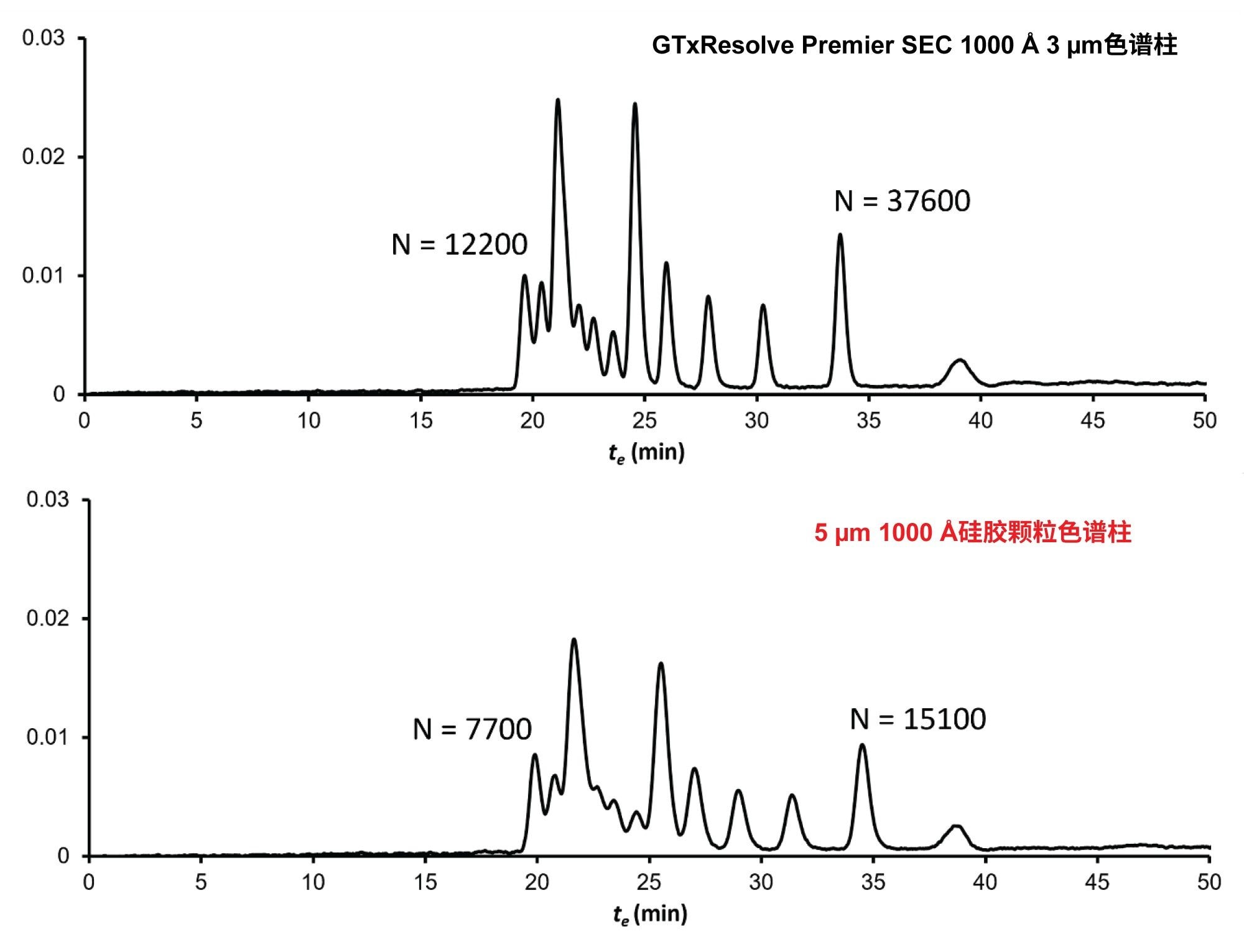
图4展示了以F = 0.05 mL/min的流速运行DNA ladder时获得的示例色谱图。图中给出了第一个洗脱峰(1500 bp DNA)和最后一个洗脱峰(100 bp DNA)的理论塔板数。GTxResolve Premier SEC 1000 Å, 3 µm色谱柱的理论塔板数大约是5 µm 1000 Å硅胶颗粒色谱柱的两倍。使用3 µm颗粒色谱柱后,各峰对之间的分离度明显提高。
结论
沃特世推出了一种新型1000 Å, 3 µm超宽孔径色谱柱,专为快速高效地分离细胞和基因治疗药物产品及原料药而设计,如完整mRNA、LNP聚集体、质粒DNA拓扑结构等。GTxResolve Premier SEC 1000 Å 3 µm色谱柱独特的小粒径和高机械稳定性可带来更高的分离效率。理论塔板高度、分离阻抗和动力学图分析表明,与其他常规的5 µm材料相比,这种新型色谱柱的整体柱效更为出色。
参考资料
- Fekete S., Doneanu C., Addepalli B., Gaye M., Nguyen J., Alden B., Birdsall R., Han D., Isaac G., Lauber M., Challenges and Emerging Trends in Liquid Chromatography-Based Analyses of mRNA Pharmaceuticals, J. Pharm.Biomed.Anal. 224 (2023) 115174, https://doi.org/10.1016/j.jpba.2022.115174.
- Analytical Procedures for mRNA Vaccine Quality (Draft Guidelines) - 2nd Edition, Posting Date: 28-Apr-2023, Access Date: 28-Feb-2024.https://www.uspnf.com/notices/analytical-procedures-mrna-vaccines-20230428.
- Tan Y.Z., Qiao L.Z., Wang S.S., Zhang J., Qian J., Zhu M., Yao S.J., Lin D.Q., Enhanced Adsorption Performance of Varying-Length mRNA on Oligo dT Affinity Resins Through Optimal Pore Size and Grafting, Biochem. Eng.J. 203 (2024) 109213, https://doi.org/10.1016/j.bej.2023.109213.
- Gilar M., Doneanu C., Gaye M.M., Liquid Chromatography Methods for Analysis of mRNA Poly(A) Tail Length and Heterogeneity, Anal.Chem. 95 (2023) 14308–14316.https://doi.org/10.1021/acs.analchem.3c02552.
- De Vos J., Morreel K., Alvarez P., Vanluchene H., Vankeirsbilck R., Sandra P., Sandra K., Evaluation of Size-Exclusion Chromatography, Multi-Angle Light Scattering Detection and Mass Photometry for the Characterization of mRNA, J. Chromatogr. A 1719 (2024) 464756.https://doi.org/10.1016/j.chroma.2024.464756.
- Weber J. S., Carlino M.S., Khattak A., Meniawy T., Ansstas G., Taylor M.H., (...) & Zaks T., Individualised Neoantigen Therapy Mrna-4157 (V940) Plus Pembrolizumab Versus Pembrolizumab Monotherapy in Resected Melanoma (Keynote-942): A Randomised, Phase 2B Study.The Lancet, 403 (2024) 632–644.https://doi.org/10.1016/S0140-6736(23)02268-7.
- Goyon A., Beck A., Colas O., Sandra K., Guillarme D., Fekete S., Evaluation of Size Exclusion Chromatography Columns Packed With Sub-3 μm Particles for the Analysis of Biopharmaceutical Proteins, J. Chromatogr. A 1498 (2017) 80–89.https://doi.org/10.1016/j.chroma.2016.11.056.
- Harlan J.E., Picot D., Loll P.J., Garavito R.M., Calibration of Size-Exclusion Chromatography: Use of a Double Gaussian Distribution Function to Describe Pore Sizes, Anal.Biochem.224 (1995) 557-563.https://doi.org/10.1006/abio.1995.1087.
- Bristow P.A., Knox J.H., Standardization of Test Conditions for High Performance Liquid Chromatography Columns, Chromatographia 10 (1977) 279–289.https://doi.org/10.1007/BF02263001.
- Poppe H., Some Reflections on Speed and Efficiency of Modern Chromatographic Methods, J. Chromatogr.A 778 (1997) 3-21.https://doi.org/10.1016/S0021-9673(97)00376-2.
- Desmet G., Clicq D., Gzil P., Geometry-Independent Plate Height Representation Methods for the Direct Comparison of the Kinetic Performance of LC Supports With a Different Size or Morphology, Anal.Chem. 77 (2005) 4058-4070.https://doi.org/10.1021/ac050160z.
720008284ZH,2024年3月