使用Xevo™ MRT QTof对类花生酸进行高灵敏度、高通量LC-MS分析
摘要
前列腺素(PG)(例如前列腺素E2 (PGE2)、前列腺素D2 (PGD2)、前列腺素F2α (PGF2α)和血栓烷B2 (TXB2))具有多种生理和病理生理功能,表现为疼痛、发烧和过敏反应。本研究将Xevo MRT QTof与UltraPerformance LCTM联用,动态范围覆盖四个数量级。检测限示例如下:白三烯B4 (LTB4)的LOD和LOQ分别为<0.05 ng/mL(柱上进样量<0.00015 ng)和0.1 ng/mL(柱上进样量0.0003 ng);PGD2的LOD和LOQ分别为0.1 ng/mL(柱上进样量0.0003 ng)和0.5 ng/mL(柱上进样量0.0015 ng)。三次重复进样在低、中、高浓度水平下均表现出良好的重现性,峰面积重现性CV <3.5%。质量精度和分辨率表现优异(例如PGD2 (C20H32O5)理论m/z [M-H]等于351.2770 m/z),质量数误差为-0.05 ppm,分辨率为69000 FWHM。RMS通常小于1 ppm,确保可靠鉴定。使用waters_connect轻松完成数据处理,但也可使用Lipostar和Skyline等第三方软件来提高工作流程的灵活性。
优势
Xevo MRT QTof与超高效液相色谱联用,提供一种简单稳定的采集策略,能够快速高效地获得高质量、全面的数据。Xevo MRT MS具备多项关键功能,使其成为代谢组学和脂质组学研究人员的理想选择,尤其适用于需结合高灵敏度、质量精度、质量分辨率与高通量方法的场景。
- 占用空间小,提升实验室效率
- 分辨率高/扫描速度快
- 灵敏度高
- 线性动态范围宽
- 质量精度优
简介
研究表明,炎性疼痛的特征是通过环氧合酶(COX)途径从外周以及中枢神经系统组织(例如脑和脊髓)释放脂质介质,例如内源性大麻素、前列腺素(PG)、血栓烷、白三烯等1。 前列腺素(例如PGE2、PGD2、PGF2α和血栓烷B2 (TXB2))具有多种生理和病理生理功能,表现为疼痛、发烧和过敏反应2。 由于生物样品中富含异构体且其丰度较低,因此监测循环系统中COX类花生酸含量的动态变化较为复杂3。 常见类花生酸的结构如图1所示。
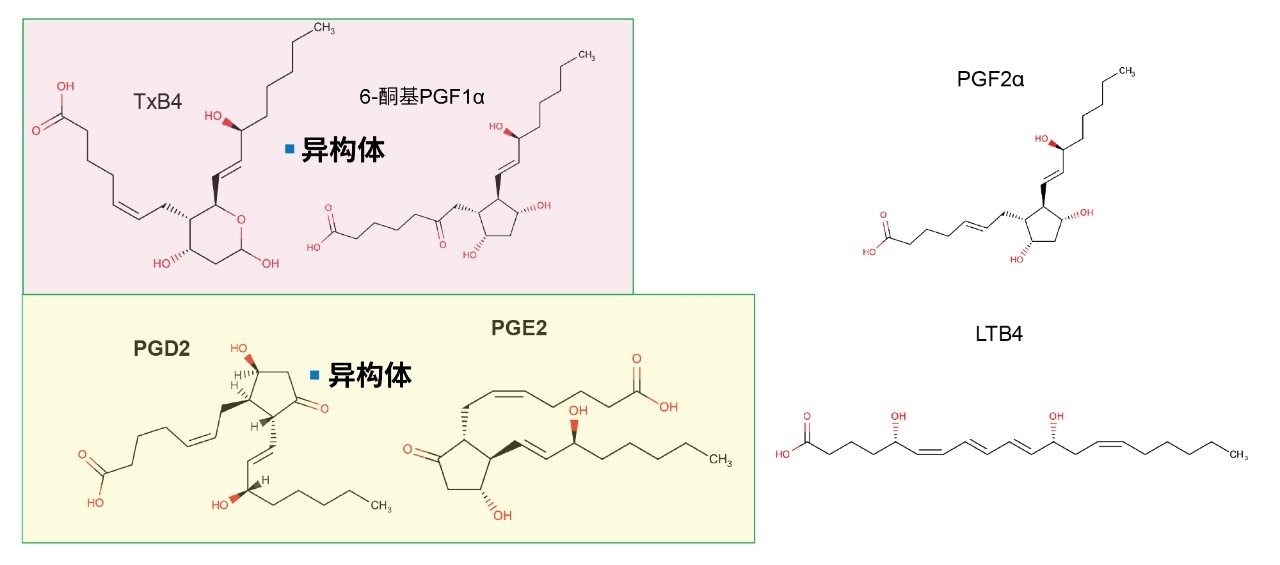
此前对这类脂质的分析主要采用放射计量法和酶联免疫分析法,但这些方法选择性不足,仅能靶向有限类别的化合物4。 还使用过气相色谱(GC-MS)法,但需要复杂的衍生化处理步骤。近年来,液相色谱(LC)与串联四极杆质谱(MS)联用技术逐渐成为主流。Schmidt等人(2005年)验证了一种LC-MS/MS方法,用于定量大鼠微透析样本中的PGE2和PGD2,LLOQ分别为25 pg/mL和50 pg/mL5。同样,使用近期研究中用于定量人血浆或痰液样本中LTB4的一种经验证方法测定了微胶质细胞中的PGE2和PGD2,定量限分别为0.2 ng/mL和0.078 ng/mL6。
本文展示了超高效液相色谱(UPLC™)与Xevo MRT质谱仪联用的主要优势。得益于质谱仪灵敏度与动态范围的提升,我们开发了一种更精简的数据采集与分析工作流程,不仅拥有串联四极杆质谱仪的灵敏度水平,还能兼具高质量精度与质量分辨率。为提高灵活性,也可以使用Lipostar 2或Skyline等第三方软件分析数据7。
实验
样品前处理
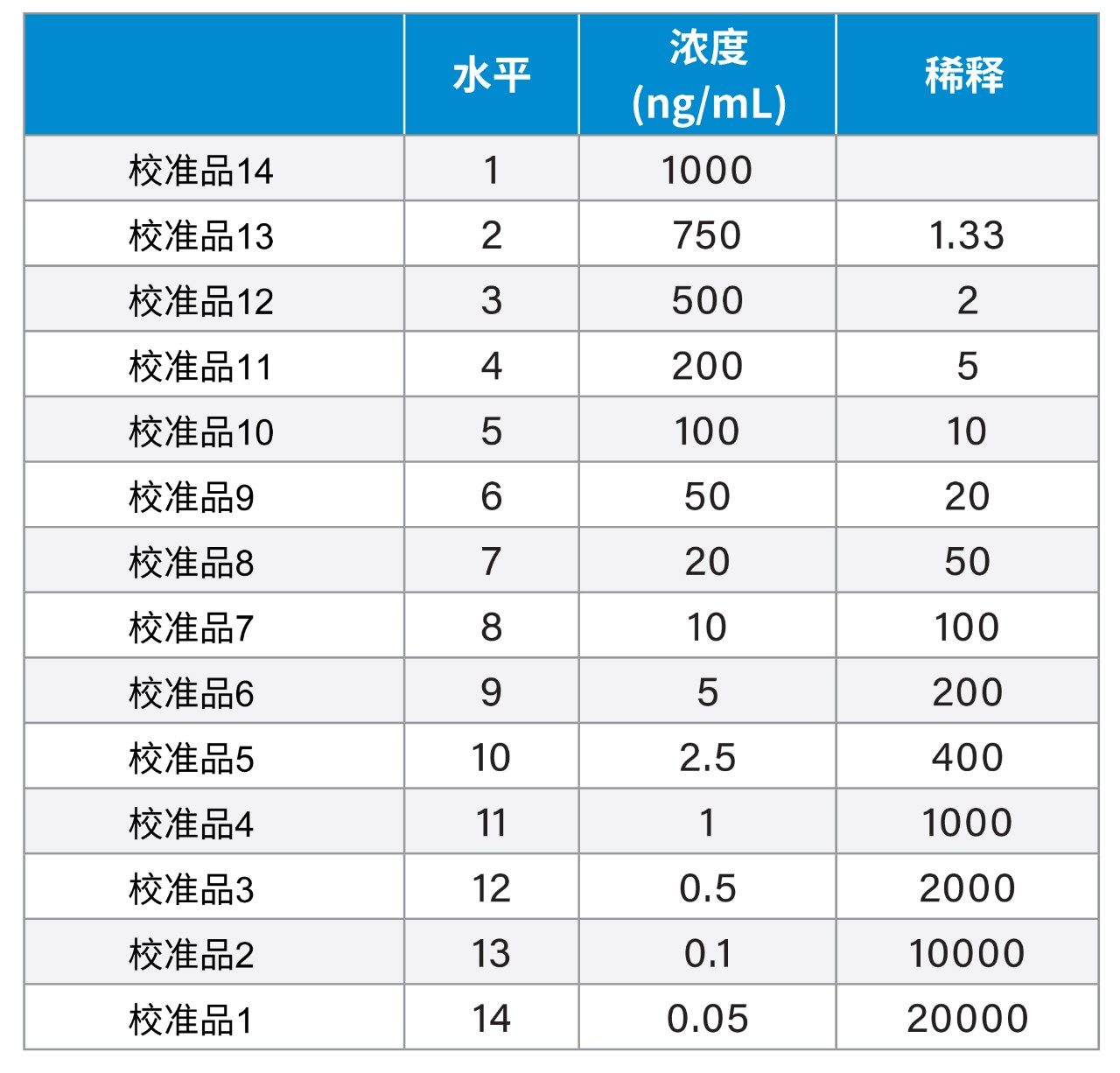
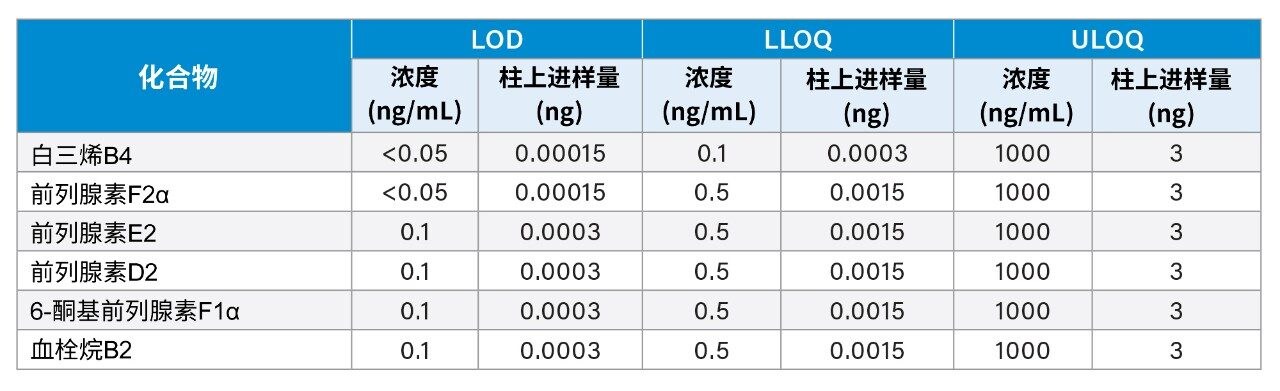
将含有LTB4、PGF2α、PGE2、PGD2、6-酮基-前列腺素F1α(6-酮基PGF1α)和TxB2的1000 ng/mL混标(Cayman Chemicals,美国密歇根州安娜堡)溶于甲醇,制备了浓度范围为1000 ng/mL~0.05 ng/mL的14点标准曲线,如下表所示。
样品制备表
液相色谱条件
|
液相色谱系统: |
ACQUITY Premier流通针式(FTN)超高效液相色谱系统 |
|
样品瓶: |
经认证的螺纹颈口最大回收玻璃样品瓶(P/N: 186000326c) |
|
色谱柱: |
CORTECS™ T3色谱柱, 120 Å, 1.6 µm, 2.1 mm x 50 mm,1根/包 - P/N:186008497 |
|
柱温: |
35 °C |
|
样品温度: |
8 °C |
|
进样体积: |
3 µL(ESI-) |
|
流速: |
0.6 mL/min |
|
流动相A: |
0.01%甲酸的水溶液 |
|
流动相B: |
0.01%甲酸的乙腈溶液 |
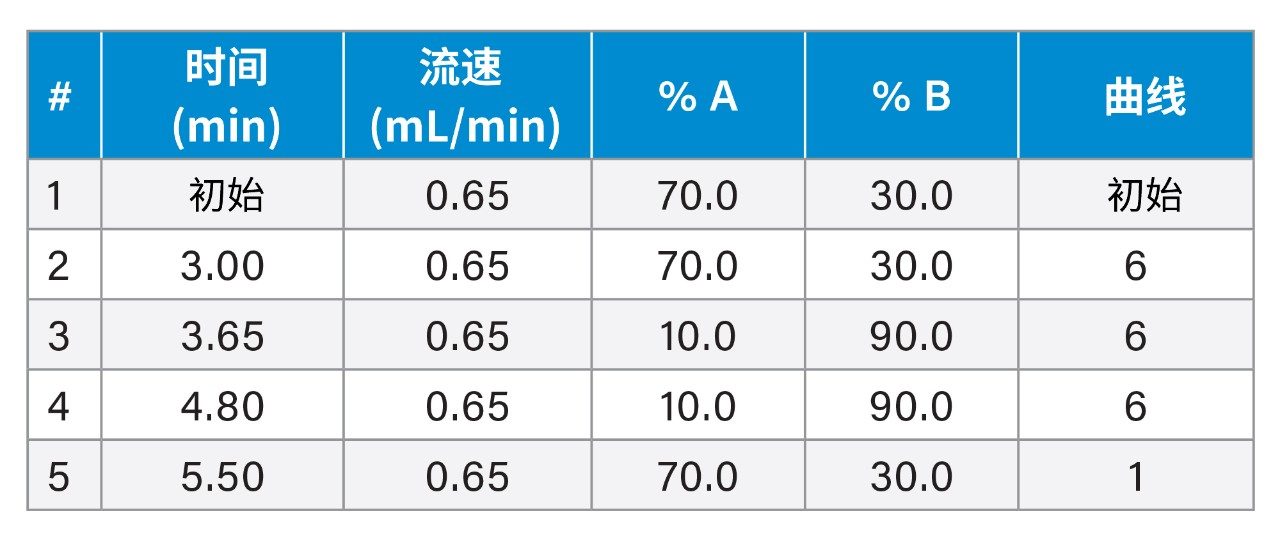
梯度表
MS离子源设置
|
变量: |
说明(负) |
|
毛细管电压: |
2.0 kV |
|
采样锥孔电压: |
30 |
|
电离源补偿: |
30 |
|
离子源温度: |
120 °C |
|
脱溶剂气温度: |
650 °C |
|
锥孔气流速: |
50 L/h |
|
脱溶剂气流速: |
600 L/h |
|
Lockspray流速: |
10 µL/min |
TOF设置
|
变量: |
说明 |
|
实验类型: |
ToF MSe |
|
扫描速率: |
10 Hz |
|
质量范围: |
50~1200 Da |
|
数据格式: |
连续 |
|
碰撞能量: |
30~40 eV |
|
Lockspray设置: |
单一模式 参比m/z 554.26202 1.5 min间隔,采样时间0.30 s,毛细管电压2.5 kV,锥孔电压30 V |
信息学软件
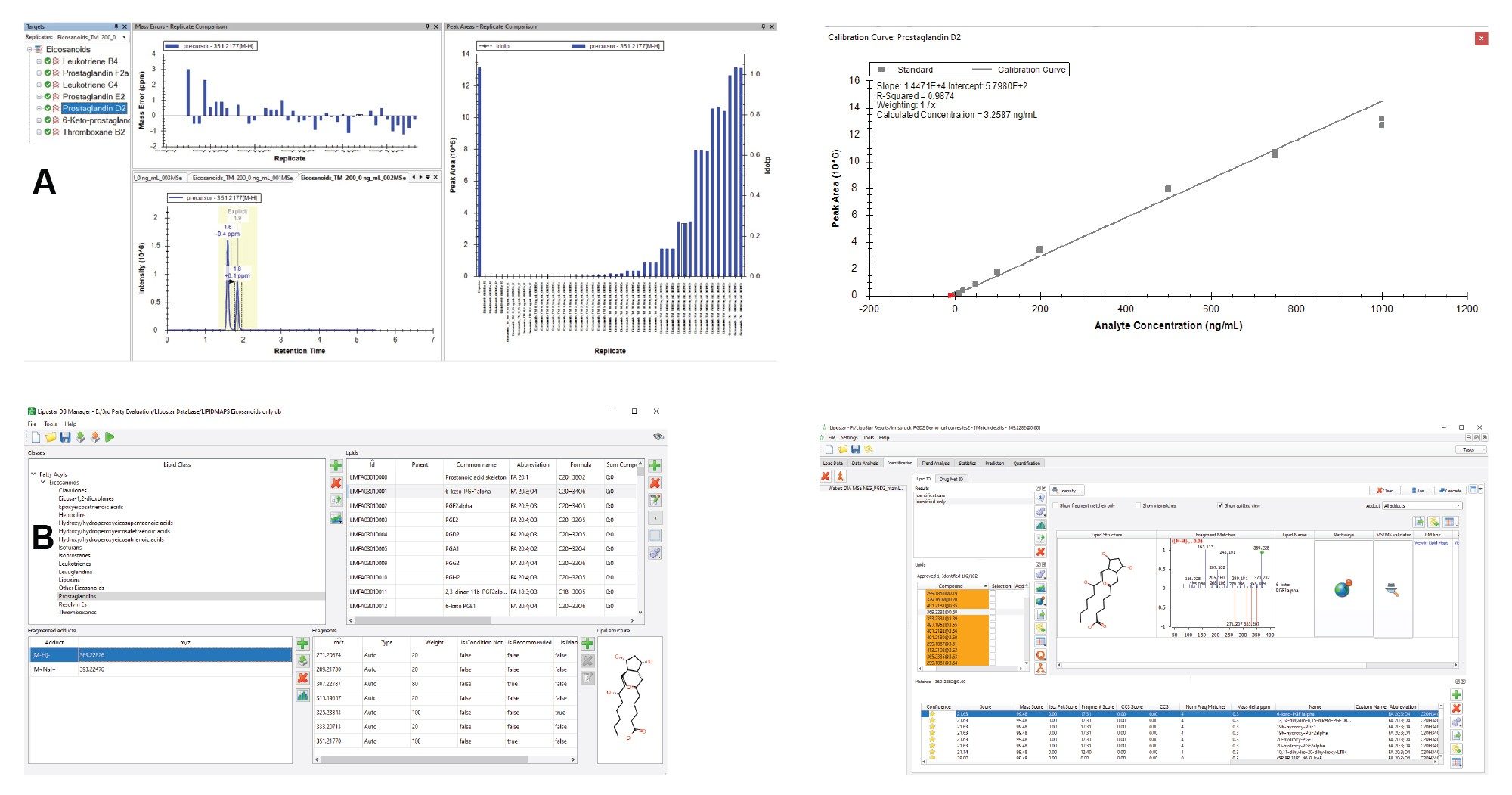
使用waters_connect™采集和处理数据,然后通过mzML文件传输至Lipostar 2软件(Mass Analytica,西班牙巴塞罗那)和Skyline(MacCoss Lab Software,华盛顿大学)。
结果与讨论
检测限和动态响应
在本研究中,检测限(LOD)定义为信噪比大于3的峰,而定量下限(LLOQ)定义为信噪比大于10、且分析物响应具有重现性和线性的峰8。 定量上限(ULOQ)定义为校准曲线上最高浓度的校准标准品。实验结果表明该方法具有优异的灵敏度(柱上进样量低于1 pg)和宽泛的线性动态范围。图2展示了白三烯B4 (LBT4)的典型数据示例。如果在空白样中未检出目标m/z信号,则可确认LOD。
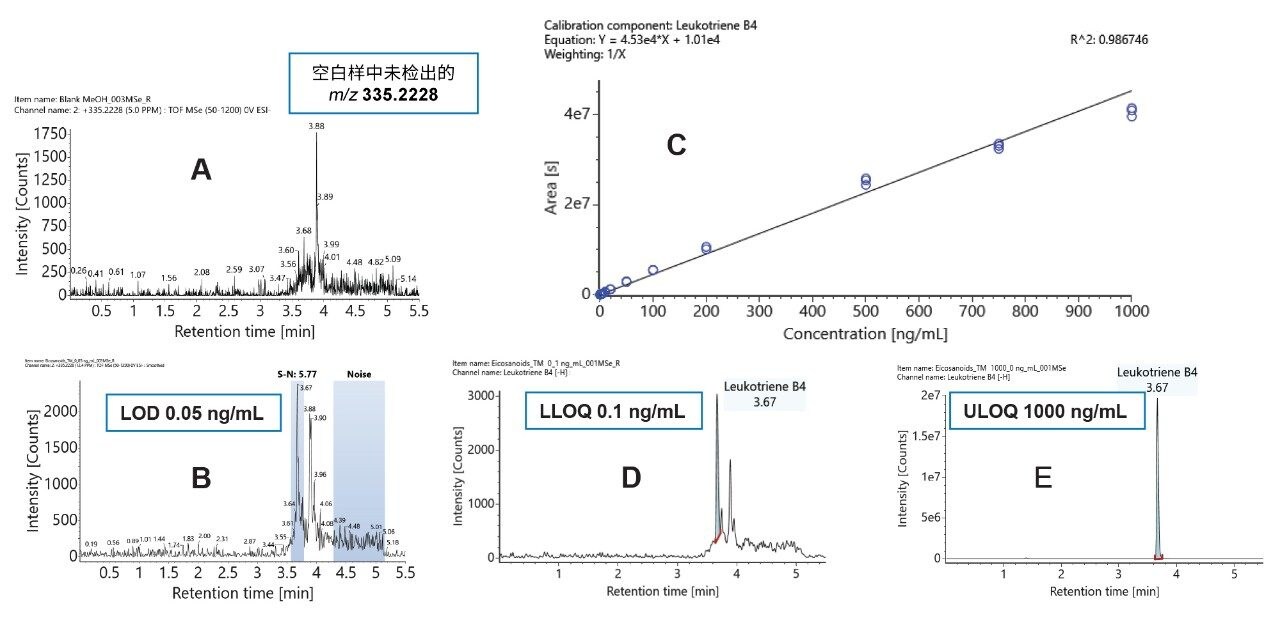
表1汇总了所有化合物的检测限,以及检测限的柱上进样量值,以便与使用不同进样体积的方法进行对比。
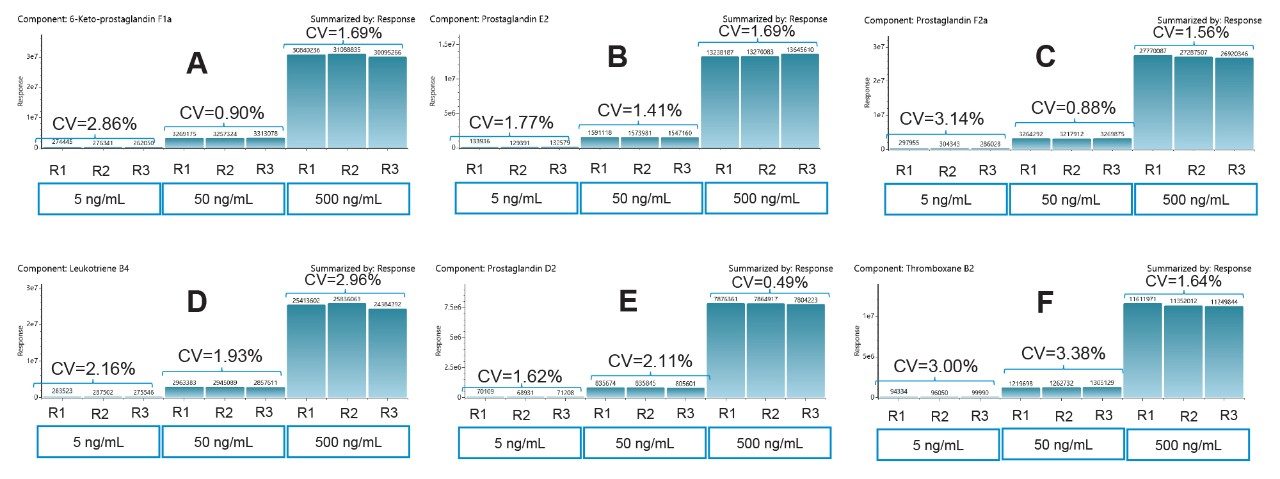
峰面积精密度
本研究所用的方法在低(5 ng/mL)、中(50 ng/mL)、高(500 ng/mL)浓度样品的三次进样(进样体积为3 µL)中表现出良好的精密度。CV均小于3.5%。图3显示了6-酮基PGF1α、PGE2、PGF2α、LTB4、PGD2和TXB2的响应和CV。
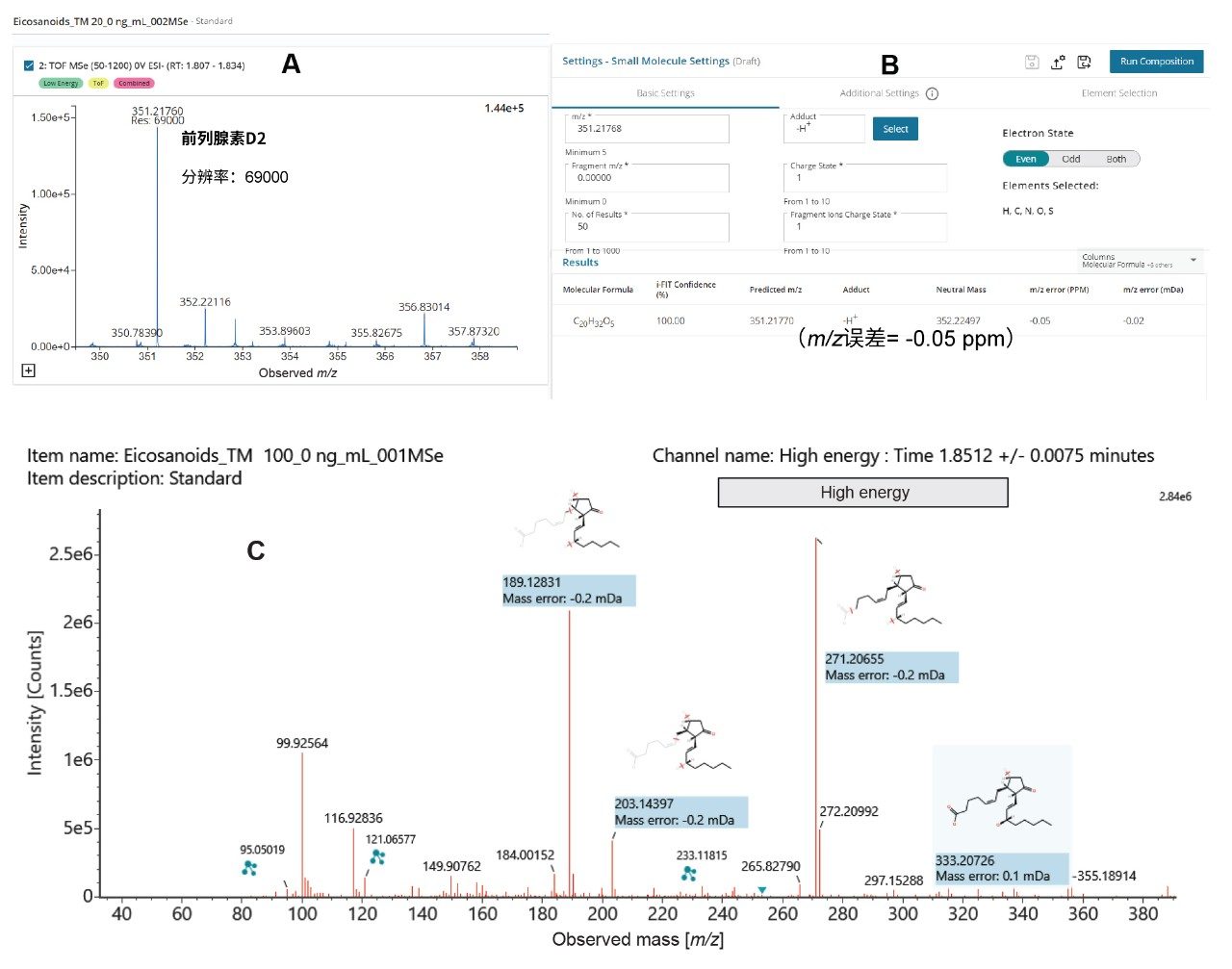
分辨率/质量精度
QTof仪器的质量精度高,与单同位素真实计算值的偏差在ppm以内,使我们可以根据质量数亏损确定经验公式。LC-MS Toolkit是waters_connect中的一款应用程序,用于评估分析中目标化合物的质量分辨率和质量精度。图4显示了PGD2 (C20H32O5)的分辨率(69000 FWHM),表明其m/z精度较高。由于质量误差较低,通过LC-MS Toolkit中的“元素组成”分析获得了高i-FIT置信度评分。PGD2的理论[M-H]加合物m/z值为351.2770。高能量谱图中PGD2碎片离子的质量误差极低,从而实现了准确的结构表征。
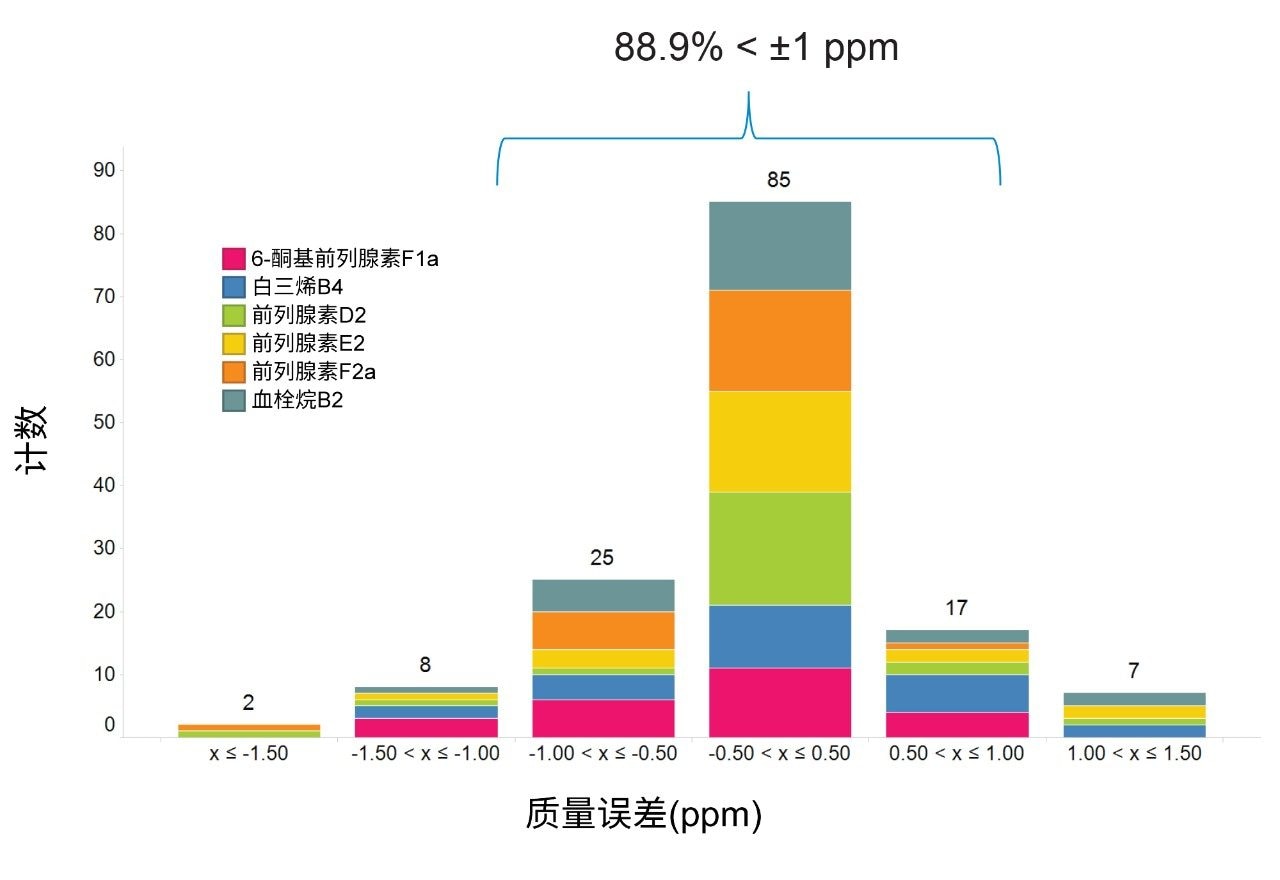
整个分析的质量数误差值通常小于1 ppm,所有化合物的RMS误差均小于1 ppm,如图5所示。这种高水平的质量精度有利于采用更窄的数据库检索窗口,进一步降低假阳性鉴定结果的可能性。
第三方软件
许多实验室均已配备信息学软件和数据处理流程,为提高灵活性,可将数据转换为广泛使用的mzML格式,以便在流行的第三方软件中进行数据处理。图6展示了如何使用Skyline处理mzML文件。用户可使用包含m/z值的简单模板将DDA和MSe数据以mzML文件形式上传至Skyline进行处理。校准曲线根据Skyline官网提供的简明教程生成。Lipostar 2通过DB Manager模块采用基于规则的碎裂方法辅助脂质鉴定。图6 (B)为Lipostar数据库示例,展示了6-酮基PGF1α的预期碎片离子,并说明了如何根据质量精度碎片和保留时间鉴定化合物。
结论
使用Xevo MRT QTof与超高效液相色谱联用系统建立的校准曲线表现出宽动态范围,线性覆盖四个数量级。这款高灵敏度仪器对于大多数此类化合物(例如白三烯B4 (LTB4)和前列腺素F2a)的LOD和LOQ可媲美串联四极杆仪器。具体而言,LTB4的LOD和LOQ分别为<0.05 ng/mL(柱上进样量<0.00015 ng)和0.1 ng/mL(柱上进样量0.0003 ng);前列腺素D2 (PGD2)的LOD和LOQ分别为0.1 ng/mL(柱上进样量0.0003 ng)和0.5 ng/mL(柱上进样量0.0015 ng)。峰面积重现性良好:使用3 µL进样量对低(5 ng/mL)、中(50 ng/mL)、高(500 ng/mL)浓度水平的样品进行三次重复进样,不同浓度下均表现出优异的重现性,CV <3.5%。
PGD2的质量分辨率为69000 FWHM,具有较高的m/z精密度。母离子和碎片离子在整个分析中均表现出优异的质量精度和较低的RMS误差(通常≤ ±1.0 ppm),与串联四极杆仪器相比,可以更可靠地鉴定类花生酸。
此外,高质量精度、高质量分辨率和高灵敏度的优势可与快速数据采集相结合,从而实现高通量方法,并能够在需要时扩展分析规模,以应对大规模群体研究。
数据兼容Skyline、Lipostar等第三方软件,使该工作流程高度灵活。通过简单教程即可轻松生成校准曲线、LOD/LOQ及质量数误差表。
参考资料
- Kidd BL, Urban LA.Mechanisms of inflammatory pain.Br.J. Anaesth.87(1), 3–11, 2001.
- Ricciotti E, FitzGerald GA.Prostaglandins and inflammation.Arterioscler.Thromb.Vasc.Biol.31(5), 986–1000, 2011.
- Tans, R., Bande, R., van Rooij, A., Molloy, B. J., Stienstra, R., Tack, C. J., Wevers, R. A., Wessels, H. J. C. T., Gloerich, J., & van Gool, A. J. (2020).Evaluation of cyclooxygenase oxylipins as potential biomarker for obesity-associated adipose tissue inflammation and type 2 diabetes using targeted multiple reaction monitoring mass spectrometry.Prostaglandins Leukotrienes and Essential Fatty Acids, 160.https://doi.org/10.1016/j.plefa.2020.102157.
- Billy J. Molloy, 脂氧化物的靶向UPLC-MS/MS分析, 沃特世应用纪要, 720007030ZH.2020年.
- Schmidt R, Coste O, Geisslinger G. LC–MS/MS-analysis of prostaglandin E2 and D2 in microdialysis samples of rats.J. Chromatogr.B Analyt.Technol.Biomed.Life Sci.826(1–2), 188–197 (2005).
- Gandhi, A. S., Budac, D., Khayrullina, T., Staal, R., & Chandrasena, G. (2017).Quantitative analysis of lipids: A higherthroughput LC-MS/MS-based method and its comparison to ELISA.Future Science OA, 3(1).https://doi.org/10.4155/fsoa-2016-0067.
- Laura Goracci, Sara Tortorella, Paolo Tiberi, Roberto Maria Pellegrino, Alessandra Di Veroli, Aurora Valeri, and Gabriele Cruciani (2017) LipoStar, a Comprehensive Platform-Neutral Cheminformatics Tool for Lipidomics, Analytical Chemistry 2017 89 (11), 6257–6264, DOI: 10.1021/acs.analchem.7b01259.
- A. Lister, Chapter 7 - Validation of HPLC Methods in Pharmaceutical Analysis, Separation Science and Technology, Vol.6, Academic Press, 2005, https://doi.org/10.1016/S0149-6395(05)80051-0.
720008647ZH,2024年12月