使用MauriceFlex™和BioAccord™ LC-MS系统表征原研药和生物类似药的电荷异构体

摘要
本应用纪要展示了一项对一种治疗性单克隆抗体和一种研究型生物类似药的电荷异构体进行的深入比较分析。利用MuriceFlex系统进行基于全柱成像毛细管等电聚焦(Imaged capillary isoelectric focusing, icIEF)的电荷分离和分馏,单次运行足以收集组分供进一步分析。随后无需额外的样品前处理操作,直接使用BioAccord系统进行LC-MS分析,揭示该原研药和生物类似药之间的关键差异,例如特定位点的轻链碎裂以及是否存在C端赖氨酸残基。使用MuriceFlex与BioAccord系统为生物治疗药物的表征提供了一种简单直接又节省时间的工作流程。
简介
由于缺少合适的分析工具,分离和表征单克隆抗体(mAb)中的电荷异构体一直是一项重大挑战。而icIEF虽然是电荷分离的黄金标准,但仅适用于光学检测。此外,由于试剂不兼容,它也不能轻松地用于质谱分析(MS)1,2。MuriceFlex系统能够进行电荷分离并收集LC-MS兼容的电荷异构体组分,解决了这一限制,使分析人员无需额外的样品前处理操作即可实现详细的质量数表征。
本研究使用这种方法分析了原研药Benlysta™(贝利尤单抗)和一种研究型生物类似药。在商业化药物开发中,监管机构(例如美国食品药品监督管理局(FDA))规定,原研药与生物类似药之间需提供结构和功能可比性证据3。 尽管本研究未使用治疗性生物类似药(并且获得的结果可能不具有临床相关性),但在整个研究过程中所选用的技术都证明,这是一个高效的工作流程。BioAccord系统是一款操作方便的紧凑型台式飞行时间(TOF)仪器,可提供高质量LC-MS数据,并可通过合规的waters_connect™信息学平台上的INTACT Mass应用程序自动处理数据。
该工作流程在BioAccord系统上直接分析通过MuriceFlex系统收集的电荷异构体组分,成功鉴定了原研药与生物类似药之间导致电荷分布差异的蛋白形态。此方法凸显了MuriceFlex和BioAccord系统用于详细比较分析的有效性。
材料与方法
icIEF方法
使用含有Pharmalytes (4%) 8–10.5和3–10 (4:1)、20% SimpleSol、5 mM精氨酸,以及Maurice pI markers 7.05和9.50的两性电解质溶液,制备最终浓度为0.1 mg/mL的原研药和生物类似药样品。样品随Maurice cIEF筒一起上样至MauriceFlex仪器,在1500 V下聚焦1分钟,然后在3000 V下聚焦12分钟。
分馏方法
使用含有Pharmalytes (4%) 8–10.5和3–10 (4:1)、30 mM精氨酸、30% SimpleSol,Maurice pI markers 7.05和9.50,以及Simple Western™ pI markers 7.00和9.70的两性电解质溶液,制备最终浓度为2 mg/mL的样品。样品随MauriceFlex cIEF分馏筒一起上样至MauriceFlex仪器,在250 V下聚焦10 min,在500 V下聚焦10 min,在1000 V下聚焦10 min,在1500 V下聚焦25 min。检出的峰在1000 V下迁移了25 min,然后在1000 V下进行45秒的馏分收集操作。使用Compass for iCE软件分析所有数据。
完整质量数分析
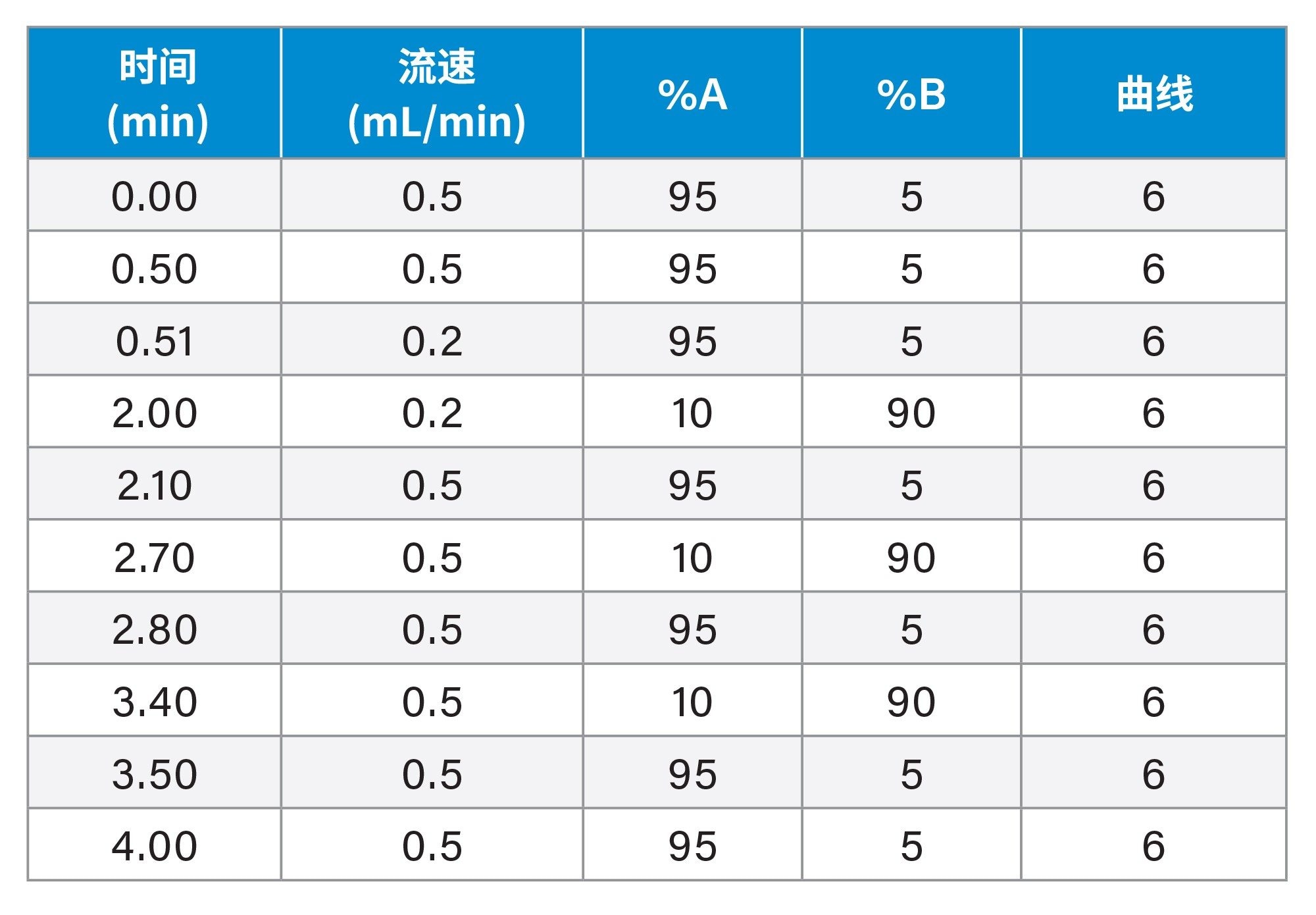
在BioAccord系统上分析从MuriceFlex系统收集的选定馏分,无需进行任何缓冲液置换或额外的样品前处理操作。BioAccord系统配备了Waters MassPREP微脱盐色谱柱(2.1 × 5 mm)。流动相A为含0.1%甲酸的水溶液,流动相B为含0.1%甲酸的乙腈溶液。使用以下梯度进行分离操作(总方法运行时间为4 min)。柱温设置为80 °C。RDa™检测器的设置如下:缺省毛细管电压为1.5 kV,缺省脱溶剂气温度为550 °C,锥孔电压为70 V。通过waters_connect信息学平台内的INTACT Mass应用程序采集各组分的质谱图、进行自动去卷积,并进行质量数匹配(误差为40 ppm)。
液相色谱条件
|
液相色谱系统: |
ACQUITY™ H-Class Bio二元系统,配备50 μL样品扩充定量环 |
|
检测: |
ACQUITY UPLC™ TUV (280 nm) |
|
色谱柱: |
Waters™ MassPREP™微脱盐色谱柱(2.1 × 5 mm)(P/N:186004032) |
|
柱温: |
80 °C |
|
样品温度: |
6 °C |
|
流速: |
变量,见梯度表 |
|
流动相A: |
0.1%甲酸水溶液 |
|
流动相B: |
0.1%甲酸的乙腈溶液 |
|
进样体积: |
30 µL |
梯度表
MS条件:RDa
|
质谱系统: |
ACQUITY RDa™ |
|
电离模式: |
ESI +ve,全扫描 |
|
采集范围: |
400~7000 m/z(高质量) |
|
毛细管电压: |
1.5 kV |
|
锥孔电压: |
70 V |
|
脱溶剂气温度: |
550 °C |
|
智能数据捕获: |
关 |
结果与讨论
电荷异质性分析和分馏
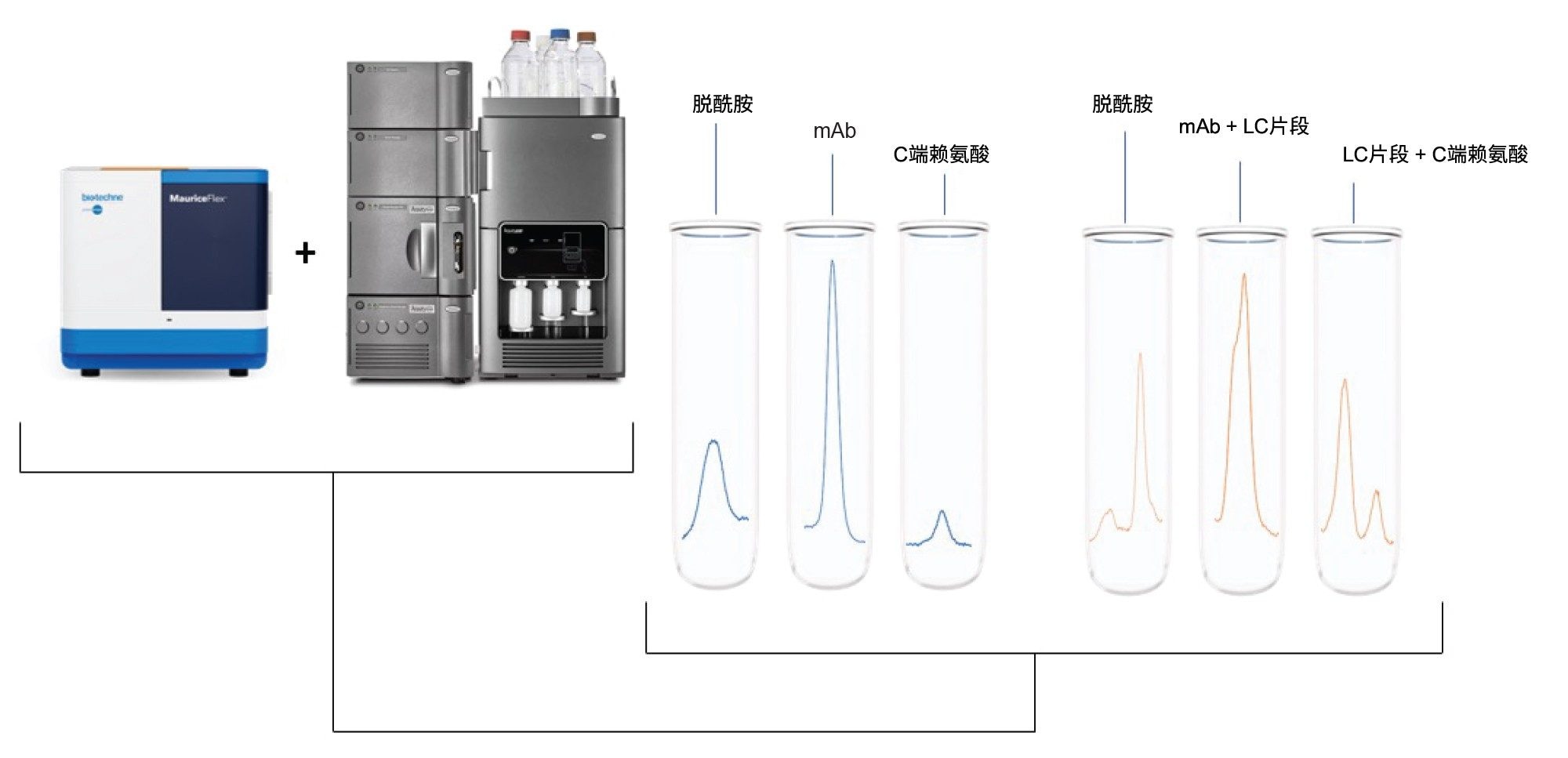
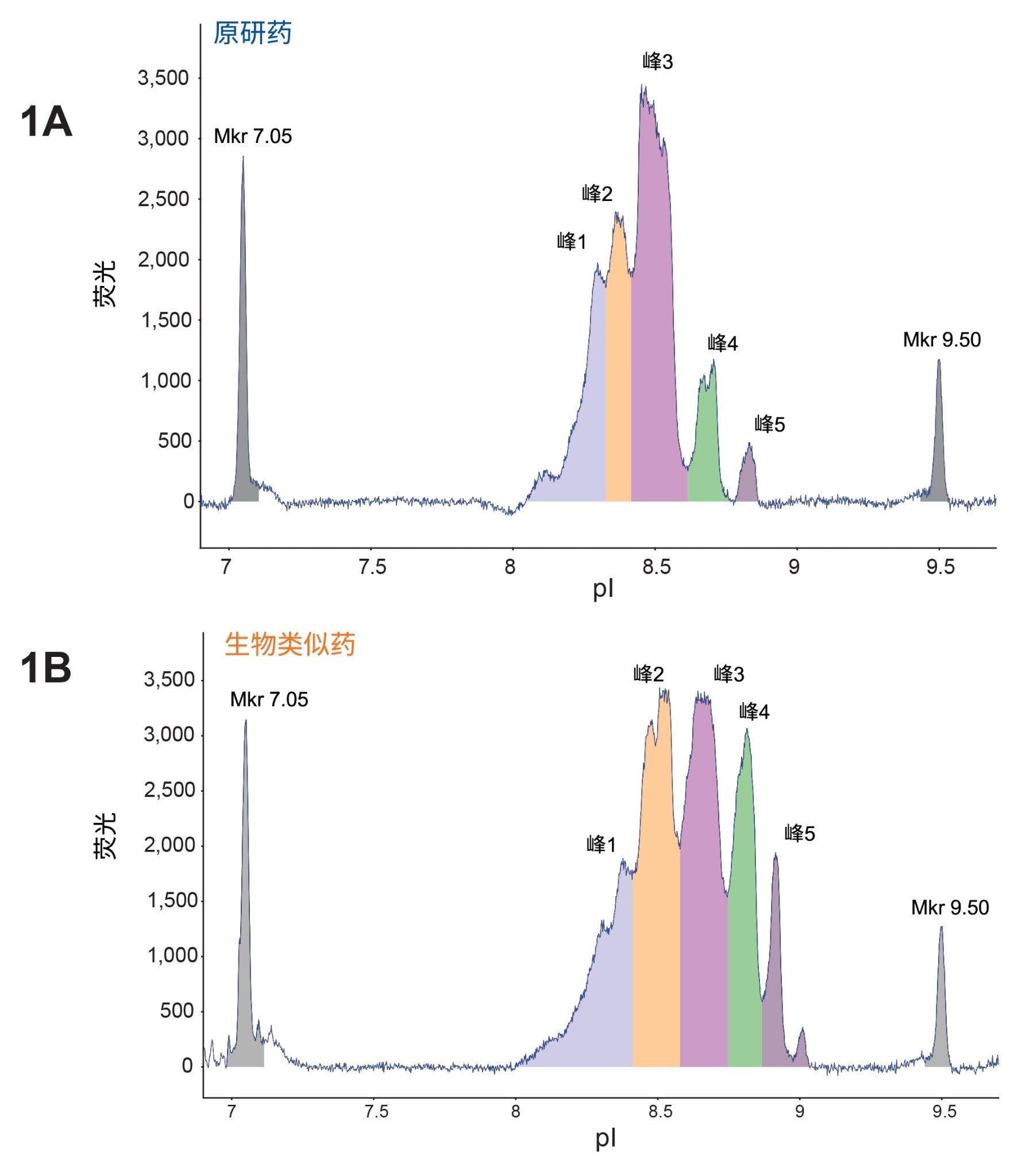
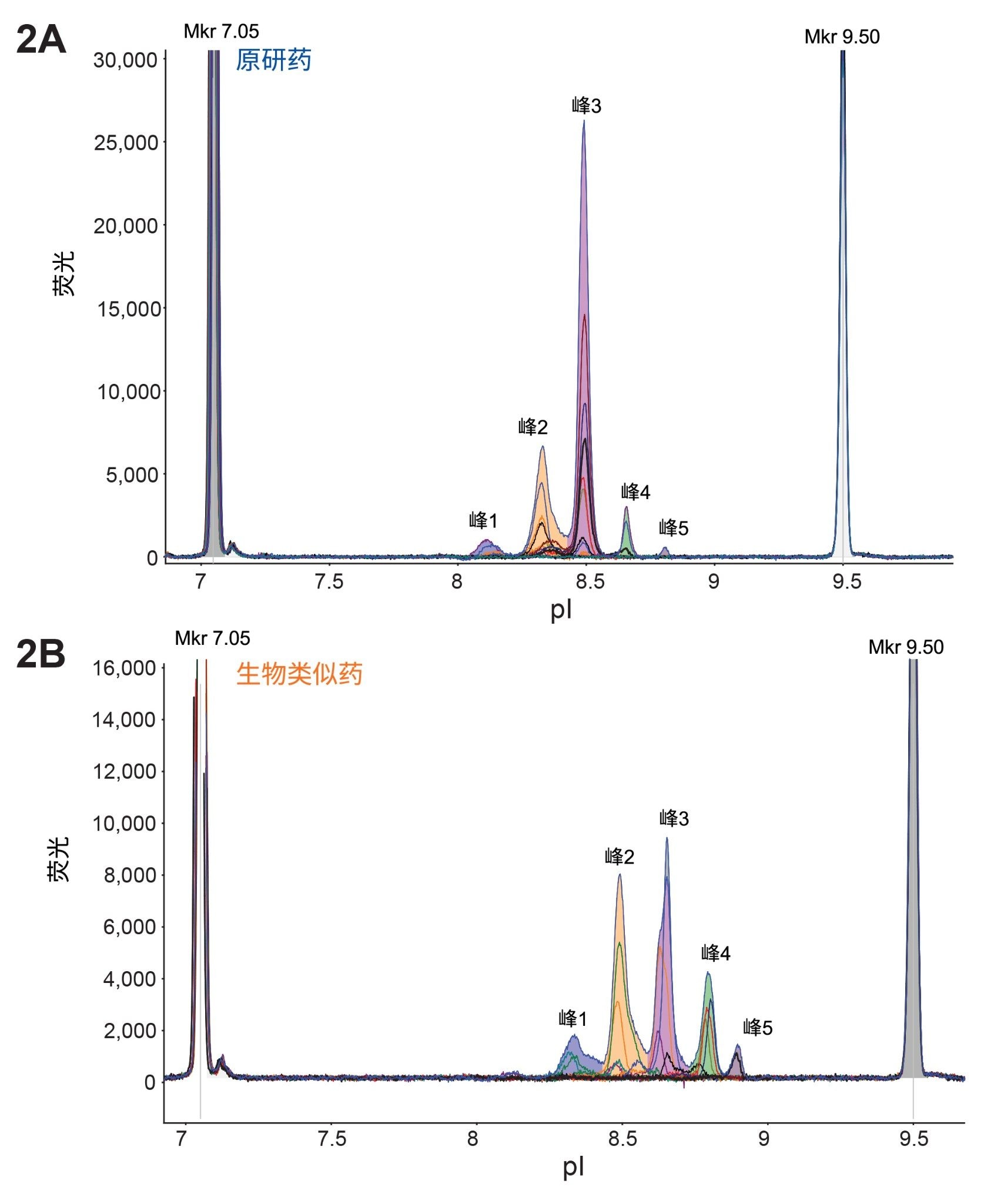
首先使用MauriceFlex cIEF分馏筒分析Benlysta(贝利尤单抗)原研药和生物类似药样品的电荷异质性,结果如图1A和1B所示,在每个样品中检测到五个主峰。有趣的是,在生物类似药样品的峰中观察到pI值总体漂移,表明存在异电荷物质,并强调需要进一步分析。随后在MauriceFlex系统上对两种样品的峰进行迁移和分馏,以供下游分析(图2A和2B)。完成馏分收集后,使用cIEF筒进行峰确证,并计算峰面积百分比(表2)。然后在BioAccord系统上选定这些峰进行LC-MS分析。

完整质量数分析
使用LC-MS分析原研药和生物类似药的酸性馏分、主要馏分和碱性馏分并进行比较。去卷积处理后揭示了一些关键修饰,尤其是生物类似药峰中的修饰,从而为研究icIEF分析过程中观察到的表观pI值漂移提供了关键信息。图3A显示了原研药和生物类似药的酸性峰的质谱图,两种样品的数据都表明存在脱酰胺的可能性。两种样品的主峰(MP)分析也表现出一些差异。MP代表完整单克隆抗体或其主要形式对应的最高丰度物质。原研药的MP中,有游离的LC和LC二聚体伴随着主峰出现(数据未显示),而生物类似药的MP中出现多种物质,除LC和LC二聚体外,还包括重链的未加工C端赖氨酸(1K),以及谷氨酸与亮氨酸(E3/L4)之间的轻链断裂,如图3B所示。两种样品的碱性馏分均显示存在多种物质,也凸显了两种mAb之间的更多差异,如图3C所示。原研药的碱性馏分主要为C端赖氨酸,而生物类似药还显示出丝氨酸与谷氨酸(S2/E3)之间的轻链断裂。两种样品之间的主要差异汇总于表3中。分析的所有馏分还突出了原研药与生物类似药之间的N-糖型差异。
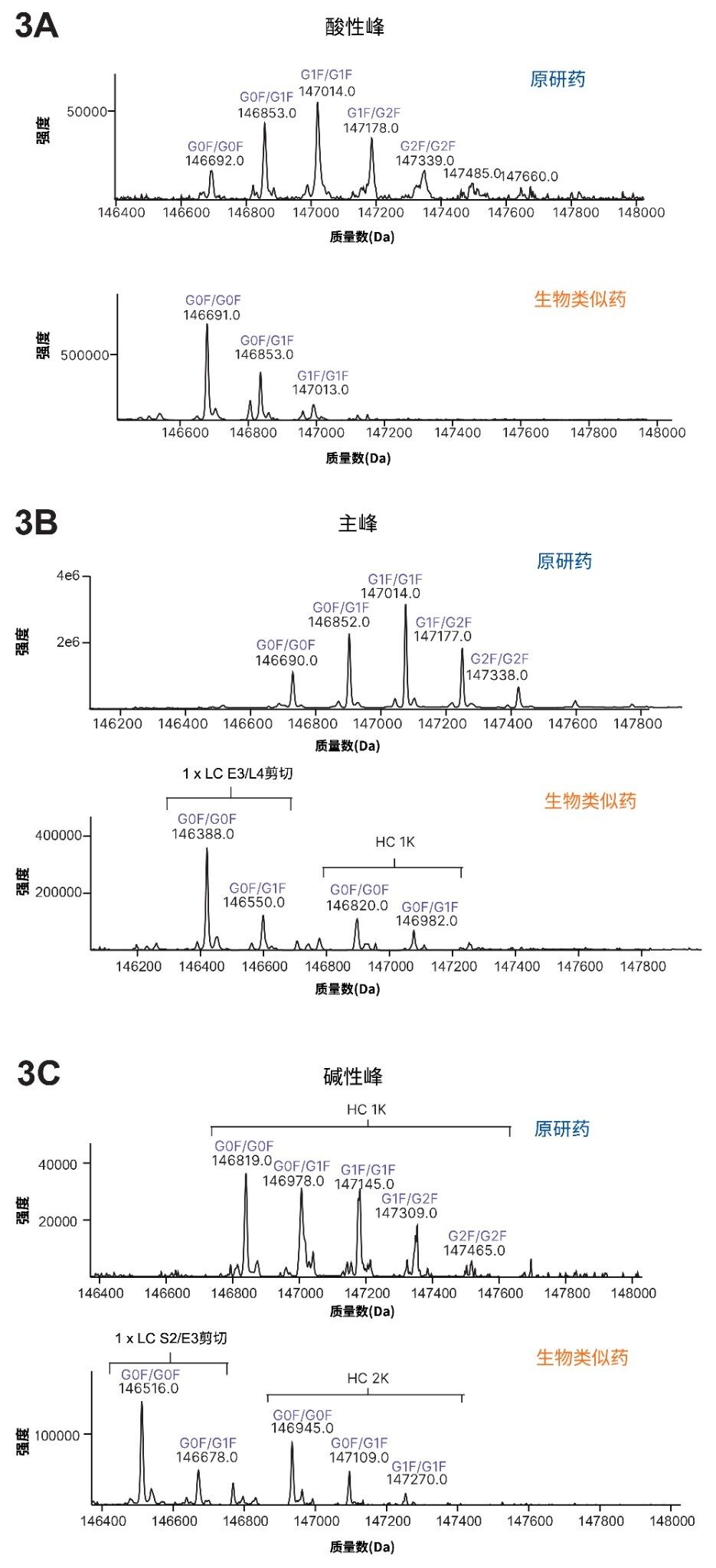
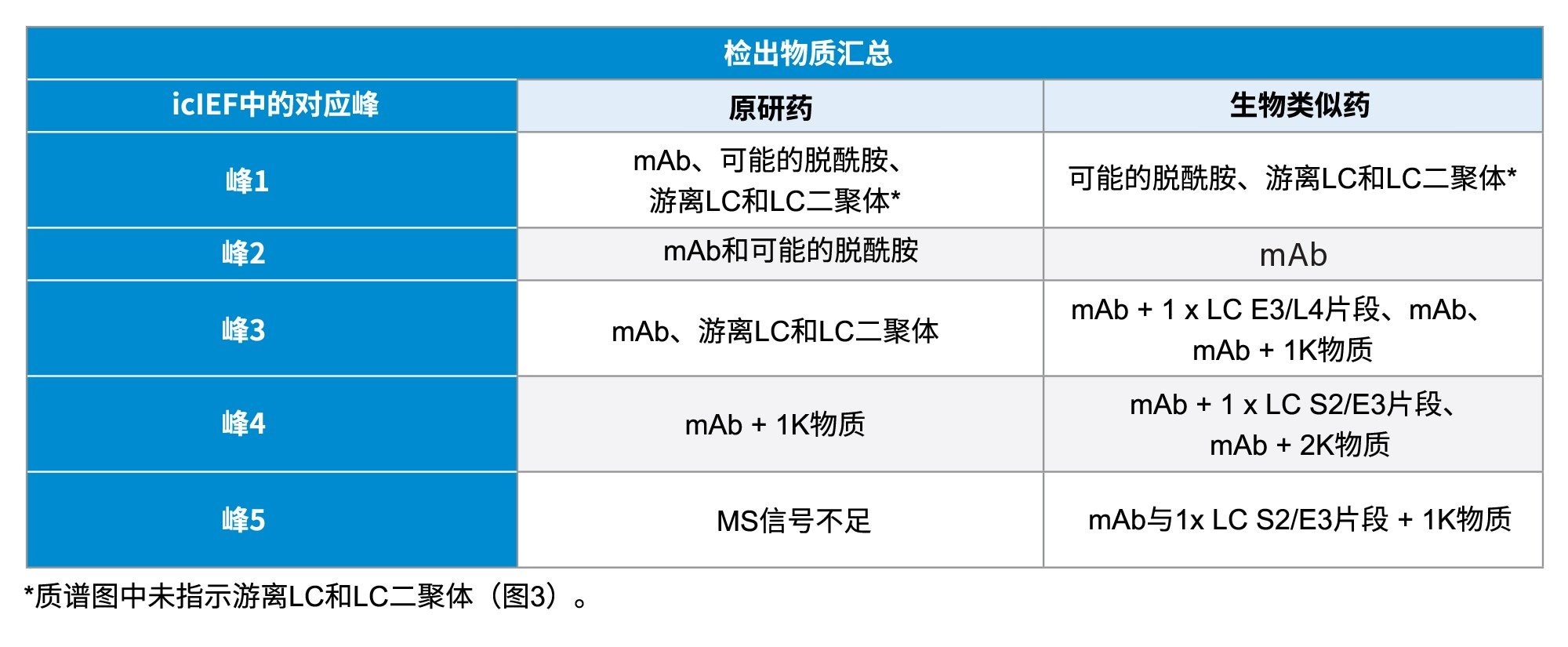
*质谱图中未指示游离LC和LC二聚体(图3)。
结论
本应用纪要展示了一种分离、收集和表征mAb电荷异构体的高效且成功的工作流程。利用MuriceFlex系统进行基于icIEF的分离和分馏,使用台式BioAccord系统进行LC-MS分析,对一种原研药和一种研究型生物类似药进行了分析,揭示出两者之间的关键差异。
分别分析酸性峰、主峰和碱性峰,揭示各种带电物质的来源,包括C-端赖氨酸、氨基酸剪切和可能的脱酰胺。鉴于电荷异构体可能对药物安全性产生重大影响,在开发的各个阶段(例如工艺表征、制剂开发和QC批次放行)进行持续监测至关重要4。
通过实施高效工作流程(如本文所述),可以显著增强确保原料药和药品的质量和一致性的能力。该方法不仅有助于满足法规要求,还通过提供电荷异构体的鉴定信息为开发更安全、更有效的治疗药物提供支持。
参考资料
- Zhang X, Chen T, Li V, Bo T, Du M, Huang T. Cutting-edge mass spectrometry strategy based on imaged capillary isoelectric focusing (icIEF) technology for characterizing charge heterogeneity of monoclonal antibody. Anal Biochem. 2023;660:114961.doi:10.1016/j.ab.2022.114961.
- Dai J, Lamp J, Xia Q, Zhang Y. Anal Chem. 2018;90(3):2246–2254.doi:10.1021/acs.analchem.7b04.
- Review and Approval, Biosimilars.U.S. Food and Drug Administration.
- Chung S, Tian J, Tan Z, et al. Industrial bioprocessing perspectives on managing therapeutic protein charge variant profiles. Biotechnol Bioeng. 2018;115(7):1646–1665.doi:10.1002/bit.26587.
720008541ZH, 2024年10月