使用BioAccord™ LC-MS系统和Vion IMS QTof质谱仪结合waters_connect™ CONFIRM Sequence应用程序对双链体siRNA进行表征和测序
摘要
过去十年来,小分子干扰RNA (siRNA)因其在基因治疗和癌症治疗中的创新应用,成为药物开发领域备受关注的一种物质。随着这一关注度的提高,对支持其开发、生产和批次放行的分析解决方案的需求也稳步增加。色谱分离联用质谱检测的分析方法经过不断发展已相当先进,其应用领域不再局限于产品和工艺开发,已发展为可部署到生产和质量控制实验室的可验证分析方法。
本文介绍了在在线色谱分离过程中,柱温在控制核酸双链体的相互作用方面所发挥的重要作用。通过调整柱温,可以保留双链体结构,或使双链体变性,得到单独的正义链和反义链。虽然这种补充方法通常用于协助分子鉴定和属性监测,但本文内容表明,它也有利于双链体序列确认。我们同时使用BioAccord LC-MS系统和Vion IMS QTof LC-MS系统对这些双链体结构进行了研究。
优势
- 非质谱专家也可以使用合规的自动化LC-MS工作流程开发质量控制方法
- 通过单次分析即可评估双链体纯度、完成双链体鉴定和双链体测序
- 使用合规的waters_connect信息学平台内的CONFIRM Sequence应用程序,对siRNA双链体快速、自动化解析复杂的串联质谱(MS/MS)和数据非依赖型MSE(未选择特定母离子)质谱
简介
寡核苷酸药物已成为治疗各种遗传性和非遗传性疾病的重要工具1~3。沉默RNA (siRNA)由能够特异性结合细胞mRNA并抑制其功能的双链体RNA分子组成,已成功运用于疾病治疗中4。
由于这类治疗药物需要精准靶向目标mRNA序列并避免次级位点效应,因此建立有效的质量控制程序对于确保产品质量、安全性和有效性至关重要。在siRNA进入临床试验阶段或用作药品之前,需要采用各种方法进行表征。应用的液相色谱技术包括离子对反相(IPRP)、离子交换(IEX)、体积排阻(SEC)和亲水作用(HILIC)5,6,7。 将这些技术与质谱联用已非常普遍,因为质谱分析可以洞察到共洗脱杂质,并且有助于分配这些产物变体8。配备碰撞诱导解离(CID)的高分辨率质谱被广泛用于确认这些分子的序列和定位修饰位点9。
本文介绍了一种常规LC-MS方法:采用离子反相色谱(IP-RP)结合数据非依赖型(未选择母离子)MSE碎裂,对siRNA双链体进行检测和测序。该方法利用易于使用的BioAccord LC-HRMS系统,在waters_connect信息学软件平台下进行自动化数据处理,支持合规的数据采集、处理和报告。
BioAccord LC-MS系统(图1)于2019年推出,是一款体积小巧、性能稳定的平台,适用于常规生物制药分析,非质谱专家也能轻松上手。本研究使用的这套完全集成的BioAccord LC-MS系统包含一套ACQUITY™ UPLC™ Premier I-Class PLUS系统、一台可变波长紫外(TUV)光学检测器,以及一台ESI-TOF ACQUITY RDa™质谱检测器。完成测序后,使用Vion IMS-QTof MS仪器,将测序结果与靶向LC-MSMS分析结果相比较。
与常规(未修饰)寡核苷酸不同,siRNA分子的复杂性和稳定性使其难以通过LC-MS进行表征。通过控制和调整柱温,可诱导双链体构象异构体解离为正义链和反义链,从而提高MS响应并降低谱图复杂性。这种做法仅通过一次进样就能提高序列覆盖率、改善链鉴定和纯度评估。或者也可以通过降低柱温保持色谱柱上的双链体构象,从而在完整双链体水平进行鉴定并测定纯度。本研究评估了在单次分析中结合使用这两种方法对深入了解双链体siRNA分子的质量属性的能力。

实验
样品描述
实验使用了双链体退火的两条RNA单链,序列如下:
实验表

杂交:移取等摩尔量的单链,加热至75 °C,并在该温度下保持5 min。然后以1 °C/min的冷却速率将溶液冷却至37 °C。
分别以25 °C和60 °C的柱温测量单链和双链体。利用固定母离子m/z和固定碰撞能量的靶向MS/MS采集(Vion IMS QTof),以及MSE数据非依赖型碎裂采集(BioAccord系统),采集(串联)质谱图。
液相色谱条件
|
液相色谱系统: |
Waters™ I-Class系统(与BioAccord系统中的Vion IMS QTof或RDa检测器联用) |
|
检测: |
UV 260 nm |
|
样品瓶: |
LCGC认证透明玻璃12 × 32 mm螺纹颈口全回收样品瓶,带瓶盖和预开口PTFE/硅胶隔垫(P/N:186000385C) |
|
色谱柱: |
ACQUITY UPLC BEH, 130 Å, C18寡核苷酸分析专用柱, 1.7 µm, 2.1 x 50 mm(P/N:186009484) |
|
柱温: |
25.0 °C和60.0 °C |
|
样品温度: |
6.0 °C |
|
进样体积: |
1 µL |
|
流速: |
0.300 mL/min |
|
流动相A: |
7 mM TEA,80 mM HFIP的水溶液 |
|
流动相B: |
3.5 mM TEA,40 mM HFIP的50%甲醇溶液 |
梯度表
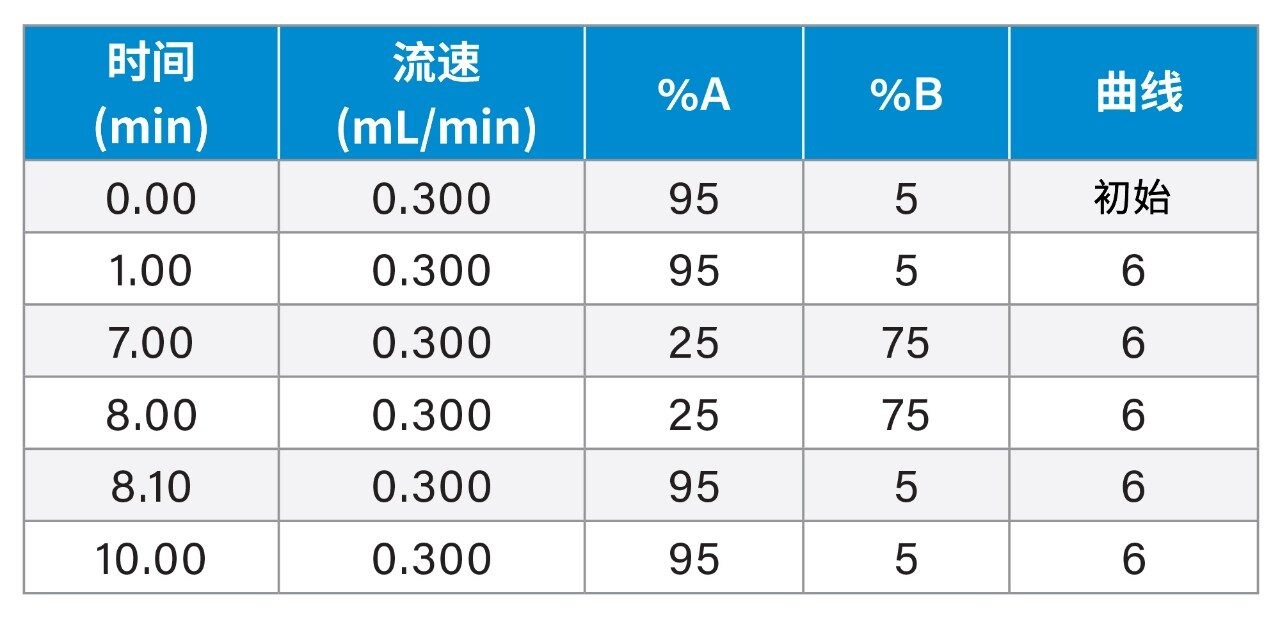
质谱条件
|
质谱系统: |
Waters BioAccord LC-MS |
|
模式: |
包括碎片的全扫描 |
|
质量范围: |
低(50~2000 m/z) |
|
极性: |
负 |
|
扫描速率: |
10 Hz |
|
锥孔电压: |
40 V |
|
碎裂锥孔电压: |
90~110 V |
|
质谱系统: |
Waters Vion IMS QTof |
|
模式: |
MS/MS |
|
质量范围: |
50~2000 m/z |
|
母离子: |
675.4 m/z,正义链 664.9 m/z,反义链 |
|
扫描时间: |
0.5 s |
|
碰撞能量 |
正义链和反义链均为20 V |
结果与讨论
为了更简单、更高效地鉴定双链体并评估其纯度、鉴定杂质并确认正义链和反义链的正确序列,我们尝试使用LC-MS/MS方法,通过单次分析对变性和非变性的双链体siRNA寡核苷酸进行测序。在全扫描MSE数据非依赖型碎裂模式下,使用waters_connect信息学平台采集和处理BioAccord LC-MS数据。在waters_connect INTACT Mass应用程序中,使用TIC峰下的合并ESI-MS谱图进行自动质谱去卷积,获得完整寡核苷酸质量数测量值,以用于链鉴定、纯度评估和修饰定位。然后使用waters_connect CONFIRM Sequence应用程序进行寡核苷酸序列分析。最后,在靶向MS/MS模式下采集Vion IMS QTof数据,与BioAccord数据非依赖型采集(DIA)序列结果进行比较。
实验采用LC柱温为25 °C(双链体未变性)和60 °C(变性)的条件,使用BioAccord系统或Vion IMS QTof质谱检测器,通过单次分析运行评估双链寡核苷酸的各种参数,以展示这两种仪器的性能。
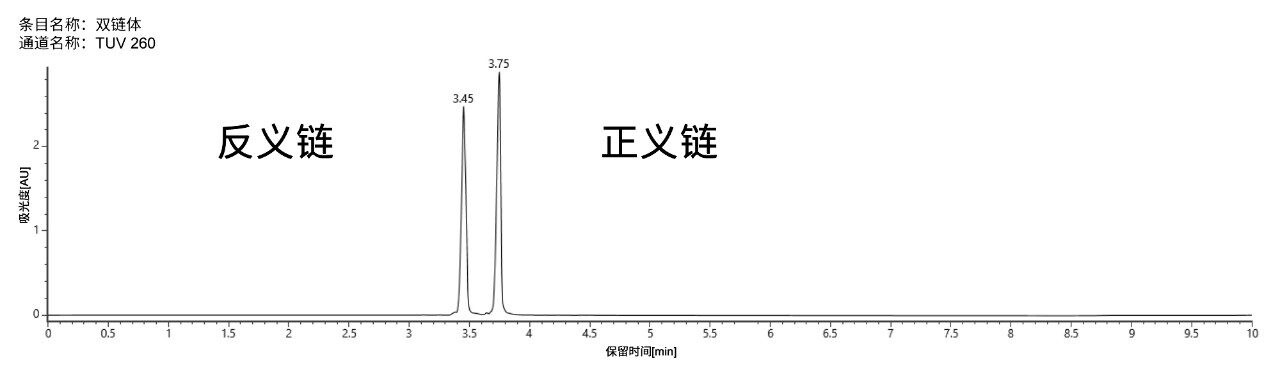
柱温为25 ℃时,双链体siRNA分子能够保留在色谱柱上(见图2)。正义链和反义链各样品与双链体分子彼此之间均实现了色谱分离。虽然在LC分析过程中使用的适中温度可以使双链体分子保持完整结构,但在电喷雾电离时,由于使用了离子对试剂和低pH值,会导致该复合物变性。因此,双链体质谱图可以单链形式进行审查和表征(图3A)。
使用waters_connect INTACT Mass应用程序自动化处理数据,该应用程序支持TIC和UV峰检测、BayesSpray电荷去卷积、修饰,以及产品相关杂质分配和纯度计算等处理功能,可帮助科学家分析较短和较长的寡核苷酸,而不需要大量的用户干预(图3B和3C)。
INTACT Mass应用程序的结果(图3C)有助于分配5.13分钟处双链体色谱峰下共洗脱的去卷积物质。由于存在共洗脱,所有物质的LC-UV纯度报告为90%。INTACT Mass应用程序还通过将所有分配的共洗脱物质视为LC和MS相对响应(LCxMS)的产物,计算了MS纯度。对于主要和次要强度物质的所有去卷积鉴定结果,观察到较低的ppm (<10 ppm)质量误差。
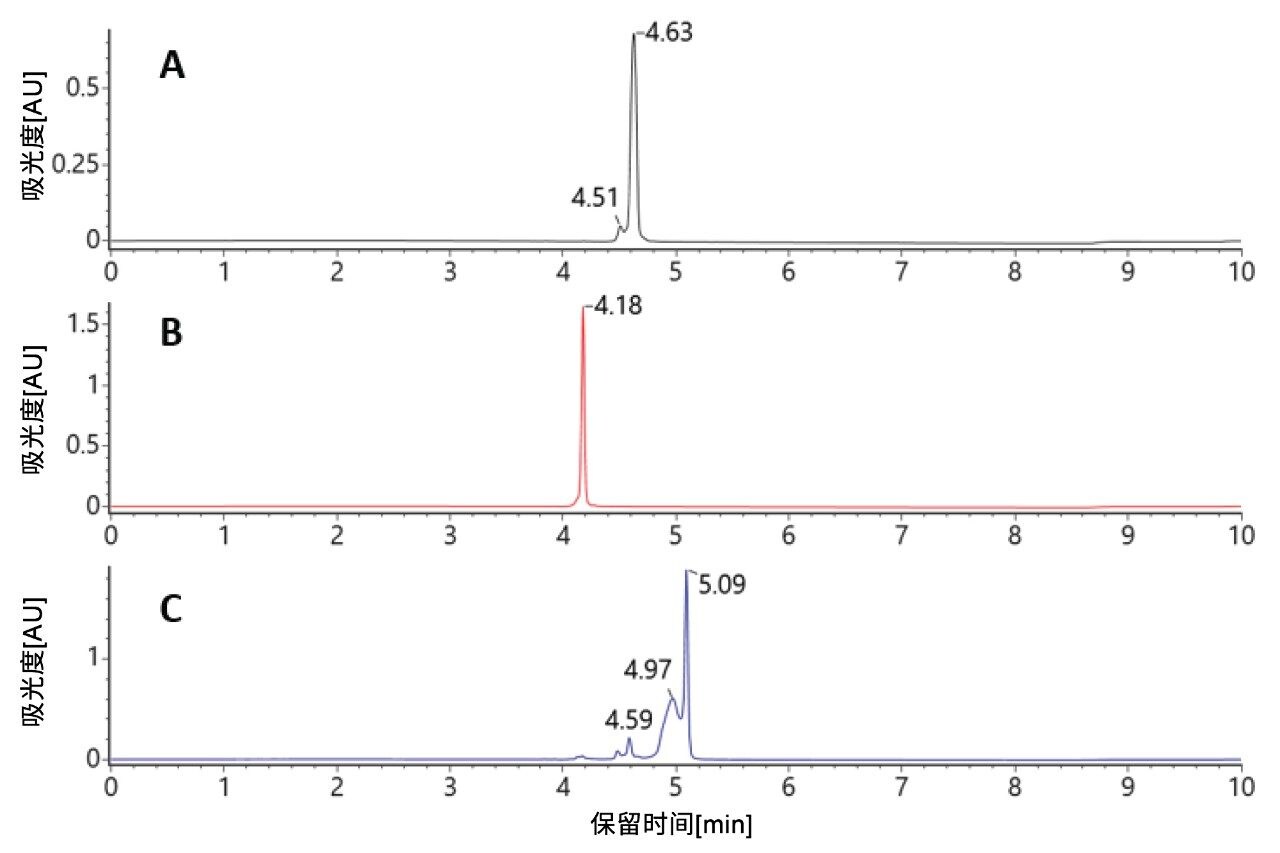
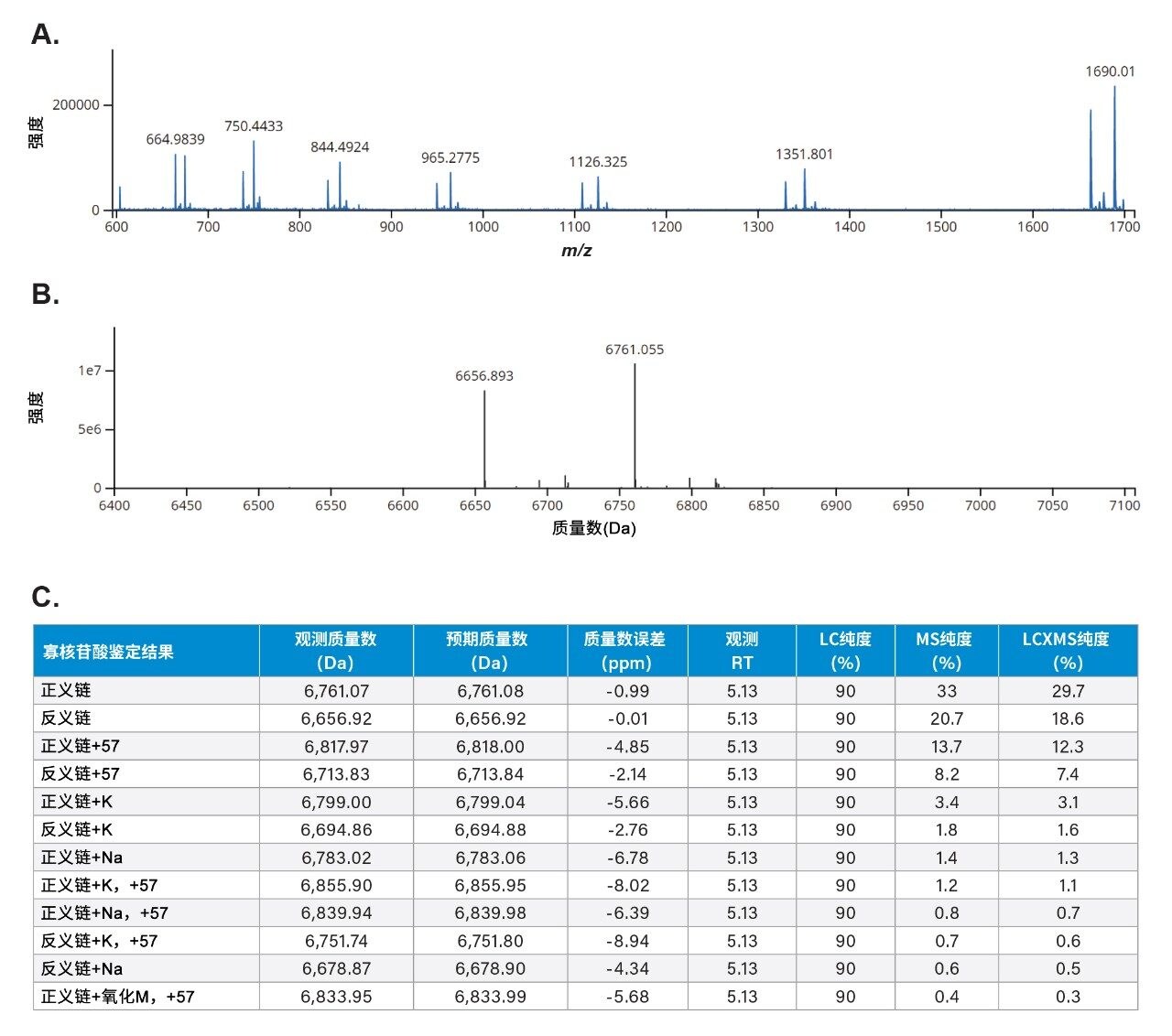
图3A.电喷雾电离过程中解离的双链体siRNA的负离子ESI原始谱图,显示了在LC保留时间5.09分钟处的双链体峰下洗脱的各正义链和反义链电荷态包络。
B. 在电喷雾电离过程中解离为正义链和反义链的双链体siRNA的waters_connect Intact Mass BayesSpray去卷积谱图。
C. waters_connect INTACT Mass应用程序对解离的双链体siRNA峰的数据处理结果。
在60 °C的高柱温下,两种纯寡核苷酸标准品再次实现了色谱基线分离。双链体分子在色谱柱上变性,产生两条单链并实现了色谱分离,其保留时间与各自的单标相匹配(图4)。
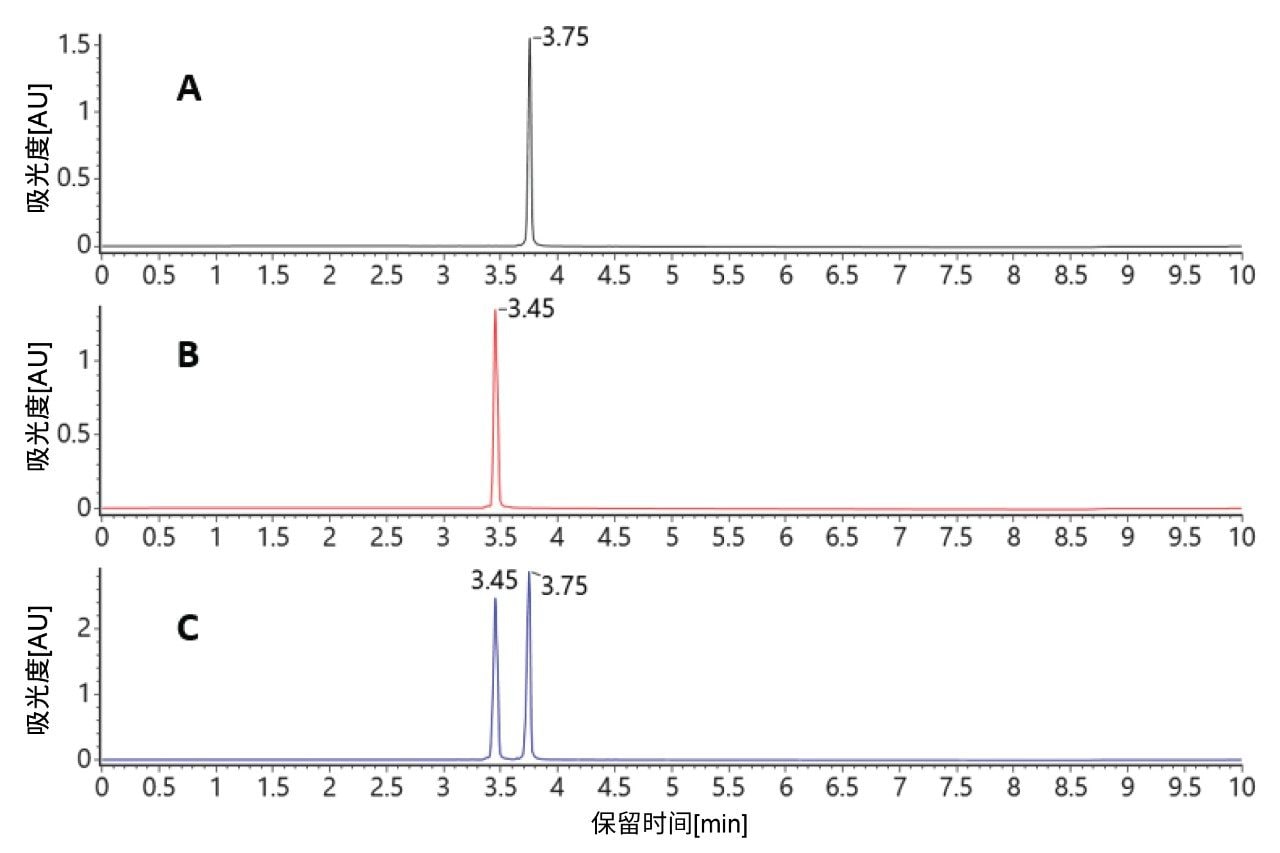
这两种结合质谱检测的方法(变性和非变性分离)都可用于确认双链体siRNA的鉴定结果,只需控制柱温和应用自动化数据处理方法即可。
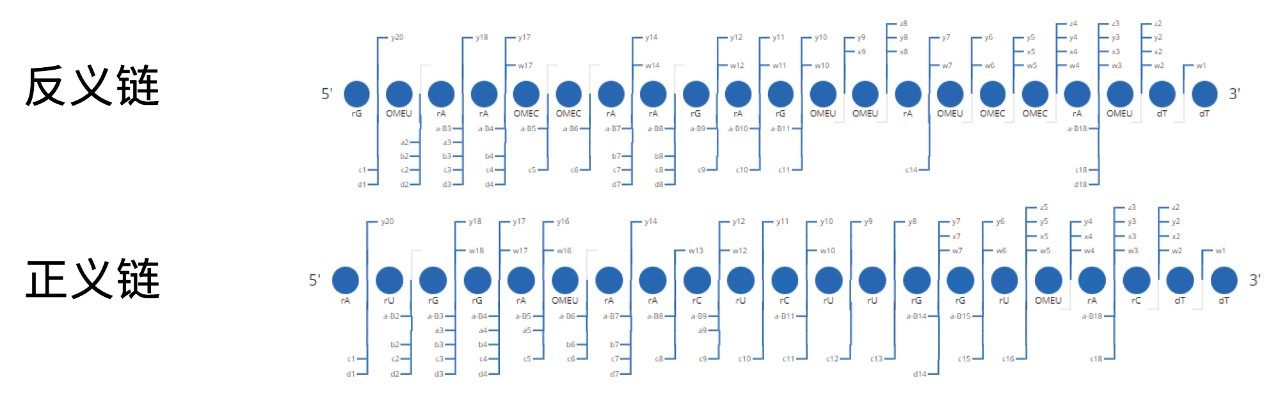
利用INTACT Mass处理数据可快速确认鉴定结果,但需要其他信息学工具来辅助进行全序列确认。CONFIRM Sequence应用程序可利用相同的BioAccord MSE包括碎片离子的全扫描采集模式数据,自动确认碎片离子数据与指定序列相对应。
本研究使用两种siRNA单链(非变性,共洗脱)的数据确认双链体序列,在高能量碎裂周期中使用100~120 V的电压梯度,两种链的序列覆盖率均达到90%。对于剩余约10%的未分配序列覆盖区域,我们开展了进一步研究,确定来自反义链碎片离子的嵌合谱图干扰为分配失败的原因(图5)。
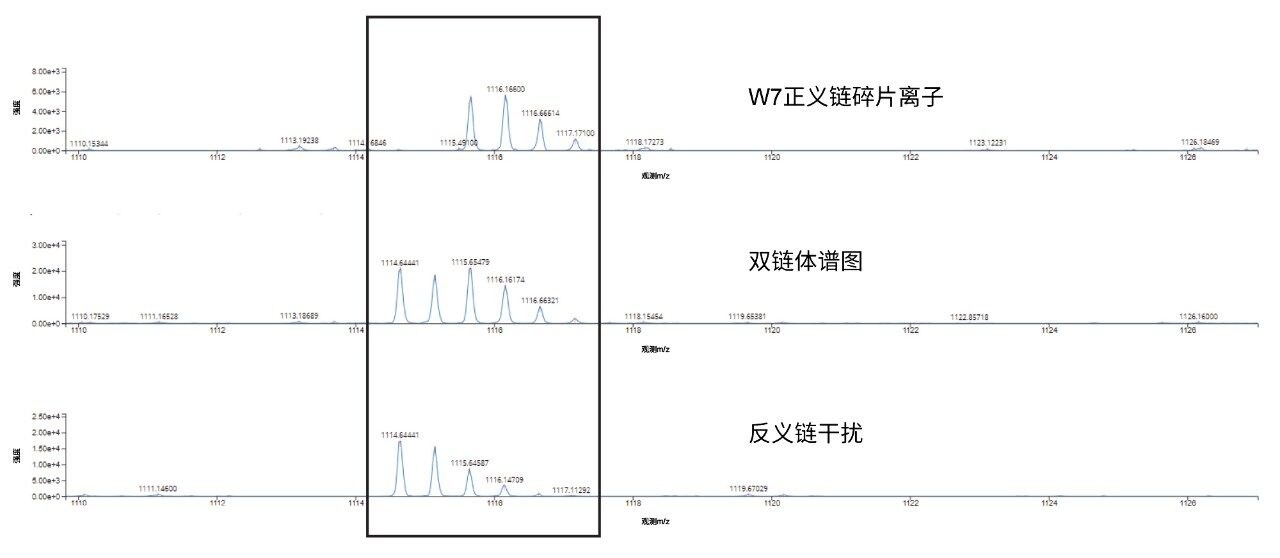
1114.7 m/z反义链w7碎片离子的MSE碎片离子数据因存在同位素模式重叠(图5),使w7正义链碎片离子的自动分配变复杂,如两种共洗脱链的合并碎片离子嵌合双链体谱图所示。
本研究还使用Vion IMS-QTof MS系统对siRNA双链体单链进行了靶向MS/MS方法分析(从每条单链中单独选择特定电荷态进行碎裂),该方法对两条链的序列覆盖率均达到100%。这种靶向MS/MS方法可以使每条单链得到更清晰的碎片离子谱图,消除多种干扰,当双链体在较低柱温下无法实现色谱分离时,仍能获得全序列覆盖。
研究和实验在60 °C高柱温下进行,产生了变性色谱条件,导致双链体色谱分离为单链组分。由于单链在色谱柱上得到良好分离,获得了优异的峰形,因此其MSE高能量碎片离子模式彼此独立,避免了当双链体保留在色谱柱上时观察到的同位素物质重叠。
消除干扰后,现在使用BioAccord系统MSE数据非依赖型方法,在60 °C柱温条件下,分配的序列覆盖率可以达到100%(图7)。因此,这种结合了变性/非变性的方法能够通过单次采集完成双链体纯度、双链体鉴定和单链鉴定的研究。序列信息可在QTof系统上通过串联MS/MS获得,也可以在BioAccord LC-MS系统上使用非靶标数据非依赖型方法获得。
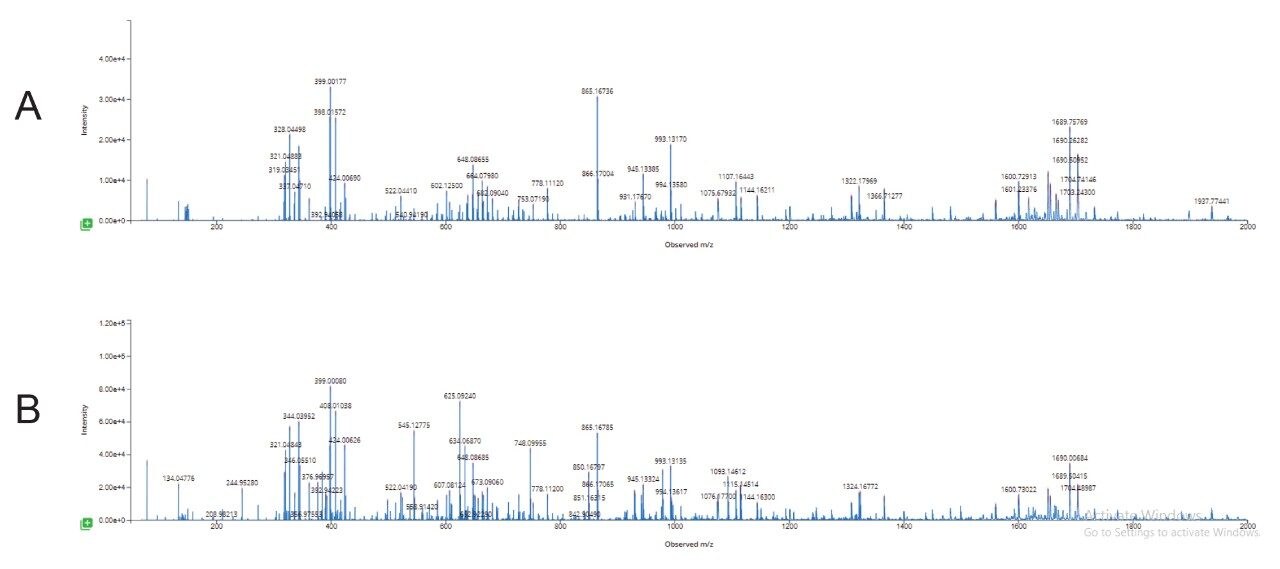
我们还额外开展了实验,以确保变性双链体siRNA和纯单链标准品的高能量MSE谱图相当(图8)。
结论
我们开发出变性(较高柱温)和非变性(较低柱温)LC-MS方法,可以使用TOF或QTof MS检测评估双链体siRNA分子的单链纯度、单链鉴定结果、双链体纯度和双链体鉴定结果。
这些方法利用了waters_connect INTACT Mass和CONFIRM Sequence应用程序,为基于完整质量数和碎片离子的测序分析提供自动化数据分析。
在BioAccord LC-MS系统上使用数据非依赖型MS碎裂方法对两条siRNA链进行完整测序,该方法得益于在变性LC分离中获得的色谱分离。
在Vion IMS-QTof系统上利用靶向MS/MS对两条siRNA链进行完整测序,该方法对在非变性LC分离中发生的寡核苷酸链共洗脱现象具有更强的耐受性。
本应用纪要探讨的工作流程显示了非变性和变性双链体siRNA分析之间的互补性,以及能够在开发环境中使用更复杂的QTof仪器,而BioAccord LC-MS系统更适合用于开发过程中的常规分析,或在受监管的生产和质控组织中用于可验证分析方法。
参考资料
- Al Shaer D, Al Musaimi O, Albericio F, de la Torre BG.2021 FDA TIDES (Peptides and Oligonucleotides) Harvest.Pharmaceuticals (Basel).2022;15(2):222.doi:10.3390/ph15020222
- Al Musaimi O, Al Shaer D, Albericio F, de la Torre BG.2022 FDA TIDES (Peptides and Oligonucleotides) Harvest.Pharmaceuticals.2023;16(3):336.doi:10.3390/ph16030336
- Al Shaer D, Al Musaimi O, Albericio F, de la Torre BG.2023 FDA TIDES (Peptides and Oligonucleotides) Harvest.Pharmaceuticals (Basel).2024;17(2):243.doi:10.3390/ph17020243
- Rossi JJ, Rossi DJ.siRNA Drugs: Here to Stay.Molecular Therapy.2021;29(2):431–432.doi:10.1016/j.ymthe.2021.01.015
- Gilar M, Koshel BM, Birdsall RE.Ion-Pair Reversed-Phase and Hydrophilic Interaction Chromatography Methods for Analysis of Phosphorothioate Oligonucleotides.Journal of Chromatography A.2023;1712:464475.doi:10.1016/j.chroma.2023.464475
- Cook K, Thayer J. Advantages of Ion-Exchange Chromatography for Oligonucleotide Analysis.Bioanalysis.2011;3(10):1109–1120.doi:10.4155/bio.11.66
- Shimoyama A, Fujisaka A, Obika S. Evaluation of Size-Exclusion Chromatography for the Analysis of Phosphorothioate Oligonucleotides.Journal of Pharmaceutical and Biomedical Analysis.2017;136:55–65.doi:10.1016/j.jpba.2016.12.036
- Donegan M, Nguyen JM, Gilar M. Effect of Ion-Pairing Reagent Hydrophobicity on Liquid Chromatography and Mass Spectrometry Analysis of Oligonucleotides.Journal of Chromatography A.2022;1666:462860.doi:10.1016/j.chroma.2022.462860
- Abdullah AM, Sommers C, Hawes J, Rodriguez JD, Yang K. Tandem mass spectrometric sequence characterization of synthetic thymidine-rich oligonucleotides.Journal of Mass Spectrometry.2022;57(4):e4819.doi:10.1002/jms.4819
- Catalin E. Doneanu, Ying Qing Yu, Joseph Fredette, William J. Warren, Weibin Chen.HILIC可用作在BioAccord系统上进行寡核苷酸完整分子量确认的替代分离模式.沃特世应用纪要. 720007395ZH. 2021年.
致谢
感谢BioSpring的Rebecca Hirschberger和Michael Rühl对本篇文章的贡献。
720008654ZH,2024年12月