一种具有更高检测灵敏度的改良版GlycoWorks流程
摘要
本文介绍了一种改良版GlycoWorks™ RapiFluor-MS™流程,在不影响数据质量或易用性的前提下,提高了FLR和MS检测低丰度游离N-糖的灵敏度。更新后的流程与基于NHS-氨基甲酸酯修饰的普鲁卡因胺(InstantPC™)的方法相比,在提高检测灵敏度和减少N-糖过度标记方面表现出优异的性能。
优势
- 改良版GlycoWorks流程在不牺牲易用性的前提下,将FLR灵敏度提高3倍,MS灵敏度提高2倍
- FLR灵敏度和MS灵敏度分别是配备IPC的Agilent™ AdvanceBio™ Gly-X™ N-糖前处理试剂盒的1.5倍和2.5倍
- 与配备IPC的Agilent AdvanceBio Gly-X N-糖前处理试剂盒相比,N-糖过度标记减少1.5-2倍
简介
N-糖基化是在生物治疗药物开发过程中受到密切监测的关键质量属性(CQA)。生物治疗药物的N-糖谱会影响清除率、效应功能和免疫原性1,2。 例如,据报道,高甘露糖聚糖可缩短治疗性抗体的血清半衰期3。 因此,快速且耐用的N-糖分析方法对于生物治疗药物的高效开发和批准很有必要。此外,这些方法必须足够灵敏,以检出低丰度糖型的变化,例如高甘露糖5 (Man5)。
Waters™ GlycoWorks RapiFluor-MS (RFMS) N-糖标记试剂盒提供了一种快速、简便的N-糖释放和标记方法,可实现灵敏的荧光和MS检测。该流程包括用PNGase F快速释放N-糖、用RFMS标记游离N-糖,并通过HILIC-SPE净化样品。整个流程需要1–2小时,具体取决于制备的样品量,且适用于各种样品4-7。
在本应用纪要中,通过增加起始样品量,RFMS标记N-糖的FLR检测灵敏度提高了3倍,MS检测灵敏度提高了2倍。本研究报告了使用这种灵敏度提升方案制备的样品的N-糖谱和HILIC-SPE回收率,并与Agilent AdvanceBio Gly-X N-糖制备和净化试剂盒进行了比较。最后评估了游离N-糖的过度标记现象,与配备InstantPC (IPC)的Agilent AdvanceBio Gly-X N-糖前处理试剂盒相比,GlycoWorks试剂盒能够将N-糖的过度标记减少1.5–2倍。
实验
GlycoWorks的样品前处理
使用GlycoWorks RapiFluor-MS Eco N-糖试剂盒(P/N:176005289)制备RFMS标记的游离N-糖。按照应用纪要720005506中发布的支持QC/自动化的方案制备试剂和样品。简而言之,就是将10 μL样品(4 mg/mL,40 µg;1.5 mg/mL,15 µg)与10 μL RapiGest™ SF表面活性剂(3%)混合,并在90 °C下加热3分钟。在室温下冷却3分钟后,加入10 μL稀释后的PNGase F,并将样品在50 °C下加热5分钟。将样品在室温下冷却3分钟,用10 μL RFMS (82.5 µg/ μL)处理、混合,并在室温下放置5分钟。按照《GlycoWorks维护和使用手册》(715005359),通过HILIC-SPE净化样品,然后不稀释直接分析。
Gly-X的样品前处理
使用配备IPC的Agilent AdvanceBio Gly-X N-糖前处理试剂盒(P/N:GX96-IPC),按照用户手册(5994-1231EN)中所述的步骤制备IPC标记的游离N-糖。所有试剂均按照用户手册中的说明制备。简而言之,就是将20 μL样品(2 mg/mL,40 µg;0.75 mg/mL,15 µg)与2 µL Gly-X变性剂混合,并在90 °C下加热3分钟。在室温下冷却2分钟后,加入2 μL N-聚糖酶工作溶液,并将样品在50 °C下加热5分钟。立即加入5 μL IPC染料溶液,将样品在50 °C下加热1分钟。按照用户手册中所述的步骤,使用Agilent AdvanceBio Gly-X InstantPC净化模块(P/N:GX96-102),通过HILIC-SPE净化样品,然后不稀释直接分析。
液相色谱条件
|
液相色谱系统: |
ACQUITY™ UPLC™ H-Class (FLR)或ACQUITY Premier UPLC (MS) |
|
色谱柱: |
ACQUITY Premier BEH™ Amide游离寡糖分析专用柱, 130 Å, 1.7 µm, 2.1 x 100 mm(P/N:186009523) |
|
柱温: |
60 ℃ |
|
样品温度: |
6 °C |
|
进样体积: |
1 µL |
|
流动相A: |
50 mM甲酸铵,pH 4.4(LC-MS级,P/N:186007081) |
|
流动相B: |
乙腈 |
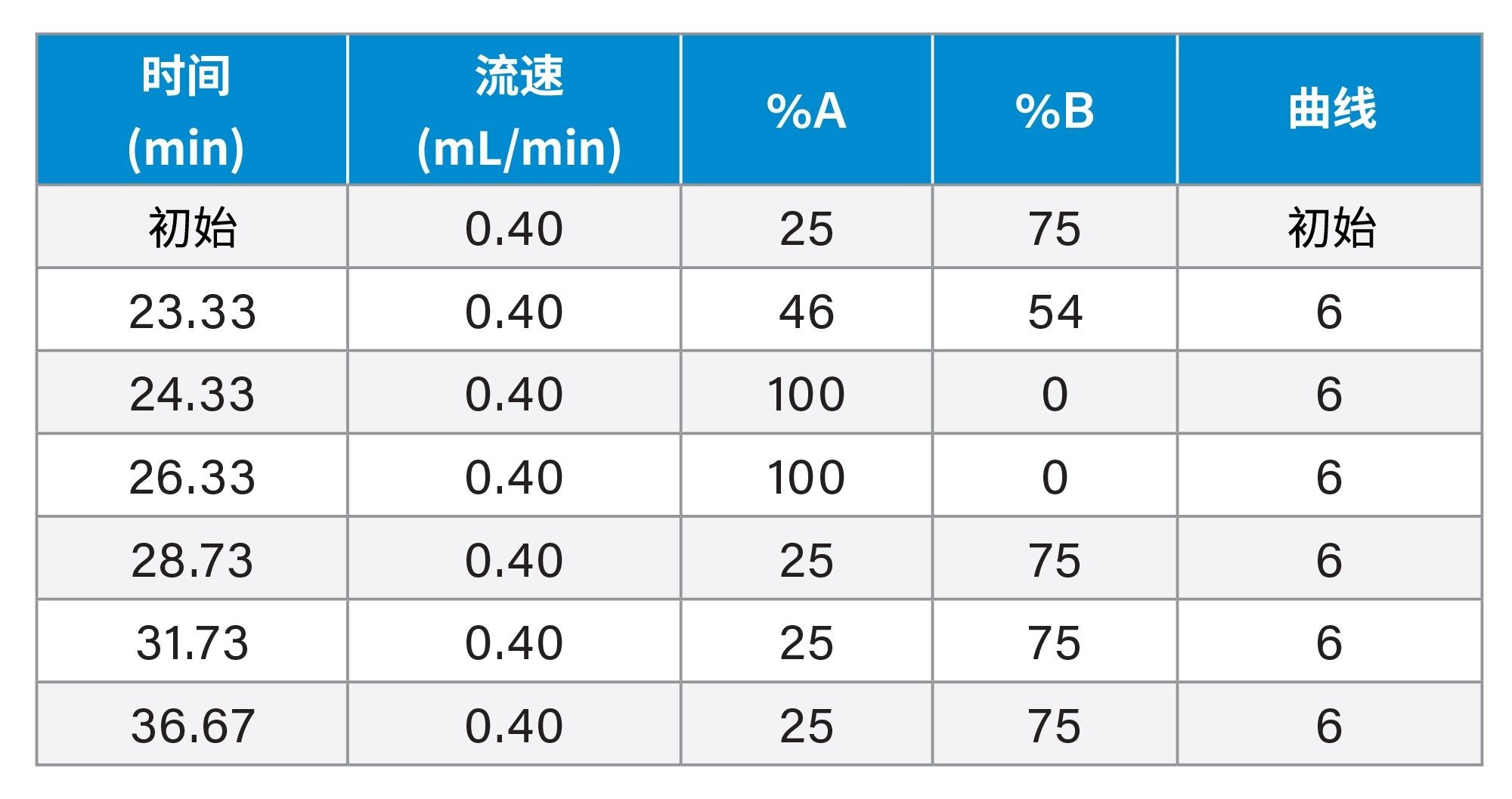
梯度表
ACQUITY UPLC FLR检测器设置
|
λex (RFMS): |
265 |
|
λem (RFMS): |
425 |
|
λex (IPC): |
285 |
|
λem (IPC): |
345 |
|
采样速率: |
2 Hz |
Xevo G2-XS QToF检测器设置
|
质量范围: |
50~2000 m/z |
|
电离模式: |
ESI+ |
|
分析器模式: |
灵敏度 |
|
实验类型: |
MSE |
|
采样速率: |
1 Hz |
|
毛细管电压: |
3.00 kV |
|
锥孔电压: |
80 V |
|
离子源温度: |
120 °C |
|
脱溶剂气温度: |
300 °C |
|
锥孔气流速: |
50 L/h |
|
脱溶剂气流速: |
800 L/h |
|
碰撞能量: |
6 V |
|
高能阶梯: |
15-40 V |
结果与讨论
对RFMS标记N-糖具有更高的灵敏度
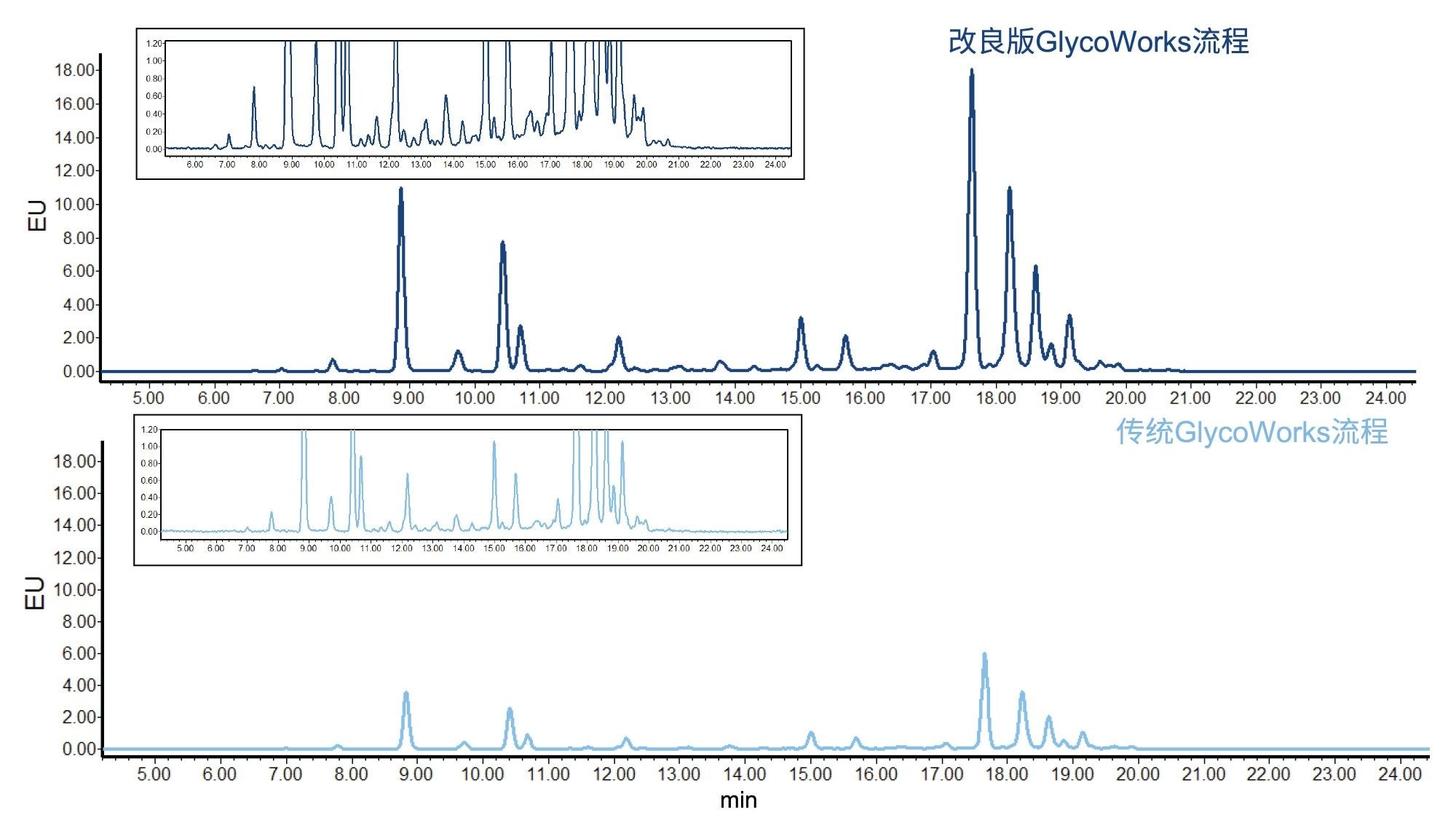
本研究使用起始样品量增加的改良版GlycoWorks流程,从单克隆抗体(NISTmAb)和牛胎球蛋白的混合物中释放并标记N-糖。这种糖蛋白混合物可涵盖各种N-糖,包括mAb中丰度更高的低天线度中性形式,以及胎球蛋白中存在的高天线度、高度唾液酸化的形式。图1显示了使用传统(每种糖蛋白15 µg)和改良版(每种糖蛋白40 µg)GlycoWorks流程制备的RFMS标记N-糖的HILIC-FLR色谱图。两张色谱图均显示了NISTmAb/胎球蛋白混合物的预期N-糖谱。使用改良版GlycoWorks流程制备的样品,其HILIC-FLR色谱图的信号是使用传统流程制备的样品的3倍。HILIC-MS色谱图也表现出类似的信号增加(请参阅下面的信噪比数据)。
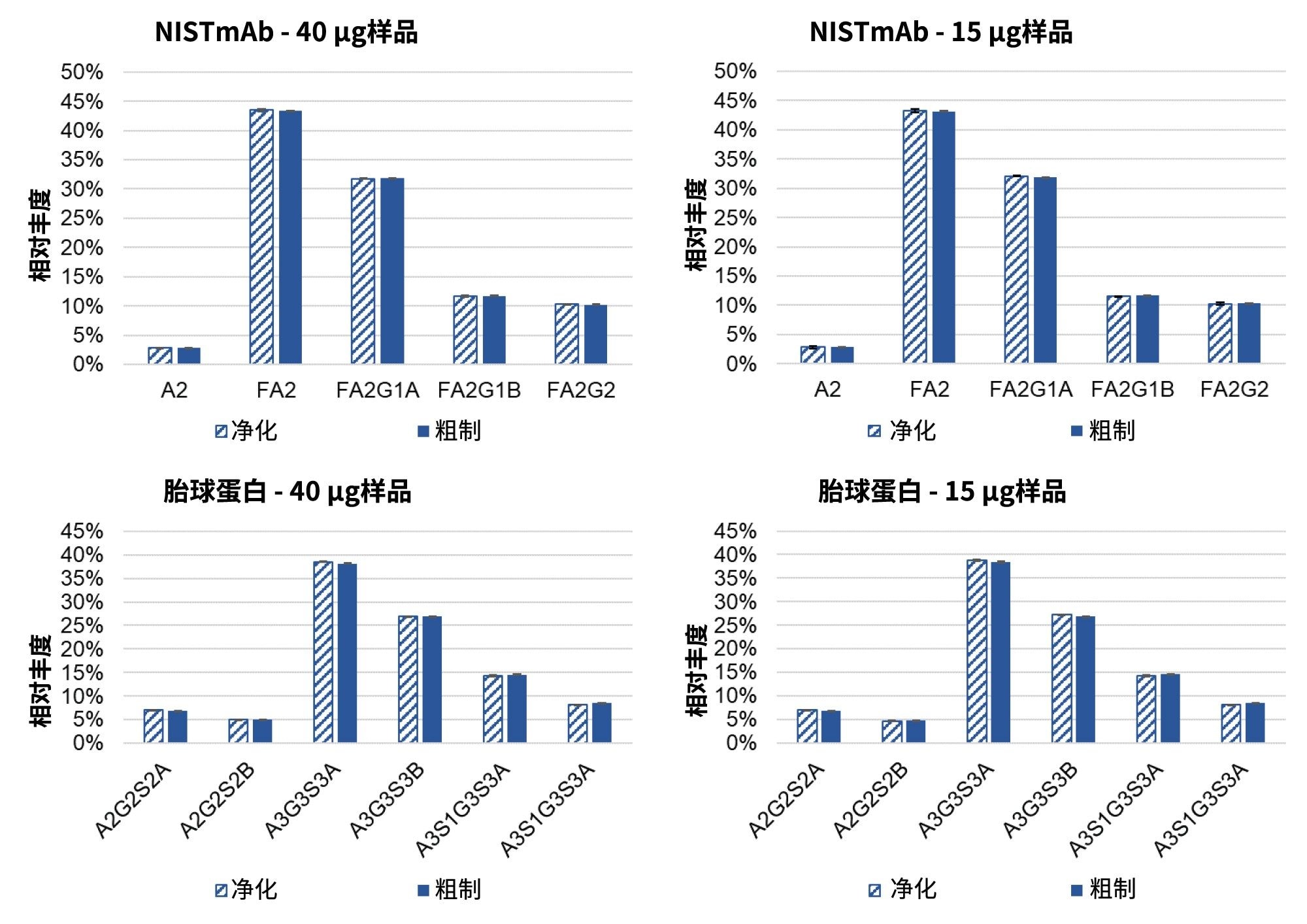
使用GlycoWorks试剂盒从40 µg和15 µg选定NISTmAb和胎球蛋白样品中释放N-糖得到的相对FLR峰丰度如图2所示。起始样品量从15 µg增加到40 µg时,NISTmAb和胎球蛋白的N-糖分布均未发生变化。这些结果证明了该试剂盒在各种样品浓度下的有效性,并证实可以提高检测灵敏度,且不会对释放和标记反应产生任何不利影响。图中显示了HILIC-SPE净化前后的相对丰度,证明无论样品浓度如何,净化步骤均不具备选择性。
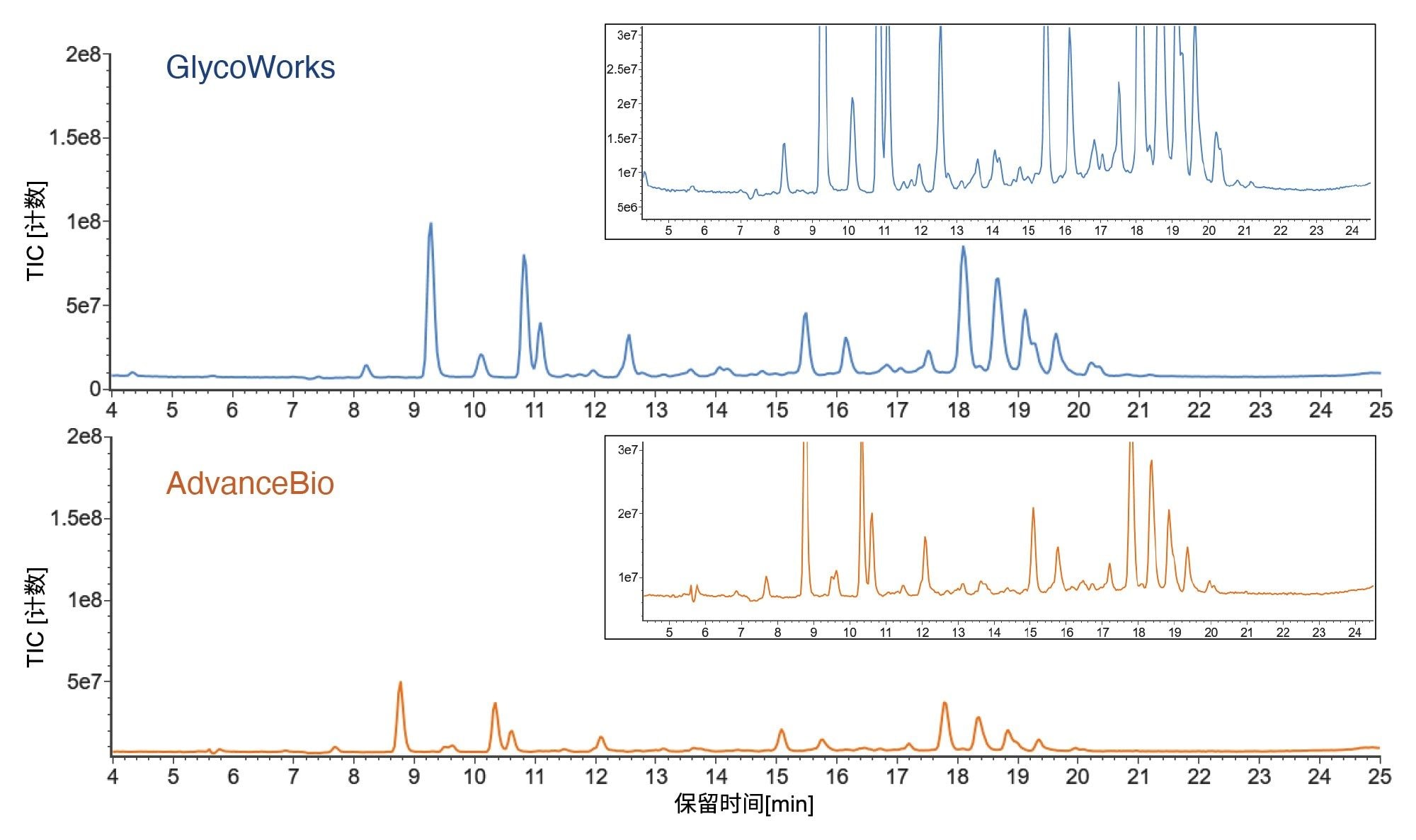
与Agilent AdvanceBio试剂盒比较
本研究还使用了配备IPC的Agilent AdvanceBio Gly-X N-糖前处理试剂盒,从相同的NISTmAb/胎球蛋白混合物(两种浓度,每种糖蛋白分别40 µg和15 µg)中释放和标记N-糖,比较了Gly-X的结果与使用Glycoworks获得的结果。无论起始样品量为多少,GlycoWorks和AdvanceBio试剂盒均提供相当的N-糖谱(见图3中的MS色谱图)。
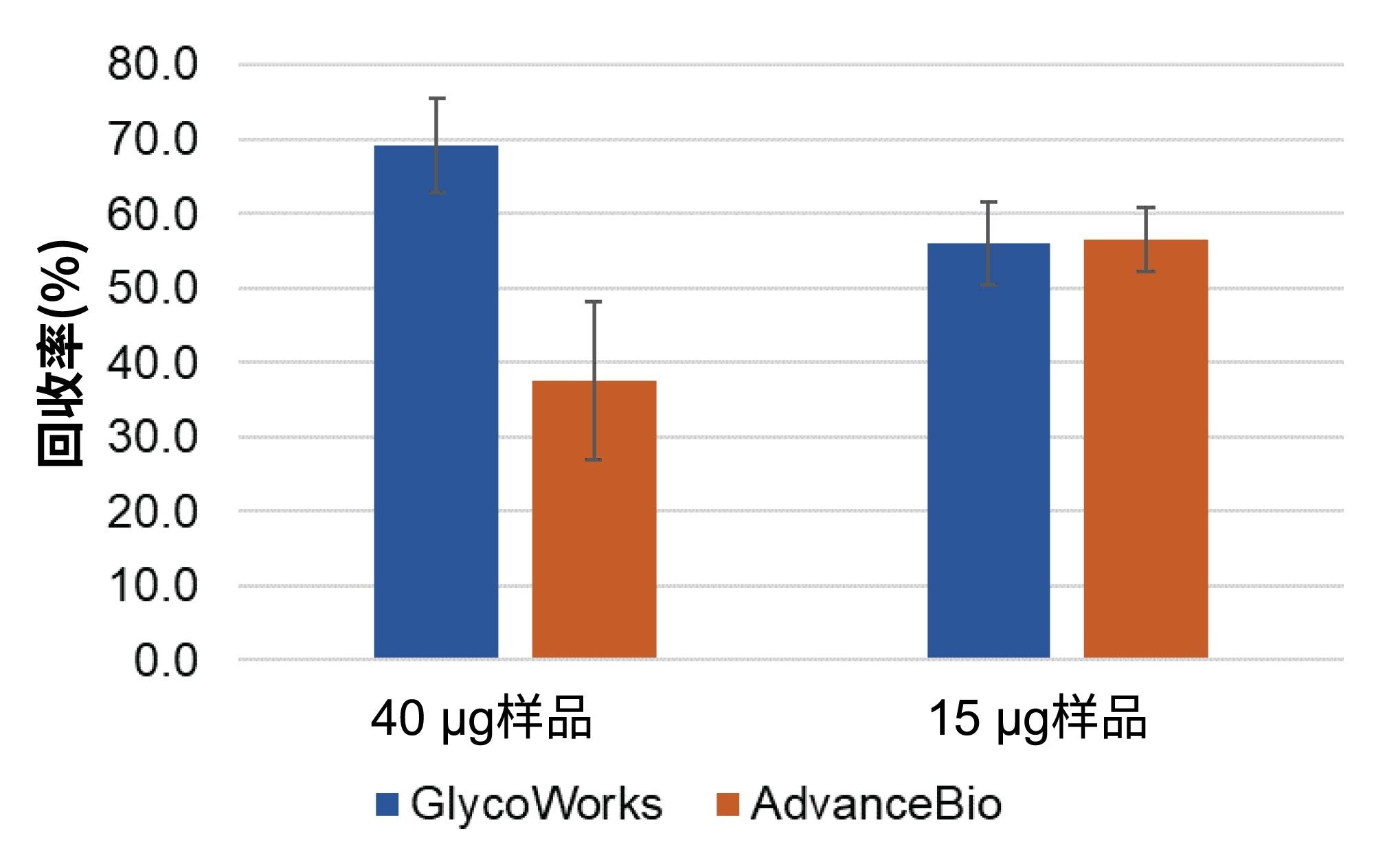
本研究通过比较样品净化前后FA2 N-糖的FLR峰面积,评估了两种试剂盒的HILIC-SPE回收率(图4)。对于每种糖蛋白15 µg的样品,两种试剂盒的SPE回收率相当。但对于每种糖蛋白40 µg的样品,GlycoWorks净化试剂盒产生的回收率是AdvanceBio试剂盒的1.5倍。GlycoWorks试剂盒的SPE回收率随样品量增加而提高。这一结果符合预期,因为样品总浓度增加时,净化过程中样品损失的相对水平减少。AdvanceBio试剂盒的SPE回收率随样品量增加而降低,可能是因为SPE程序的容量有限(建议不超过40 µg糖蛋白)。
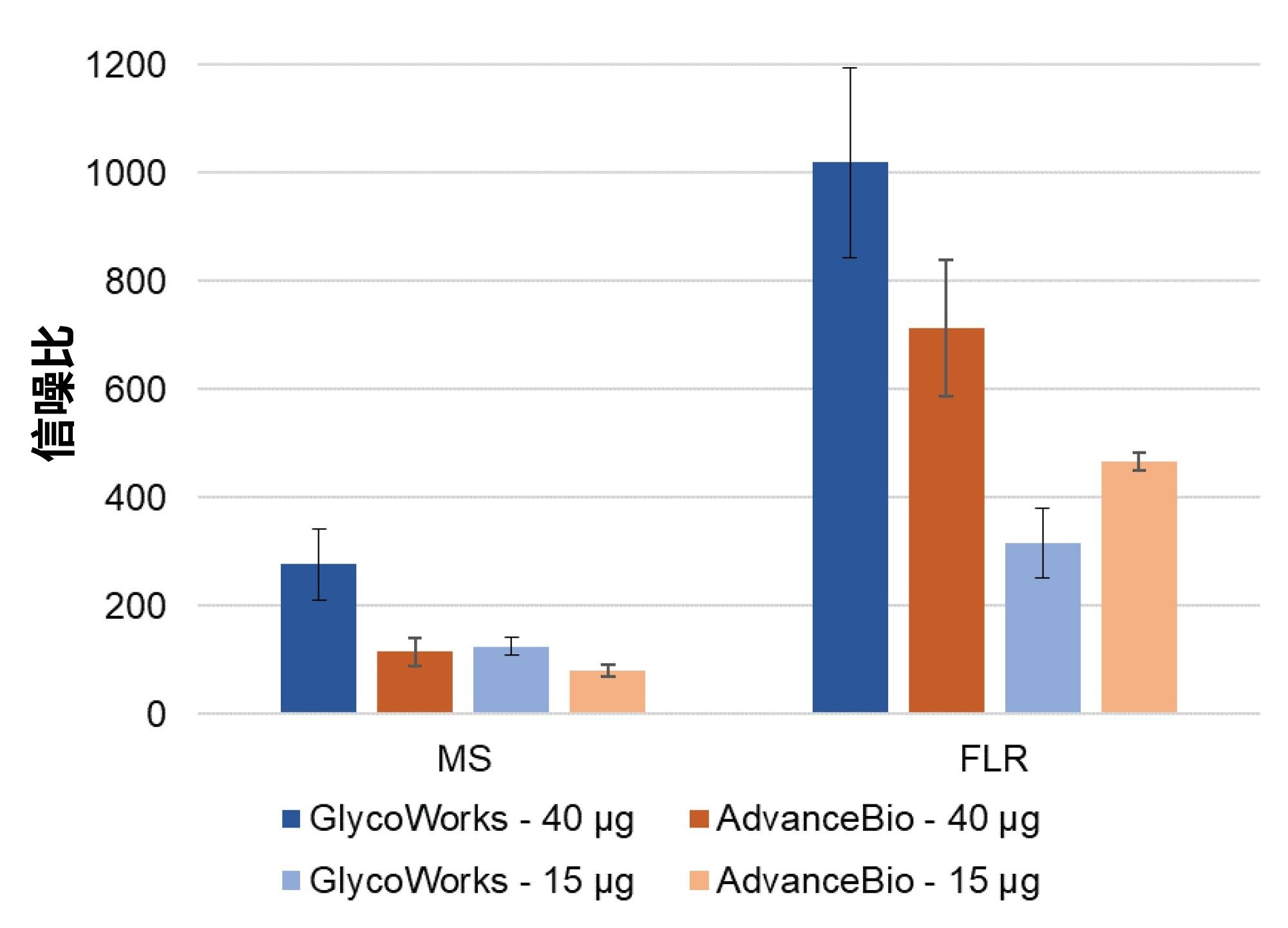
在选择游离N-糖分析的样品前处理试剂盒时,应考虑信噪比(SNR),确保检出低丰度糖型的变化。使用GlycoWorks和AdvanceBio试剂盒制备的标记游离N-糖的FLR和MS检测的SNR如图5所示。无论起始样品量为多少,GlycoWorks试剂盒的MS检测都比AdvanceBio试剂盒更灵敏。对于FLR检测,当起始样品量为每种糖蛋白40 µg时,GlycoWorks试剂盒的检测灵敏度高于AdvanceBio试剂盒;但当起始样品量为每种糖蛋白15 µg时,GlycoWorks试剂盒的检测灵敏度低于AdvanceBio试剂盒。在样品量较大的情况下,GlycoWorks试剂盒的FLR灵敏度可能优于AdvanceBio试剂盒,因为它的SPE回收率更高。
游离N-糖的过度标记
GlycoWorks和AdvanceBio试剂盒均依赖于游离糖胺与N-羟基琥珀酰亚胺(NHS)酯的化学交联,类似于蛋白质中的赖氨酸残基与经过修饰的NHS酯交联。但是,蛋白质与NHS酯发生交联后可能会与赖氨酸以外的亲核位点(例如N-端、酪氨酸、丝氨酸和苏氨酸)发生反应,导致过度标记8。 因此,对于使用GlycoWorks和AdvanceBio试剂盒制备的标记游离N-糖,同样应该仔细检查是否存在多个RFMS或IPC分子的过度标记情况。过度标记游离N-糖将导致保留时间漂移,进而可能导致低丰度N-糖的鉴定和定量分析结果不准确。
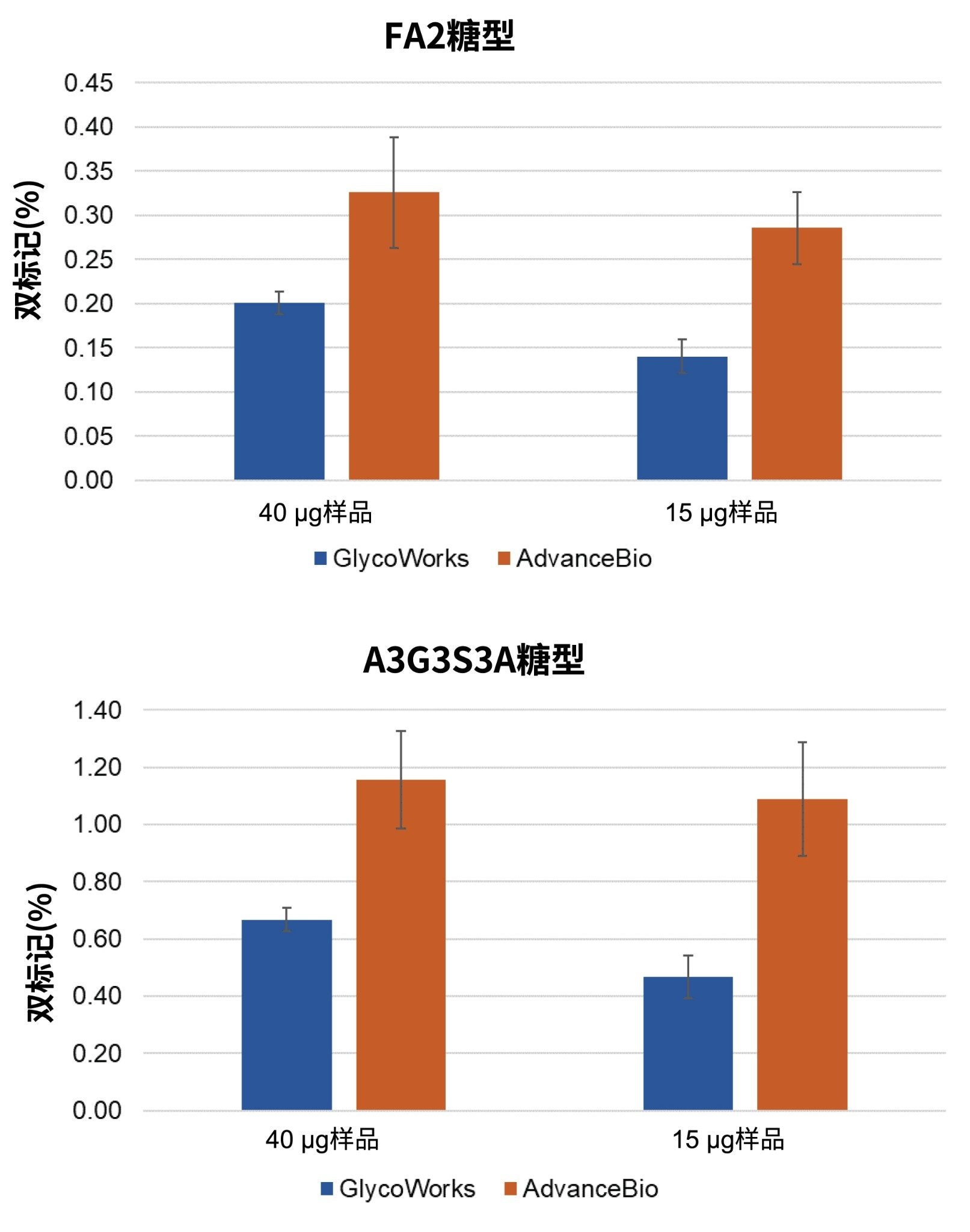
本研究通过对双标记和单标记FA2以及A3G3S3 N-糖的提取离子流色谱图(EIC)进行积分,测量了RFMS和IPC的过度标记情况。图6显示了使用GlycoWorks和AdvanceBio试剂盒制备的样品中双标记物质占双标记物质与单标记物质总和的百分比。对于这两种试剂盒,A3G3S3 N-糖均比FA2 N-糖表现出更多的过度标记现象,并且当起始样品量从15 µg增加到40 µg时,过度标记现象均略有增加。值得注意的是,使用GlycoWorks试剂盒制备的样品与使用AdvanceBio试剂盒制备的样品相比,过度标记现象少1.5–2倍。这些结果凸显了GlycoWorks试剂盒的显著优势:能够降低因过度标记而导致低丰度N-糖鉴定和定量分析结果不准确的风险。
结论
快速、耐用且灵敏的N-糖分析方法对于生物治疗药物的高效开发和批准很有必要。本研究建立了一种改良版GlycoWorks流程,能够提高检测灵敏度,且不会对标记游离N-糖的相对定量分析产生不利影响。这个新流程可通过增加起始样品量使FLR SNR增加3倍,MS SNR增加2倍。在较高的样品浓度下,GlycoWorks试剂盒与配备IPC的Agilent AdvanceBio Gly-X N-糖前处理试剂盒相比,表现出更高的SPE回收率、FLR灵敏度(1.5倍)和MS灵敏度(2.5倍)。此外,使用GlycoWorks试剂盒制备的样品与使用AdvanceBio试剂盒制备的样品相比,过度标记现象少1.5–2倍。
参考资料
- Zhang, P., Woen, S., Wang, T., Liau, B., Zhao, S., Chen, C., Yang, Y., Song, Z., Wormald, M. R., Yu, C., Rudd, P. M. Challenges of glycosylation analysis and control: an integrated approach to producing optimal and consistent therapeutic drugs.Drug Discovery Today.2016, 21 (5), 740–765.
- Reusch, D., Tejada, M.L. Fc glycans of therapeutic antibodies as critical quality attributes.Glycobiology.2015, 25 (12), 1325–1334.
- Goetze A. M., Liu Y. D., Zhang Z., Shah B., Lee E., Bondarenko P. V., Flynn GC.High-mannose glycans on the Fc region of therapeutic IgG antibodies increase serum clearance in humans.Glycobiology.2011, 21 (7), 949–959.
- Lauber, M. A.; Yu, Y.-Q.; Brousmiche, D. W.; Hua, Z.; Koza, S. M.; Magnelli, P.; Guthrie, E.; Taron, C. H.; Fountain, K. J. Rapid Preparation of Released N-Glycans for HILIC Analysis Using a Labeling Reagent That Facilitates Sensitive Fluorescence and ESI-MS Detection.Anal.Chem.2015, 87 (10), 5401–5409.
- Koza, S. M.; McCall, S. A.; Lauber, M. A.; Chambers, E. E. Quality Control and Automation Friendly GlycoWorks RapiFluor-MS N-Glycan Sample Preparation (720005506).Waters Corporation May 2020.
- Zhang, X.; Reed, C. E.; Birdsall, R. E.; Yu, Y. Q.; Chen, W. High-Throughput Analysis of Fluorescently Labeled N-Glycans Derived from Biotherapeutics Using an Automated LC-MS-Based Solution.SLAS Technology.2020, 24 (4), 380–387.
- Hanna, C.M.; Koza, S. M., Yu, Y. Q. 蛋白A纯化单克隆抗体的自动化高通量N-糖标记和LC-MS分析(720007854).沃特世公司 2023年2月.
- Kalkhof, S., Sinz, A. Chances and pitfalls of chemical cross-linking with amine-reactive N-hydroxysuccinimide esters.Anal Bioanal Chem 392, 305–312 (2008).
720008222ZH,2024年2月