在ACQUITY™ Premier系统上使用MaxPeak™ Premier色谱柱技术改善含磷酸肽的肽图分析分离结果
摘要
肽图分析研究可能会因磷酸化肽的存在而复杂化,因为此类肽容易结合整个色谱流路中暴露的金属表面。RPLC中常用的流动相添加剂无法充分减少这些相互作用,导致本已具有挑战性的RPLC分离的色谱质量降低。MaxPeak高性能表面(HPS)是Waters™专为解决这一棘手问题而开发的技术。这得益于MaxPeak HPS技术的创新设计,该技术能够减少分析物的非特异性相互作用,避免分析物吸附到流路表面。本文在基于MS检测的磷酸肽图分析应用中,使用ACQUITY Premier色谱柱,进行了ACQUITY Premier二元UPLC™系统与业内领先的生物兼容性二元UHPLC系统的比较。研究中监测了影响色谱质量的关键参数,包括峰拖尾、峰面积和信噪比。调整了流动相添加剂浓度,以确定是否可以获得更适合MS的条件。与传统的生物兼容性系统相比,ACQUITY Premier系统和色谱柱在采用质谱仪检测棘手化合物(例如磷酸肽)的RPLC应用中表现出了明显的优势。
优势
- 使用ACQUITY Premier系统和色谱柱可改善磷酸肽图分析的色谱性能
- 流动相添加剂含量更低,有助于提高质谱仪检测灵敏度并降低LOD
简介
蛋白质的肽图分析研究可能很复杂,对于大分子蛋白质尤其如此,需要能够在单次分析中解析多个峰的方法。监测肽图的一种常用方法是反相液相色谱(RPLC)与电喷雾电离质谱(ESI-MS)联用。这种技术可能会因酶解物中存在磷酸化肽(磷酸肽)而复杂化。许多细胞过程(例如细胞生长和分化)是通过蛋白激酶在丝氨酸、苏氨酸和酪氨酸的氨基酸残基上的磷酸化来控制的1。 此外,研究表明,人类基因组编码的全部蛋白质中,至少2/3在其生命周期的某个时刻曾发生过磷酸化2。 磷酸肽为“粘性”化合物,由于具有带负电荷的磷酸基团,因此容易吸附到整个色谱流路中带正电荷的金属表面。这种相互作用会导致磷酸肽峰的峰拖尾和回收率下降,以及由于色谱结果的复杂性导致肽图的整体质量较差3。
为了控制反相肽图分析方法中分析物的选择性和回收率,研究中使用了如三氟乙酸(TFA)或甲酸(FA)这样的酸性流动相添加剂。这些离子对试剂可中和自由金属离子,限制分析物与色谱系统的结合4。 在RPLC-MS肽图分析中,FA是一种常用的弱离子对试剂,因为它的离子抑制作用比其他添加剂低5。 使用基于质谱的方法时,离子抑制是一个重要的考虑因素,因为它会显著影响检测器响应。监测低丰度峰时,优化信噪比(S/N)对于提高检测限(LOD)和分析准确度非常重要。
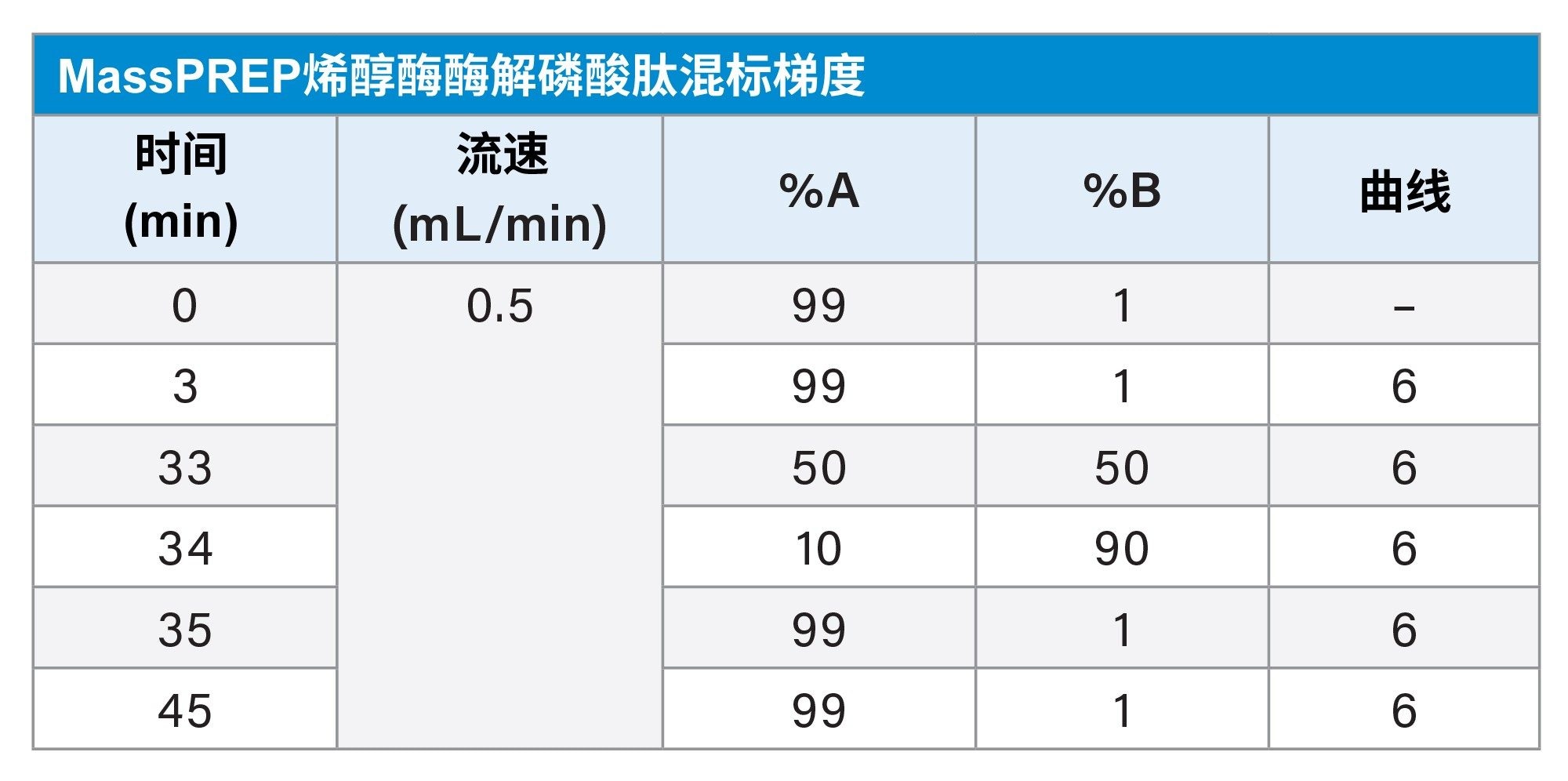
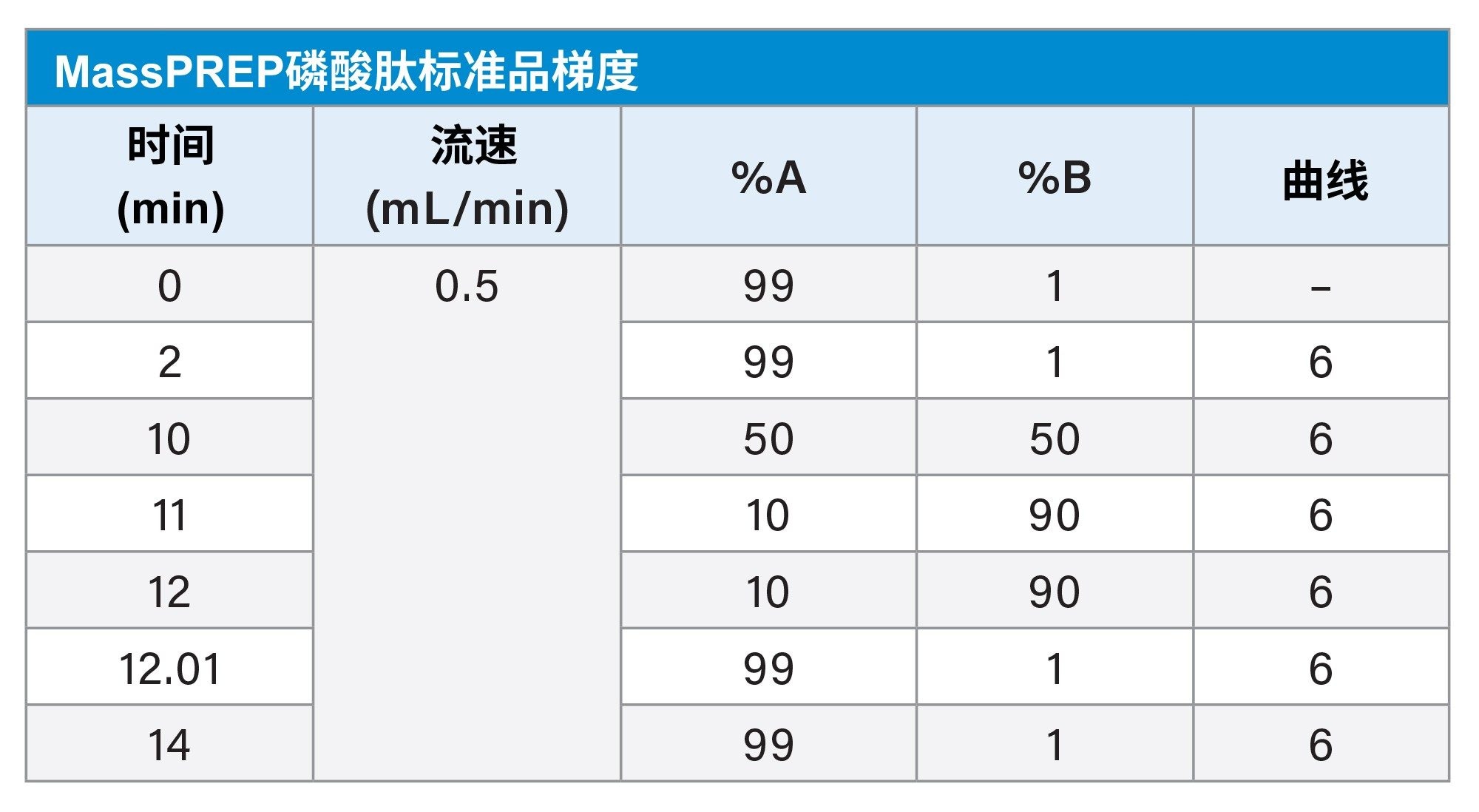
本研究介绍了ACQUITY Premier二元系统(图1)和传统生物兼容性UHPLC系统(系统X)使用ACQUITY Premier色谱柱分离磷酸肽的性能比较。生物兼容性系统使用PEEK和MP35N代替不锈钢系统组件,去除了流路中的铁离子,从而减少了腐蚀和潜在的样品污染。ACQUITY Premier系统和MaxPeak Premier色谱柱凭借MaxPeak HPS技术提供了额外的价值,该技术旨在大幅减少可能导致样品损失的分析物/表面相互作用。使用ACQUITY QDa™质谱检测器在多天内运行多个样品组,监测峰拖尾、信噪比和峰面积等适应性参数。此外,我们将流动相中的FA从0.1%减少到0.01%,以确定能否使用更温和的流动相条件来提高质谱仪检测的灵敏度。

实验
液相色谱条件
|
液相色谱系统: |
1. 配备ACQUITY APC储液瓶盖套件(P/N:205001152)的ACQUITY Premier二元系统 2. 配备标准储液瓶盖的系统X生物兼容性UHPLC二元系统 |
|
样品瓶: |
全回收(P/N:186002805) |
|
色谱柱: |
ACQUITY Premier CSH™ C18肽分析专用柱, 130 Å, 1.7 µm, 2.1 × 150 mm(P/N:186009489) |
|
柱温: |
65 °C |
|
样品温度: |
6 °C |
|
进样体积: |
1.MassPREP烯醇酶酶解磷酸肽混标 = 1 µL 2. MassPREP磷酸肽烯醇酶标准品 = 1、3和5 µL |
|
流动相A: |
含0.1%或0.01%甲酸(FA)的Milli-Q水溶液 |
|
流动相B: |
含0.1%或0.01% FA的乙腈(ACN)溶液 |
梯度表
质谱条件
|
质谱系统: |
QDa |
|
电离模式: |
正离子 |
|
毛细管电压: |
1.5 kV |
|
锥孔电压: |
15 V |
数据管理
|
色谱软件: |
Empower™ 3.6.1 |
结果与讨论
为了评估这两套UHPLC系统在RPLC-MS中分离磷酸肽的适用性,对这两个系统进行了为期三天的测试。使用的样品包括由三个单磷酸化肽和一个双磷酸化肽组成的磷酸化肽标准品,以及加入了四种相同磷酸肽的酵母烯醇酶蛋白胰蛋白酶酶解物。磷酸肽标准品和烯醇酶酶解物分别使用6.13% B/min和1.63% B/min的梯度斜率,以确保肽充分分离。对不同进样体积(1 µL、3 µL和5 µL)的磷酸肽混标进行测试以评估LOD。两个系统均使用相同的QDa质谱检测器,因此仅使用质谱数据进行比较。质谱数据是肽图分析研究中不可或缺的一部分,其中峰的质量数确认对于解析蛋白质的肽序列至关重要。在本研究中使用的FA,作为酸性流动相添加剂,其浓度可以针对肽峰的选择性进行优化。一般来说,流动相体系中0.1%的添加剂浓度就足以实现肽图中大多数峰的良好分离6-8。 ACQUITY Premier系统和色谱柱中使用的表面改性剂应能够减少分析物/表面相互作用,从而减少使用的流动相添加剂。为此,研究中测试并比较了两种流动相体系:含0.1% FA的标准流动相以及含0.01% FA的较低离子对流动相。
在研究开始时收集烯醇酶酶解物的总离子流色谱图(TIC),确定覆盖梯度的目标肽峰。选定目标肽段后,在整个研究过程中使用单离子扫描(SIR)监测肽段。这种方法允许用户增加扫描时间,以尽可能提高检测器灵敏度,并收集单电荷和双电荷态的肽离子数据,进一步确认目标物质。
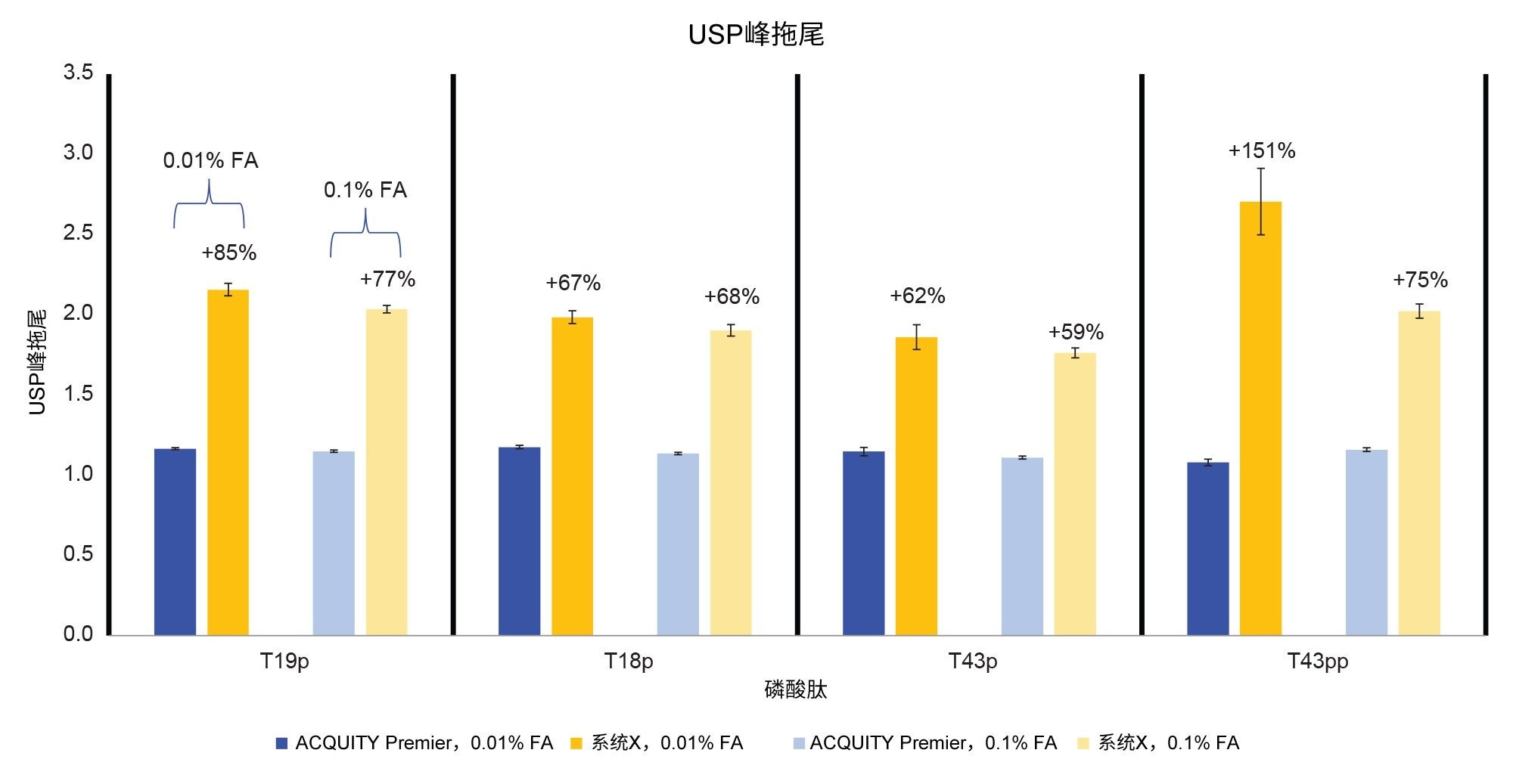
图2展示了在含0.1%和0.01% FA的流动相条件下,在两个系统上进行的MassPREP磷酸肽混标的分离情况。与系统X相比,在两种条件下,ACQUITY Premier系统均显示出更好的峰形。此外,降低流动相添加剂浓度时,ACQUITY Premier系统上的峰拖尾没有显著增加,而系统X上的峰拖尾略有增加。图3中确证了这些观察结果,该图中比较了5 µL进样量时的峰拖尾情况。使用含0.01% FA的流动相时,系统X的峰拖尾因子高出了62%~151%。当使用0.1% FA时,与ACQUITY Premier相比,系统X上的峰拖尾增加了59%~75%。由于离子对试剂抑制了非目标相互作用,因此预计系统间的差异会减少。即使使用较高浓度的FA,系统X的峰拖尾仍高于ACQUITY Premier系统。此外,ACQUITY Premier系统在两种条件下所有峰的峰拖尾偏差均更小。值得注意的是,在使用ACQUITY Premier系统时,当流动相添加剂从标准的0.1% FA降至0.01% FA时,峰拖尾没有显著增加,这证明了MaxPeak HPS可以在不牺牲色谱性能的情况下使用更少的离子对试剂。这一现象在双磷酸化形式的T43肽(T43pp)上表现得尤其明显,这种形式的肽特别容易与流路发生非目标相互作用。系统X在标准品中三种单磷酸化肽的流动相条件之间展现出相当的结果,在使用0.01% FA流动相时观察到的峰拖尾略有增加,与使用0.1% FA流动相时观察到的峰拖尾程度在偏差范围内。但是,分析T43pp肽时,在系统X上观察到拖尾显著增加,而在ACQUITY Premier系统上未观察到这种现象。
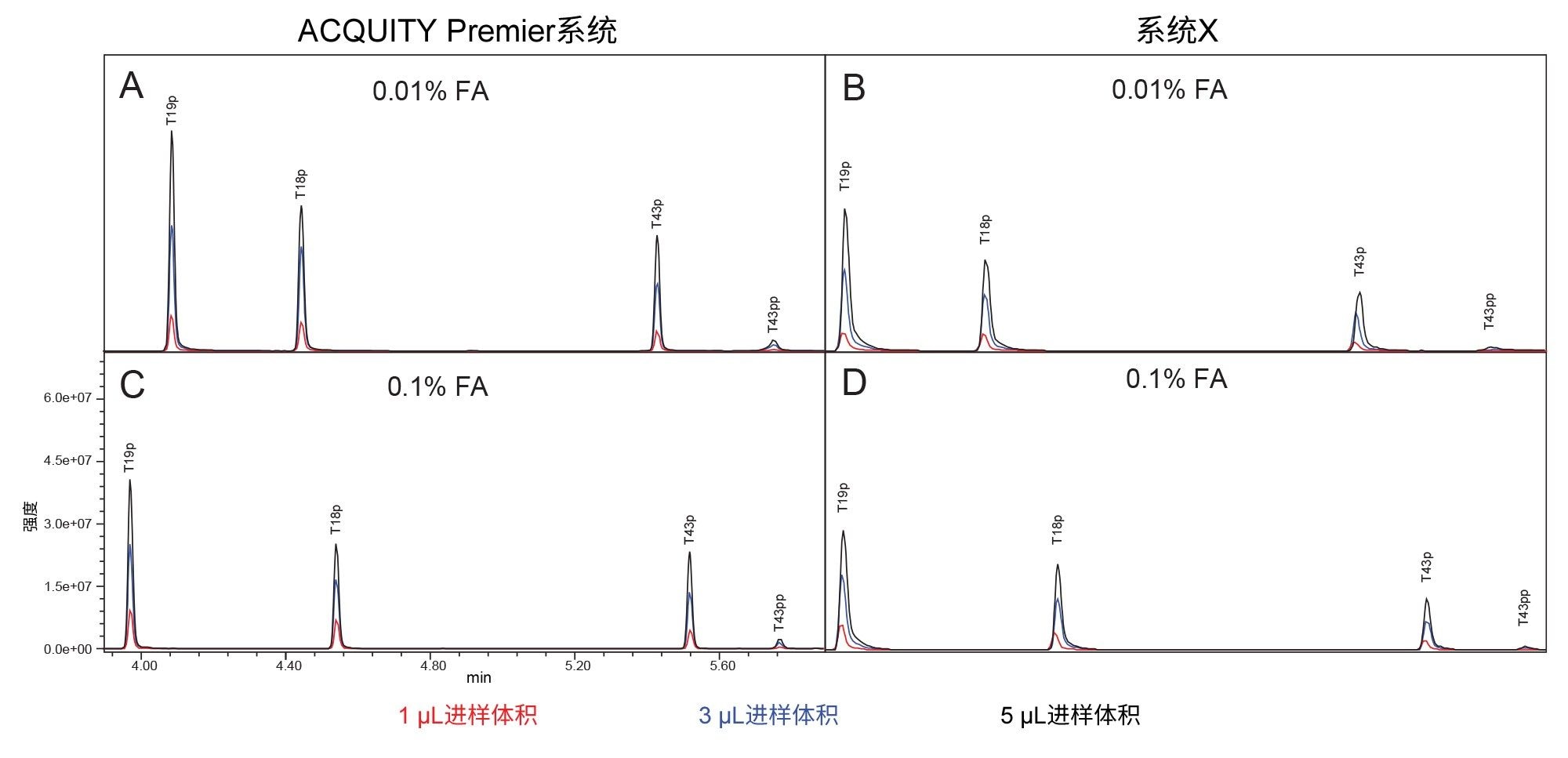
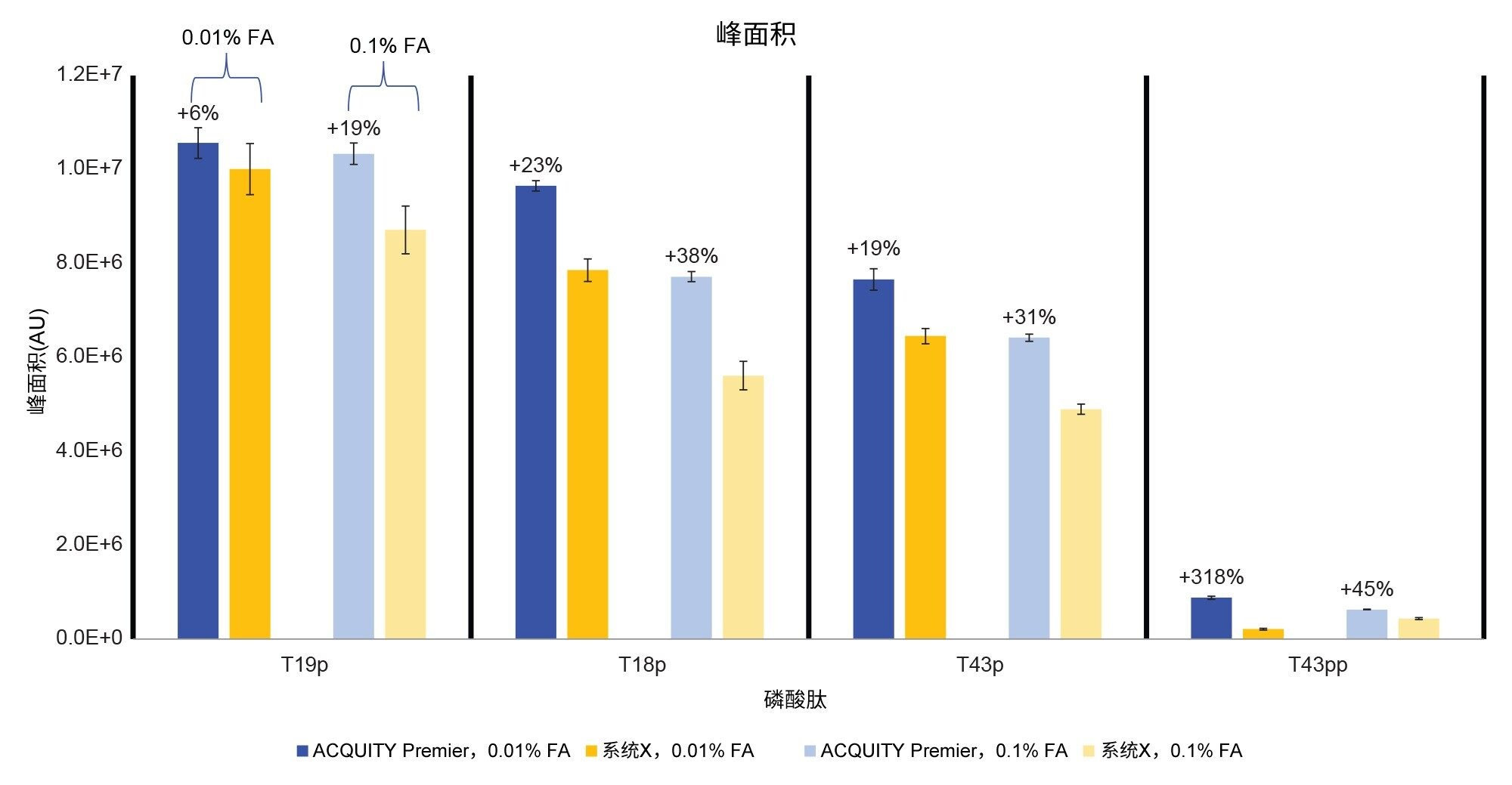
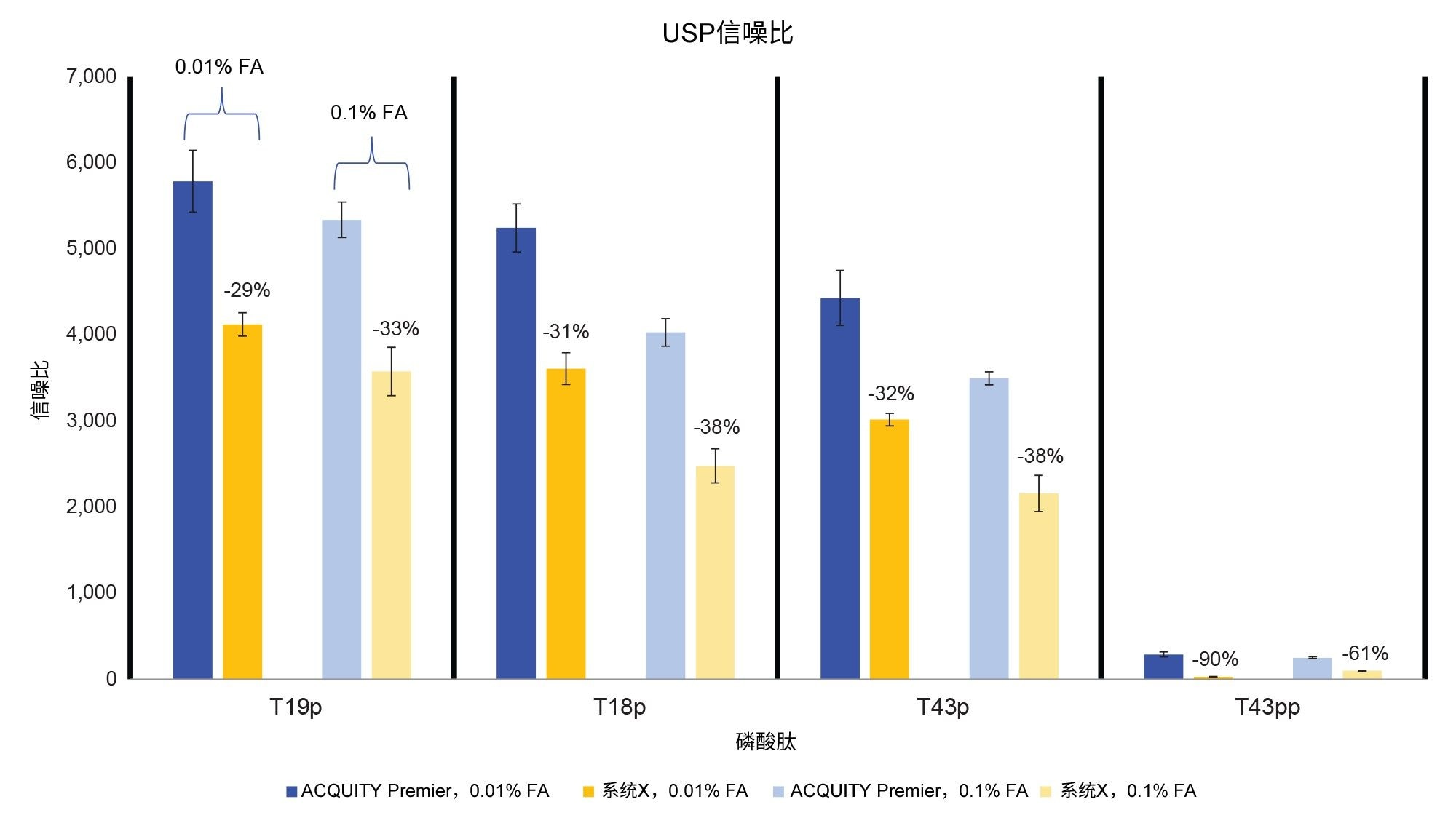
除了峰形的改善外,ACQUITY Premier系统还表现出更高的分析物回收率和S/N(图4和图5)。使用离子强度较低的流动相时,与生物兼容性系统相比,ACQUITY Premier系统上观察到的峰面积增加范围从T19p磷酸肽的6%到T43pp肽的3倍。同样,在采用较高离子强度的流动相时,也观察到分析物回收率的提高(19%和45%),这些结果证明了Premier技术在常规分析中的价值(图4)。此外,使用生物兼容性系统时增加流动相的离子强度并不能充分减少分析物损失,正如使用0.1% FA时ACQUITY Premier系统与系统X相比所展示的峰面积增加一样。当降低流动相添加剂浓度时,两个系统得到的所有单磷酸化肽的峰面积和信噪比均有所增加,这可能是由于离子抑制效应减弱所致。系统X在双磷酸化肽的这两个指标上均有所下降,而在ACQUITY Premier系统上未观察到这一现象。这种差异表明,生物兼容性系统更依赖于流动相添加剂来防止棘手分析物发生非靶向相互作用。值得注意的是,尽管ACQUITY Premier系统在T43pp肽的信噪比或峰面积方面没有表现出大幅改善,但HPS减少了使用0.01% FA时生物兼容性系统所经历的性能损失。如图2中的色谱图所示,T43pp在系统X上几乎看不见,但在ACQUITY Premier系统上却可以通过峰面积和信噪比测量值将它清晰地识别出来。与使用0.01% FA流动相的ACQUITY Premier系统相比,系统X的信噪比损失在-29% (T19p)~-90% (T43pp)之间。而当使用更高离子强度的流动相时,同一峰的上述降低幅度分别为-33%和-61%。
使用磷酸肽标准品进样所得的低丰度T43pp肽计算两个系统上两种条件下的LOD。将S/N = 3作为截止标准。使用0.1% FA时,ACQUITY Premier系统的LOD为1.53 pmol,系统X为2.74 pmol。使用0.01% FA流动相时,ACQUITY Premier系统的LOD为5.06 pmol,而系统X为10.67 pmol。如预期一样,较高浓度的流动相添加剂遮盖了系统流路内的结合位点,两个系统上的LOD均较低。随着添加剂浓度的降低,两个色谱系统之间的差异变得更加明显,ACQUITY Premier系统的LOD比系统X低2倍。这可以归因于ACQUITY Premier系统的MaxPeak HPS继续限制了色谱系统中分析物的非目标相互作用,即使流动相添加剂浓度降低时也是如此。
目前讨论的结果展示了在质谱检测“粘性”分析物,如磷酸化肽时,使用HPS技术的优势。但是,肽图很复杂,包含许多磷酸化和非磷酸化肽。为了将研究扩展至包括完整的肽图分析方法,研究中使用了烯醇酶酶解标准品(图6)。该标准品中包含胰蛋白酶酶解酵母烯醇酶产生的肽,其中加标了磷酸肽混标的四种磷酸肽9。 选择梯度范围内的9种肽,通过SIR进行监测,其中包括4种磷酸肽。ACQUITY Premier系统色谱图中的峰形和峰高明显更优。这一点通过峰拖尾和峰面积测量结果得到了证实,如图7和图8所示。监测的所有峰(包括非磷酸化肽峰)在ACQUITY Premier系统中均表现出较低的峰拖尾,其范围为0.01% FA流动相,12% (T6)至77% (T43pp),以及0.1% FA流动相,4% (T4)至85% (T43pp)(图7)。使用离子强度较低的流动相时,峰面积增加了11% (T14)~113% (T43pp)。使用离子强度较高的流动相时,T18肽在ACQUITY Premier系统中的峰面积没有显著变化,但T6肽的峰面积增加了212%。
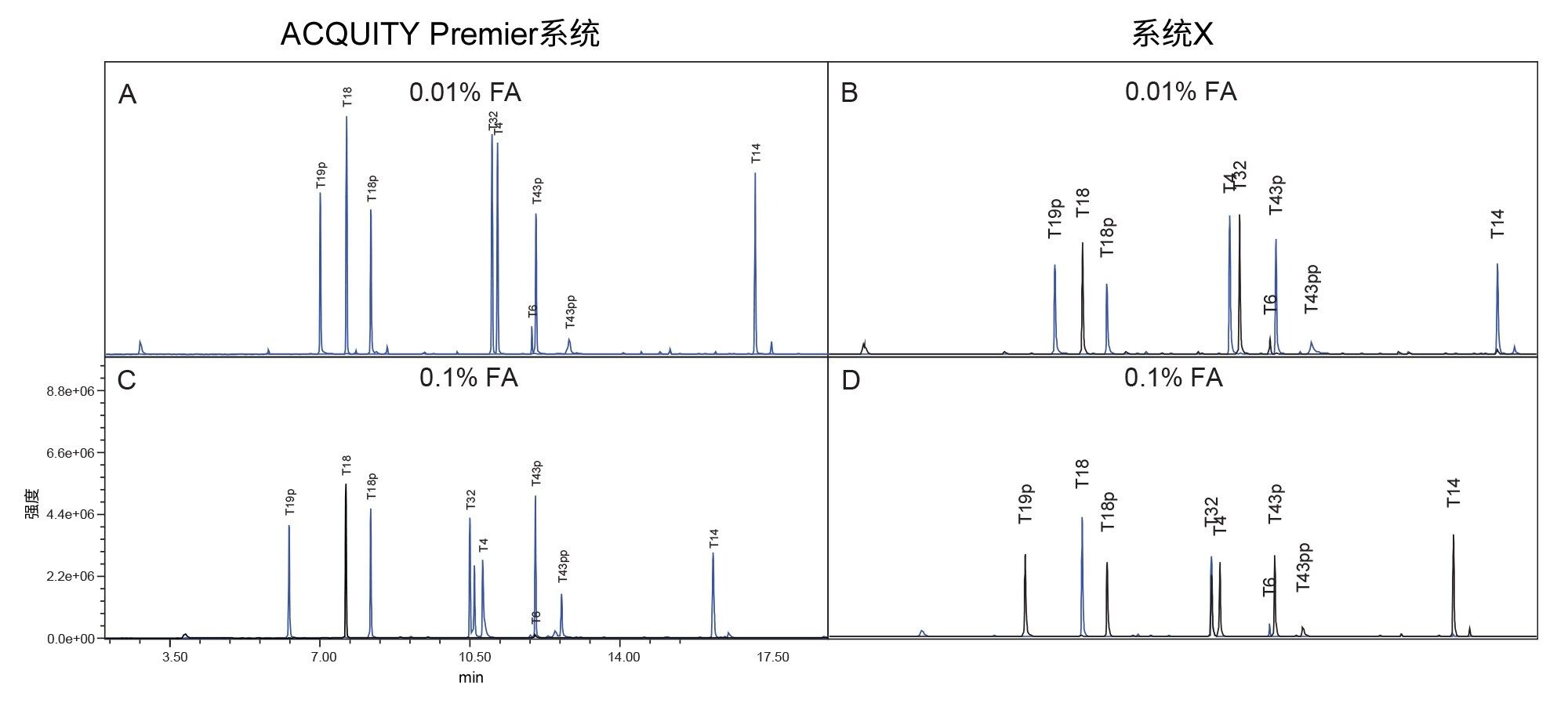
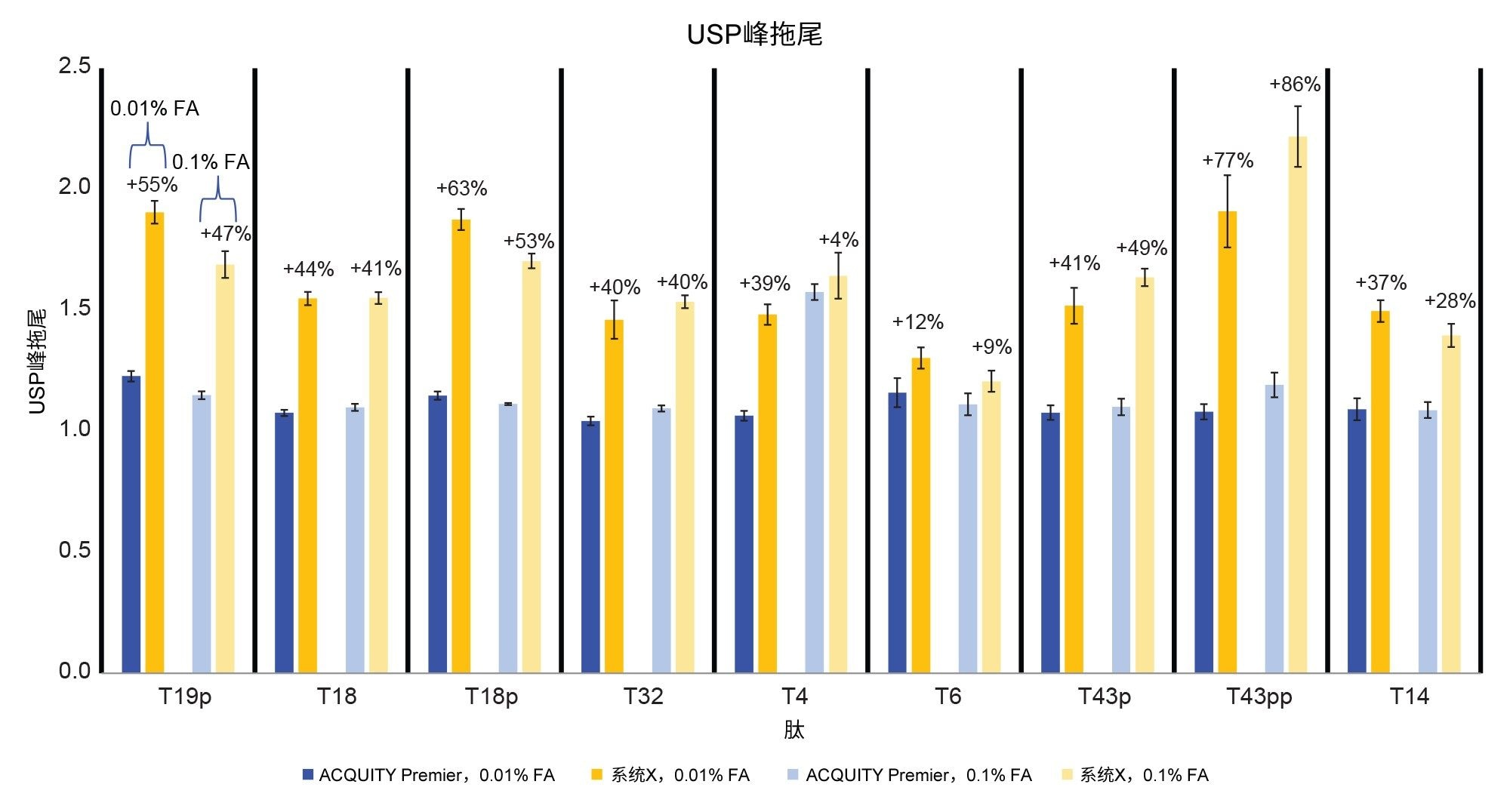
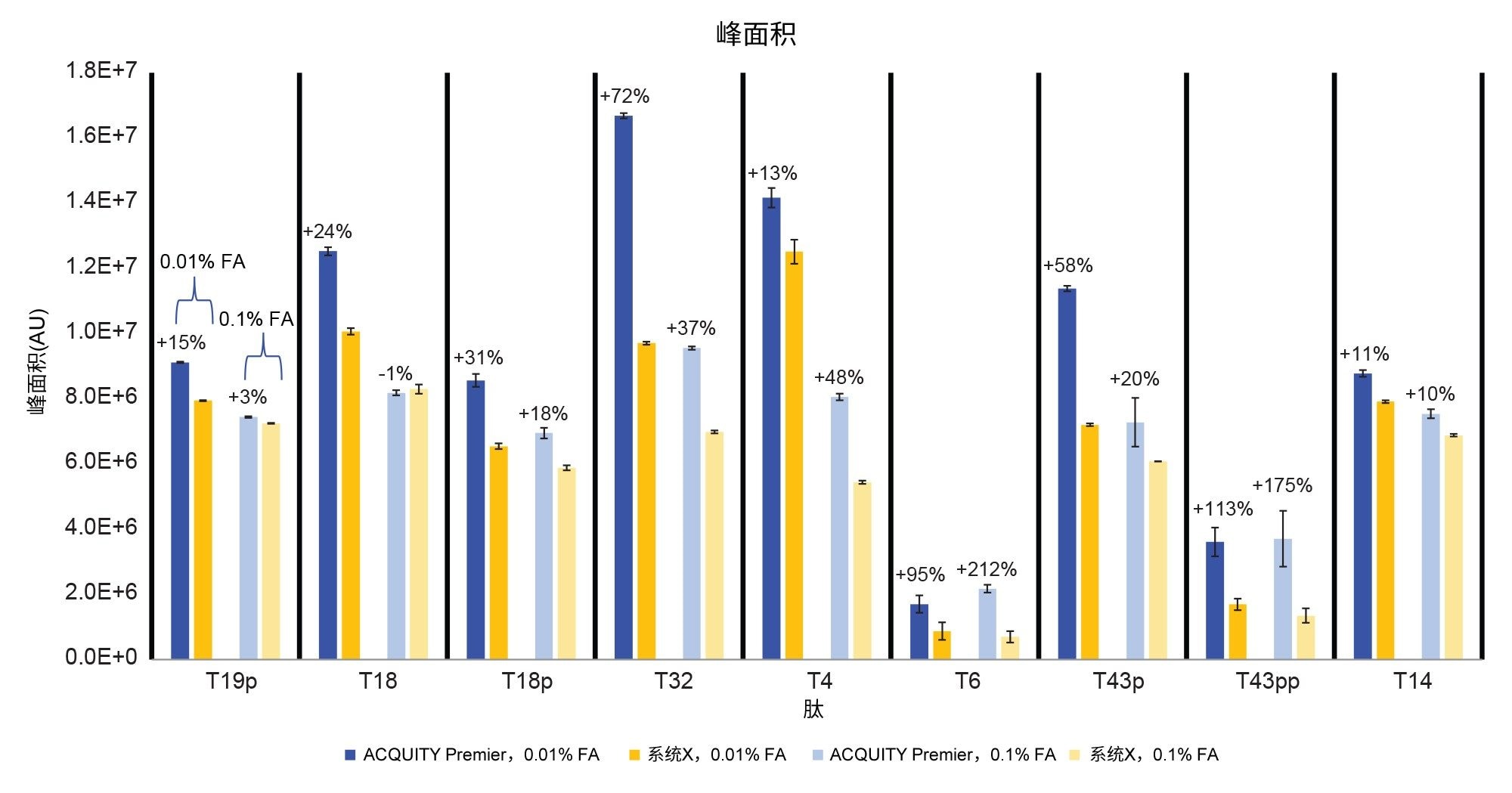
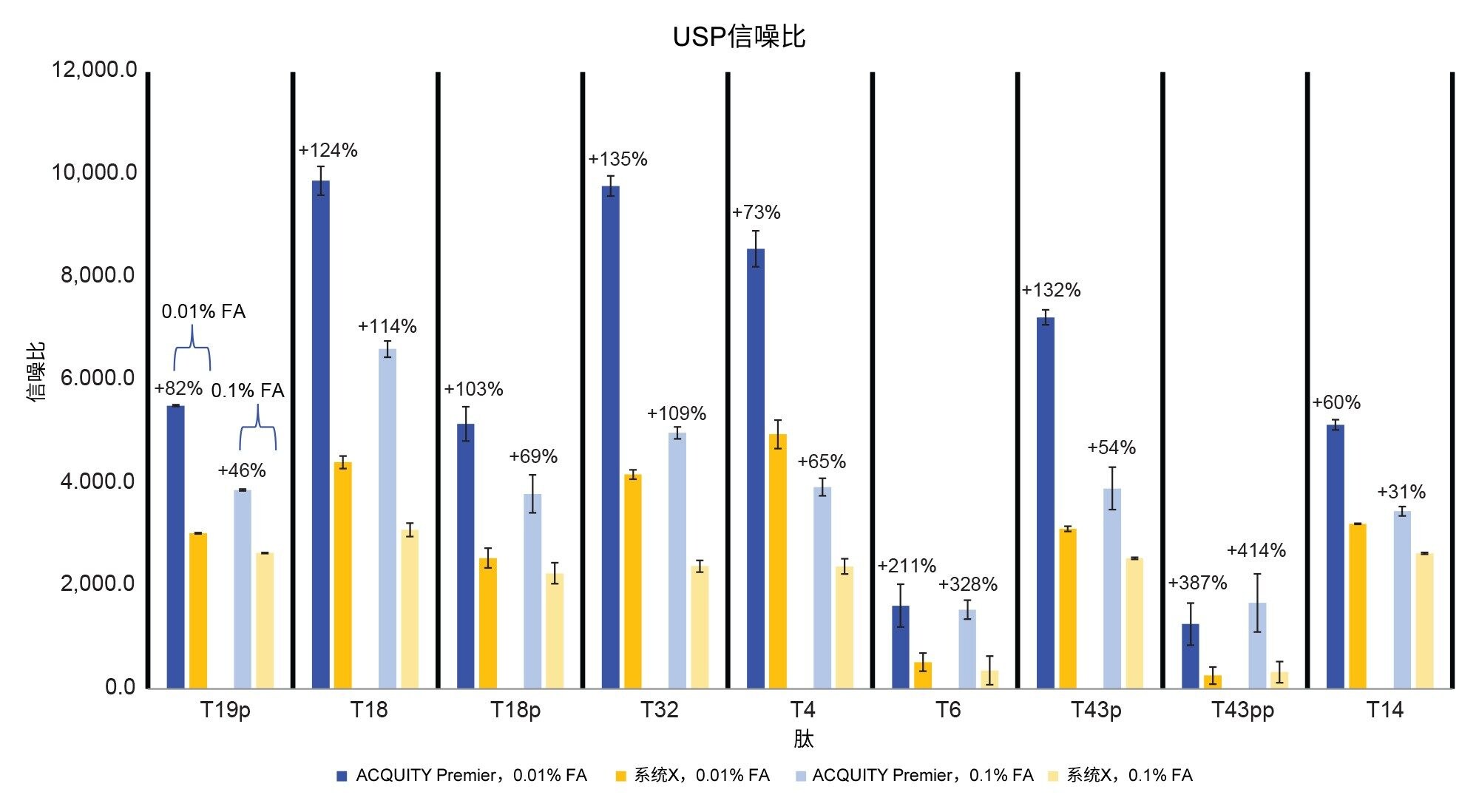
图9比较了两种系统之间的信噪比。使用高离子强度流动相时,ACQUITY Premier系统的信噪比实现了从31% (T14)到414% (T43pp)的改善。而使用低离子强度流动相时,离子强度的改善范围为60% (T14)~387% (T43pp)。在这项指标上,最大的改进体现在双磷酸化T43pp肽上,正如之前所讨论的,这种肽的含量较低,可能难以检测。总体而言,配备MaxPeak Premier色谱柱的ACQUITY Premier系统是使用质谱检测进行磷酸肽图分析研究的理想色谱解决方案。
结论
本研究使用MaxPeak Premier色谱柱在两种不同的流动相条件下对磷酸肽进行了RPLC-MS分离,将搭载MaxPeak高性能表面技术的ACQUITY Premier系统与传统的生物兼容性系统进行了比较。使用磷酸肽混标时,ACQUITY Premier系统与生物兼容系统相比,峰拖尾更小、峰面积更大,且信噪比更出色,使用低离子强度的流动相时可获得更大优势。这些改进降低了ACQUITY Premier系统的检测限。使用加标磷酸肽的胰蛋白酶烯醇酶酶解物,ACQUITY Premier系统在复杂肽图分析中对于磷酸化和非磷酸化肽的分析性能均优于生物兼容性系统。生物兼容性系统上的峰拖尾随着流动相强度的增加,可增加多达77%(T43pp,0.01% FA)和86%(T43pp,0.1% FA)。在ACQUITY Premier系统上使用低离子强度流动相时,峰面积增加了113% (T43pp),信噪比增加了387% (T43pp)。使用高离子强度流动相进行相同的测定时,则分别增加了212% (T6)和414% (T43pp)。ACQUITY Premier系统的MaxPeak HPS技术可帮助用户减少RPLC分离中的酸性流动相添加剂,同时不会如生物兼容性系统上观察到的那样影响分离质量。使用质谱进行肽分析时,这意味着离子抑制效应的减少,从而改善了信噪比,并最终降低了检测限。总体而言,有了MaxPeak HPS技术的ACQUITY Premier系统,分析人员就能够在传统生物兼容性系统难以处理的条件下,为磷酸肽等棘手化合物生成高质量的肽图。
参考资料
- Lord, J.; Bunce, C.; Brown, G. The Role of Protein Phosphorylation in the Control of Cell Growth and Differentiation.Br.J. Cancer 1988, 58 (5), 549–555.https://doi.org/10.1038/bjc.1988.256.
- Ardito, F.; Giuliani, M.; Perrone, D.; Troiano, G.; Lo Muzio, L. The Crucial Role of Protein Phosphorylation in Cell Signaling and Its Use as Targeted Therapy (Review).Int.J. Mol.Med. 2017, 40 (2), 271–280.https://doi.org/10.3892/ijmm.2017.3036.
- Separation of Phospho- and Non-Phosphopeptides Using Reverse Phase Column Chromatography.FEBS Lett. 1995, 368 (3), 452-454.https://doi.org/10.1016/0014-5793(95)00710-Q.
- Birdsall, R. E.; Kellett, J.; Yu, Y. Q.; Chen, W. Application of Mobile Phase Additives to Reduce Metal-Ion Mediated Adsorption of Non-Phosphorylated Peptides in RPLC/MS-Based Assays.J. Chromatogr.B 2019, 1126–1127, 121773.https://doi.org/10.1016/j.jchromb.2019.121773.
- Núñez, O.; Lucci, P. Applications and Uses of Formic Acid in Liquid Chromatography-Mass Spectrometry Analysis; 2014; pp 71–86.
- Reed, C. E.; Simeone, J.; Hong, P. 展示ACQUITY Premier二元系统在长时间缓梯度肽图分析中的适用性.沃特世应用纪要, 720007631ZH. 2022.
- Dao, D.; Koshel, B. M.; Birdsall, R. E.; Yu, Y. Q. 缓梯度条件下肽图分析的保留时间重复性.沃特世应用纪要, 720007086ZH. 2020.
- Simeone, J.; Hong, P.; McConville, P. R. ACQUITY UPLC I-Class PLUS系统运行长时间缓梯度时的分析性能.沃特世应用纪要, 720006290ZH. 2018.
- MassPREP烯醇酶酶解磷酸肽混标。
720008136ZH,2023年12月