考察色谱柱重现性:使用三个历史批次的1.8 µm HSS T3固定相分析血清中的内源性类固醇激素
摘要
通过给定分析测试固定相的批次间性能是一种常见的方法稳定性实验1-3。 使用可重现的色谱柱是保证测试成功并确保长期分析性能的关键。为证明沃特世色谱柱填料的重现性,我们使用在五年内生产的三批ACQUITY UPLC HSS T3进行了内源性类固醇激素分析。保留时间、峰面积、峰宽和峰对称性的%RSD值都保持在较低水平,表明HSS T3固定相的重现性高,新旧批次之间几乎不存在色谱差异。
优势
- 三个历史批次的HSS T3材料的批次间性能相当
- 使用固相萃取法取代蛋白沉淀法,搭配ACQUITY UPLC HSS T3色谱柱,改善分析物信号和检测性能
简介
使用高质量产品,尤其是液相色谱(LC)固定相和色谱柱,能够确保生成的分析数据在长时间内始终准确且可重现。液相色谱固定相的质量可以通过给定分析的批次间重现性测试来评估,确保生产的每批材料性能相近。大多数批次间测试是使用在一段时间内生产的三批材料进行的,例如方法验证包中的材料。这些材料虽然好用,但它们可能只能对产品的整体质量提供大致了解。为获取全面了解,应测试不同历史批次的材料,才能提供更全面的整体产品质量信息。
ACQUITY HSS T3固定相是一种常用的C18键合相,采用了全多孔硅胶颗粒。这款固定相比传统C18能更好地保留极性分析物,同时不会影响疏水化合物的分离。许多应用和出版刊物中都使用该固定相进行分离,从小分子药物制剂到生物分析应用均有涉及4-6。 为证明HSS T3材料的质量,用不同批次的材料分别填充三根色谱柱。这些材料的生产时间相隔五年(2016年~2021年)。使用这三根色谱柱分离人血清中的内源性类固醇激素,评估色谱柱数据的重现性。
实验
样品描述
对人血清进行固相萃取(SPE)和蛋白沉淀(PPT)处理。PPT使用乙腈(3:1乙腈:血清)进行。将样品涡旋、离心并取出上清液用于分析。SPE使用Oasis HLB 1 cc 30 mg小柱(部件号:WAT094225)。如文献7中所述,将吸附剂用甲醇活化、用水平衡。 在通用SPE条件下使用100%乙腈进行洗脱。洗脱液于60 °C氮气环境中干燥,然后用100 µL Milli-Q水复溶留待分析。
液相色谱条件
|
液相色谱系统: |
ACQUITY UPLC I-Class PLUS,配备二元溶剂管理器(BSM)、流通针式样品管理器(SM-FTN)和PDA检测器 |
|
检测: |
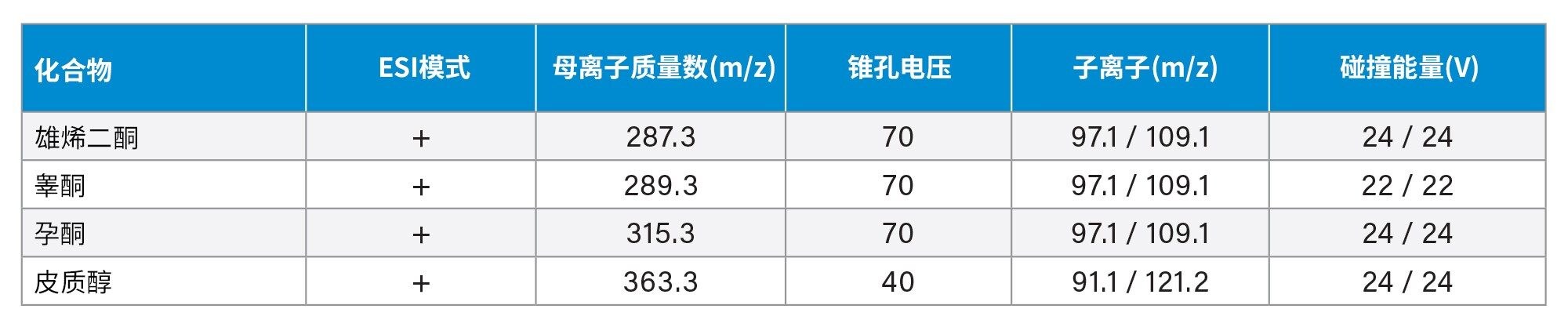
血清激素的MRM见表1 |
|
色谱柱: |
ACQUITY UPLC HSS T3 1.8 μm, 2.1 x 50 mm(部件号:186009467) 三(3)批材料: 189 – 2016年10月生产 233 – 2019年11月生产 270 – 2021年11月生产 |
|
柱温: |
30 °C |
|
样品温度: |
10 °C |
|
进样体积: |
5.0 µL |
|
流速: |
0.6 mL/min |
|
流动相A: |
含0.1%甲酸的Milli-Q水溶液 |
|
流动相B: |
0.1%甲酸的乙腈溶液 |
|
梯度曲线: |
流动相B在5.0分钟内从5%增加到95%,并在95%流动相B条件下保持0.5分钟。 |
质谱条件
|
质谱系统: |
Xevo TQ-S micro |
|
电离模式: |
ESI+ |
|
采集范围: |
MRM见表1 |
|
毛细管电压: |
3.0 kV |
|
锥孔电压: |
依具体分析物而定(表1) |
|
脱溶剂气温度: |
500 °C |
|
脱溶剂气流速: |
500 L/h |
|
锥孔气流速: |
10 L/h |
数据管理
|
色谱软件: |
MassLynx 4.1版 |
结果与讨论
在色谱柱测试之前,评估了两种不同的样品前处理技术以优化分析。对人血清样本进行PPT和SPE处理。实验部分概述的SPE方案使用Oasis HLB 1 cc 30 mg小柱,本实验未进一步优化。在通用SPE条件下证明SPE与PPT相比的有效性。优化SPE方案可以进一步改善信号。两种样品前处理技术均使用单批次的ACQUITY UPLC HSS T3色谱柱(1.8 µm, 2.1 x 50 mm)进行分析,以评估预期分析物的质谱(MS)信号强度。图1显示了在血清中检测类固醇激素的SPE与PPT结果对比图。
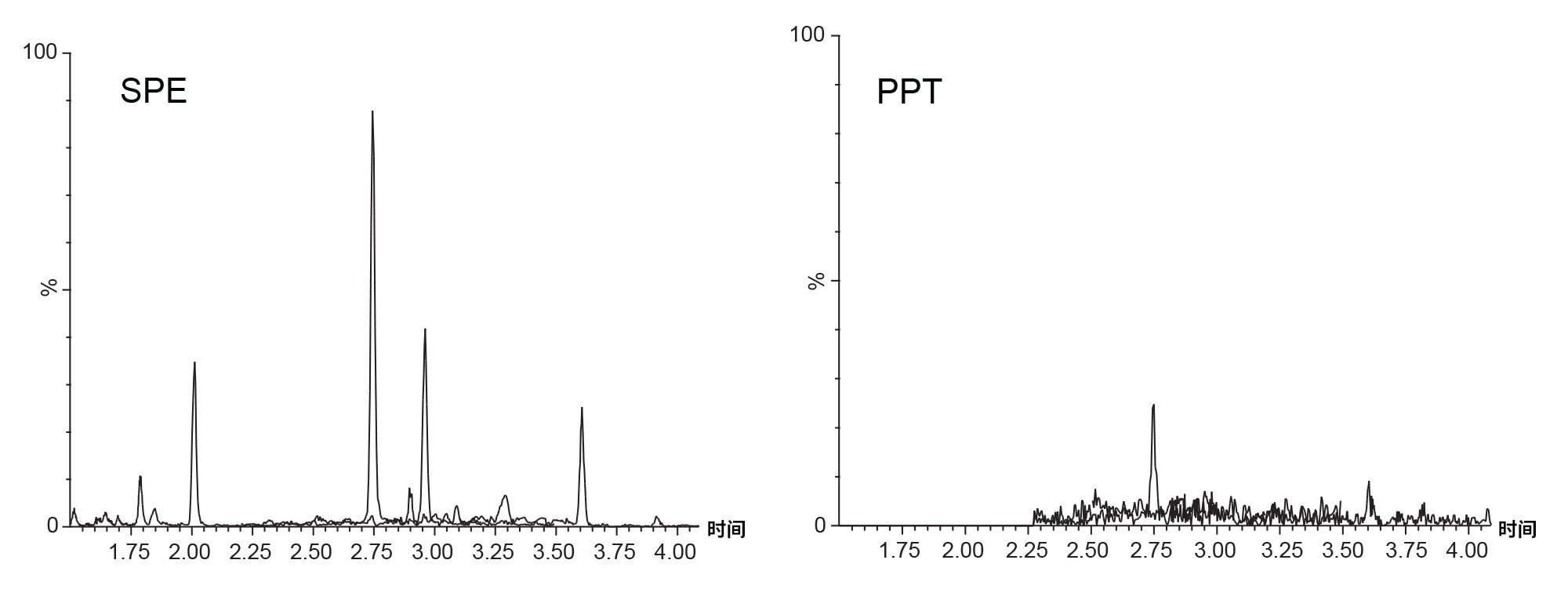
我们考察了血清中的一组潜在类固醇8。 在这些条件下,SPE后检出的四种类固醇激素信号>1e5。其余类固醇未检出。使用类固醇混标和所述的测试条件进行峰鉴定。PPT后的结果显示只有两种类固醇激素(睾酮和皮质醇),且信号强度与SPE相比明显更弱。PPT后未检出雄烯二酮和孕酮。SPE产生的皮质醇信号增加5倍,睾酮信号增加约30倍。这不仅更容易检出峰,还降低了分析的LOD和LOQ,并且可以为SPE回收率研究提供更宽的动态范围。SPE还通过去除磷脂和其他棘手化合物来产生更洁净的样品9,10。更洁净的样品有助于降低仪器和色谱柱的污染率,同时还可以减少离子抑制或增强等基质效应。使用SPE作为样品前处理方法,继续进行色谱柱比较。
通过SPE现配新鲜样品用于评估三个历史批次的ACQUITY UPLC HSS T3 1.8 µm材料。这些批次的生产时间跨度长达五年,最早的批次是在2016年10月生产和测试的。其余批次分别于2019年11月和2021年11月生产。图2展示了四种内源性类固醇在三根色谱柱上的色谱图。在每根色谱柱上重复进样(n=3)血清,每次进样前后有两个空白样品,确保没有系统残留。
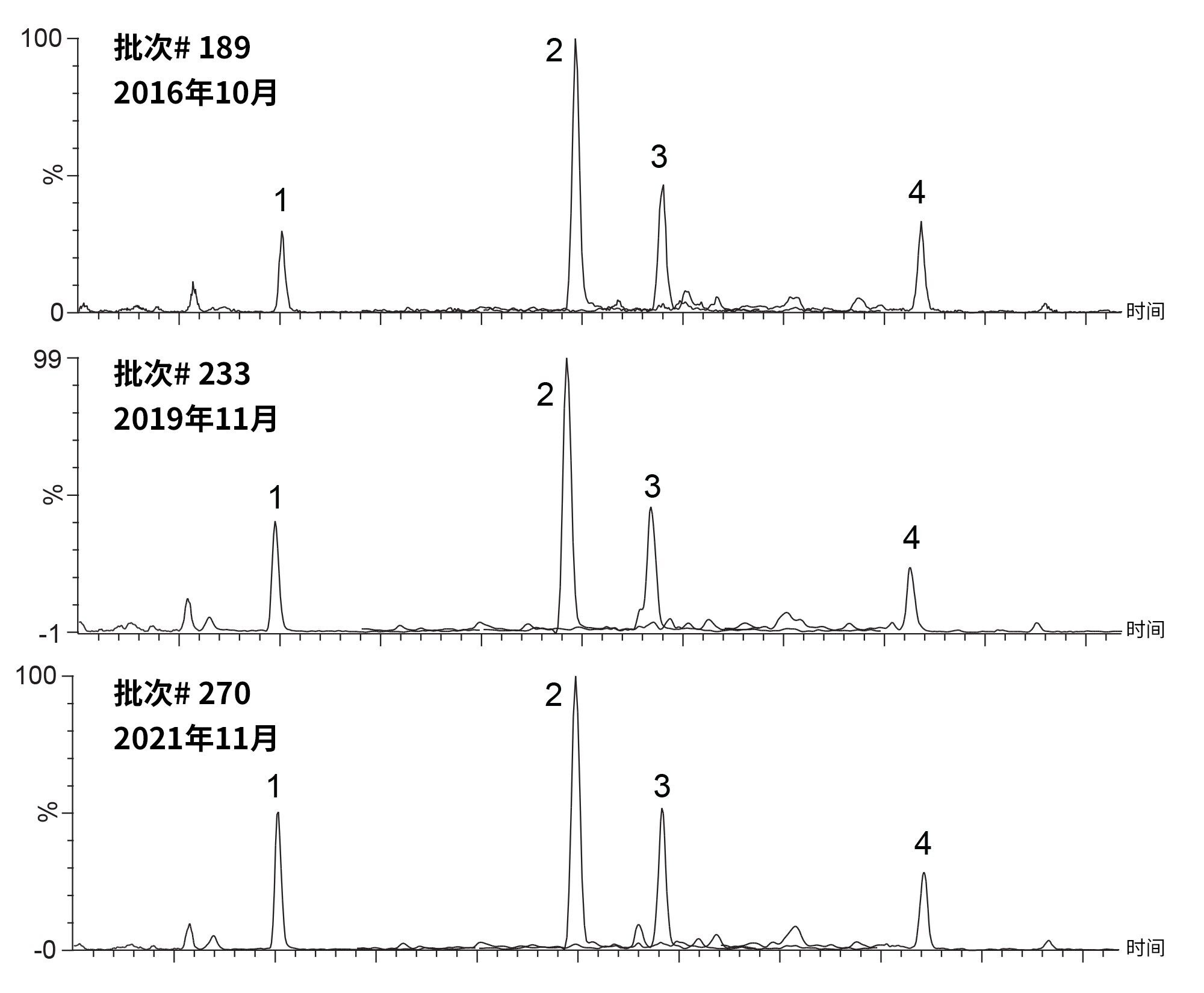
1)皮质醇、2)睾酮、3)雄烯二酮、4)孕酮。
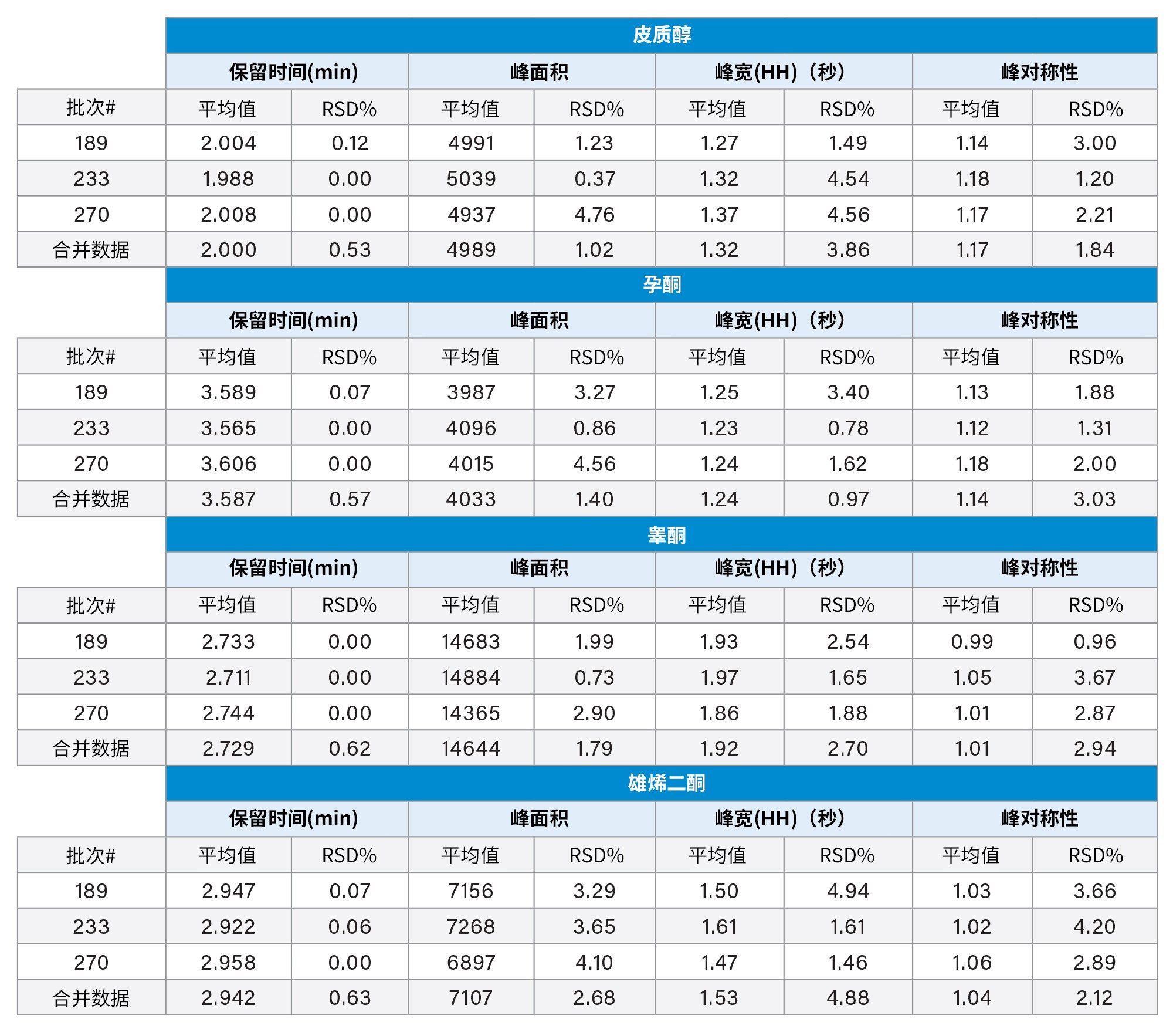
这三根色谱柱分析内源性类固醇的结果相当。监测和评估这三根色谱柱以及合并数据样本的峰保留时间、峰面积、峰宽和峰对称性,结果见表2。每根色谱柱(n=3)以及合并数据集(n=9)上所有探针的保留时间%RSD<1%。峰面积重现性良好,每根色谱柱以及合并数据样本的%RSD <5%。(半高)峰宽和峰对称性的%RSD值同样较低。
本次实验的材料生产时间跨度长达五年,仍获得了良好的批次间重现性。使用具有这种重现性水平的材料能够确保实验在长达数年的有效期内保持相同的性能。沃特世色谱柱通过严格的质量控制和生产工艺达到这种重现性水平,确保使用这些色谱柱生成的数据具有非常高的质量。
结论
为证明沃特世颗粒和色谱柱生产工艺的质量,我们使用在五年间生产的三批ACQUITY HSS T3固定相来分离人血清中的内源性类固醇激素。重现性测试的所有样品前处理均使用SPE进行。
这三个批次展示出可重现的色谱性能。每根色谱柱以及合并数据集(n=9)的保留时间%RSD值均<1%。此外,每种检测到的分析物的峰面积、峰宽和峰对称性的%RSD均<5%。实验结果表明,即使所用材料的生产时间相隔五年,仍然可以生成相同质量的数据。这有助于保证数据质量常年保持稳定,对开发新方法非常有用。如果确定选择的固定相能在不同生产批次以及不同生产年份中发挥相同性能,就能延长实验有效期,且无需额外返工。
致谢
非常感谢Jonathan Danaceau、Chelsea Plummer、Jonathan Turner和Kim Haynes审阅本应用纪要并提供宝贵的反馈意见。
参考资料
- Heyden YV, Nijhuis A, Smeyers-Verbeke J, Vandeginste BGM, Massart DL.Guidance for Robustness/Ruggedness Tests in Method Validation.Journal of Pharmaceutical and Biomedical Analysis.2001.723–753.
- Vervoort RJ, Ruyter E, Debets A, Claessens HA, Cramers C, de Jong GJ.Influence of Batch-To-Batch Reproducibility of Luna c18 (2) Packing Material, Nature of Column Wall Material, and Column Diameter on the Liquid Chromatographic Analysis of Basic Analytes.Journal of Separation Science. 2001.167-172.
- Summers M, Fountain K. Validation of a Method for the Separation of Ziprasidone and Its Degradants using Empower 2 with Method Validation Manager (MVM).Waters Application Note, 720004077, 2011.Accessed 10-Jan-2022.
- New LS, Chan ECY.Evaluation of BEH C18, BEH HILIC and HSS T3 (C18) Column Chemistries for the UPLC-MS-MS Analysis of Glutathione, Glutathione Disulfide, and Ophthalmic Acid in Mouse Liver and Human Plasma.Journal of Chromatographic Science.2008.209-214.
- Mohamed, M. Stability Indicating New RP-UPLC Method for Simultaneous Determination of a Quaternary Mixture of Paracetamol, Pseudoephedrine, Chlorpheniramine, and Sodium Benzoate in (Cold-Flu) Syrup Dosage Form.Journal of AOAC International. 2022.
- Sottani C, Grignani E, Cottica D, et.al.Development and Validation of a Bioanalytical UHPLC-MS/MS Method Applied to Murine Liver Tissue for the Determination of Indocyanine Green Loaded in H-Ferritin Nanoparticles.Frontiers in Chemistry 2022.
- Elmongy H, Masquelier M, Ericsson M. Development and Validation of a Uhplc-Hrms Method for the Simultaneous Determination of the Endogenous Anabolic Androgenic Steroids in Human Serum.Journal of Chromatography A.2019.1613.
- Foley D, Carlton LJ.Confidence in Your Calibrators: Confidence in Your Calibrators: MassTrak Endocrine Steroid Calibrators and Quality Control Sets for the LC-MS/MS Analysis of Steroid Hormones.Waters Application Note, 720007401, 2021.Accessed 10-Jan-2021.
- Zhang X, Danaceau JP, Chambers EC.Quantitative Analysis of THC and its Metabolites in Plasma Using Oasis PRiME HLB for Toxicology and Forensic Laboratories.Waters Application Note, 720005820, 2019.Accessed 13-Jan-2022.
- Zhang X, Danaceau JP, Chambers EC.使用Oasis PRiME HLB简单、快速地从全血中获得洁净的合成大麻素萃取液.沃特世应用纪要, 720005417ZH, 2015.2022年1月14日访问.
720007529ZH,2022年2月