在内部实验室和外部合同机构之间转移方法是生物制药分析方法开发的重要组成部分。发送和接收实验室面临以下挑战:各实验室根据各自的时间表随着旧仪器的淘汰而不断更新仪器,这些实验室拥有来自不同供应商的仪器。无论这些差异如何,两家实验室产生的所有数据都必须被证明具有可比性。尽管开发和质量控制实验室替换现有技术的速度可能很慢,但在方法生命周期管理过程中,现代技术可以使传统方法和未来的开发活动获益。Arc Premier系统作为一款现代UHPLC推出,还可以支持过去在HPLC平台上运行的更多常规分析。从Alliance HPLC系统迁移方法时,质量控制过程常用的两种分析方法(体积排阻和离子交换色谱法)表现出高重现性结果。两个平台之间的保留时间和峰面积百分比差异可以忽略不计,使人们相信传统方法可以被成功复制到Arc Premier系统上。为进一步利用更加现代化的UHPLC技术,还更新了色谱柱填料,通过改善色谱性能来实现更可靠的定量。
由于生物制药产品的生命周期长达数年,因此分析方法稳定可靠对于确保产品质量至关重要。这些方法进一步要求分析所用的仪器平台和色谱柱填料能够提供一致的结果。在生物制药领域,体积排阻色谱(SEC)和离子交换色谱(IEX)是评估单克隆抗体(mAb)产品质量的两种常用分析方法。由于传统方法需要在内部和外部实验室之间转移,因此无论发送实验室与接收实验室之间的环境因素可能有哪些不同,重现这些方法都至关重要。
本研究考察了SEC和IEX方法从Alliance HPLC系统(一款行业标准不锈钢HPLC系统)到Arc Premier系统(一款现代UHPLC平台)的迁移。Arc Premier系统采用MaxPeak高性能表面(HPS)技术,这项技术专为减少金属敏感分析物在金属表面的不必要吸附而开发1。尽管已证明该技术对RPLC和HILIC分析有利(由于分析物和金属表面的固有电荷特性,因此在流动相离子强度高的SEC和IEX中通常无法检出),但我们还需要让新技术可以更广泛地部署并支持现有方法。证明传统SEC和IEX方法成功实现方法迁移后,将更新的色谱柱填料与Arc Premier系统结合使用,以展示现代技术既可以支持传统方法,又可以提供优于这些常规方法的明显优势。
按照美国药典<129>关于SEC实验的的规定,用流动相制备浓度为10 mg/mL的曲妥珠单抗制剂。而IEX实验则将曲妥珠单抗用水稀释至1 mg/mL。每次临分析前新制样品。
|
液相色谱系统: |
配备2489紫外/可见光检测器的Alliance HPLC系统 配备2489紫外/可见光检测器的Arc Premier系统 |
|
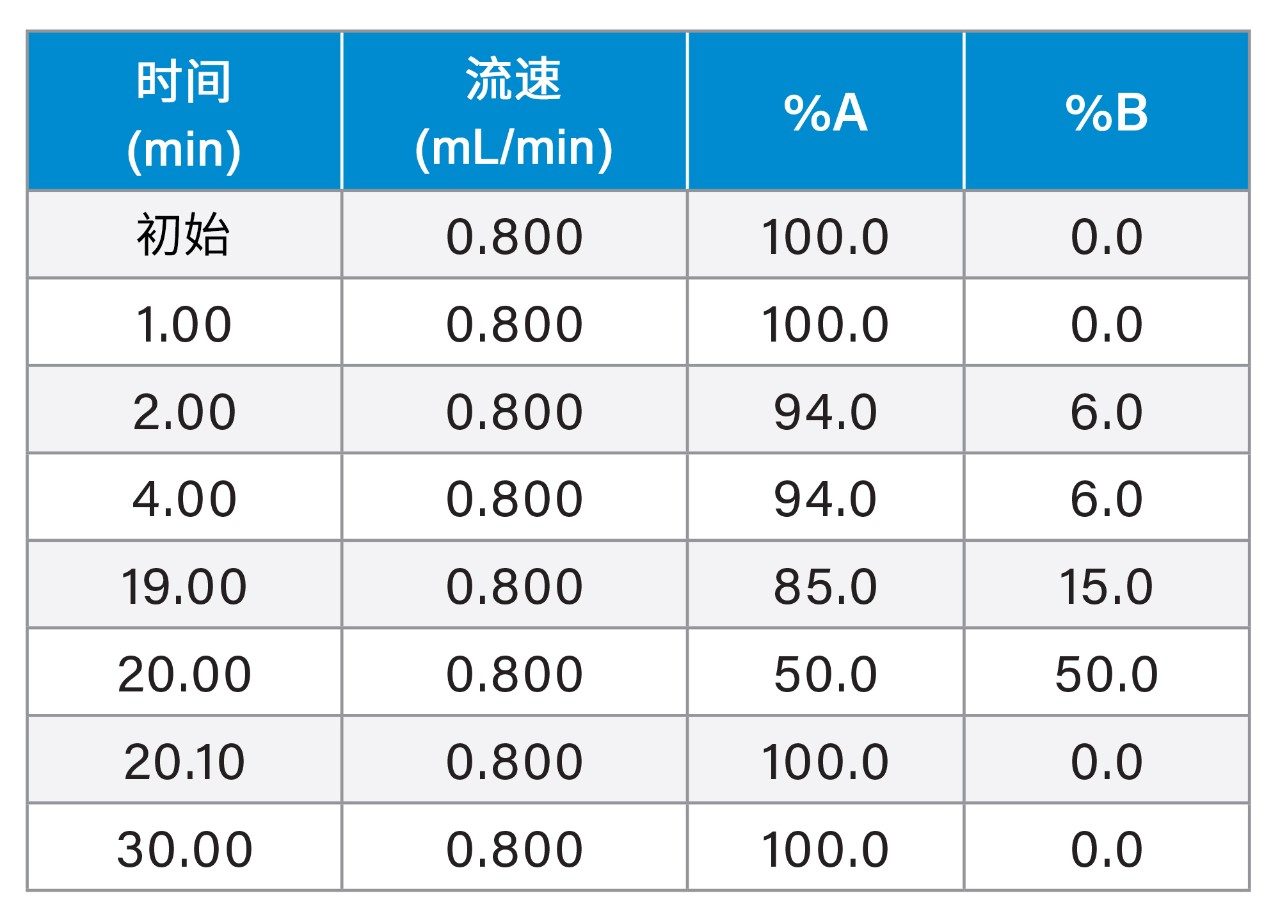
SEC |
|
|
色谱柱: |
BioSuite Diol (OH)色谱柱, 250 Å, 5 µm, 7.8 x 300 mm,USP分类L59(部件号:186002165) BioResolve SEC mAb色谱柱,200 Å, 2.5 µm, 7.8 × 300 mm(部件号:186009441) |
|
波长: |
280 nm |
|
进样体积: |
20 µL |
|
柱温: |
室温 |
|
流速: |
0.500 mL/min |
|
流动相: |
200 mM磷酸钾缓冲液,250 mM KCl,pH 6.2 |
|
方法: |
等度运行时间30 min |
|
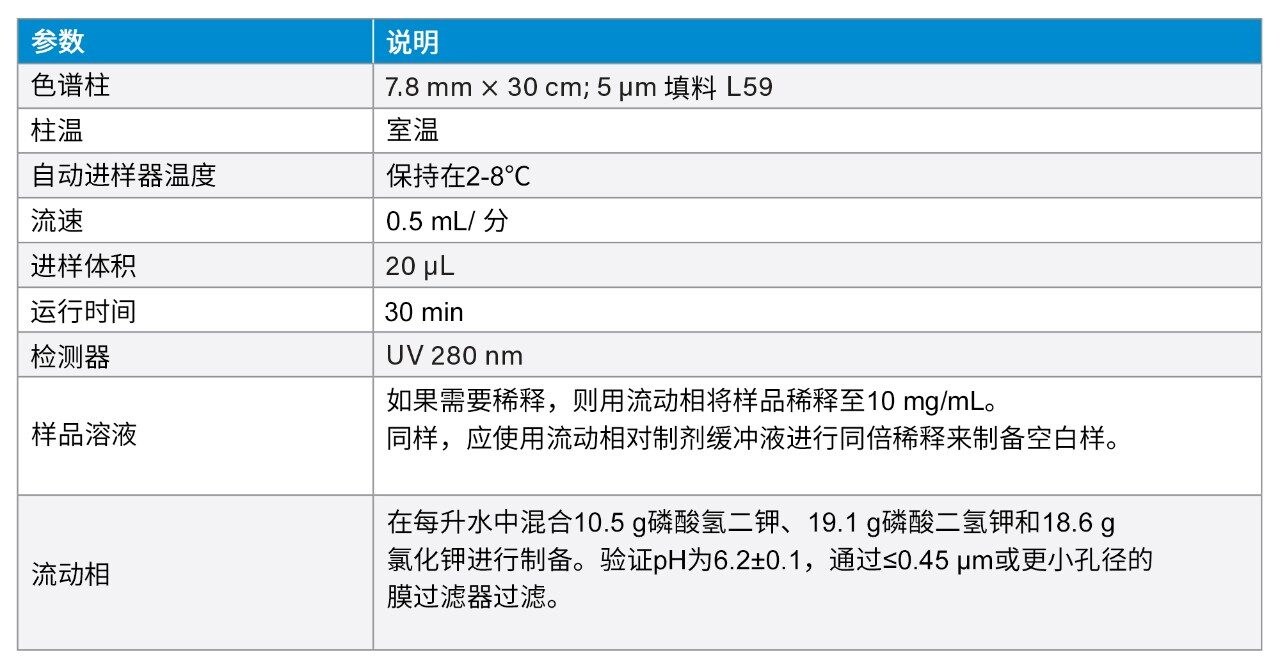
色谱柱: |
Protein-Pak Hi Res CM, 7 µm, 4.6 × 100 mm(部件号:186004929) Protein-Pak Hi Res SP, 7 µm, 4.6 × 100 mm(部件号:186004930) BioResolve SCX mAb, 3 µm, 4.6 × 100 mm(部件号:186009060) |
|
波长: |
280 nm |
|
进样体积: |
20 µL |
|
柱温: |
25 °C |
|
流动相A: |
20 mM MES缓冲液,pH 6.6 |
|
流动相B: |
20 mM MES缓冲液,pH 6.6,1 M NaCl |
Empower 3 FR4色谱数据软件
在mAb的开发和质量控制中,SEC是研究大小异构体(例如高分子量物质(HMWS)或聚集体)的理想方法。mAb会因为其固有特性或生产和储存过程中的外部因素而发生聚集,从而导致免疫原性增加。传统SEC方法使用大粒径色谱柱和系统扩散高的HPLC系统,为HMWS和单体峰提供了足够高的分离度。虽然也存在低分子量物质(LMWS),但毛细管电泳过去就可以对这类物质实现更可靠的定量,因为HPLC方法所提供的分离度不足。SEC技术的进步虽然已经可以对LMWS提供更出色的分离度,但随着新型液相色谱平台被纳入不断发展的实验室环境,这些系统继续支持传统方法并与传统液相色谱平台生成相同的结果仍然很重要。
为评估传统SEC方法,本研究根据USP <129>(提供了利用SEC、毛细管电泳和寡糖分析对mAb进行纯度评估的分析程序)选择了方法条件。SEC条件汇总见表1,这些条件在使用时未对提出的方法进行任何更改。在Alliance HPLC系统和Arc Premier系统上运行一系列进样,将曲妥珠单抗进样六次。代表性色谱图表明,采用两种平台获得了相似的谱图(图1)。
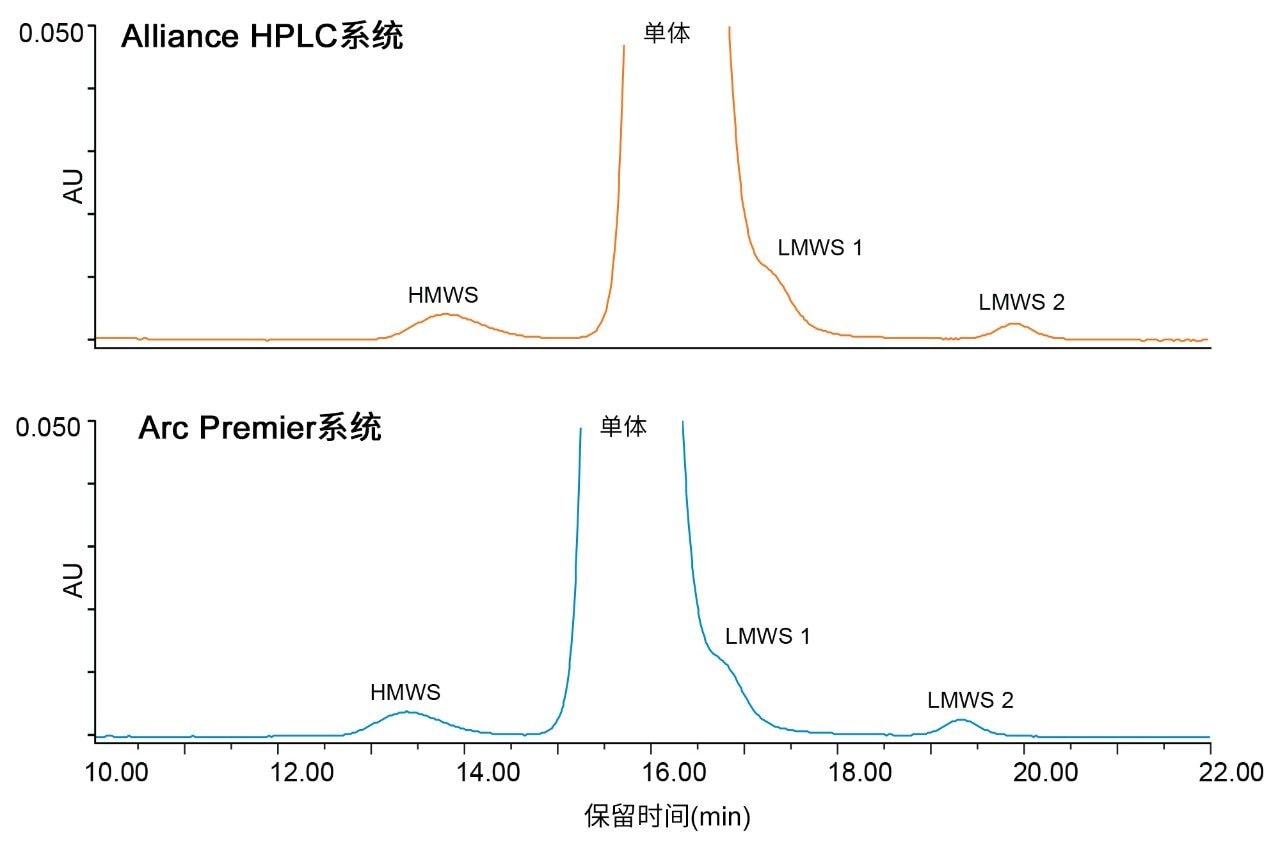
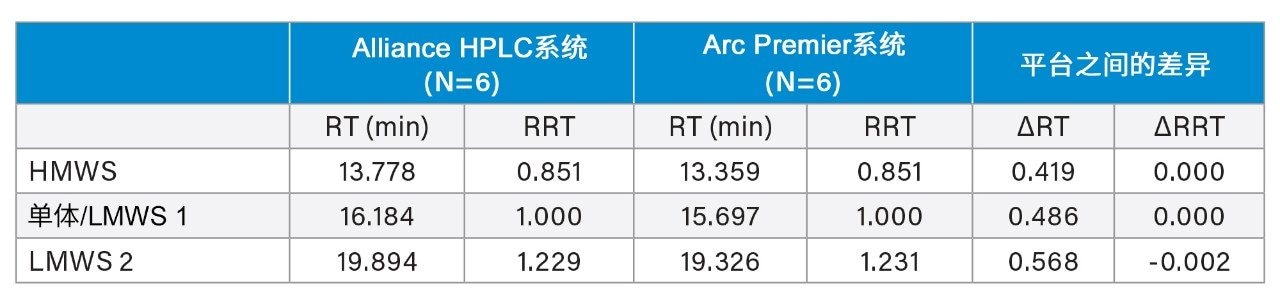
本研究进一步比较了保留时间和峰面积以验证方法等效性。表2列出了在各液相色谱平台上进样六次所得到的HMWS、单体和LMWS 2(LMWS 1与单体峰共流出)的平均保留时间和相对保留时间。两套系统所得各个峰的保留时间差异小于0.6 min。为说明保留时间漂移,还报告了相对保留时间的差异,结果可以忽略不计。不同平台之间的峰面积也保持一致(表3)。在六次进样中,两种平台得到的单体峰的峰面积差异不大于0.07%。HMWS和LMWS 2的丰度非常低,但也得到可靠定量,峰面积差异分别为0.064%和0.006%。此外,在单个液相色谱平台上获得的结果也具有重复性。任一平台上所有峰的%RSD均不超过2%。保留时间和峰面积的组合表明,Arc Premier系统产生的结果与传统液相色谱系统一致。
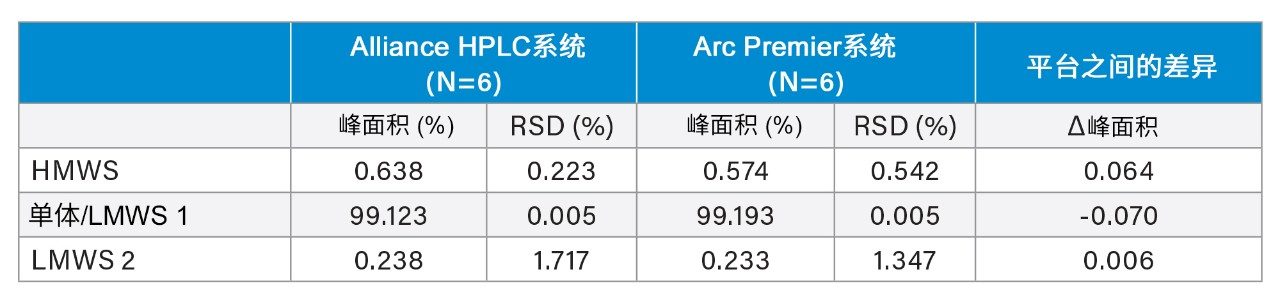
为测试Arc Premier系统更广泛的适用性,还评估了IEX,作为在QA/QC环境中执行的常规分析。IEX是一种基于电荷的分离,可以定量分析酸性和碱性杂质,传统方法常使用盐梯度(相对于pH梯度而言)洗脱这类杂质。由于IEX方法需要针对具体分析物进行优化,因此不存在提供更通用的方法建议的指南文件。首先在Alliance HPLC系统上使用Protein-Pak Hi Res CM色谱柱(7 µm, 4.6 × 100 mm)优化IEX方法条件,以此代表使用传统液相色谱系统和色谱柱技术的方法。在Alliance HPLC系统和Arc Premier系统上,将1 mg/mL曲妥珠单抗进样六次,比较结果。观察到两种平台得到的色谱图高度相似(图2)。如预期一样,由于延迟体积的系统差异(Alliance HPLC系统:1050 µL;Arc Premier系统:950 µL),观察到保留时间漂移。尽管传统方法通常使用较长的梯度/运行时间,但此处使用的方法运行时间较短,因为色谱图以及酸性和碱性变体的归属与内部实验室获得的历史结果相匹配2,3。
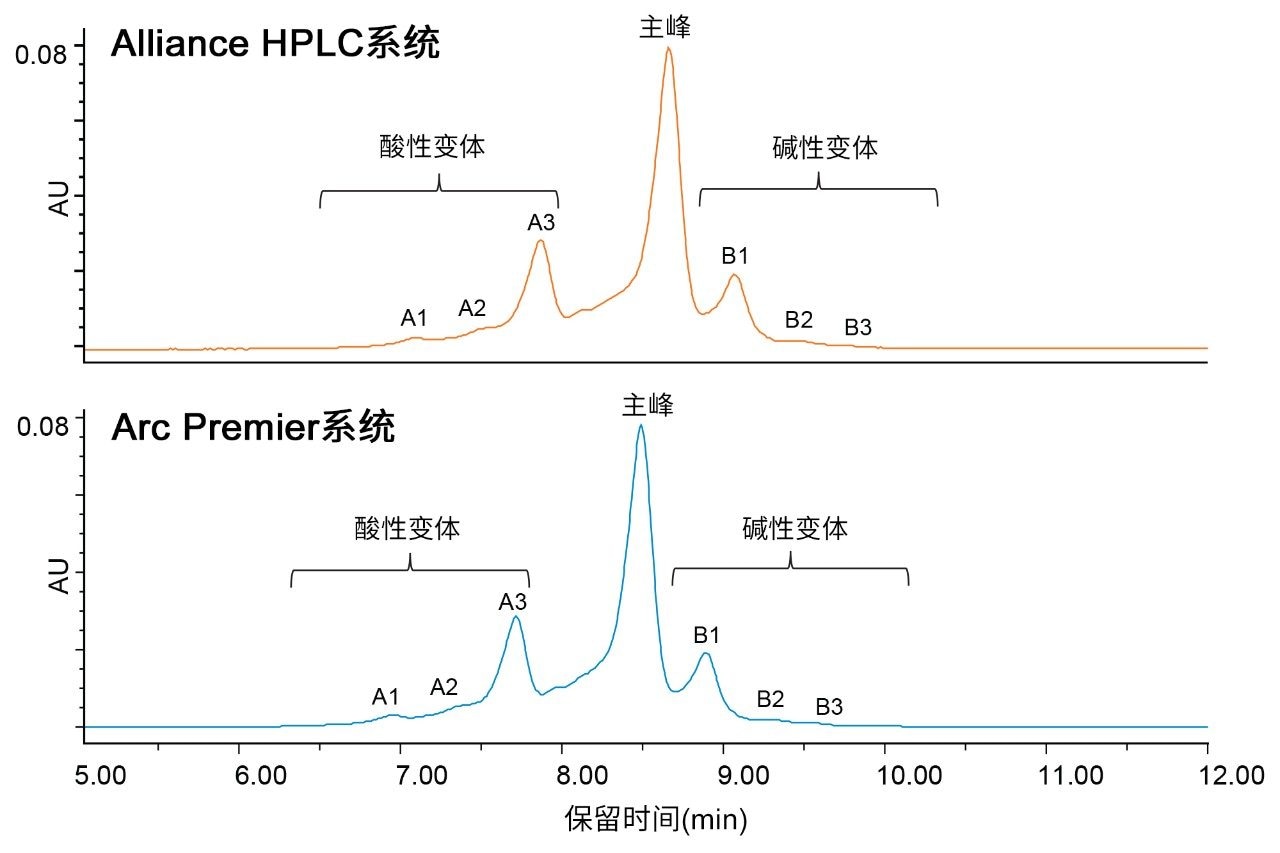
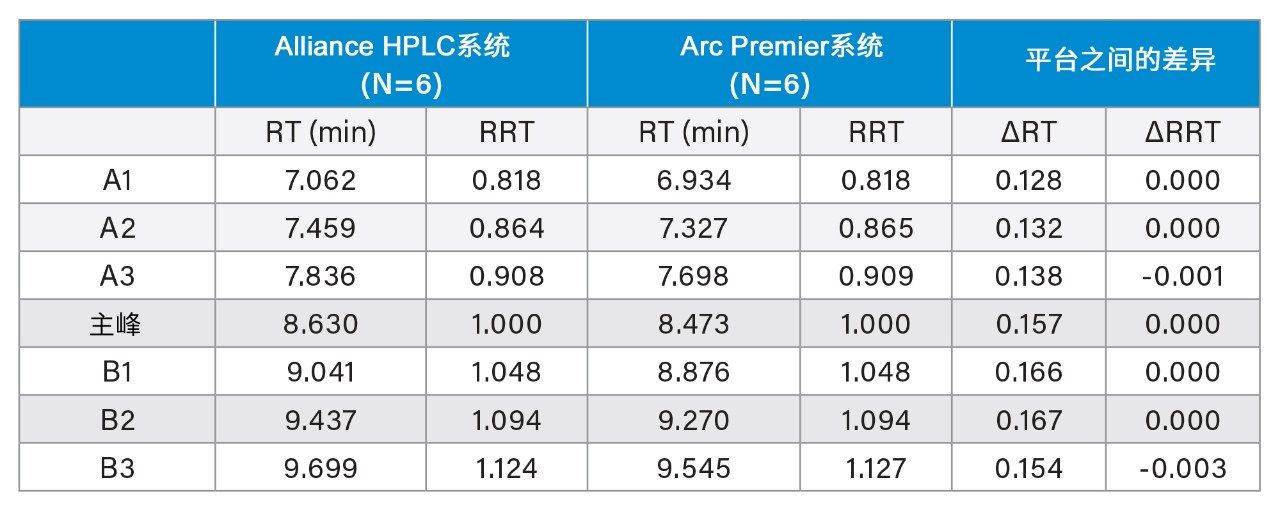
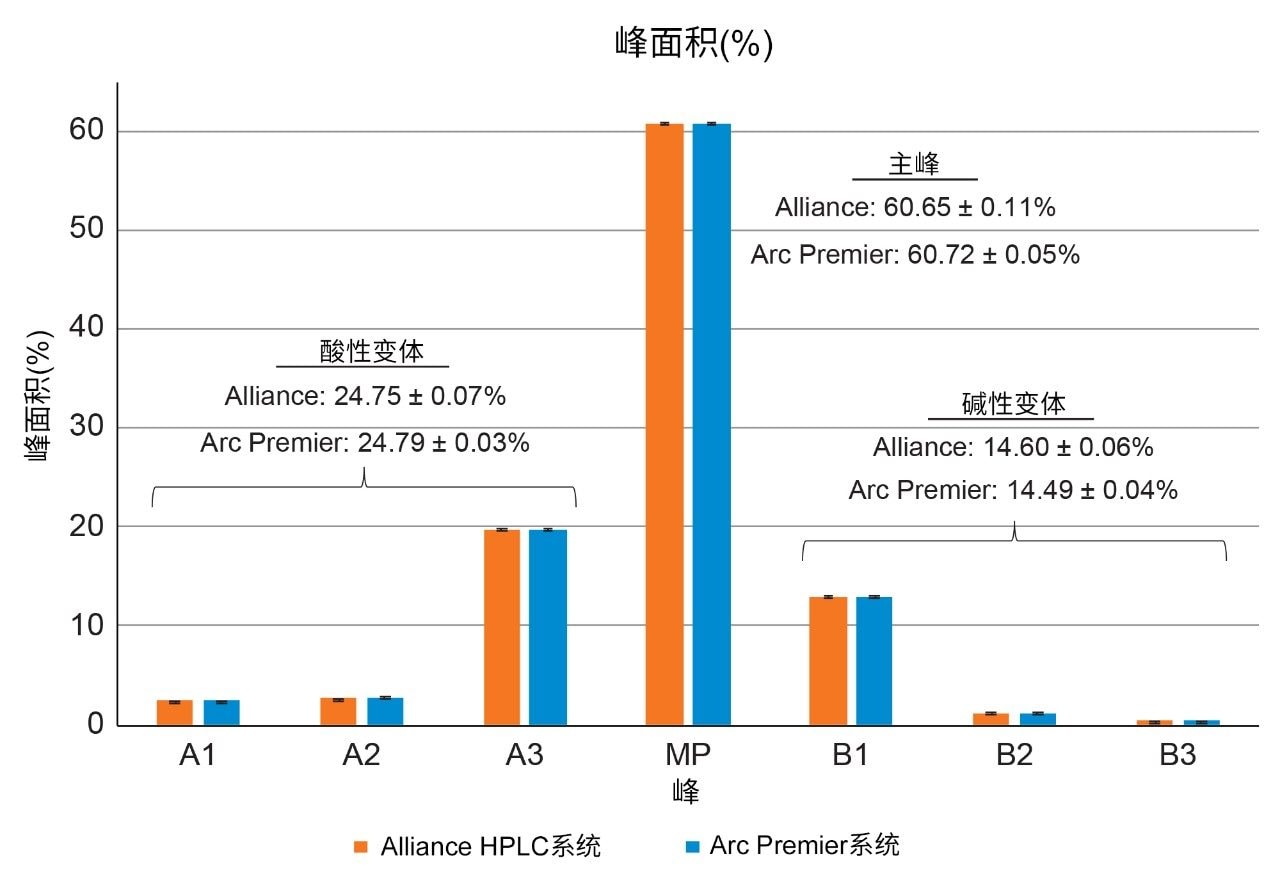
为进一步评价液相色谱平台的结果,表4列出了在图2中鉴定出的七个峰的保留时间和相对保留时间。保留时间的平均差异为0.149 min,与两种平台之间的延迟体积差异一致(0.149 min × 0.8 mL/min = 0.126 mL)。通过报告相对保留时间来校正这种差异,该差异可忽略不计。这七个相同峰的相对峰面积也高度相似,其中单独报告的峰在彼此的误差范围内(图3)。报告所有酸性变体和碱性变体时,两种平台之间的结果差异分别在0.04%和0.11%以内。Alliance HPLC系统和Arc Premier系统分别产生了可重复的数据,两种平台的比较也证明由它们获得的结果相当。
通过替换传统液相色谱平台并将更加现代化的仪器引入实验室,还可以结合更小粒径的新型填料以创建更稳定耐用的方法,提供更高分离度和更短运行时间等优势。图4A显示了使用USP <129>中的方法条件采集的曲妥珠单抗的SEC数据,但所用条件将建议的色谱柱更新为具有更小粒径(和孔径)的色谱柱。传统方法通常无法准确定量LMWS 1,因为它与单体的大小相似,常洗脱为后部肩峰。改用BioResolve SEC mAb色谱柱后,现在可以分离此后部肩峰,并确定此肩峰使单体峰的峰面积百分比高估了约0.6%(图4A)。
为考察在IEX中能否实现这些相同的优势,利用Arc Premier系统评价了包含强阳离子交换剂(Protein-Pak Hi Res SP色谱柱)和弱阳离子交换剂(Protein-Pak Hi Res CM色谱柱)的7 µm色谱柱填料,以及BioResolve SCX mAb色谱柱(一种强阳离子交换柱,粒径为3 µm)(图4B)。在所有三种色谱柱上使用相同的方法条件时,BioResolve SCX mAb色谱柱分离出最多的变体。此外,酸性和碱性变体的总数与采用Protein-Pak Hi Res SP色谱柱报告的结果一致。虽然Protein-Pak Hi Res CM色谱柱(弱阳离子交换色谱柱)报告的峰面积纯度与其他两种色谱柱相似,但酸性和碱性变体的总数与强阳离子交换色谱柱相比变化很大。与SEC仅通过大幅减小液相色谱扩散来提高分离度不同,IEX方法还可通过针对不同色谱柱填料和分析物进一步优化得到获益。因为在IEX中通常需要权衡酸性和碱性变体的分离:在提高其中一种变体的分离度时,另一种变体的分离度通常会下降,因此定制方法以更好地平衡各杂质组的分离度可能是有益的。
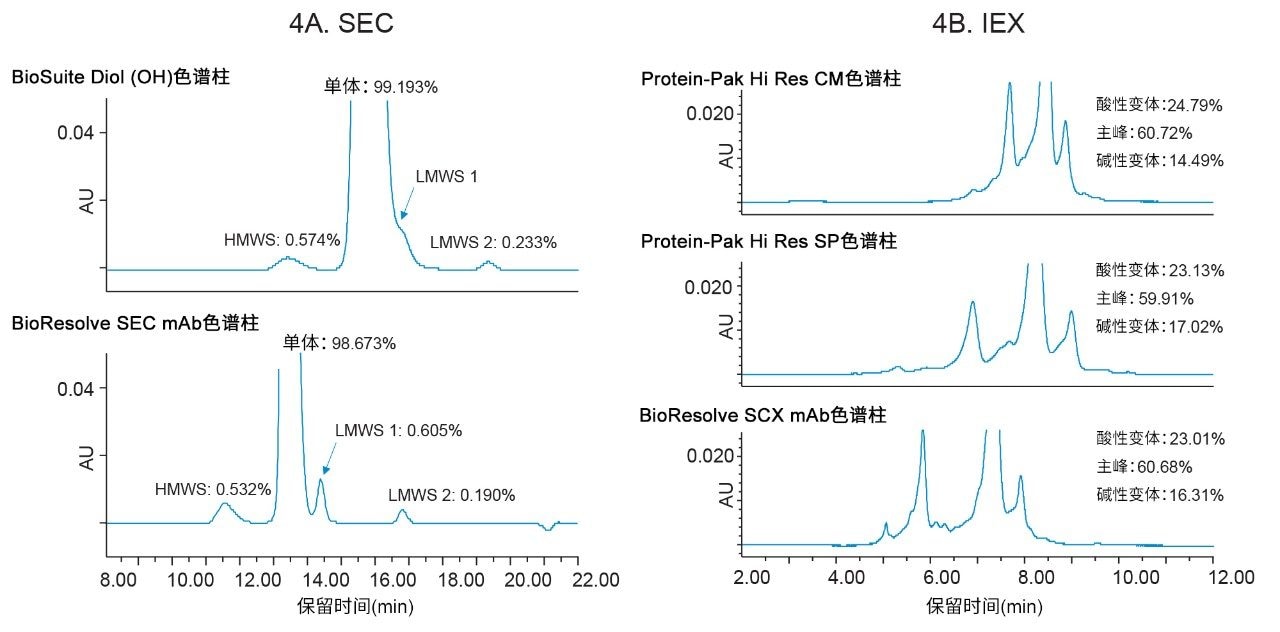
传统SEC和IEX方法使用HPLC系统和大粒径色谱柱填料,以免超出这些老旧平台的压力限值。随着实验室加入更现代化的液相色谱平台,必须证明这些新系统能够产生与现有技术相媲美的结果。本研究证明,传统SEC和IEX方法可以从Alliance HPLC系统迁移至Arc Premier系统,保留时间和峰面积百分比的差异可以忽略不计。将Arc Premier系统与现代UHPLC色谱柱相结合,可以获得更高的效率、选择性和更高的分离度,从而更准确地解析数据。
720007283ZH,2021年8月修订