推出更耐用的色谱材料有助于应用更广泛的方法条件。但是,根据分析物的化学性质不同,在色谱分离过程中可能发生样品降解。这种降解可能由多种因素引起,包括高温条件、在某些流动相中的稳定性、pH条件,甚至是与固定相和色谱柱的相互作用。
据报道,生物药物比小分子药物更容易发生柱上降解。这些生物大分子在固定相和液相色谱条件下分别会发生构象变化和柱上降解。小分子的柱上降解虽然鲜有报道,但已经观察到明显的案例。研究人员已经遇到过氨基化合物的柱上降解情况,并且发现使用高pH流动相会加剧降解。
本应用纪要证明,使用传统不锈钢色谱柱进行分离时,小分子胺的确会发生柱上氧化。而采用ACQUITY Premier色谱柱可以缓解这种降解情况。ACQUITY Premier色谱柱具有MaxPeak高性能表面,可为金属与分析物相互作用提供屏障。这种基于有机-无机杂化硅胶的屏障还有助于保护金属液相色谱表面免受腐蚀,从而避免进一步加剧分析物降解。这些结果表明,MaxPeak Premier技术可以减少柱上的金属催化反应(例如氧化反应)。因此,应考虑将ACQUITY Premier色谱柱用于液相色谱工作、纯度测量和杂质分析或相关分析可能影响分析价值的任何应用中。
由于多种原因,分析物与色谱系统之间的相互作用可能存在问题。一方面,样品吸附到液相色谱系统的固定相或表面会导致回收率和重现性下降。另一方面,分析物可能在色谱柱内发生反应。已知肽和蛋白质在温和的酸性条件下可能发生各种降解1。 当使用酸性流动相和高柱温时,柱上降解成为一大问题。肽和蛋白质不仅容易发生水解反应,其半胱氨酸和蛋氨酸残基位点还会发生氧化2,3。研究发现,含有蛋氨酸残基的肽的相对丰度会随着时间推移降低,而氧化物质则不断增加3。近二十年来,小分子的柱上降解现象有所增加,可能是由于使用了更广泛的流动相和pH以及新型耐pH的固定相4。使用高pH流动相对于碱性化合物的方法开发尤为重要。但是,研究证实,这些条件会加剧氧化5,6。2011年,Wang及其共同作者发现,使用传统金属色谱柱技术和氢氧化铵高pH流动相时,苯胺发生柱上降解5。观察到的氧化反应产生了偶氮和亚肼基二聚体,这种现象随着色谱柱的持续使用不断恶化5。
Wang及其共同作者没有详细说明氧化的来源和原因,但Myers及其共同作者于2013年开展了后续研究6。 与Wang相似,他们也发现胺类化合物的氧化亚硝化产物随时间推移而增加。他们开展相关实验后提出,这种现象的原因在于氨反应形成了亚硝化剂一氧化氮。他们认为,这是由金属催化的反应,使用某些有机溶剂(如乙腈)可能导致反应加剧6,7。
在本应用纪要中,我们应用Myers、Wang及其共同作者发表的见解来研究MaxPeak Premier技术能否减轻柱上反应。本研究比较了传统不锈钢色谱柱与采用MaxPeak高性能表面(HPS)的ACQUITY Premier色谱柱分离小分子胺类抗精神病药物氯氮平的结果。之前已证明这种表面可以充当屏障,减少导致分析物吸附的金属与分析物相互作用8。 本研究观察了氯氮平N-氧化物和亚硝基杂质在柱上的氧化形成,发现当使用不锈钢色谱柱和氢氧化铵改性的水和乙腈洗脱液时,这些物质的含量随时间推移不断增加。采用具有MaxPeak高性能表面的ACQUITY Premier色谱柱时,氯氮平的柱上氧化明显减少,在多次进样后得到的UV色谱图中未观察到杂质。
使用0.1% (w/v)的20/80/0.08乙腈/水/乙酸溶液制备浓度为6 mg/mL的氯氮平,并以0.25 µL(载样量0.15 µg)的样品体积进样。
|
液相色谱系统: |
ACQUITY UPLC I-Class* |
|
检测器: |
UV检测(波长290 nm) |
|
样品瓶: |
最大回收样品瓶(部件号:186002802) |
|
色谱柱: |
ACQUITY UPLC BEH C18, 130 Å, 1.7 µm, 2.1 × 50 mm(部件号:186002350) ACQUITY Premier BEH C18, 130 Å, 1.7 µm, 2.1 × 50 mm(部件号:186009452) |
|
柱温: |
30 °C |
|
样品温度: |
4 °C |
|
进样体积: |
0.25 µL |
|
流速: |
0.31 mL/min |
|
流动相A: |
0.05% (w/v)氢氧化铵水溶液 |
|
流动相B: |
乙腈 |
|
样品稀释剂: |
20/80/0.08 (w/v)乙腈/水/乙酸 |
|
梯度: |
流动相B在10.31 min内从25%增加至80% |
|
*应考虑使用ACQUITY Premier系统提供额外保护以防分析物氧化。 |
|
质谱系统: |
Vion IMS QTof |
|
电离模式: |
ESI+,灵敏度 |
|
采集范围: |
50-1500 m/z |
|
毛细管电压: |
3.5 kV |
|
采样锥孔电压: |
40 V |
|
电离源补偿: |
80 V |
|
离子源温度: |
100 °C |
|
脱溶剂气温度: |
250 °C |
|
脱溶剂气流速: |
600 L/h |
|
四极杆选项: |
自动 |
|
色谱和质谱软件: |
UNIFI v1.8 |
根据氯氮平及其降解产物的实测峰面积(UV或TIC),估算氧化物质的相对含量(%)。
本研究旨在考察氯氮平,它是一种用于治疗精神分裂症的氨基化合物。Myers及共同作者在其论文中描述一组可能发生柱上亚硝化的胺类时,简单讨论了氯氮平。文献中另一条已知的主要氧化途径是氯氮平发生叔胺氧化,形成N-氧化物9,10。 图1展示了氯氮平及其潜在降解产物(氯氮平N-氧化物及其Z和E亚硝基异构体杂质)的结构。
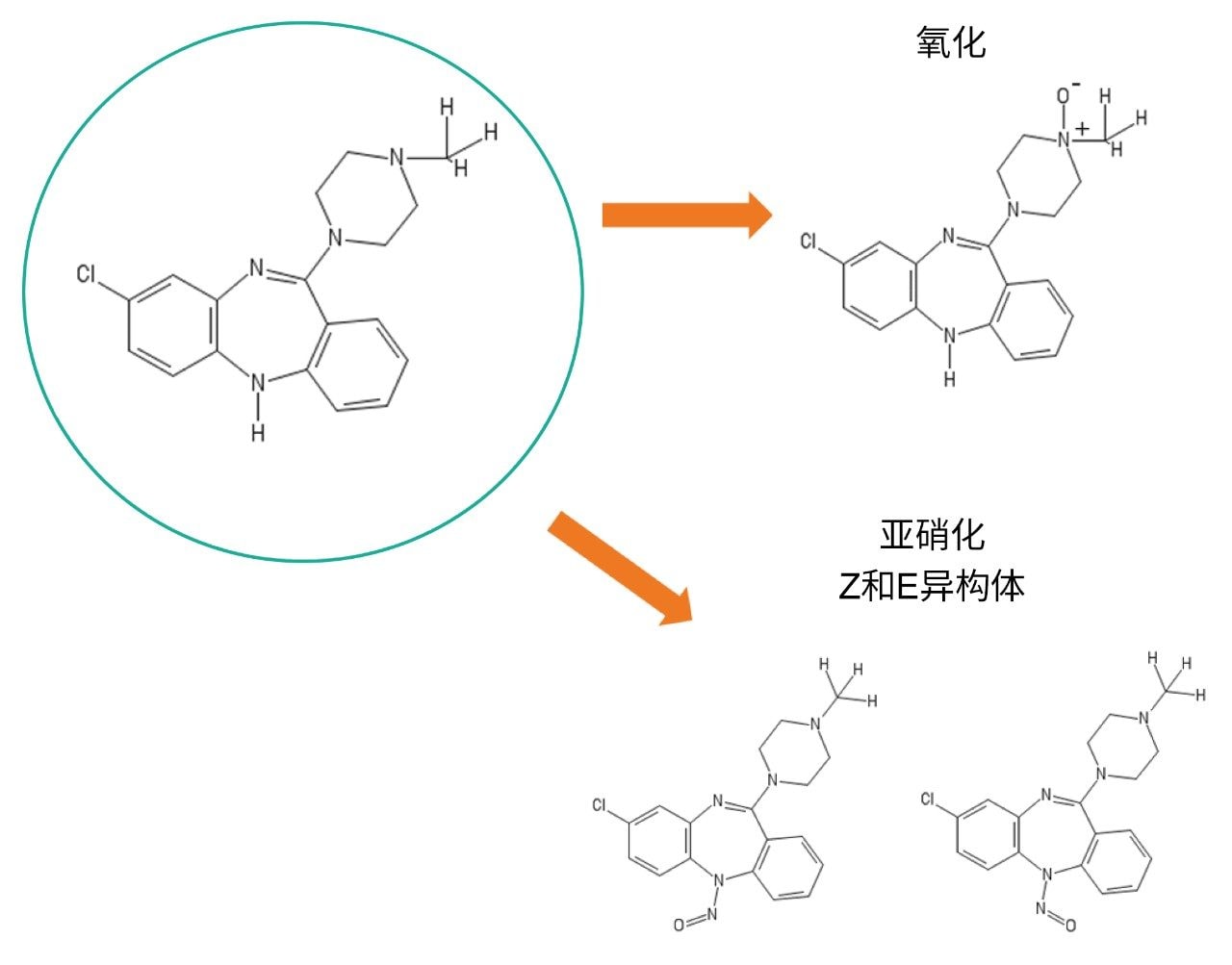
本研究采用Myers及其共同作者描述的色谱条件,以便比较由上述两种色谱柱技术产生的氧化物质。采用全新未用过的不锈钢ACQUITY UPLC BEH C18, 1.7 µm, 2.1 × 50 mm色谱柱或全新未用过的ACQUITY Premier BEH C18, 1.7 µm, 2.1 × 50 mm色谱柱,以0.05% (w/v)氢氧化铵水溶液和乙腈作为流动相进行分离。通过监测UV或TIC峰面积来确定随时间推移所形成的氯氮平氧化物质,并通过质谱分析进行验证。实验采用ACQUITY UPLC I-Class与Vion IMS QTof联用系统。
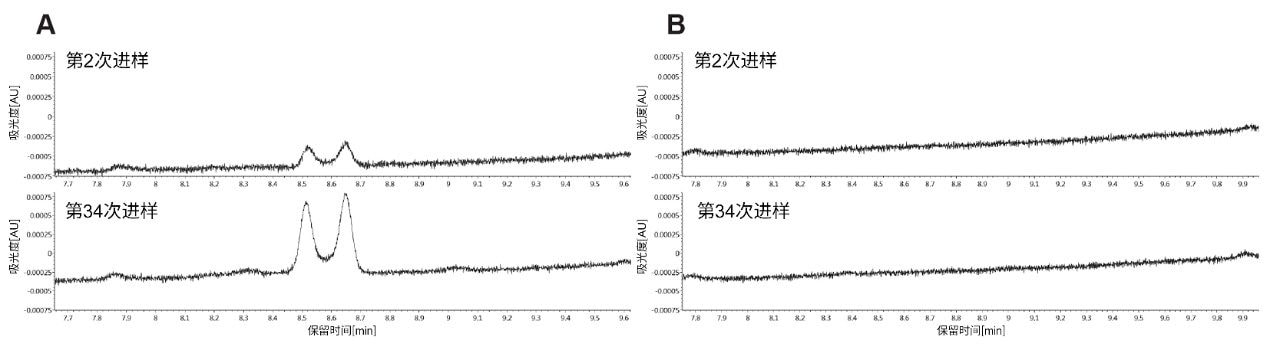
在不锈钢ACQUITY UPLC BEH C18色谱柱和ACQUITY Premier BEH C18色谱柱上连续进样34次。监测每种色谱柱上氯氮平氧化物质UV峰面积百分比随时间推移的变化。图2展示了在传统不锈钢色谱柱上第2次和第13次进样氯氮平得到的UV色谱图。从图中可以清楚地看出,形成的氯氮平N-氧化物随时间推移而增加。
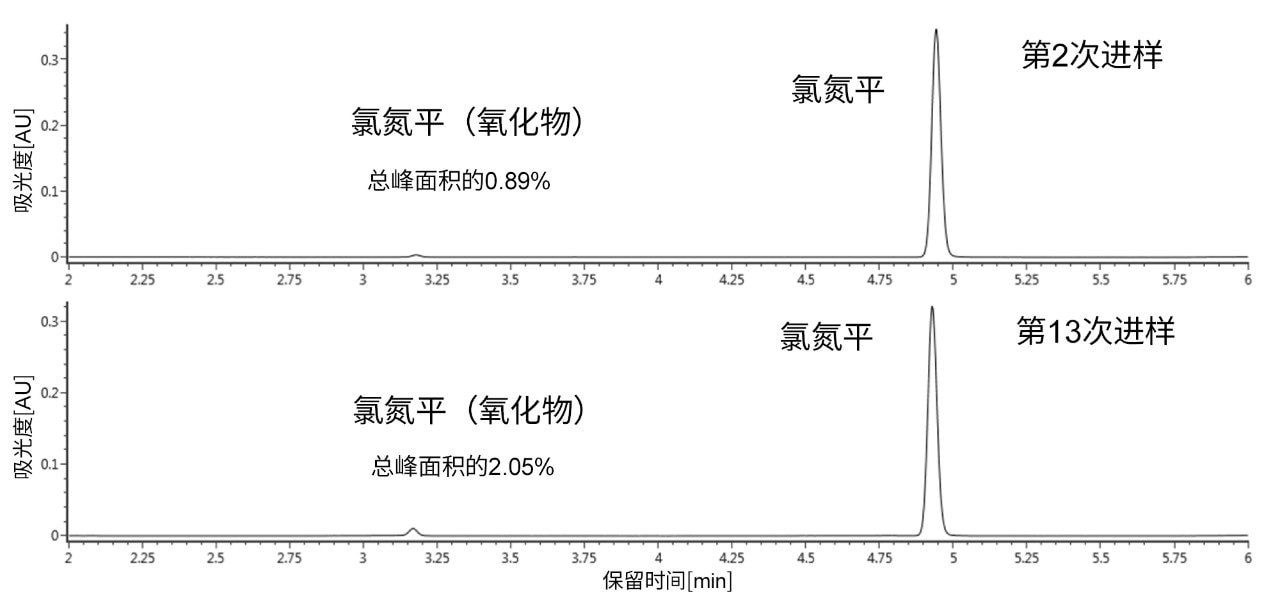
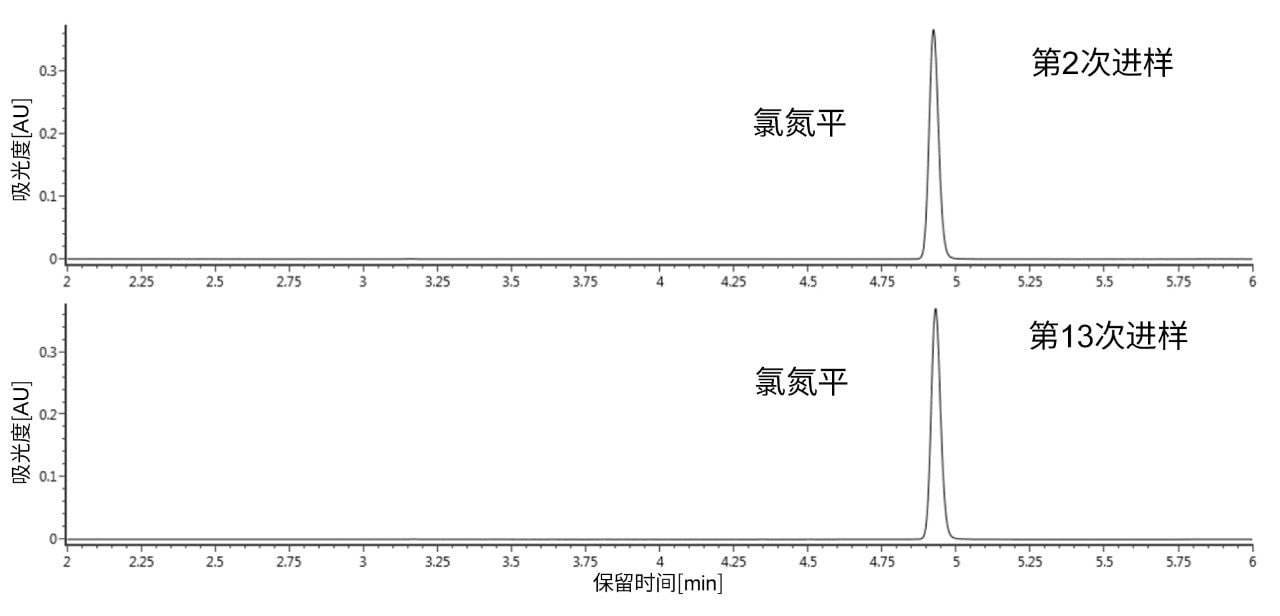
从第2次进样到第13次进样,叔胺氧化增加至2倍以上,与之前引用的文献结果一致。有趣的是,我们的结果表明,主要氧化产物是氯氮平N-氧化物,而不是由仲胺亚硝化所产生的杂质。这似乎与Myers及其共同作者发表的论文形成鲜明的对比,他们主要讨论了亚硝化作用随时间推移而形成的杂质6。 这可能是由于系统配置或变量组合不同所致;需要开展更多研究来探讨其中差异。我们还使用相同的条件和进样次数对ACQUITY Premier BEH C18色谱柱进行了评估。在该色谱柱上第2次进样和第13次进样得到的UV色谱图如图3所示。与不锈钢ACQUITY UPLC BEH C18色谱柱相比,在采用ACQUITY Premier BEH C18色谱柱得到的UV色谱图中未观察到N-氧化物降解产物。这些结果表明,使用MaxPeak HPS的有机/无机杂化技术制成的ACQUITY Premier色谱柱可以为金属与分析物相互作用提供屏障,避免可能发生的柱上反应,例如氧化。这种氧化可能由金属表面(尤其是筛板)的表面腐蚀引起6。 在本例中,由MaxPeak HPS技术形成的屏障似乎可以通过阻碍直接催化相互作用来保护易氧化的胺。MaxPeak HPS技术还可以赋予金属表面一定程度的耐腐蚀性,为确保准确分析氯氮平带来额外优势。
为确保正确鉴别该杂质峰,我们使用质谱分析来确认N-氧化物的种类。图4B展示了使用不锈钢ACQUITY UPLC BEH C18色谱柱分离氯氮平后采集的质谱图。图4A为第2次进样和第34次进样得到的TIC色谱图,其中氯氮平N-氧化物的百分比上升至总峰面积的4.12%。
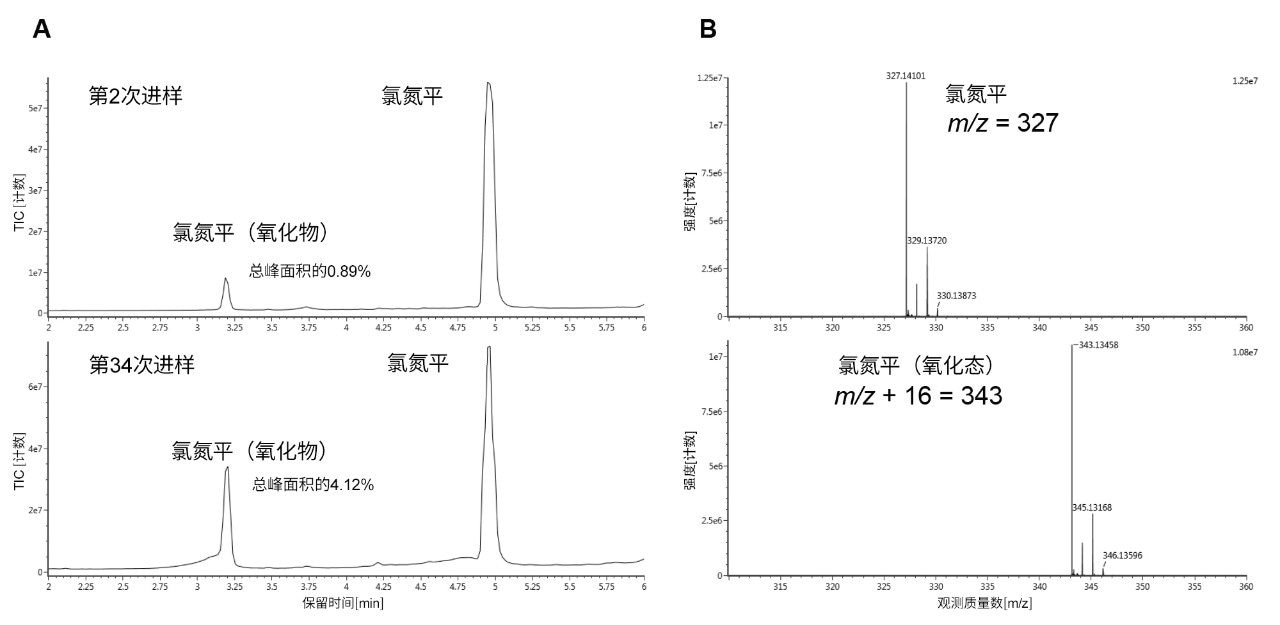
氯氮平的柱上降解主要是N-氧化,不过也观察到痕量亚硝化,表现为Z异构体和E异构体含量增加。这些物质的含量低于氯氮平N-氧化物,并且仅存在于不锈钢色谱柱上。与氯氮平N-氧化物的形成随时间推移增加类似,在第2次进样至第34次进样之间,亚硝基物质也逐渐增加(图5)。同样,仅在不锈钢色谱柱上观察到这些降解产物,因为即使在第34次进样时,ACQUITY Premier色谱柱上也未见Z亚硝基异构体和E亚硝基异构体。
值得注意的是,N-氧化百分比在连续34次进样中随时间推移不断增加,并且与进样次数大致呈线性关系。对这种线性关系进行建模,发现随着不锈钢色谱柱的持续使用,可能会产生越来越多的N-氧化物干扰物质。为全面评估这种关系,有必要开展实证研究。此外,还需要考虑亚硝基杂质的形成。
本应用纪要证明,采用MaxPeak高性能表面的ACQUITY Premier BEH C18色谱柱能够缓解氯氮平的柱上降解问题。MaxPeak HPS独特的有机/无机杂化屏障似乎阻止了金属与分析物相互作用,这在不锈钢色谱柱中会引起柱上反应。本文所述的研究证实,当使用不锈钢色谱柱时,分析人员很可能遇到叔胺氧化和仲胺亚硝化现象,在连续进样和长时间使用的情况下尤其如此。使用ACQUITY Premier色谱柱时,未观察到这些降解物。
这些结果表明,ACQUITY Premier色谱柱在提高色谱数据的重现性和可靠性方面具有明显优势。该技术在包括质量控制在内的许多领域中非常具有应用前景,在这些领域中,杂质检测可能由于柱上降解产物的形成而受到不利影响。此外,可以预见,该技术可用于减轻其他分析物的柱上反应,例如肽和蛋白质中氨基酸残基的氧化以及某些类型寡核苷酸的氧化。
720007160ZH,2021年2月