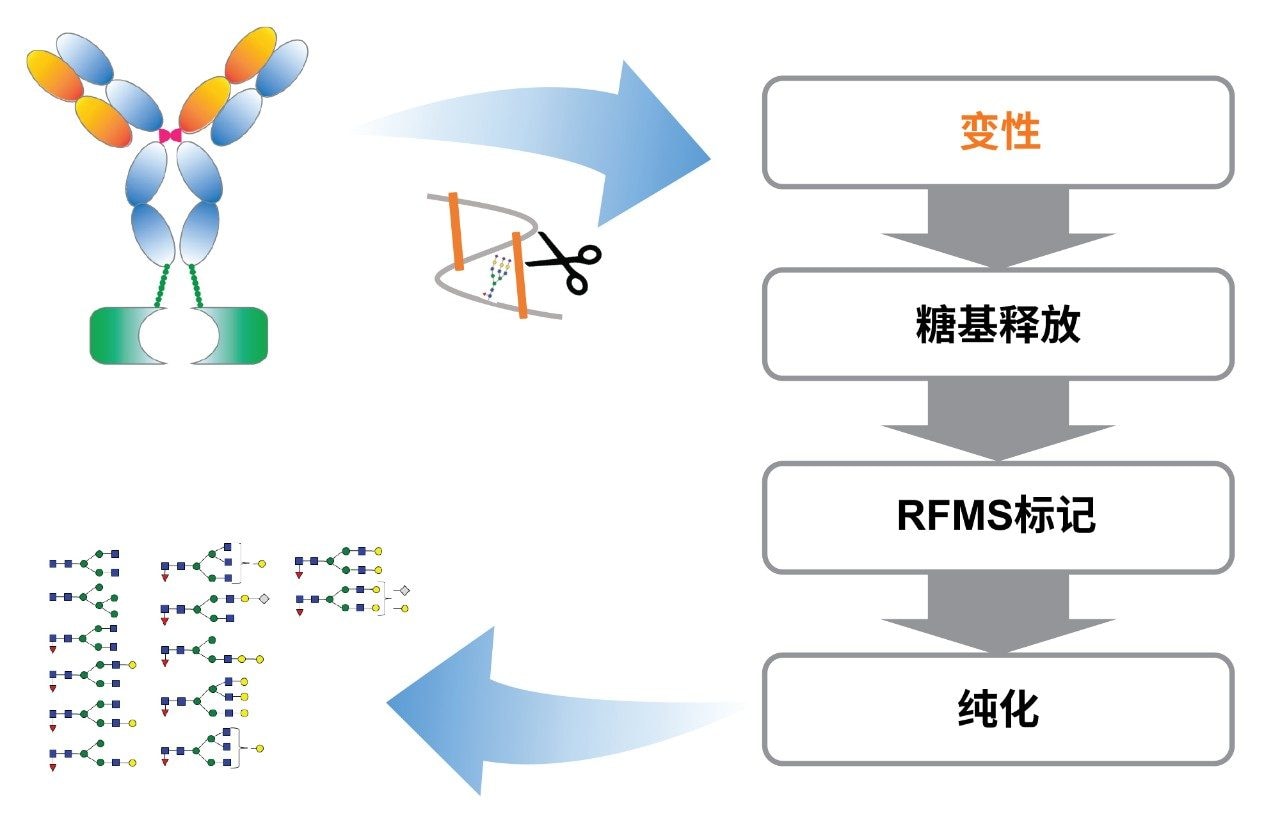
融合蛋白代表一类新型生物治疗药物,具有延长血浆半衰期和增强治疗活性等优势。融合蛋白的糖基化可能影响药品的安全性、有效性和PK,需要在开发过程中进行充分表征和监测,以确保产品质量。与单克隆抗体(mAb)相比,融合蛋白的分子结构和糖谱通常更为复杂。此外,通常开发用于mAb游离寡糖分析的常规方法可能不适用于分析融合蛋白。本文报告了如何开发一种经过优化的样品前处理方法,以便对包含高水平二硫键和复杂糖谱的融合蛋白中的N-糖进行UPLC-FLR-MS分析。
融合蛋白代表一类新型生物治疗药物,与单克隆抗体(mAb)相比具有多项优势,例如延长血浆半衰期和增强治疗活性1。从结构上讲,一类主要的融合蛋白通常由IgG Fc区和衍生自受体或配体的目标结合区组成2。与密切相关的mAb相比,Fc融合蛋白通常具有更复杂的糖谱,这是因为该蛋白在目标结合区具有额外的糖基化位点以及更复杂的糖基结构。糖谱的准确表征和监测对于产品质量和一致性至关重要,因为N-糖基化水平可能影响融合蛋白治疗药物的安全性、有效性和药代动力学2。通过衍生化和LC荧光(FLR)-MS进行游离寡糖分析已成为获得蛋白质生物治疗药物中N-糖基化修饰详细信息的有效方法。但是,融合蛋白上常见的大量二硫键可能会阻碍肽-N-糖苷酶F (PNGase F)进入包埋的糖基化位点,导致游离寡糖释放不完全。除糖谱复杂以外,这些富含二硫键的结构在适应mAb游离寡糖分析工作流程方面也面临挑战。因此,迫切需要一种高效的游离寡糖分析工作流程,以改善对富含二硫键的融合蛋白中N-糖基化的表征和监测工作。
本文报告了一种新的样品前处理方法,该方法使用改进的Waters GlycoWorks RapiFluor-MS N-糖分析试剂盒方案,改善了具有高水平二硫键和复杂糖谱的融合蛋白中N-糖的UPLC-FLR-MS的分析。选择Waters GlycoWorks RapiFluor-MS N-糖分析试剂盒作为快速释放和标记试剂盒,可以轻松适应富含二硫键的融合蛋白,只需对方案进行少量变更,同时在N-游离寡糖的FLR和MS检测中保持显著的信号增强3。 改良版方案在变性步骤中添加了还原剂,以还原二硫键并增加PNGase F酶与N-糖的接触(图1)。与BioAccord系统所提供的LC-FLR-MS游离寡糖分析精简工作流程相结合4,这种经过改善的样品前处理方法可以在富含二硫键的融合蛋白的开发和生产过程中提高N-糖分析的准确度和效率。
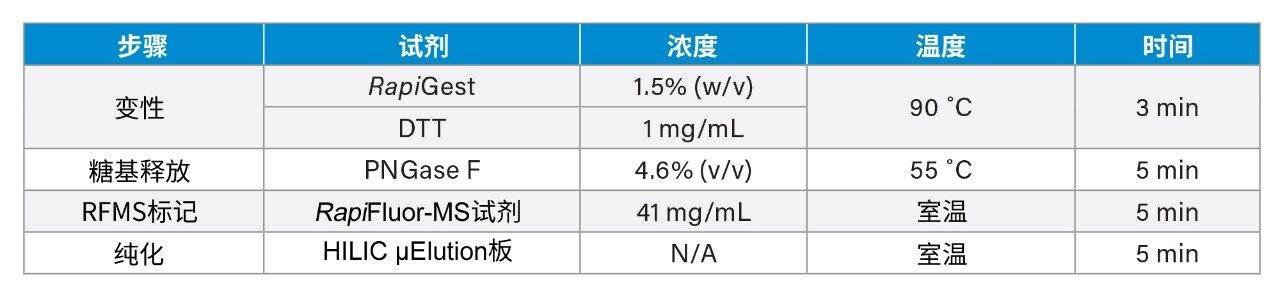
*DTT和TCEP的无重量形式可提高重现性和易用性。TCEP在临用前先用NaOH中和。
*样品前处理的其他详细信息请参见适用于富含二硫键的蛋白质的《GlycoWorks快速入门方案》(720006992ZH)。
|
液相色谱系统: |
ACQUITY UPLC I-Class PLUS |
|
检测器: |
ACQUITY FLR检测器(λ激发 = 265 nm,λ发射 = 425 nm,2 Hz) |
|
样品瓶: |
采用MaxPeak HPS的QuanRecovery样品瓶,300 µL(部件号186009186) |
|
色谱柱: |
ACQUITY BEH Amide游离寡糖分析专用柱, 1.7 µm, 130 Å, 2.1 × 150 mm |
|
柱温: |
60 °C |
|
样品温度: |
6 °C |
|
进样量: |
10 µL (2.5 pmol) |
|
密封清洗液: |
含20%乙腈的水溶液 |
|
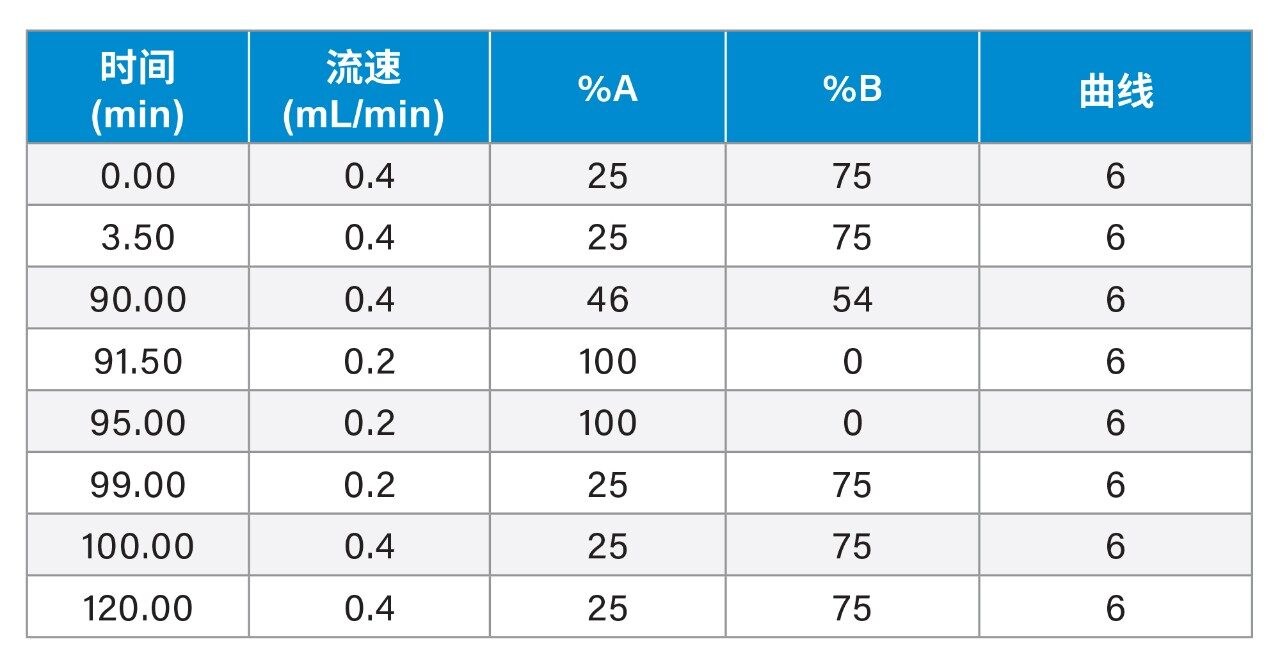
流动相A: |
100 mM NH4HCO2水溶液 |
|
流动相B: |
乙腈 |
|
质谱系统: |
ACQUITY RDa质谱检测器 |
|
电离模式: |
ESI+ |
|
采集范围: |
50-2,000 m/z |
|
毛细管电压: |
1.5 kV |
|
锥孔电压(CV): |
45 V |
|
碎裂CV: |
70-90 V |
|
信息学软件: |
waters_connect中的UNIFI v1.9.4 |
|
工作流程: |
“游离寡糖FLR和MS确证”工作流程 |
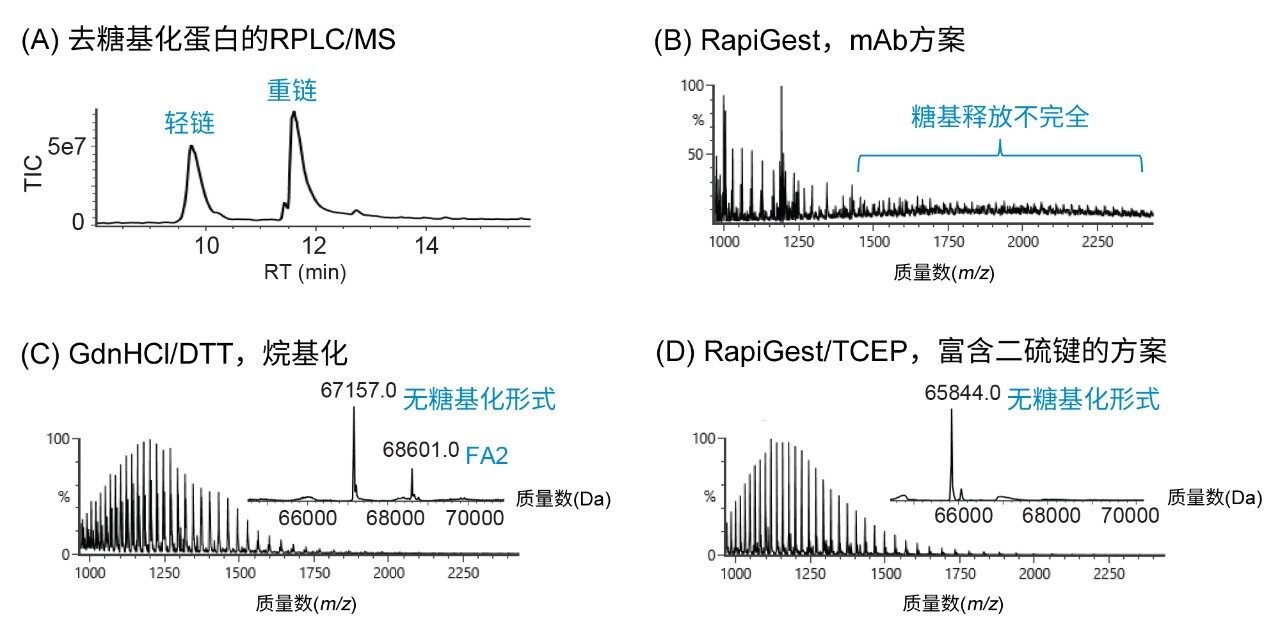
作为mAb设计的副产物,融合蛋白的结构往往比mAb更为复杂,包括增加的二硫键和糖基化位点,因此需要优化样品前处理方法以分析游离N-糖。为优化N-糖释放方法,本研究选择具有28对二硫键、总共6个N-糖基化位点的融合蛋白作为代表复杂生物治疗药物的替代分子。使用Waters GlycoWorks RFMS N-糖分析试剂盒评估当前可用N-糖释放方法的适用性。在90 ℃下使用清洗剂RapiGest SF变性3 min后,在55 ℃下用Rapid PNGase F进行5 min的糖基释放。为直接测量游离寡糖释放量,在配备在线FLR检测器的BioAccord LC-MS系统上通过反相色谱(RPLC)-MS对一部分去糖基化蛋白进行分析。如图2A所示,分离出两个峰,分别鉴定为轻链(约22.8 kDa)和重链(约65.8 kDa)。在重链的ESI+质谱图中(图2B),观察到1,500–2,500 m/z范围内出现低水平MS响应,表明变性不完全,可能导致仅部分糖基释放,因为PNGase F与糖基化位点的接触受到阻碍。为确保蛋白质完全变性,对使用8 M盐酸胍(GdnHCl)作为变性剂并使用5 mM DTT作为还原剂还原二硫键的常规方法进行了评估6。 在室温下温育30 min后,将变性的融合蛋白用碘乙酰胺烷基化,并交换至酶解缓冲液中,尽量降低GdnHCl对酶活性的影响,然后在37 ℃下用PNGase F酶进行16 h的酶解。在去糖基化蛋白的RPLC-MS分析中,未在质谱图中观察到完整蛋白(连接有异质性糖基)(图2C),表明变性完全。但是,在去卷积质谱图中,除在烷基化重链的67,157 Da处观察到无糖基化形式以外,还观察到FA2 (G0F)糖型的质量数(68,601 Da)(图2C插图),表明由于糖基释放缓冲液中不存在清洗剂而导致糖基释放不完全。因此,评估了一种酶友好型还原剂与GlycoWorks RapiFluor-MS N-糖分析试剂盒样品前处理方案的相容性。在变性步骤中,同时使用6 mM三(2-羧乙基)膦酸(TCEP)与RapiGest SF可进一步还原二硫键。另一个优势在于,酶解缓冲液中存在的酶友好型清洗剂和还原剂使分析人员无需进行烷基化或缓冲液交换,并促进了N-糖的释放。经5 min PNGase F温育后,去糖基化蛋白在RPLC-MS分析得到的电荷去卷积质谱图中显示为质量数65,844 Da处的单个峰(图2D),与无糖基化重链的质量数相符。因此,由富含二硫键的融合蛋白实现了完全的糖基释放,从而在随后的LC-FLR-MS分析中能够可靠地分配并定量游离N-糖。
借助经过优化的糖基释放方法,从融合蛋白中释放出N-糖,然后用FLR/MS信号增强标记RFMS进行标记,再进行HILIC-FLR-MS分析。使用60 min梯度并借助定制的糖基结构谱库,分离并鉴定出总计84种游离寡糖4。 为评估还原剂对RFMS标记的影响,选择丰度最高的游离寡糖FA2,比较由原始方法和经过优化的RFMS糖基释放方法获得的荧光响应。如图3A所示,添加TCEP后,FA2的FLR响应降低了约5%,表明还原剂的添加以较小的程度抑制了标记效率。为大幅降低还原剂的影响,将RFMS与蛋白的比率增加至原来的两倍,由此获得了相媲美的FA2回收率,如图3A所示。此外,溶剂可及性较低的游离寡糖(FA3G3S3)的FLR响应提高至两倍,表明使用TCEP改善了PNGaseF酶与游离寡糖位点的接触(图3B)。这些数据表明,酶友好型还原剂可与GlycoWorks RapiFluor-MS标记方案相容,与原始标记方案相比,只需略微调整RFMS与蛋白比率,即可产生相同或更高的检测器响应。
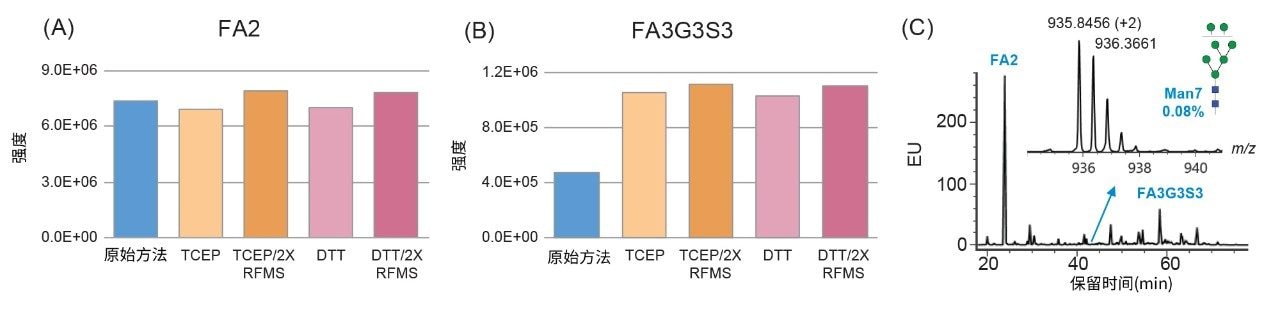
为扩展该样品前处理方法在上游和下游活动中的可用性,评估了常用还原剂DTT对标记效率和游离寡糖产量的影响。尽管DTT上的巯基可能与RFMS试剂发生反应并影响游离寡糖标记,但发现最终浓度为6.5 mM的DTT对标记和游离寡糖释放的影响与TCEP的影响相似(图3A和3B)。由于DTT在使用前无需中和,且成本效益通常更高,因此在常规分析环境中用作样品前处理的还原剂更符合质量控制要求。如前文所述,在变性步骤中加入还原剂可以提高PNGaseF酶与溶剂受限的游离寡糖位点的接触。由此提高N-糖产量,使用FLR和MS方法均可检测到低丰度游离寡糖,如相对丰度为0.08%的游离寡糖Man7所获得的高信噪比所示(图3C)。总而言之,这些结果表明该样品前处理方法在富含二硫键且高度糖基化的融合蛋白的N-糖分析中获得了更高的准确度和效率。
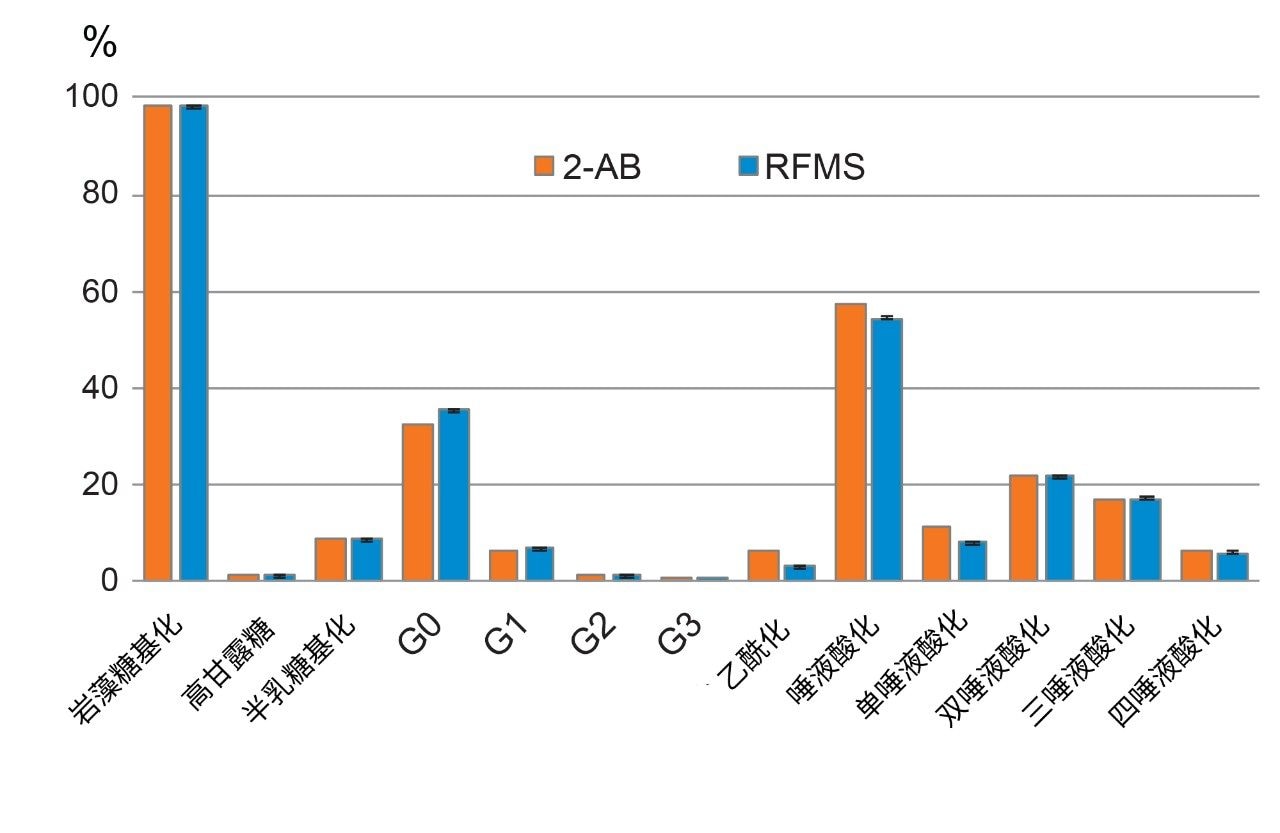
国际人用药品注册技术要求协调会(ICH)建议评估并采用新技术以确保产品质量和安全性,强调了比较研究在促进传统方法的转换方面的重要性。在生物制药行业中,常规的标记试剂(例如2-氨基苯甲酰胺(2-AB)和2-氨基苯甲酸(2-AA))广泛用于FLR检测过程中的游离寡糖衍生化7。 这些方法虽然可以有效地获得灵敏的FLR反应,但需要较长时间进行酶解糖基释放和FLR标记,并且会用到复杂的样品前处理方案。生物制药行业的科学家一直在寻找高效、易于遵循且灵敏的替代方法。为了评估使用不同样品前处理方法所得到N-糖分析结果的可比性,本研究对使用经过优化的RFMS方法制得的游离寡糖进行了分离,并根据FLR色谱图中的相对峰面积进行定量,然后基于糖基结构属性进行分组。如图4所示,使用经过优化的RFMS样品前处理方法获得了98.3%的岩藻糖基化游离寡糖、54.3%的唾液酸化游离寡糖和1.2%的高甘露糖型游离寡糖。这些结果与之前采用GdnHCl/DTT变性和2-AB标记的常规标记方法所获得的数据总体上相当,证明了从传统的2-AB标记方法过渡到优化的RFMS方法的可行性。此外,在RFMS衍生化方法中观察到较高水平的FA2(或G0组中的G0F),与图2C中的观察结果一致(FA2在GdnHCl变性方法中未完全释放)。综上所述,这些结果证明,该样品前处理方法可轻松适用于经过优化的RFMS方法,以对富含二硫键的融合蛋白进行N-糖分析,改善糖基释放效率,提高糖分析的总体准确度。
本研究基于GlycoWorks RFMS N-糖分析试剂盒开发出一种快速样品前处理方法,适用于对富含二硫键的融合蛋白进行N-糖分析。结合使用还原剂与酶友好型清洗剂RapiGest SF以破坏蛋白质二硫键,使用试剂盒中提供的Rapid PNGase可实现完全的糖基释放,从而实现高效标记,并通过HILIC-FLR-MS分析对RFMS标记的游离寡糖实现准确定量。总体样品前处理时间短于30 min。通过将RFMS标记试剂的比率提高至2倍,减轻了还原剂对标记效率的影响。总之,本应用纪要介绍了一种经过优化的样品前处理方法,可以提高N-糖分析的准确度和效率,适用于棘手的生物治疗蛋白(二硫键含量高)。
感谢Merck Serono的合作者Mauro Sassi、Erika Birolo、Nunzio Sepe、Paolo Felici和Angelo Palmese为本研究提供样品和结构信息。
720007162ZH,2021年2月