开发利用超高效合相色谱(UPC2)分析降胆固醇药物的多产物方法
摘要
本研究介绍了使用ACQUITY超高效合相色谱(UPC²)系统基于实验设计方法进行方法开发的步骤。研究的化合物属于他汀类,用于降低高胆固醇血清水平。专门添加了依折麦布,因为它在几种药物制剂中与他汀类药物联合使用。首先,利用不同的改性剂和样品稀释剂对一组五根色谱柱进行了评估。ACQUITY UPC²色谱柱设计的Torus 1-氨基蒽(1-AA)在分离所有分析物方面表现出优异性能。随后,采用中心复合设计(CCD)评估压力、温度和改性剂用量作为微调参数对分离的影响。在最终色谱条件(采用Torus 1-AA色谱柱,以乙醇-水(95:5)作为改性剂,乙腈-乙醇(3:2)作为稀释剂,流速为1.80 mL·min-1,柱温箱温度为42 °C,反压调节器压力为2175 psi,梯度运行条件为改性剂在4 min内从5%增加到15.5%)下,获得了出色的分离结果,关键分析物对的分离度不低于2.0。根据巴西监管机构(ANVISA)的规定验证了该方法,所得r > 0.99;准确度范围为95%~105%,且精密度不大于4.4%(日内和日间精密度均如此),根据分析物的浓度,判定该方法的性能可接受。
优势
- 一种快速分析降胆固醇药物的ACQUITY UPC2方法
- 使用少量乙醇(一种环保溶剂)分析酸性降胆固醇药物,无需在流动相中使用添加剂。
- 以二氧化碳作为主要流动相,减少有机溶剂消耗量
简介
世界卫生组织的一个小组在2016年指出,缺血性心脏病是全球范围内致死的主要疾病,其次是中风(主要发生在高收入国家)1。 这些疾病与血清中胆固醇水平升高有关。已知他汀类药物能够降低胆固醇水平,因为它们会抑制羟甲基戊二酰辅酶A (HMG-CoA)还原酶在肝细胞中合成胆固醇的作用2。 因此,他汀类药物广泛用于治疗高胆固醇血症。某些疗法不能通过抑制HMG-CoA的作用来适当地降低胆固醇水平,因此将他汀类药物与依折麦布(一种减少小肠中胆固醇摄取的药物)成功联用3。
通常,针对各种他汀类药物或其与依折麦布的联用开发方法4-7。 对于这些药物,最常用的分析方法是反相液相色谱(RP-LC),会消耗大量有机溶剂(乙腈、甲醇)并使用酸性添加剂。本研究介绍了一种利用超临界流体色谱(SFC)的快速多产物分析方法,该方法使用亚2 μm颗粒填充柱8,溶剂消耗量低且无需使用添加剂9。所谓“多产物方法”是指开发一种可用于多种药物(无论这些药物是否存在于同一制剂中)的单一方法。
SFC使用超临界流体(通常是二氧化碳(CO2))作为流动相。超临界CO2作为流动相的优势在于粘度低、溶剂化能力强、介于气相与液相之间,而且据称更环保10。 使用自动反压调节器(ABPR)改善加压CO2的输送并实现稳定的压力控制以稳定超临界流体,是超临界流体色谱作为一种有竞争力的分析技术复兴的里程碑。在CO2中添加有机溶剂(改性剂)可以改变其固有的非极性特征,从而洗脱更多极性化合物11。这一事实与专为SFC设计的色谱柱以及减小的柱外体积和亚2 μm颗粒的推出相关,提供了更快速、更灵敏的分析,且分离效率与超高效液相色谱一样高或更高8。
在现代分析方法开发中,强烈建议利用DOE(实验设计)工具12,将色谱响应作为实验变量的函数建模,在“分析方法质量源于设计”的框架内尤其如此13。在本研究中,首先利用多层分类设计对固定相、流动相改性剂和样品稀释剂等参数进行评估,结果与分析物的化学结构相关(第I部分)。这些是影响选择性、峰形和SFC效率的主要变量14。然后使用中心复合设计(CCD)研究影响洗脱强度15的温度、压力和改性剂百分比等参数,优化该方法,目的在于通过多产物方法分离所有化合物(第II部分)。
实验
第I部分
|
系统: |
ACQUITY UPC2系统 |
|
检测: |
PDA检测器(检测波长240 nm) |
|
色谱柱: |
ACQUITY UPC2: 1)亚乙基桥杂化(BEH); 2)十八烷基键合高强度硅胶(HSS C18); 3)表面带电杂化五氟苯基(CSH PFP); 4) Torus 1-氨基蒽(1-AA)和 5) Torus 2-氨甲基吡啶(2-PIC) |
|
流动相A: |
CO2(罐装,医用级) |
|
流动相B: |
乙醇:H2O 95:5 (0~30% (v/v)) |
|
柱温: |
40 °C |
|
ABPR: |
1500 psi |
|
样品管理器温度: |
室温 |
|
样品稀释剂: |
乙腈:乙醇3:2 (v/v) |
|
进样体积: |
1 µL |
|
流速: |
1.50 mL/min |
|
样品瓶: |
沃特世棕色玻璃12 × 32 mm螺纹颈口样品瓶,2 mL |
|
PDA扫描范围: |
210~400 nm |
|
强洗针液: |
甲醇 |
|
弱洗针液: |
2-丙醇:甲醇(1:1) |
|
密封清洗液: |
甲醇 |
第II部分
|
系统: |
ACQUITY UPC2系统 |
|
检测: |
PDA检测器(检测波长275 nm) |
|
色谱柱: |
ACQUITY UPC2 Torus 1-AA 2.1 × 50 mm, 1.7 µm(部件号:186007623) |
|
流动相A: |
CO2(罐装,医用级) |
|
流动相B: |
乙醇:H2O 95:5 (v/v),梯度结束根据中心复合设计而异(15.5~27.5%,在CO2中) |
|
柱温: |
根据中心复合设计而异(25~50 °C) |
|
ABPR: |
根据中心复合设计而异(10.5~16.3 MPa) |
|
样品管理器温度: |
室温 |
|
样品稀释剂: |
乙腈:乙醇3:2 (v/v) |
|
进样体积: |
1 µL |
|
流速: |
1.80 mL/min |
|
样品瓶: |
沃特世棕色玻璃12 × 32 mm螺纹颈口样品瓶,2 mL |
|
PDA扫描范围: |
210~400 nm |
|
强洗针液: |
甲醇 |
|
弱洗针液: |
2-丙醇:甲醇(1:1) |
|
密封清洗液: |
甲醇 |
将最长分析时间设置为10 min,以便在合理的时间完成分离。
样品描述
辛伐他汀、洛伐他汀、瑞舒伐他汀钙、氟伐他汀钠、阿托伐他汀钙和依折麦布作为二级药物标准品购自Sigma-Aldrich(美国密苏里州,获得紧急使用授权(EUA))。普伐他汀钠和匹伐他汀钙购自Cayman Chemicals(美国密歇根州,获得紧急使用授权(EUA)),纯度等于或高于98%。所有实验均使用乙腈:乙醇3:2 v/v配制浓度为0.5 mg/mL的混标溶液,并在进样前通过0.22 μm针式过滤器进行过滤。巴西市场的商品购自当地药店。
结果与讨论
第I部分:固定相和有机改性剂的选择
方法开发的第一步包括选择合适的固定相。除辛伐他汀、洛伐他汀和依折麦布以外,其他分析物可能呈阴离子形式。这是由于它们的pKa值低于5,且基于CO2的流动相在添加醇类改性剂时呈现出的表观pH据称约为5~616。
如图1所示,ACQUITY UPC2 Torus 1-AA和Torus 2-PIC色谱柱在无需使用添加剂的情况下对阴离子及中性物质辛伐他汀、洛伐他汀和依折麦布表现良好。其他色谱柱无法洗脱阴离子分析物并获得适当的峰形,这可能是由于对硅醇基团的排斥作用。这些结果与针对SFC固定相的分类研究一致16,17。此外,Torus 1-AA是唯一能够轻微分离辛伐他汀(1)与洛伐他汀(2)的色谱柱18。由于这两种分子的差异仅在于一个甲基,因此不太可能完全分离。
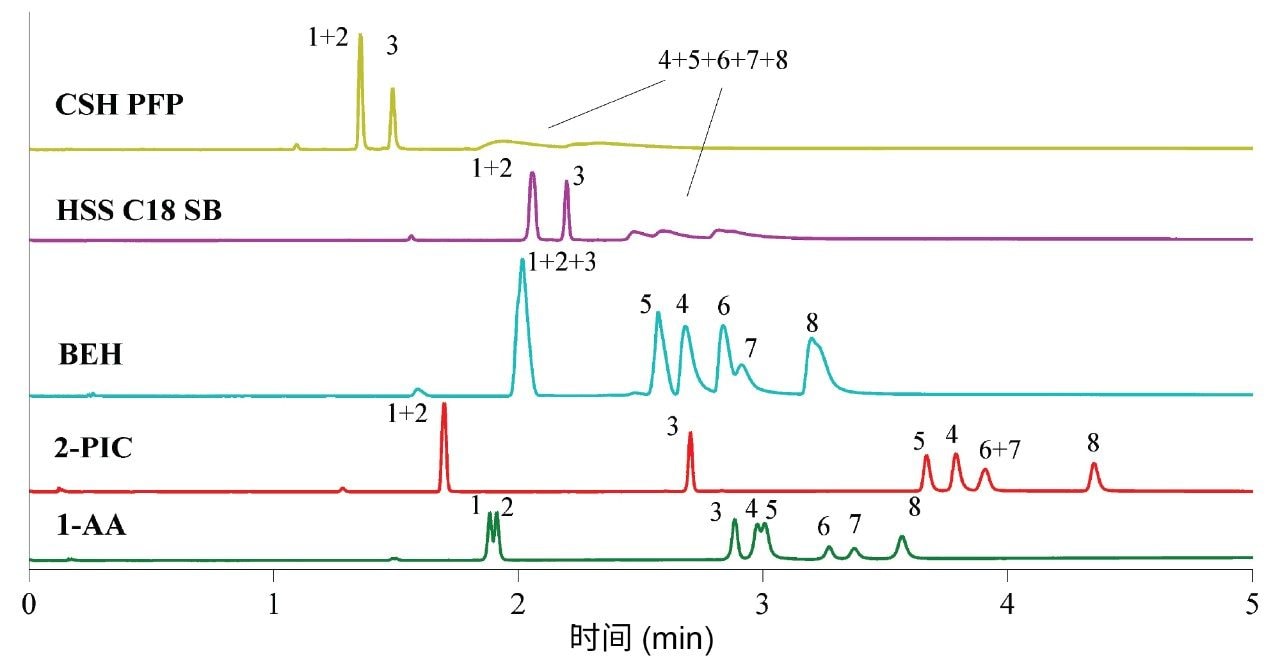
使用有机改性剂在5 min内从0%增加到30%的梯度洗脱条件进行初步筛选。使用甲醇、乙醇和异丙醇等醇类在选择性方面变化极小,而乙腈作为改性剂不足以满足要求,因为运行时间较长并且含量高达30%时与超临界CO2不混溶。由于乙醇毒性较低,因此选择用于进一步方法开发。然后,将梯度洗脱的初始组成更改为5%,并在4 min内达到25%的最终组成,以便与5 min内从0%增加到30%的梯度洗脱条件保持相同的梯度斜率。梯度洗脱开始时的较高浓度导致流动相吸附减少,因此提高了洗脱强度。
进样体积保持1.0 µL,并且用乙腈:乙醇3:2 (v/v)作为稀释剂制备溶液。应首选弱溶剂作为稀释剂,尽可能减小超临界流体色谱中溶剂与固定相之间的相互作用。因此,使用较弱溶剂乙腈与乙醇的混合物代替较强溶剂(例如甲醇)。此外,乙腈/乙醇混合物为这些分析物提供了更稳定的溶液,同时能够将其溶解。
该步骤的结果表明适合使用以下色谱条件:Torus 1-AA色谱柱,起始梯度组成包含5%的改性剂乙醇:水(95:5),进样体积为1.0 µL,并且以乙腈:乙醇3:2 (v/v)作为稀释剂。
第II部分:利用DoE研究超临界流体的密度
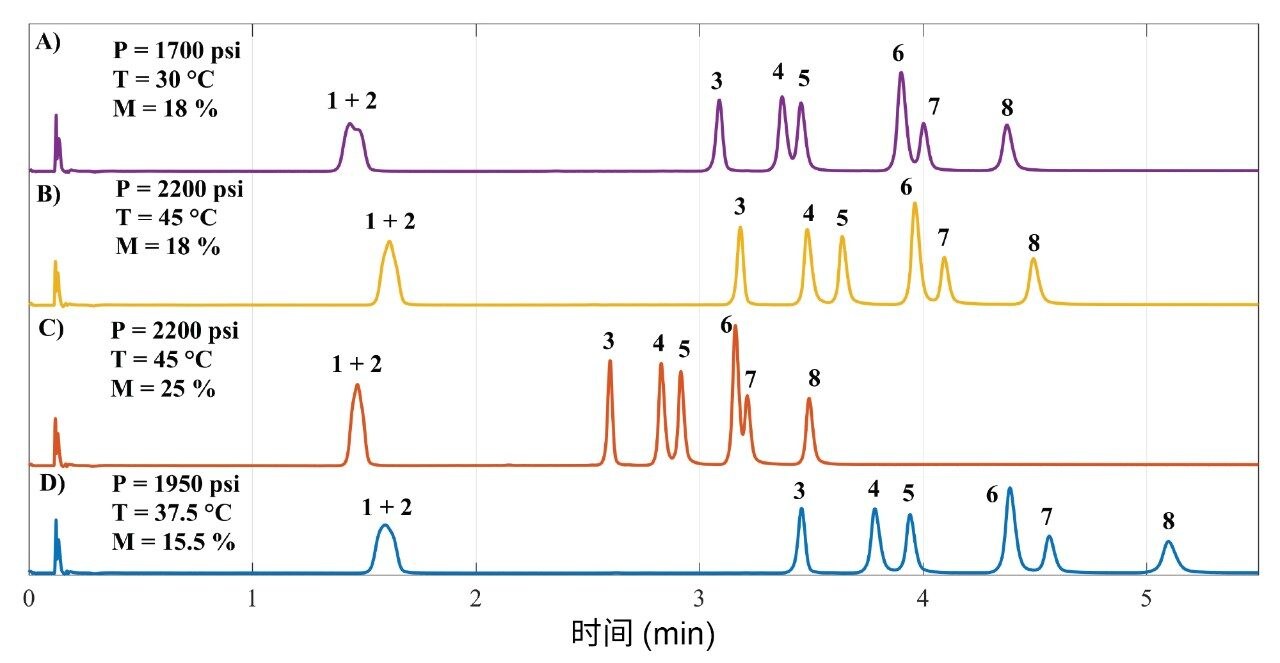
利用中心复合设计(CCD)研究受压力、温度和改性剂百分比等参数影响的超临界流体的密度。因此,沿六个轴向点以及中心点采用全因子2³(重复测量五次)。该设置能够通过较少的实验扩展知识空间19。图2显示了19幅色谱图中的4幅,展示了通过更改因子所获得的不同曲线。图2A和2B显示了洗脱曲线之间的细微差别,但图2B中显示的分离效果更出色。在这两种情况下,梯度洗脱结束时的改性剂含量相同(18%),但图2B中显示的结果在较高的压力(2200 psi)和温度(45 °C)条件下获得,这些条件使得RSV/FLV以及PRV/PTV之间的分离度高于1.5。
此外,当改性剂含量设置为25%(图2C)时,洗脱速度更快,但PRV与PTV之间严重重叠。在另一种条件(平均压力和温度分别为1950 psi和37.5 °C,但所用的改性剂含量最低(15.5%))下,关键分析物对RSV/FLV以及PRV/PTV之间的分离度高达2.0。图2B和图2D所示的色谱图提供了出色分离结果。这些色谱图表明,可以采用较低的改性剂含量和较高的压力和温度实现稳定的分离。改性剂的百分比是影响最大的参数,其缩短了保留时间并提高了化合物在流动相中的溶解度。
无论采用哪种条件,EZT与ATV之间均获得了足够高的分离度,而SMV与LOV由于高度相似(相差一个CH3基团,如上所述),在任何条件下均未得到分离。因此,CCD集中研究关键分析物对RSV/FLV和PRV/PTV之间的分离。利用分离因子(α)作为响应建模。为实现不低于2.0的分离度,关键分析物对所需的分离因子不低于1.04。值得一提的是,由于PTV与PRV之间的高度比为约2:1,因此使用的分离度为大于或等于2.020。
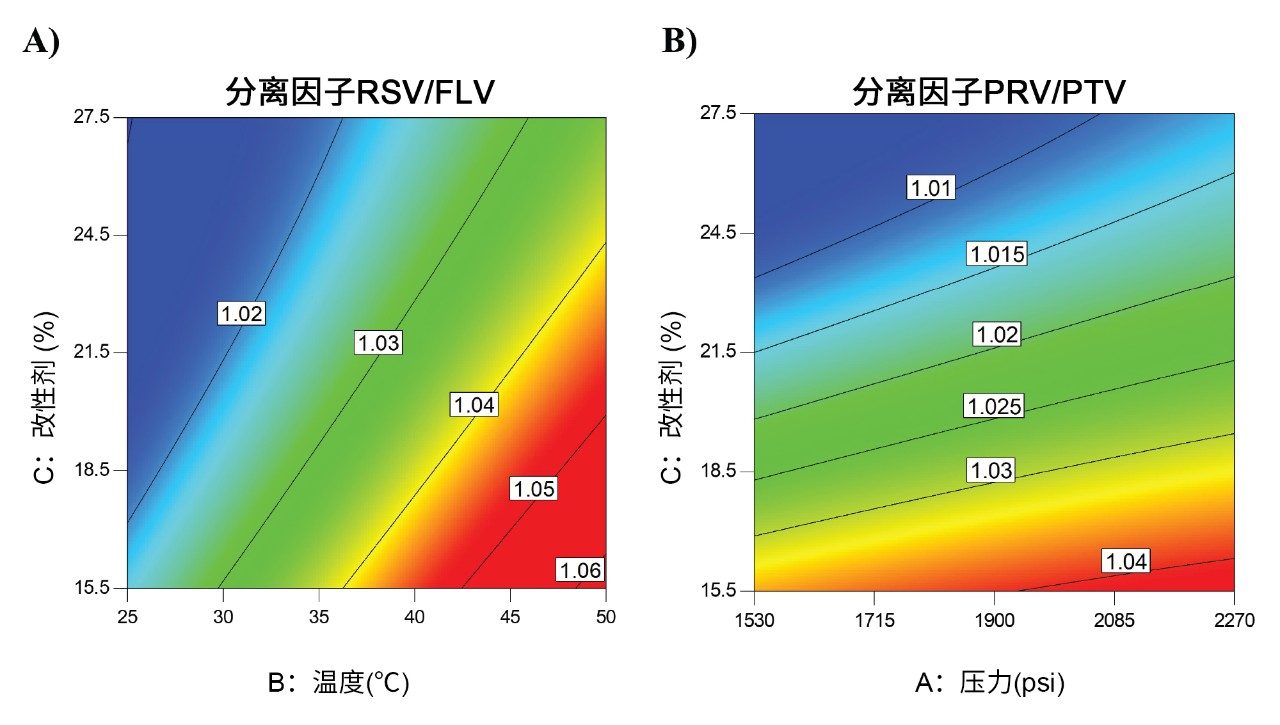
有趣的是,还观察到RSV与FLV之间的分离受到温度的巨大影响(图3A),而PRV与PTV之间的分离最主要受压力影响(图3B),结果朝向红色区域移动。这些影响在改性剂含量较低时更为明显,当流动相中的CO2含量较高时,流体更容易压缩。换言之,预计温度和压力对流体参数的影响更大。由此凸显了使用多变量方法研究影响SFC条件下的分离特性的参数的重要性。
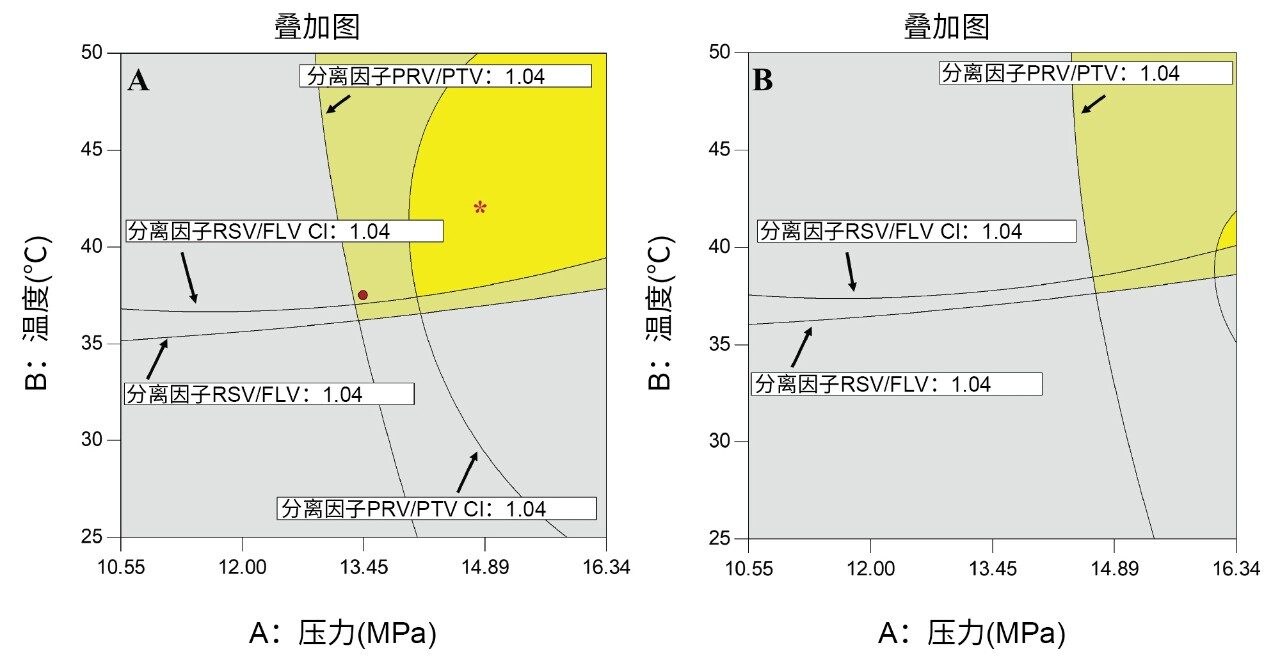
两对关键分析物的叠加图如图4所示,梯度结束时的有机改性剂含量为15.5%(图4A)和16.0%(图4B)。亮黄色区域显示了理想的响应区域。淡黄色区域显示了预测不确定性区域(平均预测值的95%置信区间)。灰色区域定义了不可接受的因子设置。
选择进行验证的方法条件为:温度42 °C,压力14.83 MPa,并且梯度洗脱条件为改性剂在4 min内从5%增加到15.5%,其处于亮黄色区域内并用星号(*)表示。通过比较图4A和4B可以看出,实现这一分离的关键变量是流动相中有机改性剂的百分比。这一理解只有在方法开发过程中使用CCD建模才有可能实现。
最后一步,评估流速以尝试缩短分析时间。观察到PTV与PRV峰之间分离度稍有改善(图5),因为增加流速也导致总压力升高,随后获得了更高的分离因子,如图3和4所示。图5显示了在初始流速(A, 1.50 mL·min-1)和选定流速(B, 1.80 mL·min-1)下得到的色谱图。流速的进一步增加将受限于压力限值(上限为41.4 MPa)
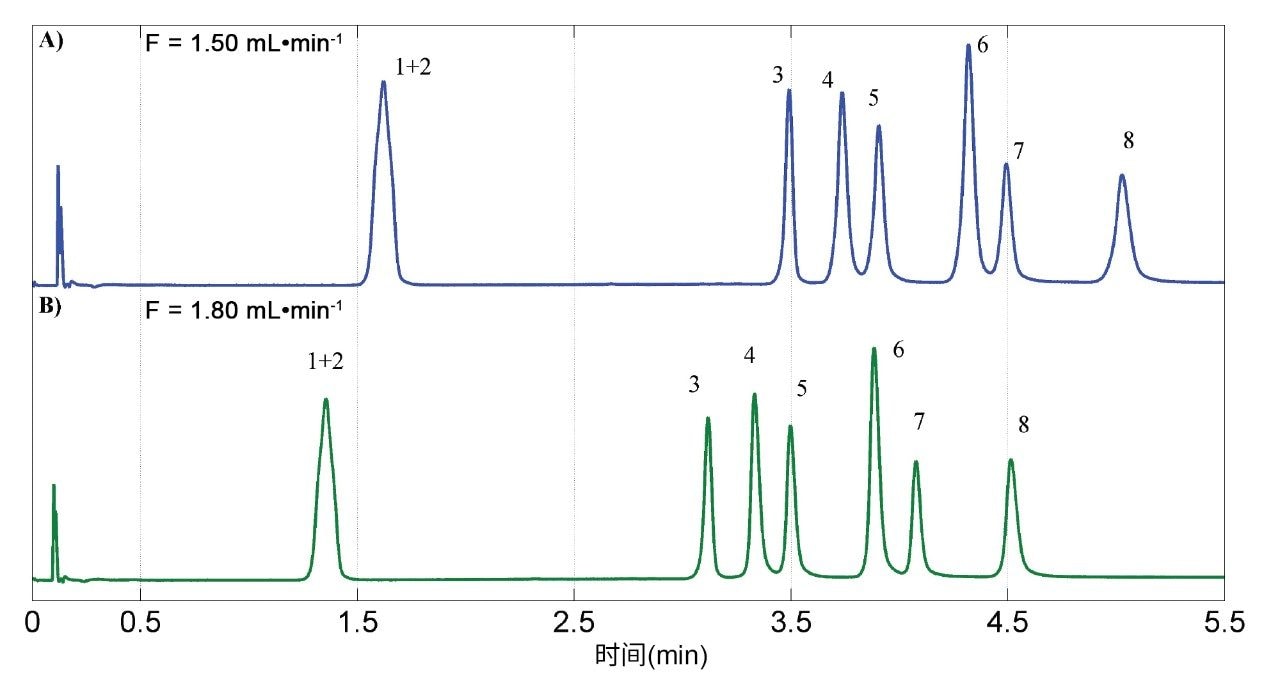
因此,经优化的方法条件为:Torus 1-AA 色谱柱,以乙醇:水95:5 v/v作为改性剂,流速为1.80 mL·min-1,压力为14.83 MPa,温度为42 °C,梯度洗脱条件为改性剂在4 min内从5%增加到15.5%,然后在15.5%下额外等度洗脱2 min,进样体积为1.0 µL18。为验证该方法,使用下一节所述的药物标准品,将PDA的检测条件设置为针对每种分析物采用特定的波长,范围为231 nm~244 nm。
方法验证
根据巴西最新指导原则验证该方法21。 第一步是通过进样分析空白溶液(仅稀释剂)、安慰剂样品和药物标准溶液来评估方法的选择性。除标准品外,未观察到任何信号。然后,通过将三份独立制备的储备液稀释至五个不同水平来制备校准标样。浓度范围为0.80 mg·mL-1~1.20 mg·mL-1,但PRV和PTV除外,其浓度范围为0.32 mg·mL-1~0.48 mg·mL-1。在验证中评估的性能表征为线性、准确度(体现为回收率)以及精密度(体现为日内和日间测量结果的变异系数)。未评估检测限和定量限,因为该方法仅拟定用于分析最终产品中的活性药物成分(API)。
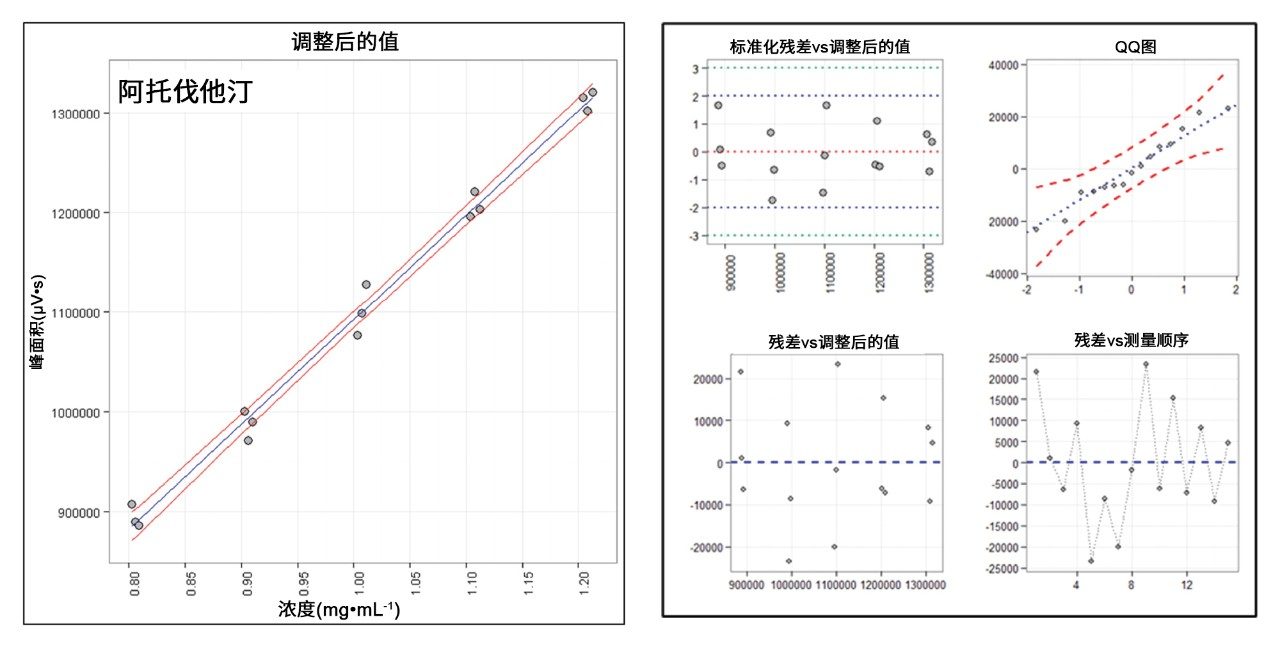
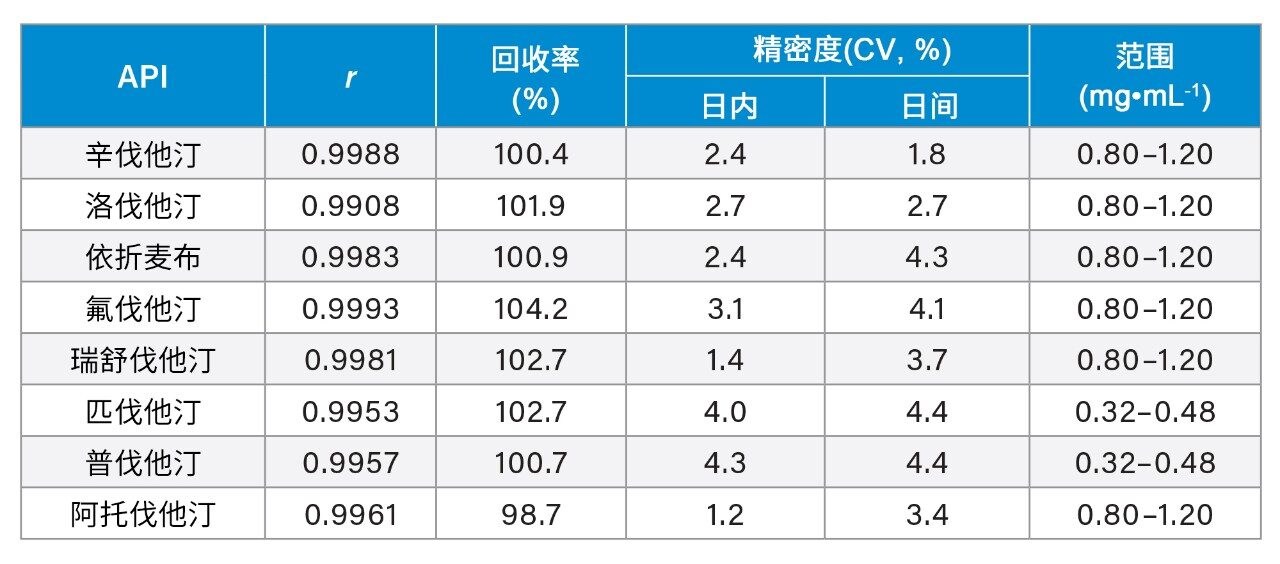
线性以Pearson相关系数(r)来衡量,结果不低于0.99。图6A作为示例显示了ATV的分析曲线,图6B则显示了相应回归的残差分析结果。选择ATV作为代表性药物的原因在于,它代表了药物史上最畅销的产品立普妥。表1总结了获得的性能表征。仅显示了100%分析水平下的回收率和精密度。根据Horwitz方程,预计所用浓度的变异系数不高于5.4%。回收率应处于95%~105%的范围内。所有检测的水平均处于这些范围内。
结论
本研究介绍了一种用于分析降胆固醇药物的ACQUITY UPC2方法的开发和验证,该方法使用现代Torus 1-AA色谱柱和少量乙醇(一种环保溶剂),无需在流动相中使用添加剂。顺序DoE方法可揭示压力、温度,尤其是改性剂含量等因素对超临界流体的洗脱强度的影响及其对分析物保留和分离的影响,为获得优化方法提供了关键的工具。
CCD结果有助于了解压力、温度和有机改性剂百分比对分析物的保留和分离的影响,并选择稳定的工作点进行验证。为实现所需的分离,有机改性剂的百分比是需要控制的关键变量。根据巴西最新指导原则,针对所有分析物对优化的方法进行了验证。结果发现,该方法准确、精密,r大于0.990,回收率在95%~105%之间,且精密度(日内和日间)不大于4.4%。对11种市售产品的分析表明,只有一种包含阿托伐他汀的产品不符合USP标准。因此,证明ACQUITY UPC²是分析这些药物的一种更环保的替代方案。
参考资料
- Global Health Estimates 2016: Deaths by Cause, Age, Sex, by Country and by Region 2000–2016, Geneva, World Heal.Organ.2018.
- D.S. Kazi, J.M. Penko, K. Bibbins-Domingo, Statins for Primary Prevention of Cardiovascular Disease, Med.Clin.North Am.101, 2017.689–699.doi:10.1016/j.mcna.2017.03.001.
- S. Nodari, P. Rocca, A. Saporetti, L. Bettari, A.L. Foresti, E. Tanghetti, M. Metra, L. Dei Cas, The Combination of Ezetimibe and Statin: A New Treatment For Hypercholesterolemia, Heart Int.3, 2007.12. doi:10.4081/hi.2007.12.
- L. Nováková, D. Šatínský, P. Solich, HPLC Methods for the Determination of Simvastatin and Atorvastatin, Trends Anal.Chem. 27, 2008.352-367.doi:10.1016/j.trac.2008.01.013.
- M.I. Beludari, K.V. Prakash, G.K. Mohan, RP-HPLC Method for Simultaneous Estimation of Rosuvastatin and Ezetimibe from their Combination Tablet Dosage Form, Int.J. Chem.Anal.Sci. 4, 2013.205-209.doi:10.1016/j.ijcas.2013.04.006.
- M. Campos‐Lara, J.A. Mendoza‐Espinoza, Development of a Selective Extraction Method for Pravastatin Quantification in Tablets using HPLC with Ultraviolet Detection, J. Liq.Chromatogr.Relat.Technol. 31, 2008.619-623.doi:10.1080/10826070701815288.
- T.D. Silva, M. a Oliveira, R.B. de Oliveira, C.D. Vianna-Soares, Development and Validation of a Simple and Fast HPLC Method for Determination of Lovastatin, Pravastatin, and Simvastatin, J.Chromatogr.Sci. 2012.
- L. Nováková, A. Grand-Guillaume Perrenoud, I. Francois, C. West, E. Lesellier, D. Guillarme, Modern Analytical Supercritical Fluid Chromatography Using Columns Packed With Sub-2-μm Particles: A tutorial, Anal.Chim.Acta. 824, 2014 18–35.doi:10.1016/j.aca.2014.03.034.
- L. Ferey, A. Raimbault, I. Rivals, K. Gaudin, UHPLC Method for Multiproduct Pharmaceutical Analysis by Quality-by-Design, J. Pharm.Biomed.Anal. 148 (2018) 361–368.doi:10.1016/j.jpba.2017.10.014.
- A. Grand-Guillaume Perrenoud, J.L. Veuthey, D. Guillarme, Comparison of Ultra-High Performance Supercritical Fluid Chromatography and Ultra-High Performance Liquid Chromatography for the Analysis of Pharmaceutical Compounds, J. Chromatogr.A. 1266, 2012.158-167.doi:10.1016/j.chroma.2012.10.005.
- A. Tarafder, Metamorphosis of Supercritical Fluid Chromatography to SFC: An Overview, Trends Anal.Chem. 81, (2016) 3–10.doi:10.1016/j.trac.2016.01.002.
- D.B. Hibbert, Experimental Design in Chromatography: A Tutorial Review, J. Chromatogr.B. 910, 2012.2-13.doi:10.1016/j.jchromb.2012.01.020.
- A. Dispas, P. Lebrun, B. Andri, E. Rozet, P. Hubert, Robust Method Optimization Strategy – A Useful Tool for Method Transfer: The Case of SFC, J. Pharm.Biomed.Anal.88, 2014.519-524.doi:10.1016/j.jpba.2013.09.030.
- V. Abrahamsson, M. Sandahl, Impact of Injection Solvents on Efficiency in Supercritical Fluid Chromatography, J. Chromatogr.A. 1306, 2013.80-88.
- E. Lesellier, C. West, The many faces of packed column supercritical fluid chromatography - A critical review, J. Chromatogr.A. 1382, 2015.2-46.doi:10.1016/j.chroma.2014.12.083.
- C. West, E. Lemasson, S. Bertin, P. Hennig, E. Lesellier, An Improved Classification of Stationary Phases for Ultra-High Performance Supercritical Fluid Chromatography, J. Chrtitomatography A. 1440, 2016.212-228.doi:10.1016/j.chroma.2016.02.052.
- C. West, E. Lesellier, Characterisation of Stationary Phases in Subcritical Fluid Chromatography With the Solvation Parameter Model: III.Polar Stationary Phases, J. Chromatogr.A. 1110, 2006.200-213.doi:10.1016/j.chroma.2006.01.109.
- I. M. Santana, I. C. S. F. Jardim, M. C. Breitkreitz, Sequential Design of Experiments Approach for the Multiproduct Analysis of Cholesterol-Lowering Drugs by Ultra-High-Performance Supercritical Fluid Chromatography, J. Sep. Sci., 43, 2020, 4234–4242.doi: 10.1002/jssc.202000702.
- P.K. Sahu, N.R. Ramisetti, T. Cecchi, S. Swain, C.S. Patro, J. Panda, An Overview of Experimental Designs in HPLC Method Development and Validation, J. Pharm.Biomed.Anal. 147, 2018.590-611.doi:10.1016/j.jpba.2017.05.006.
- L.R. Snyder, J.J. Kirkland, J.L. Glajch, Practical HPLC Method Development, John Wiley & Sons, Inc., Hoboken, NJ, USA, 1997.doi:10.1002/9781118592014.
- Agência Nacional de Vigilância Sanitária, Resolução RDC 166.2017.
720007390ZH,2021年11月