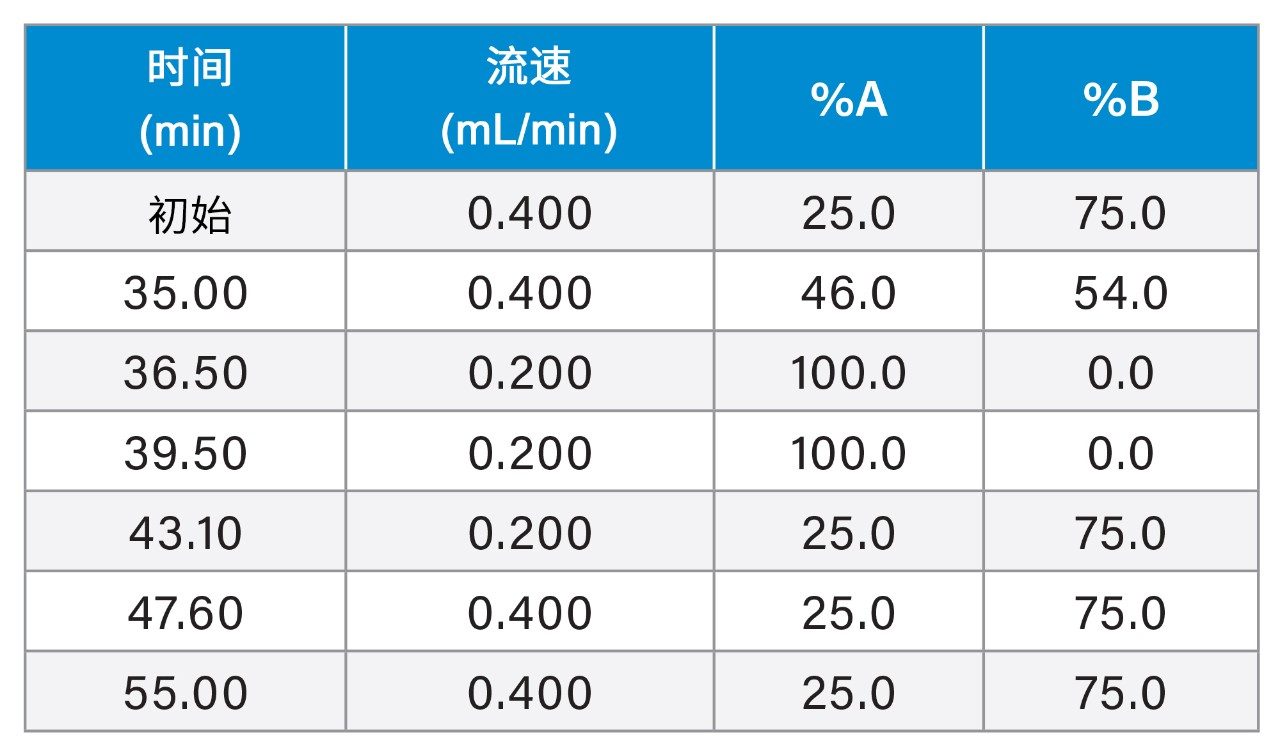
许多生物制药实验室并没有足够的资源将液相色谱仪器专用于单个分析方法。尽管二元液相色谱系统支持更严格的方法条件,例如通常与肽图分析方法相关的低流速和缓梯度,但无论采用哪种液相色谱平台,重要的是让所有分析都获得可重现的结果。本研究使用HILIC、HIC和SEC方法评估了ACQUITY UPLC H-Class PLUS Bio二元系统的性能,证明该系统为执行常见生物制药分析方法的适用液相色谱系统。
使用低流速和缓梯度条件使复杂样品获得理想分离度的分析方法是一些极难重现的方法。生物制药领域的肽图分析方法即属于此类方法,在该方法中,保留时间重复性对于峰的正确鉴定和定量至关重要。大多数开展肽图分析实验的科学家普遍认为,由于泵的设计方式存在根本差异,二元液相色谱系统相比于四元液相色谱系统可提供更准确、精密的梯度输送。虽然ACQUITY UPLC H-Class PLUS Bio二元系统已被证明可提供出色的肽图分析重复性1,2,但HIC、IEX或SEC等非变性分析方法通常不需要严格的二元泵即可提供可靠结果。四元液相色谱系统通常被视为一种更实惠的选择,其配备额外的在线溶剂瓶,因此具有更适合方法开发的额外优势。由于实验室并不一定有专门用于单个分析方法的仪器,因此证明无论采用哪种液相色谱平台均可获得所需的结果变得很重要。本研究评估了ACQUITY UPLC H-Class PLUS Bio二元系统执行过去不需要使用二元系统的方法所发挥的性能,确认该液相色谱系统适用于多数生物制药分析。
|
液相色谱系统: |
配备CH-A的ACQUITY UPLC H-Class PLUS Bio二元系统(二元) 配备CH-A的ACQUITY UPLC H-Class PLUS Bio系统(四元) |
|
色谱柱: |
ACQUITY UPLC BEH Amide糖基分析柱, 130 Å, 1.7 µm, 2.1 mm × 150 mm(部件号:186004742) |
||
|
波长: |
FLR检测;激发波长265 nm,发射波长425 nm |
||
|
进样体积: |
6 µL(RFMSt糖基标准品),1 µL(葡聚糖校准曲线标准品) |
||
|
柱温: |
60 °C |
||
|
流动相A: |
50 mM NH4HCO2,pH 4.4 |
||
|
流动相B: |
乙腈 |
半胱氨酸偶联的抗体偶联药物(ADC)由合作者提供,浓度为10 mg/mL,用1 M (NH4)2SO4(流动相A)稀释至2 mg/mL。
|
色谱柱: |
Protein-Pak Hi Res HIC色谱柱, 2.5 µm, 4.6 mm × 100 mm(部件号:186007583) |
||
|
波长: |
TUV检测,波长280 nm |
||
|
进样体积: |
10 µL |
||
|
柱温: |
25 °C |
||
|
流速: |
0.500 mL/min |
||
|
流动相A: |
1 M (NH4)2SO4溶于50 mM NaH2PO4/Na2HPO4中,pH 6.8 |
||
|
流动相B: |
50 mM NaH2PO4/Na2HPO4,pH 6.8 + 10%异丙醇 |
||
|
方法: |
流动相B在10 min内从0%增加到100%(总运行时间30 min) |
沃特世mAb大小异构体标准品(部件号:186009429),NIST mAb与非还原IdeS酶解NIST mAb片段的混合物,将其复溶于120 µL水中,最终浓度为1.5 mg/mL。
|
色谱柱: |
BioResolve SEC mAb色谱柱, 200 Å, 2.5 µm, 4.6 mm × 150 mm(部件号:176004592) |
||
|
波长: |
TUV检测,波长280 nm |
||
|
进样体积: |
5 µL |
||
|
柱温: |
35 °C |
||
|
流速: |
0.200 mL/min |
||
|
流动相: |
50 mM Na3PO4,pH 7.0,含200 mM氯化钾 |
||
|
方法: |
等度运行时间8.5 min |
|
质谱系统: |
ACQUITY QDa检测器 |
|
|
电离模式: |
ESI+ |
|
|
采集范围: |
350–1250 m/z |
|
|
毛细管电压: |
1.5 kV |
|
|
锥孔电压: |
15 V |
|
|
探头温度: |
400 °C |
Empower 3 FR4色谱数据软件
生物制药开发中通常会对游离寡糖进行表征和监测,现有工作流程已非常成熟,支持样品前处理、荧光和质谱检测,还提供用于数据处理和报告的信息学软件。过去,选择用于分析的液相色谱系统一直是四元液相色谱系统,因为使用的分析方法并不需要二元液相色谱系统所提供的性能。
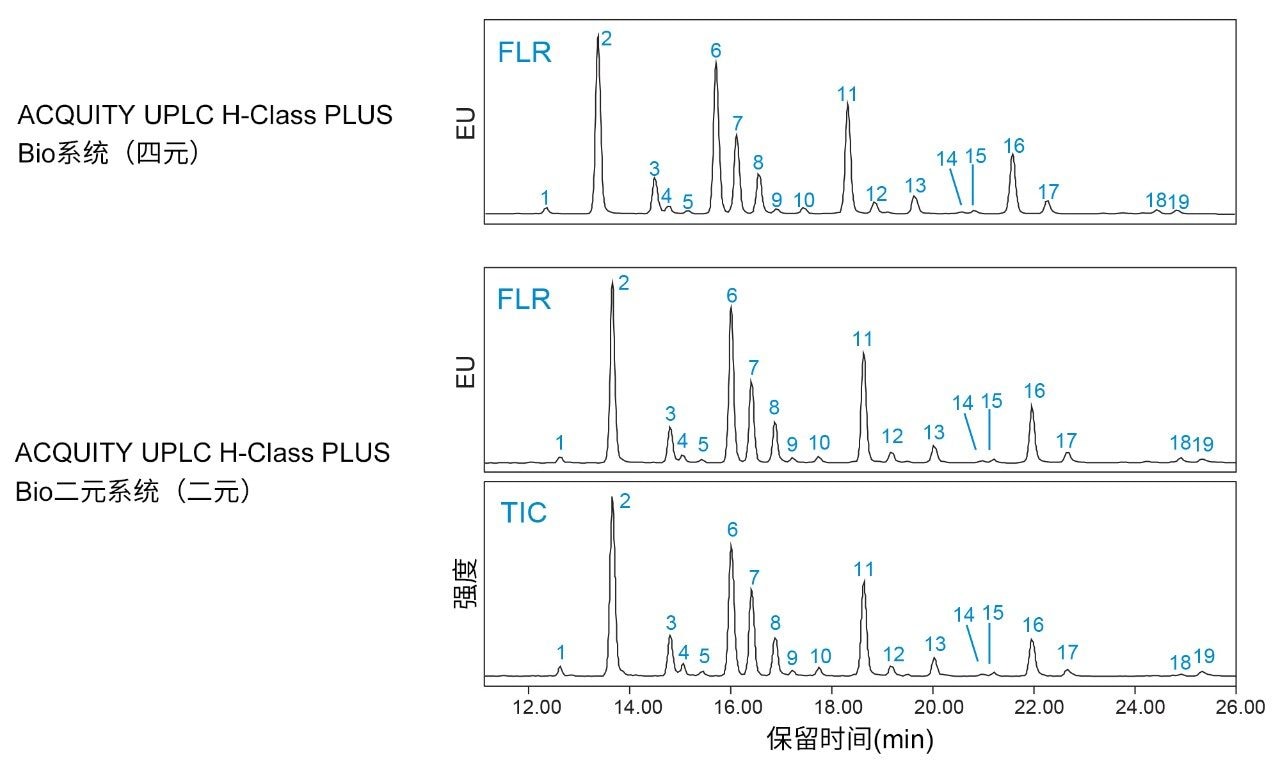
为评价ACQUITY UPLC H-Class PLUS Bio二元系统在糖基分析中的性能,我们使用RapiFluor-MS糖基性能测试标准品比较了采用该系统得到的结果与采用四元液相色谱所获得的结果。图1展示了在二元和四元液相色谱系统上进行一系列进样所得到的代表性色谱图。该标准品包含19种已鉴定N-糖,已在色谱图中标记3。四元液相色谱系统和二元液相色谱系统得到相似的色谱图,19个峰中各峰的相对丰度相似。在二元液相色谱系统中,FLR检测器后方在线安装了ACQUITY QDa检测器,用于确认FLR流通池的压力不会因质谱检测器压力增加而超出规格。FLR流通池的压力约60 psi,远低于仪器规格。增加ACQUITY QDa检测器还可采集补充质谱数据,如图1中相应的TIC(下图)所示,以增加糖基分析的灵活性。
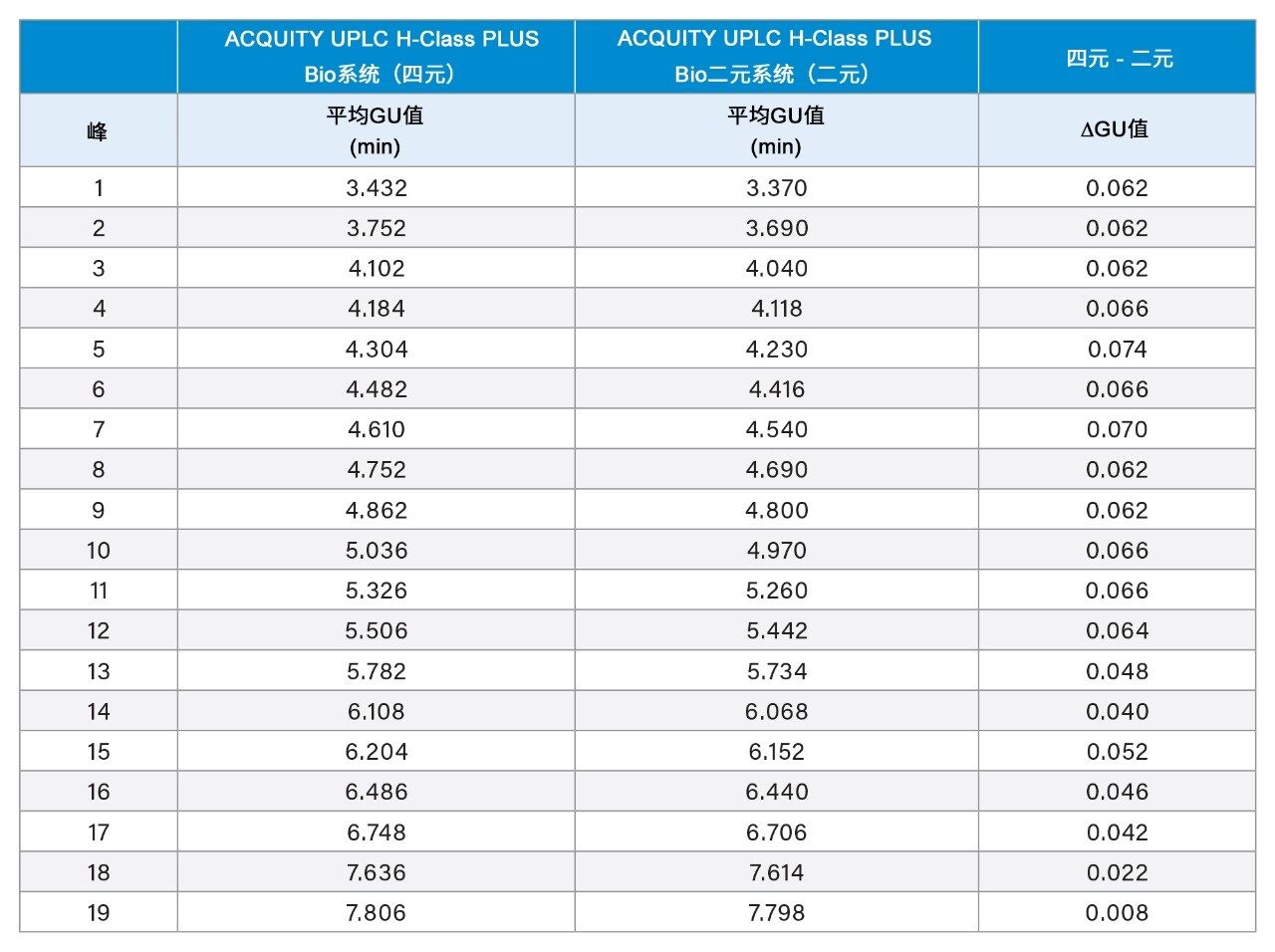
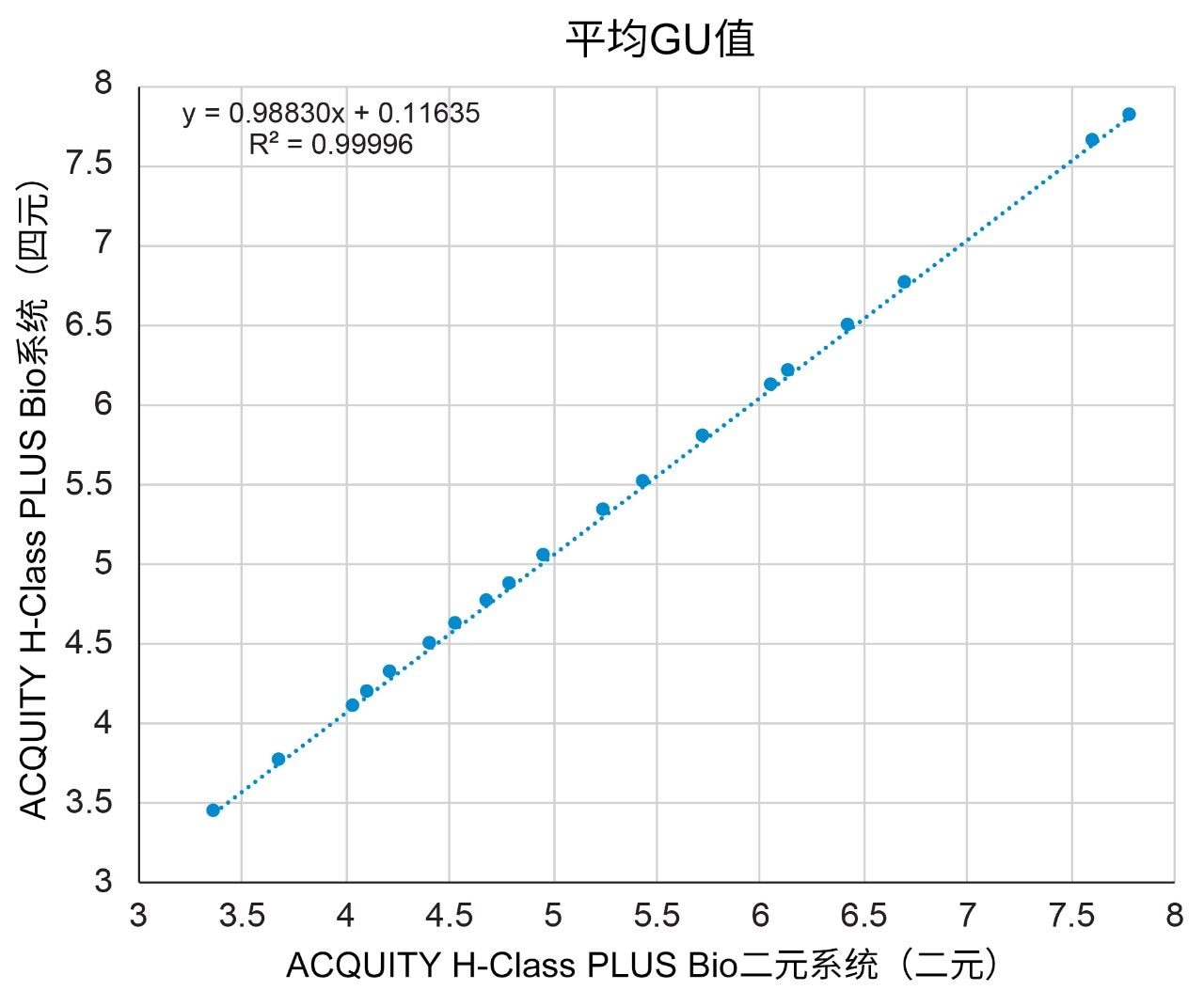
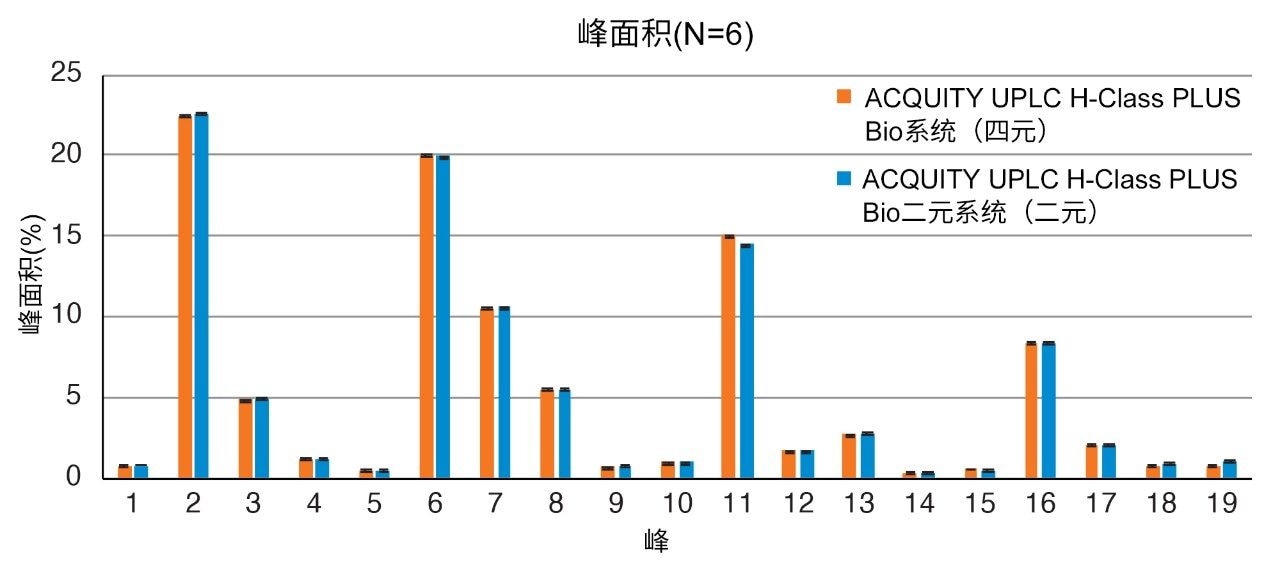
根据葡萄糖单位(GU)值鉴定糖基可减小因不同液相色谱系统引起的保留时间差异。通过葡聚糖校准曲线标准品测定GU值,该标准品可将葡萄糖多聚体的洗脱时间与糖基保留时间关联。为了更系统地比较结果,测定19个标准品峰中各峰的GU值,取5次进样结果的平均值(表1)。两种液相色谱系统之间的GU值差异也列于表1中,其中平均GU值差异小于0.1 (3.5 s)。这一差异完全处于GU重复性的预期范围内;如果需要,用户可以参考沃特世GU科学数据库。还使用各系统的平均GU值相互作图,观察选择性是否存在任何差异(图2),得到的R2值为0.99996,说明两种液相色谱平台之间的结果高度相似。采用这两种系统得到的峰面积百分比也高度相似(图3)。在大多数情况下,峰面积差异可忽略不计(19个峰中有16个峰的峰面积差异小于0.06%)。观察到的最大峰面积差异为峰11的0.6%,这一结果同样可忽略不计,因为峰11的含量约为15%且丰度较高。这些数据表明,ACQUITY UPLC H-Class PLUS Bio二元系统可用于游离寡糖分析,且获得的结果与使用四元液相色谱平台获得的结果相当。
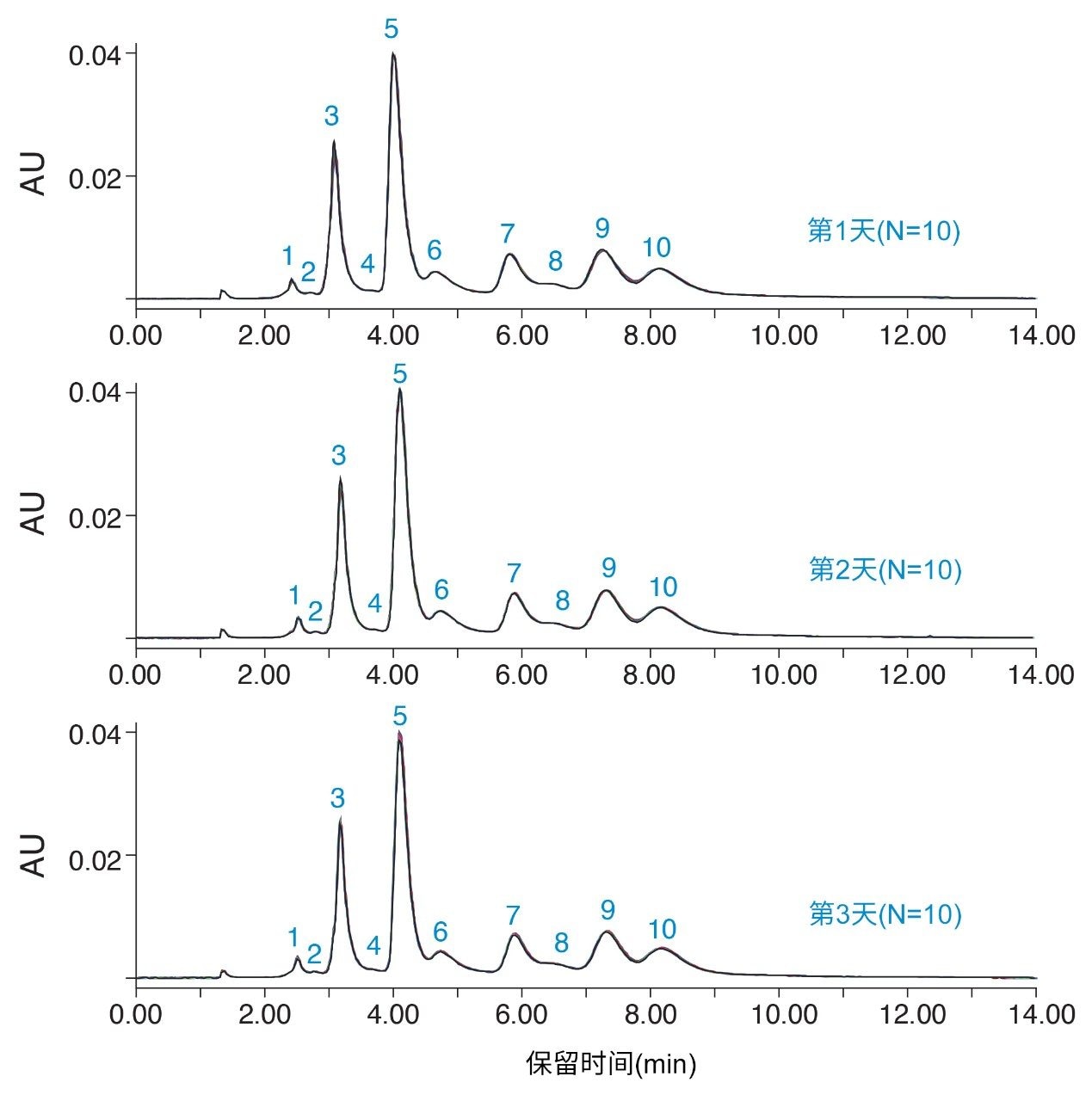
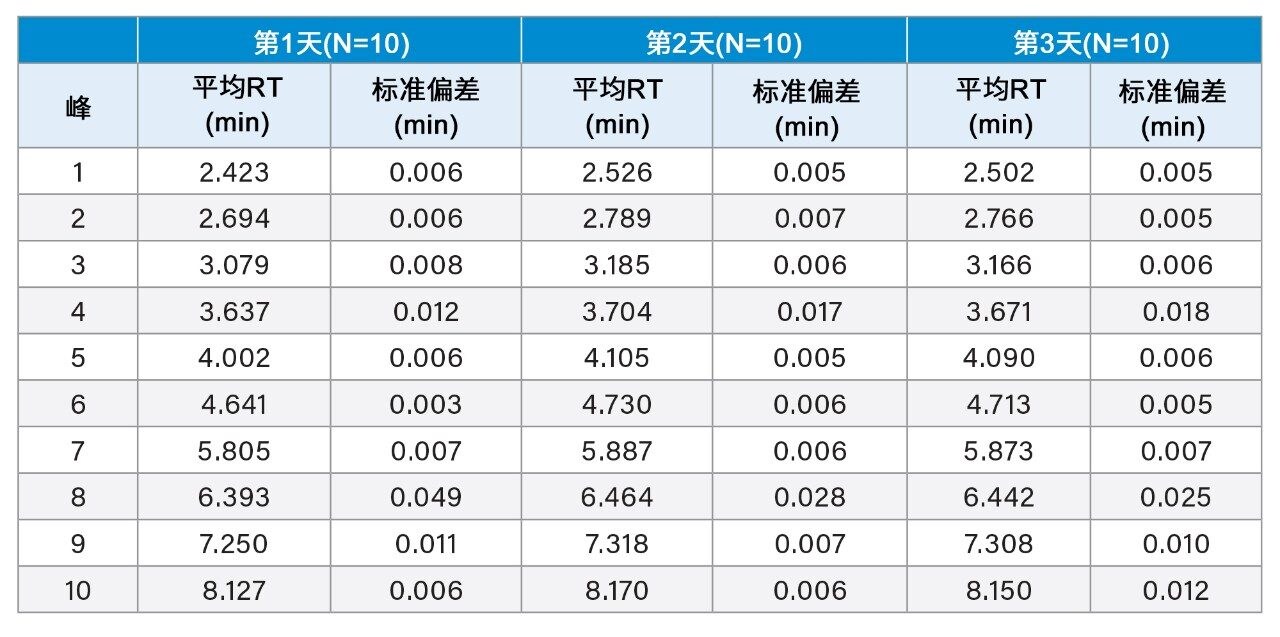
天然或非变性蛋白质分离通常需要使用高盐浓度流动相。尽管低扩散液相色谱系统通常是实现最佳性能和分离度的理想选择,但与传统HPLC系统相关的宽径管路相比,窄径管路可能更容易发生堵塞和沉淀。为评价ACQUITY UPLC H-Class PLUS Bio二元系统在长时间暴露于高盐浓度环境后的堵塞和沉淀情况,采用分析ADC的HIC方法进行了多天研究。具有无毒有效负载的半胱氨酸偶联ADC由合作者提供,以2 mg/mL的浓度进样至Protein-Pak Hi Res HIC色谱柱(2.5 µm, 4.6 mm × 100 mm)。实验方式为,在4次空白进样(流动相A)后进行1次样品进样。该进样系列重复10次,样品组的总运行时间为25 h。每天制备新鲜的流动相和样品,连续3天进行实验。图4展示了每天25 h运行时间得到的每5次ADC进样的叠加色谱图,该色谱图在各个数据集中很好地重叠,与随后每天的结果也很好地对齐。在色谱图中鉴定出10个峰,它们的平均保留时间见表2。数据集中每个峰的保留时间标准偏差可忽略不计,3天内每天的平均标准偏差小于1 s。由于流动相配制不同,不同日期之间的保留时间会存在细微差异。
根据药物偶联比(DAR)评价同一数据集的峰面积。DAR是指与抗体偶联的平均药物数量,是ADC的重要质量属性之一。由于有效负载通过二硫键偶联,因此DAR可能为0、2、4、6和8。图5展示了色谱DAR分布及相应的峰面积百分比条形图,观察到每个数据集的标准偏差都很低。此外,3天中每天的结果均处于彼此的误差范围内。
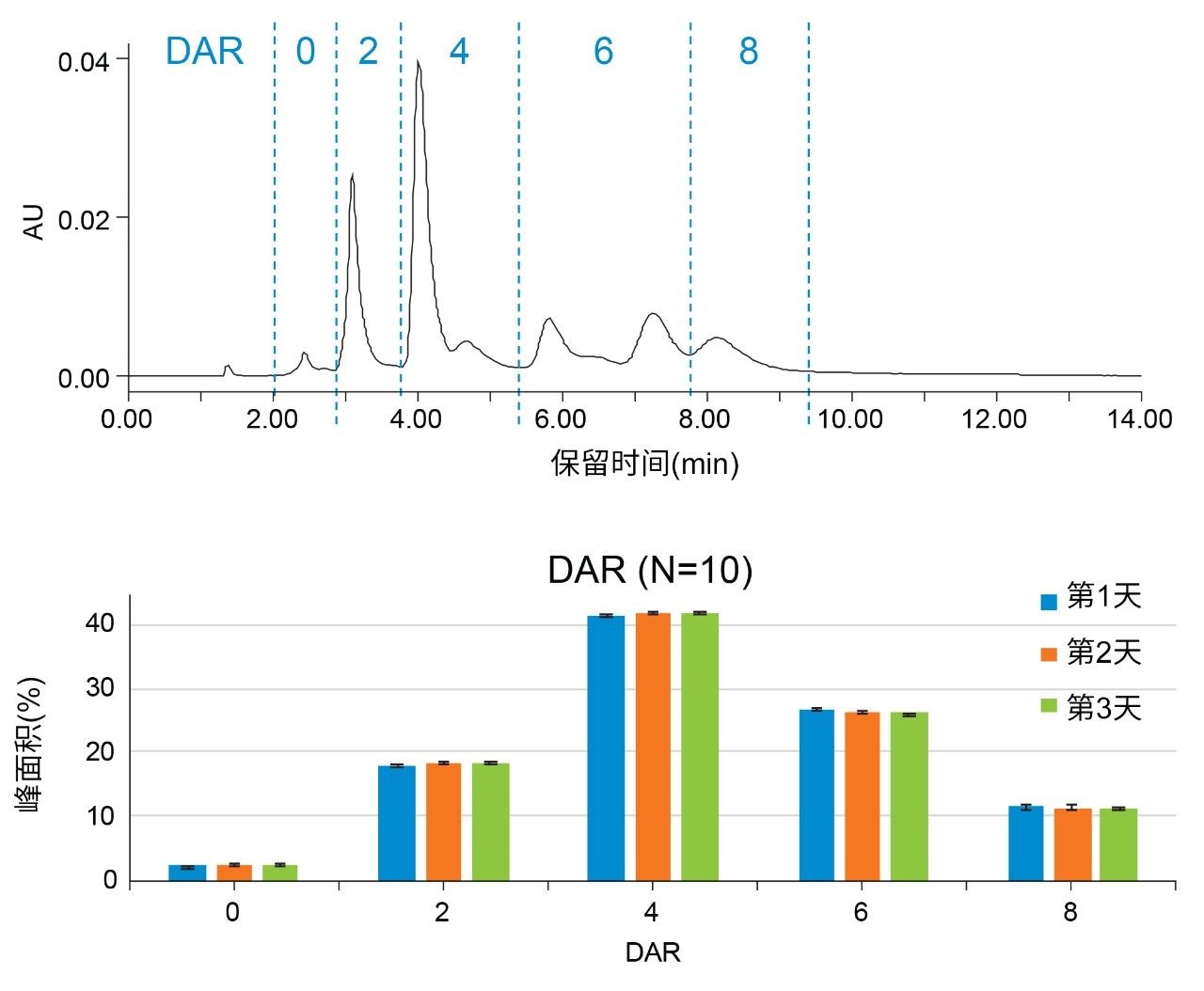
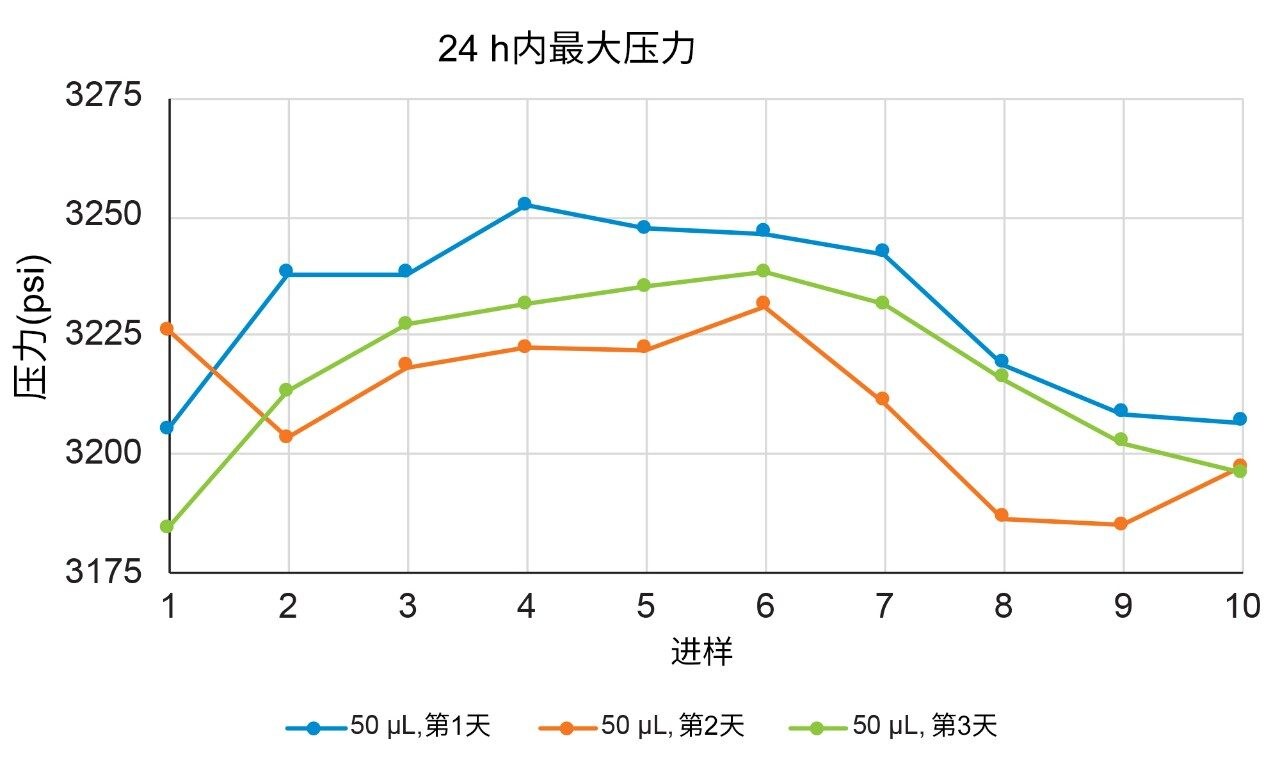
根据保留时间和峰面积重现性评估结果,无证据表明色谱柱或液相色谱系统发生堵塞或盐沉淀。报告的标准偏差符合系统规格,且在数据采集过程中未观察到明显漏液。为进一步考察发生这些隐患的可能性,研究了每个进样系列过程中的压力迹线。盐沉淀可表现为压力(和光学)迹线中的尖峰,但在所有空白进样中都观察到可重现的无噪音基线(数据未显示)。通过对每次ADC运行中观察到的最大压力作图,发现3天研究中的压力保持稳定,每个样品组的压力变化约为50 psi。如果发生色谱柱或液相色谱系统堵塞,预期压力将在进样系列过程中以及在多天内随着色谱柱进样次数增多稳步增加,但并未发生这种情况。ACQUITY UPLC H-Class PLUS Bio二元系统为使用所测试的条件进行高盐浓度分离提供了一种适用解决方案。
SEC是生物制药开发中使用的常规分析方法,过去用于评估蛋白质聚集或高分子量物质(HMWS)。使用大粒径色谱柱和高扩散液相色谱系统的传统方法无法使片段或碎片等低分子量物质(LMWS)获得最佳分离度。随着新型色谱柱技术和低扩散液相色谱系统的出现,可以更好地分离这些LMWS,从而实现更准确地定量,提高结果可信度并且更深入地了解结果。
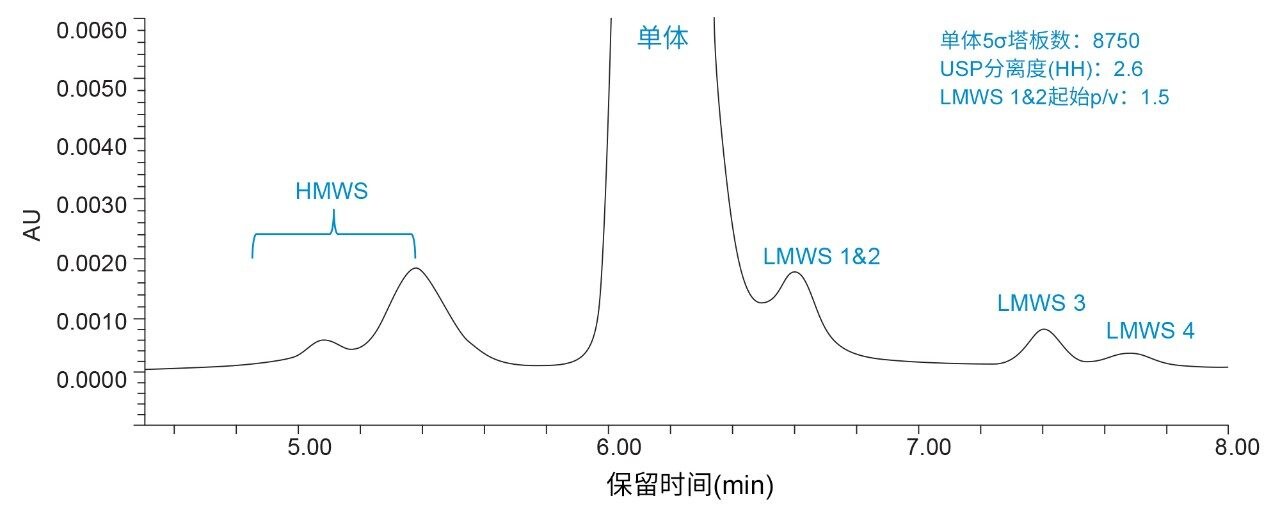
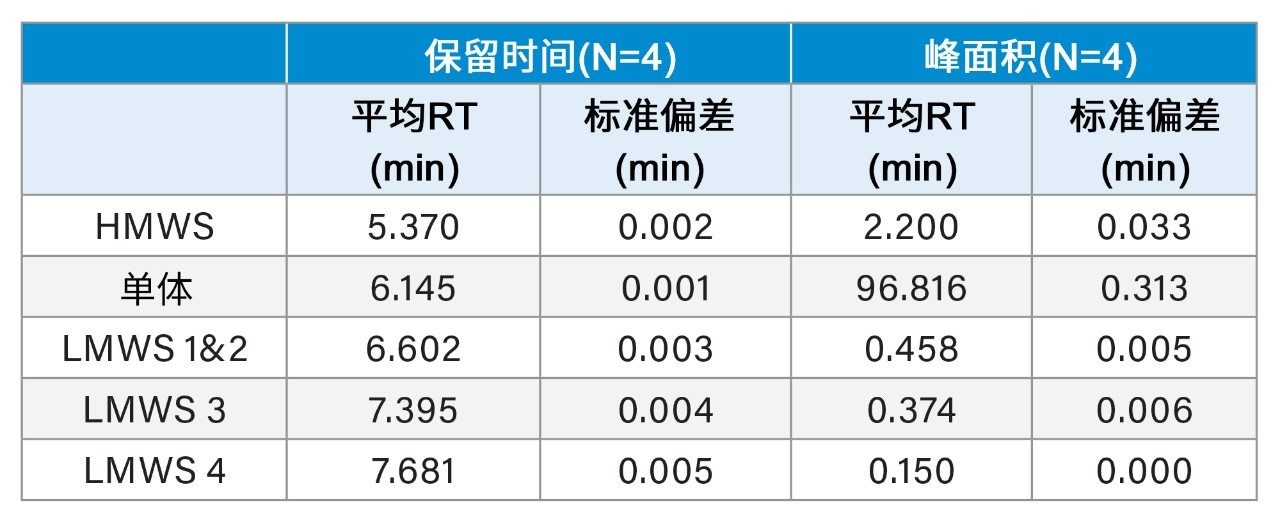
将BioResolve SEC mAb色谱柱(2.5 µm, 4.6 mm × 150 mm)与ACQUITY UPLC H-Class PLUS Bio二元系统(一款低扩散液相色谱系统)结合使用,以证明沃特世mAb大小异构体标准品单体与LMWS能够实现足够高的分离度(图7)。从色谱图中可以看出,如预期一样,由于分子量差异较大,HMWS与单体实现了良好分离。使用传统色谱柱和液相色谱系统时通常与单体峰共洗脱的LMWS 1&2也得到充分分离,即使使用柱长较短的色谱柱也是如此。为进一步评价结果,列出了峰面积和保留时间(表3)。无论相对峰面积百分比如何,所有物质的结果均表现出高重现性。通过将更多现代先进技术融入开发和QC环境,与传统方法相比,常规分析可提供更多信息。
我们之前的研究已经证明,ACQUITY UPLC H-Class PLUS Bio二元系统为需要低流速和缓梯度的方法提供了出色的性能。由于许多实验室并没有足够的资源将液相色谱系统专用于单个分析,因此使分析方法在不同液相色谱平台之间迁移时产生可靠的结果至关重要。利用HILIC、HIC和SEC方法评估ACQUITY UPLC H-Class PLUS Bio二元系统执行更常用于四元液相色谱系统的方法时所发挥的性能。本研究评价的所有方法均可直接使用,无需对传统使用的方法条件进行任何更改或予以特别考虑,证明ACQUITY UPLC H-Class PLUS Bio二元系统适用于常见生物制药的色谱分析方法。
720007304ZH,2021年7月