LipidQuan在前列腺癌研究以及不同方法治疗效果考察中的应用
仅供研究使用,不适用于诊断。
摘要
借助稳定耐用且可重现的脂质靶向定量方法区分各期前列腺癌(PCa)和相应治疗手段,是转化研究的关键领域。本应用纪要介绍了如何通过便于部署的LipidQuan平台来开发靶向分析方法,同时使用Quanpedia数据库降低方法开发和培训成本。该数据库收录了2000多种脂质,鉴定和鉴别均得到改善(例如,使用两个脂肪酰基链碎片离子作为磷脂相关的MRM可增加专属性)。使用TargetLynx软件和第三方信息学软件(即Skyline)实现快速数据处理和数据可视化,为研究人员充分发挥灵活性。我们通过评估线性动态范围、准确度和精密度等参数,证实了方法的重现性和稳健性。定量重要脂质有助于在使用该方法的PCa前导研究中确定组间差异。
优势
- 能够区分各期前列腺癌(PCa)和相应治疗手段的脂质靶向定量方法
- 使用Quanpedia构建性能稳定、便于部署的平台,降低方法开发和培训成本
- 使用两个脂肪酰基链碎片离子的MRM通道改善磷脂的鉴定和鉴别
- 使用TargetLynx软件和第三方信息学软件(即Skyline)实现快速数据处理和数据可视化,充分发挥灵活性
简介
前列腺癌(PCa)是一种相对常见的癌症(占全球癌症的40%),但在诊断和预后方面仍然存在挑战1。 在目前可用于临床实践的少数血液蛋白质生物标志物中,前列腺特异性抗原(PSA)水平最为常见,但PSA本身并不准确,主要是因为没有可靠的PSA范围能够明确提示存在PCa2。 分析准确度、精密度和灵敏度仍未达到要求。因此,研究该疾病的潜在生物标志物和可测量特征仍然是转化研究的一个关键领域。
研究人员已经在多项研究中确定,溶血磷脂酰胆碱(LPC)、磷脂酰胆碱(PC)、溶血磷脂酰乙醇胺(LPE)、磷脂酰乙醇胺和鞘磷脂(SM)可以作为表征PCa的诊断特征4,5。 最近,一项分别结合脂质和蛋白质测量的多组学研究也发现了在确定可能患有前列腺癌的男性疾病状态方面适用性更强的生物标志物6。
本文介绍了LipidQuan工作流程7的应用,通过该工作流程开发出一种极性切换方法,用于定量前列腺癌相关生物分子过程中涉及的关键脂质,以及不同治疗方法的差异。
实验
样品
混合42例受试者的血清样品,建立表型组。这些混合样品包括对照(确诊PCa的受试者)(n=6)、主动监测(AS) (n=6)、近距离放射治疗(n=6)、仅激素治疗(n=6)、健康对照(n=6)、放射治疗联合激素治疗(n=6)和前列腺切除术(n=6)。
使用Avanti Odd-Chained LIPIDOMIX在异丙醇中制备10倍、20倍和50倍稀释的三种加标溶液。对于所有可用的脂质标准品,在玻璃样品瓶中将纯净的混标和加标溶液以低于5% v/v的水平(尽量减小加标对基质的影响)直接加标到混合后的“对照血浆”(使用抗凝剂K2 EDTA)中,生成10点校准曲线和3个QC水平(LQC、MQC和HQC)样品,浓度范围为5 ng/mL~423,750 ng/mL。使用购自Sigma Aldrich(英国多塞特吉林汉姆)的研究标准品(SR)混合物进行QC,其中包含冷冻人血浆中的所有7个混合样品和NIST SRM 1950-代谢物。
样品前处理
首先取25 µL等份校准品、质控品和样品转移到LoBind微量离心管(Eppendorf,德国汉堡)中。向每个孔板中加入125 µL异丙醇/乙腈(1:2, v/v),其中包含500倍稀释的纯氘代Ceramide LIPIDOMIX和SPLASH LIPIDOMIX作为内标,双空白样品除外。内标混合物涵盖多种脂质,由重(d7-d9)同位素组成。双空白样品使用异丙醇/乙腈(1:2, v/v)制备,不含内标。将样品涡旋混合30秒,然后在5 °C下振荡培养2小时,确保蛋白质完全沉淀。提取的样品在10 °C以3000 g离心20分钟,然后将上清液转移到全回收UPLC样品瓶(Waters,部件号186005669CV)中供LC-MS分析。
液相色谱条件
|
液相色谱系统: |
ACQUITY Premier I-Class流通针式(FTN) |
|
色谱柱: |
ACQUITY Premier UPLC BEH Amide 2.1 x 100 mm, 1.7 μm,部件号:186009505 |
|
柱温: |
45 °C |
|
流速: |
0.6 mL/min |
|
流动相: |
95:5乙腈/水 + 10 mM醋酸铵(A);50:50乙腈/水 + 10 mM醋酸铵(B) |
|
梯度: |
流动相B在2 min内从0.1%升至20.0%,然后在3 min内从20%升至80%,随后重新平衡3 min |
|
运行时间: |
8 min |
|
进样体积: |
1 μL |
质谱条件
|
MS系统: |
Xevo TQ-XS |
|
电离模式: |
ESI (+/-) – 极性切换 |
|
毛细管电压: |
2.8 kV (+) 1.9 kV (-) |
|
采集模式: |
MRM |
|
离子源温度: |
120 °C |
|
脱溶剂气温度: |
500 °C |
|
锥孔气流速: |
150 L/h |
|
脱溶剂气流速: |
1000 L/h |
|
雾化气: |
7 bar |
|
离子导入装置偏移1: |
3 V |
|
离子导入装置偏移2: |
0.3 V |
信息学软件
使用沃特世靶向组学方法库(TOML)生成这些方法,该方法库中包含LC条件、MS方法和相关的TargetLynx处理方法(包括保留时间和MRM通道)。使用TargetLynx或Skyline(华盛顿大学MacCoss实验室)处理所得数据。
结果与讨论
本研究在诊断为前列腺癌的受试者、接受各种治疗的患者和健康受试者中收集血清样品并使用LipidQuan平台进行了靶向脂质分析。LC-MS分析样品使用上一节描述的样品前处理方法制备。从沃特世靶向组学方法库(TOML;www.waters.com/targetedomics)网站下载LipidQuan方法包并导入MassLynx。
该方法包所含的Quanpedia方法文件中包含2000多种脂质的色谱设置和MRM通道。使用Quanpedia文件导入预填充的方法文件可省去LC-MS/MS设置的手动输入操作,避免任何潜在的数据转录错误。在本研究中,我们生成了一种靶向极性切换LC-MS方法,使用Quanpedia数据库监测39种内源性脂质,种类包括Cer、LPE、LPI、PG、PI和SM(图1)。该方法可在两种极性模式下测量和定量4种LPE物质。
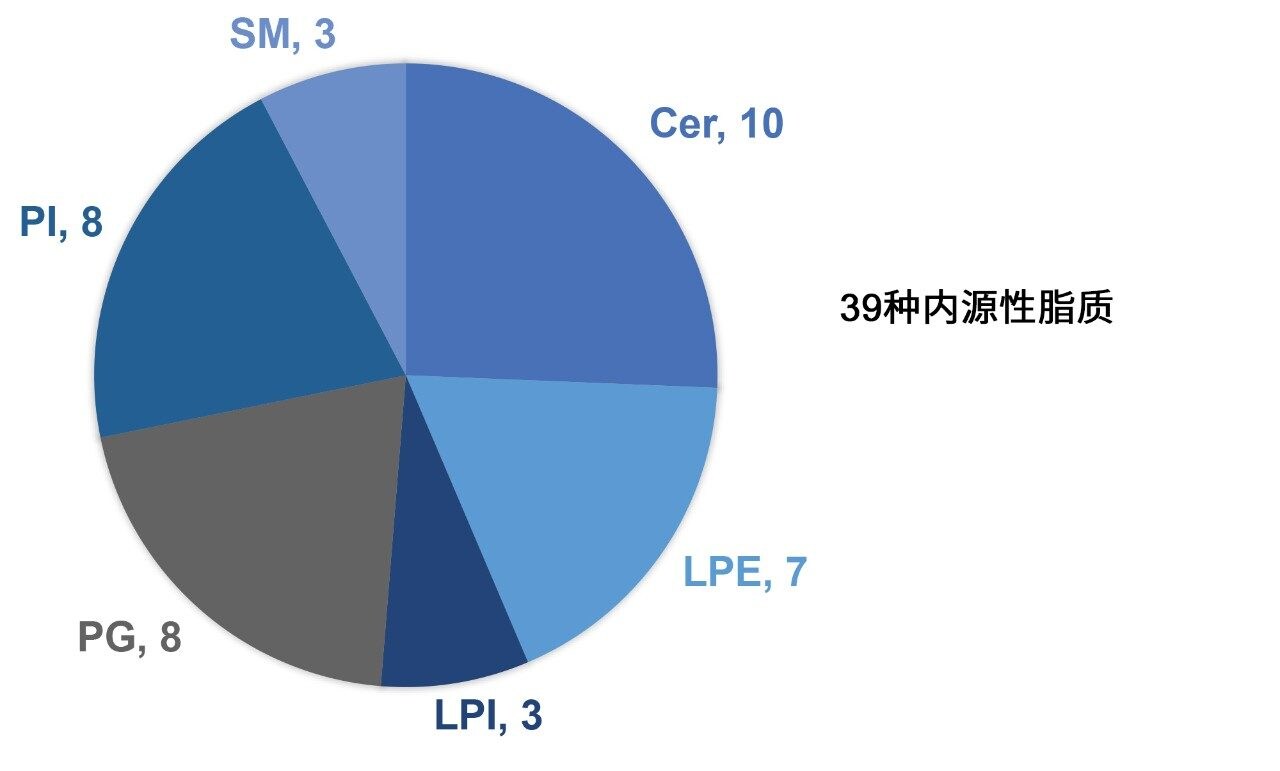
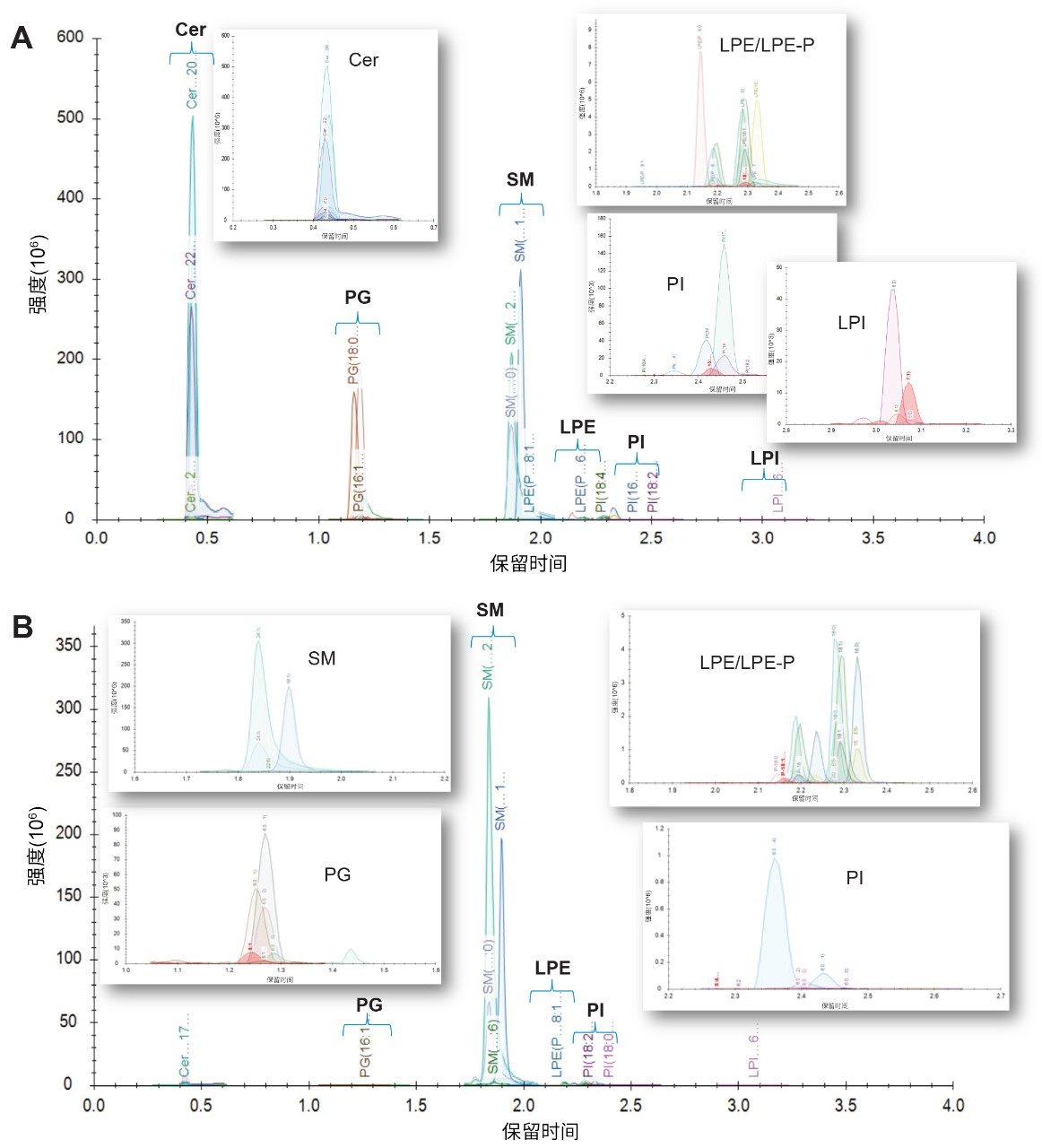
该解决方案包含32种标准品,涵盖了可用的关键分析物和其他感兴趣的类别,用于在方法开发过程中确认脂质鉴定结果、保留时间和MRM通道。色谱图示例如图2A所示。以随机顺序重复进样混合样品,然后进样以3个浓度水平加标奇链标准品的QC样品,以及SR和NIST样品。在运行开始和运行结束时分析校准曲线样品。研究样品的代表性色谱图如图2B所示。
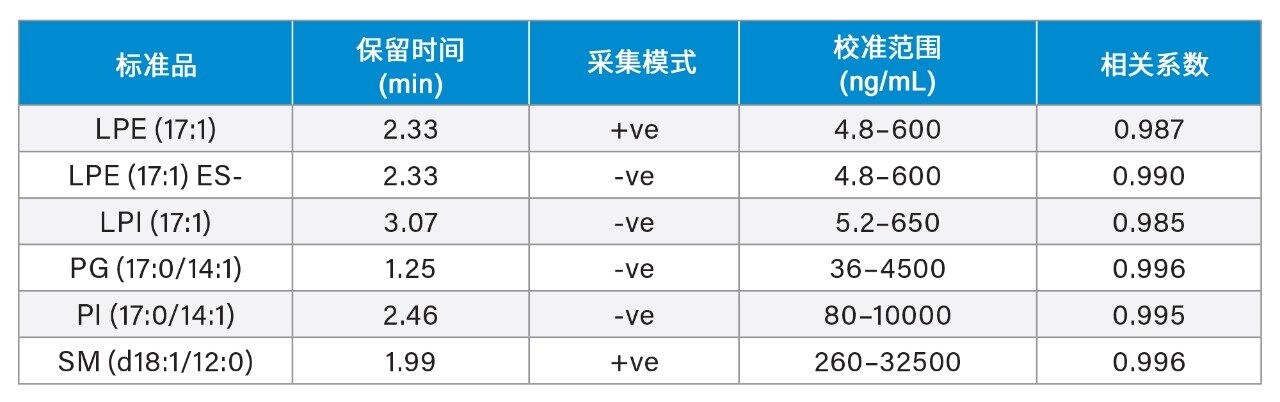
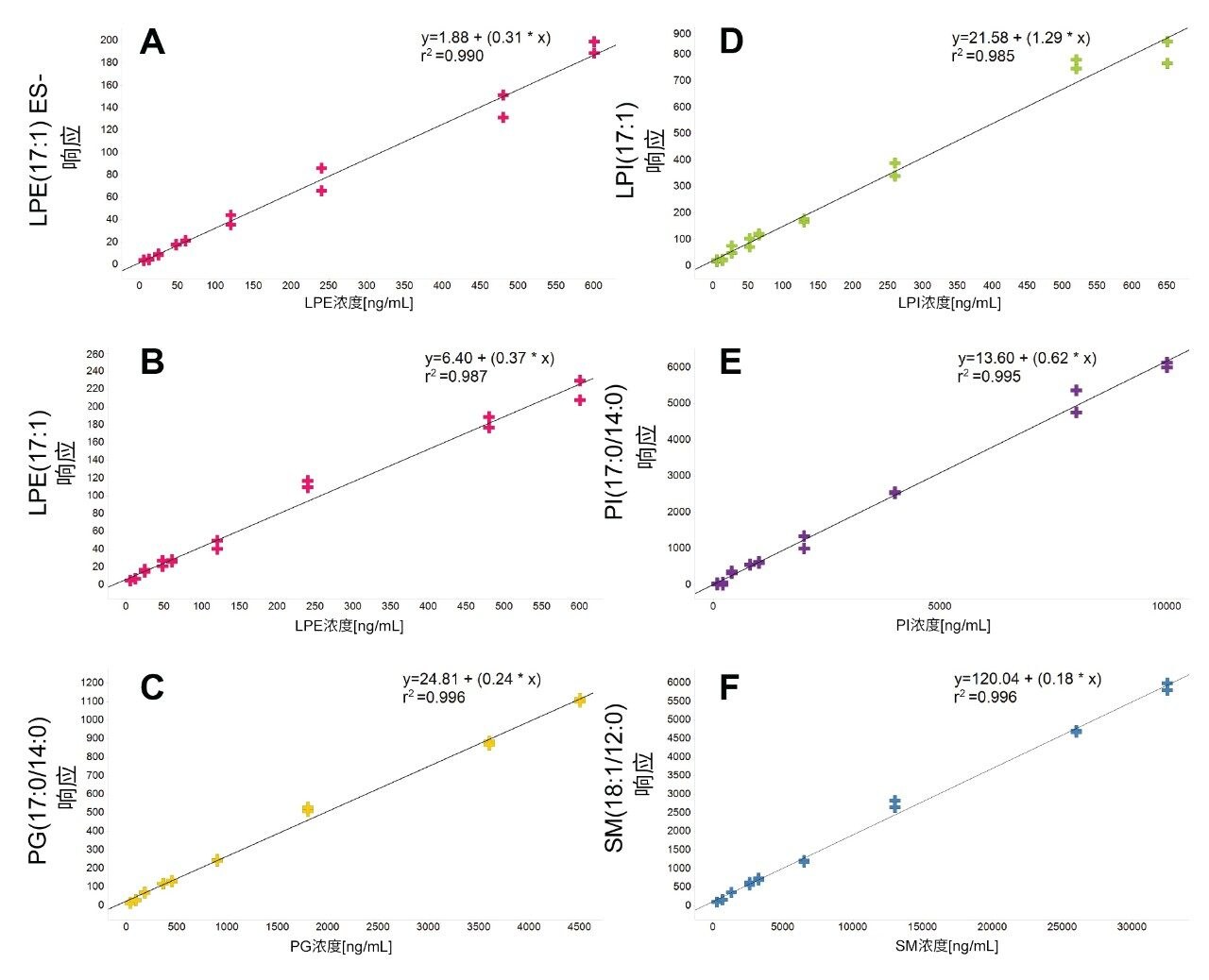
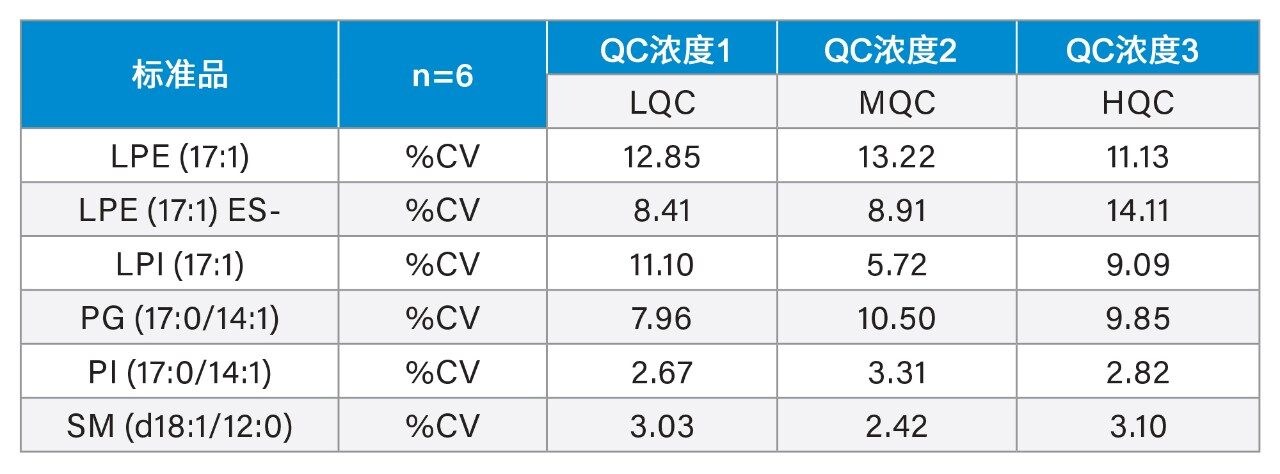
使用萃取前加标已知浓度标准品的血浆样品制备标准曲线用于定量分析。将校准品和内源性脂质的峰面积响应归一化为氘代SIL响应用作内标。对于表1所述范围内的各种目标脂质类别,使用奇链脂质标准品评估浓度的线性响应。典型的R2值范围为0.985–0.996,校准曲线示例见图3。使用加标奇链标准品的3个浓度QC样品监测方法精密度。这些QC样品的箱线图见图4。表2中的结果表明,整个采集过程中的变异系数(CV)均低于15%。这些结果证实了数据质量的可靠性,表明可在分析过程中准确、精密地测量目标内源性脂质。
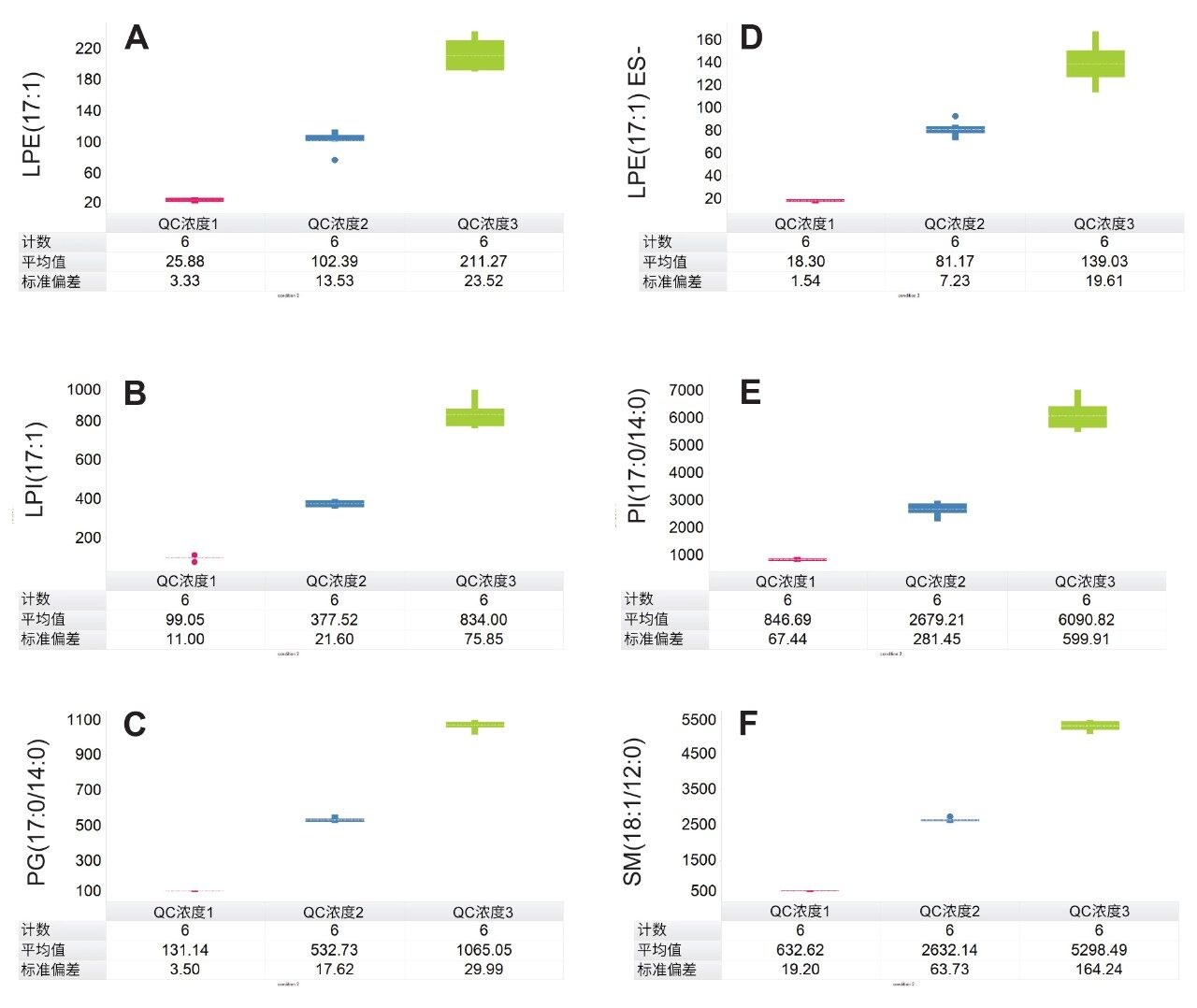
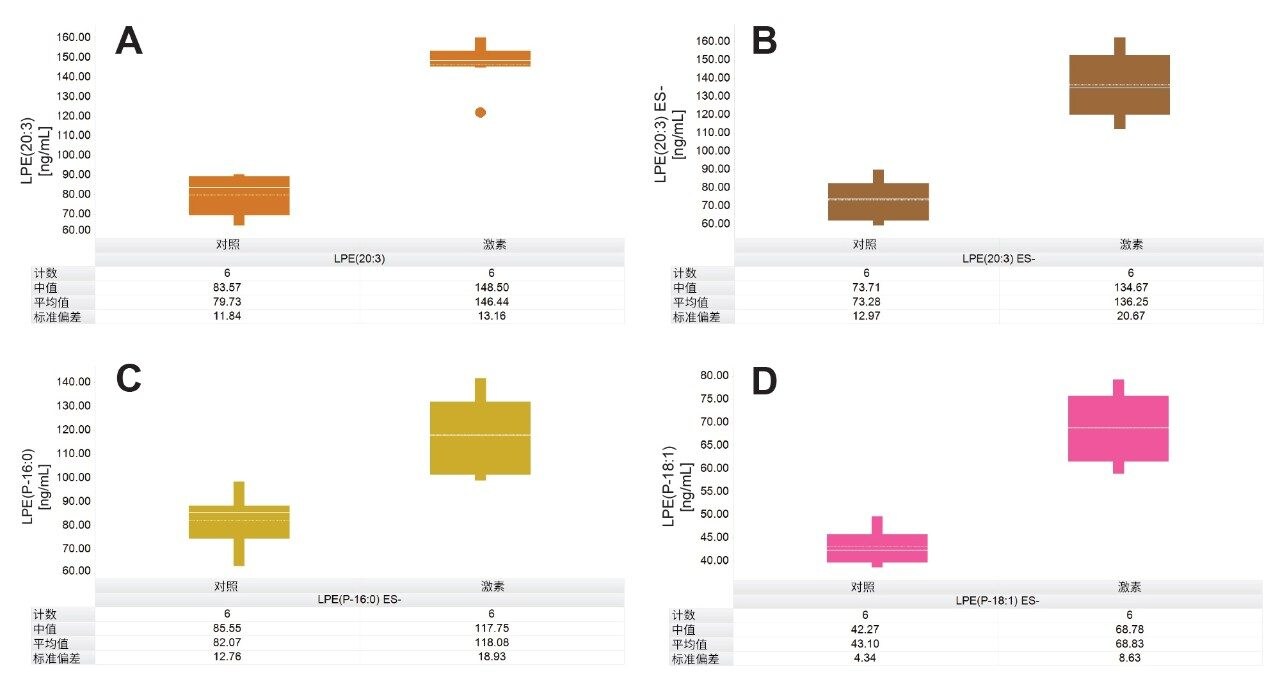
脂质组学分析着重考察了多种重要脂质,包括SM、Cer和LPE。例如,LPE(20:3)、LPE(P-16:0)和LPE(P-18:1)是区分对照患者(即诊断为PCa的受试者)和激素治疗患者的关键脂质。图5显示了比较这些LPE的计算浓度水平的箱线图。LPE(20:3)的浓度同时在正离子和负离子模式下测定(图5A和5B),对照(PCa)受试者的浓度在正负离子模式下分别定量为79.7 ng/mL和73.3 ng/mL。相比之下,激素治疗患者混合样品中LPE(20:3)的浓度在正离子模式下为146.5 ng/mL,在负离子模式下为136.3 ng/mL。LPE(P-16:0)和LPE(P-18:1)虽然仅在负离子模式下测量,但结果也显示出激素治疗组过度表达。
结论
- 我们为前列腺癌相关研究中的血清分析开发并部署了一种快速的脂质组学定量方法(LipidQuan)。
- 该方法在3个数量级内呈线性,并且具有足够的灵敏度,可分析人血清中的内源性脂质。
- 使用HILIC进行色谱分离,不同脂质按类别洗脱,减少了潜在的同分异构/同量异位物质干扰,也减少了定量分析所需的校准品和内标,分析成本得以降低。
- 该方法能够定量在综合脂质组学和蛋白质组学研究中确定的关键脂质。
- 与对照样品相比,LPE、Cer和SM在前列腺癌样品中过度表达。
参考资料
- Worldwide cancer statistics | Cancer Research UK.Available at: https://www.cancerresearchuk.org/health-professional/cancer-statistics/worldwide-cancer#heading-Zero.(Accessed: 17th July 2021).
- Drabovich, A. P. et al. Multi-Omics Biomarker Pipeline Reveals Elevated Levels of Protein-Glutamine Gamma-Glutamyltransferase 4 in Seminal Plasma of Prostate Cancer Patients *[S]. Mol. Cell. Proteomics 18, 1807–1823, 2019.
- Lloyd-Price, J. et al.Multi-Omics of the Gut Microbial Ecosystem in Inflammatory Bowel Diseases.Nat.2019 5697758 569, 655–662, 2019.
- Zhou, X., Mao, J., Ai, J., Deng, Y., Roth, M.R., Pound, C., Henegar, J., Welti, R., Bigler, S.A., Identification of Plasma Lipid Biomarkers for Prostate Cancer by Lipidomics and Bioinformatics, PLoS One, vol.7, no.11, 2012.
- Perrotti.F., Rosa.C., Cicalini.I., Sacchetta.P., Del Boccio., P., Genovesi., D., Pieragostino.D., Advances in Lipidomics for Cancer Biomarkers Discovery, Int.J. Mol.Sci., vol.17, no.12, 2016.
- Isaac, G., Munjoma, N., Gethings, L., Plumb, R., LipidQuan for Comprehensive and High-Throughput HILIC-Based LC-MS/MS Targeted Lipid Quantitation, Waters Application Note: 720006402EN, 2018.
- Chong, J., Wishart, D.S., Xia, J. Using MetaboAnalyst 4.0 for Comprehensive and Integrative Metabolomics Data Analysis.Current Protocols in Bioinformatics 68, e86 (128 pages), 2019.
- Koivusalo, M., Haimi, P., Heikinheimo, L., Kostiainen, R., Somerharju, P. Quantitative Determination of Phospholipid Compositions by ESI-MS: Effects of Acyl Chain Length, Unsaturation, and Lipid Concentration on Instrument Response. Journal of Lipid Research, 42(4), 663–72.Retrieved from http://www.ncbi.nlm.nih.gov/pubmed/11290839, 2001.
致谢
Ammara Muazzam, Anthony D. Whetton - 曼彻斯特大学生物、医学与健康学部,英国曼彻斯特。
Olivier Cexus, Hardev Pandha, Paul A. Townsend, Nophar Geifman - 萨里大学健康与医学科学学院,英国萨里吉尔福德。
Fowz Azhar - 索尔福德皇家NHS基金会信托,索尔福德皇家医院,英国曼彻斯特索尔福德
Nyasha Munjoma, Chris Hughes, Giorgis Isaac, Lee A. Gethings, Robert S. Plumb - Waters Corporation
720007419ZH,2021年11月