分析血浆样品中抗生素的临床研究方法
仅供研究使用,不适用于诊断。
摘要
本应用纪要介绍了一种使用蛋白沉淀法分析含内标血浆样品的临床研究方法。
优势
- 小体积、简单的样品前处理
- 一种适用于宽极性范围内16种抗生素的定量分析前处理方法
简介
抗生素给药后的药代动力学和药效学效应目前尚未得到充分了解,因此,拥有一种可靠的临床研究方法来分析单个样品中的大量抗生素,对于了解这类行为非常有用。
本文介绍了一种使用蛋白沉淀法分析含内标血浆样品的临床研究方法。色谱洗脱在5 min内完成,分析组分两次运行,先使用配备Waters ACQUITY UPLC BEH C18色谱柱的Waters ACQUITY UPLC I-Class系统进行分离,然后利用Xevo TQD质谱仪在极性切换模式下执行检测(图1)。

实验
样品前处理
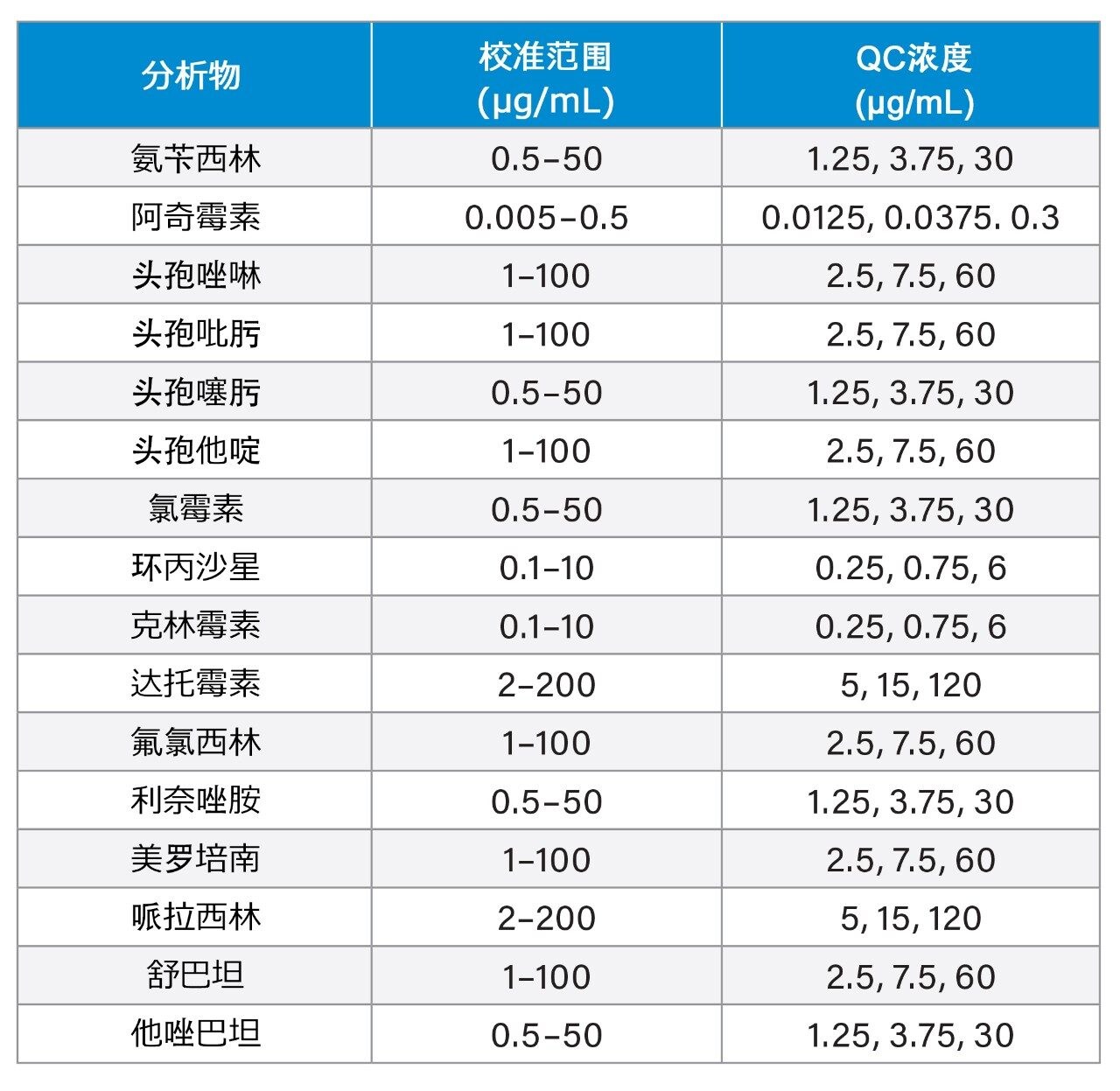
使用BioIVT(英国西萨塞克斯郡)提供的合并人血浆制备内部血浆校准品和质控物质。使用Cambridge Bioscience(英国剑桥)、Fisher(英国拉夫堡)、Merck Life Science(英国多塞特)和Toronto Research Chemicals(加拿大安大略)提供的认证粉末和溶液制备浓缩储备液。稳定同位素标记的内标由Alsachim(法国斯特拉斯堡)、Cambridge Bioscience(英国剑桥)和Toronto Research Chemicals(加拿大安大略)提供。校准和QC浓度(低浓度、中浓度和高浓度)详见表1。
样品提取
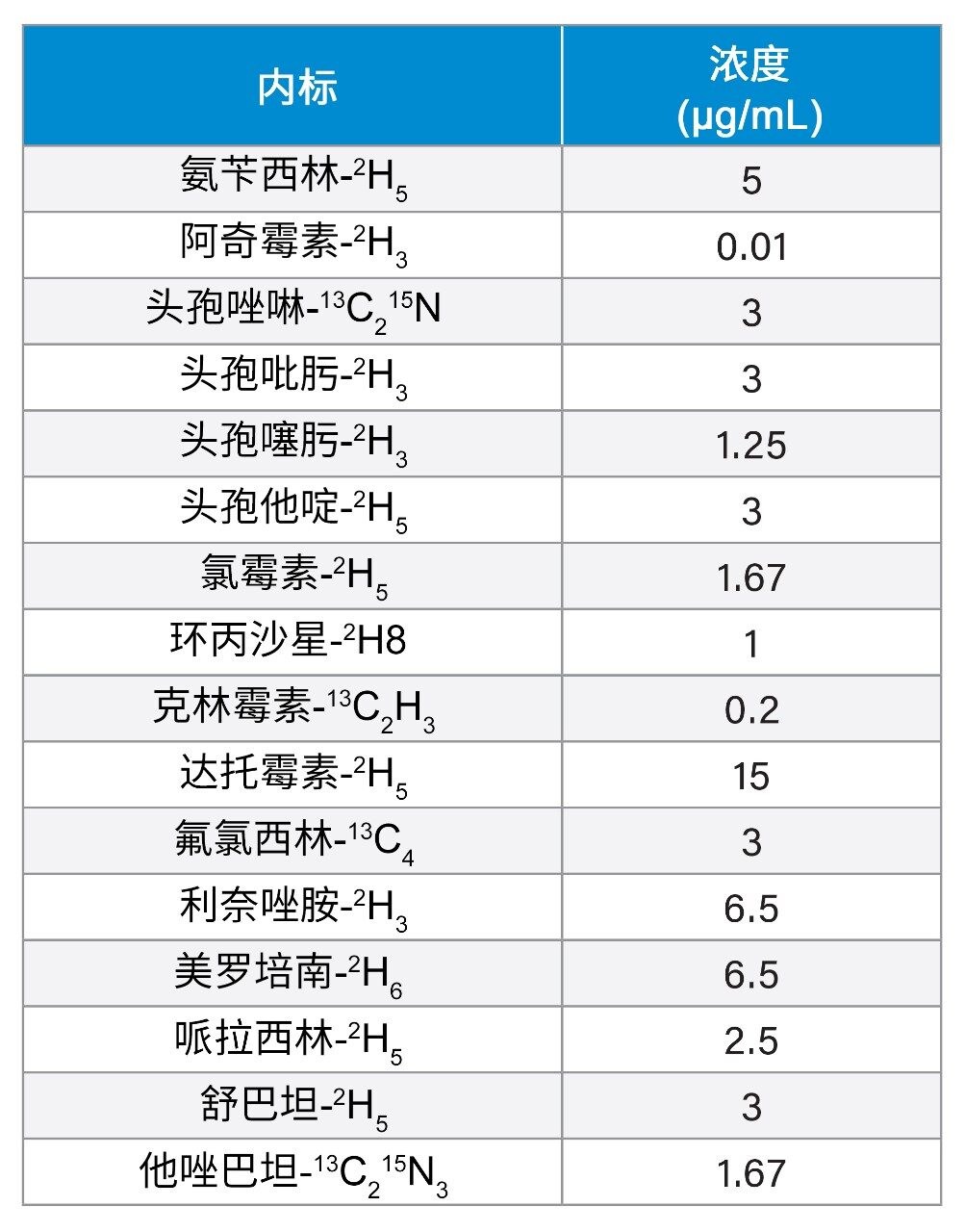
向盛装有50 µL样品的微量离心管中加入150 µL内标的甲醇溶液,内标浓度详见表2。
将试管置于多管涡旋混合器上,以2500 rpm涡旋混合30 s,然后以16,100 g离心2 min。取100 µL上清液转移到1 mL 96孔板中,并加入300 µL 1%甲酸水溶液。临分析前,将样品板以4,696 g离心 2 min。通过两次运行(第1组和第2组)分析提取物。美罗培南样品提取物不稳定,应首先分析。建议在8 h内完成分析。
UPLC条件
|
系统: |
配备FTN的ACQUITY UPLC I-Class |
|
进样针: |
30 µL |
|
色谱柱: |
ACQUITY UPLC BEH C18色谱柱;1.7 µm, 2.1 x 100 mm(部件号186002352) |
|
流动相A: |
0.1%氨水 |
|
流动相B: |
甲醇 |
|
洗针液: |
80%甲醇水溶液 + 0.1%甲酸 |
|
清除溶剂: |
10%甲醇水溶液 |
|
密封件清洗液: |
20%甲醇水溶液 |
|
柱温: |
60 °C(柱前预加热器) |
|
进样体积: |
2 µL*/10 µL** |
|
流速: |
0.50 mL/min |
|
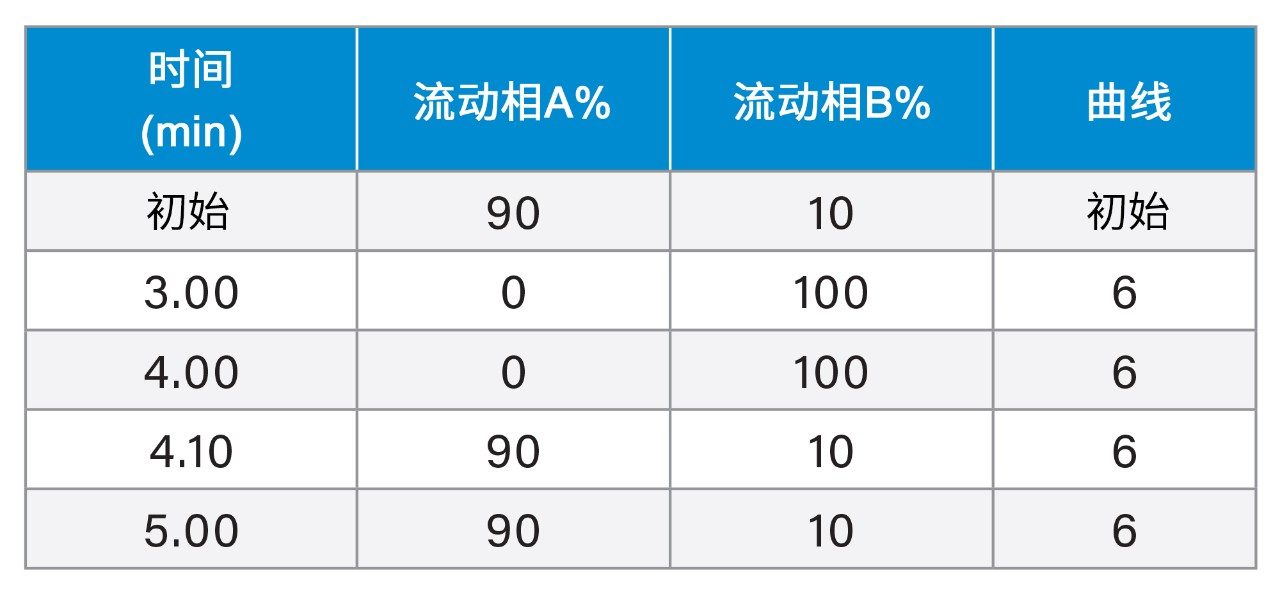
梯度洗脱: |
表3 |
|
运行时间: |
5.0 min(进样间隔5.5 min) |
*第1组:头孢唑啉、头孢吡肟、环丙沙星、克林霉素、氟氯西林、利奈唑胺、美罗培南和哌拉西林。
**第2组:氨苄西林、阿奇霉素、头孢噻肟、头孢他啶、氯霉素、达托霉素、舒巴坦和他唑巴坦。
Gradient Elution
质谱条件
|
系统: |
Xevo TQD |
|
|
分辨率: |
MS1 (0.7 FWHM) MS2 (0.7 FWHM) |
|
|
采集模式: |
多反应监测(MRM)(详见表4) |
|
|
极性: |
ESI正离子模式/ESI负离子模式(ESI+/ESI-) |
|
|
毛细管电压: |
3.0 kV (ESI+)/3.0 (ESI-) |
|
|
离子源温度: |
150 °C |
|
|
脱溶剂气温度: |
500 °C |
|
|
锥孔气流速: |
100 L/h |
|
|
扫描间延迟时间: |
0.003 s |
|
|
极性/模式切换间扫描延迟时间: |
0.020 s |
|
|
通道间延迟时间: |
0.003 s |
数据管理
|
软件: |
MassLynx软件4.2版自带的TargetLynx应用管理软件 |
Method Conditions
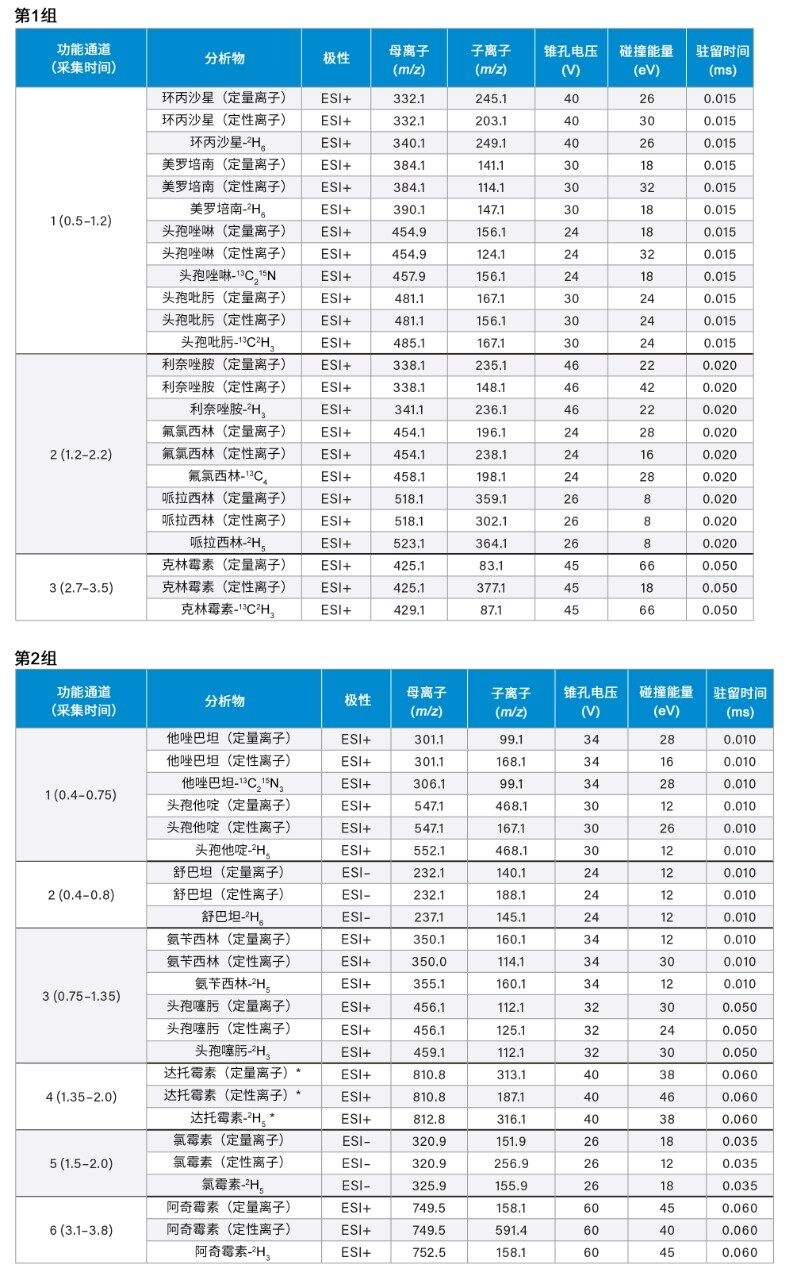
*注:达托霉素的分子量为1620.7 g/mol,其双电荷离子[M+2H]2+丰度最高。
结果与讨论
在表1所示各分析物相应的最高校准品浓度下分析血浆样品抗生素后,未观察到系统残留。
图2显示了分析16种抗生素所得到的示例色谱图。

在5天内对用血浆制备的10个低浓度重复样进行萃取和定量,评估分析灵敏度(n = 50)。考察结果表明,该方法能够在表5所示的浓度下实现精确定量(CV≤20%,偏差≤15%)。
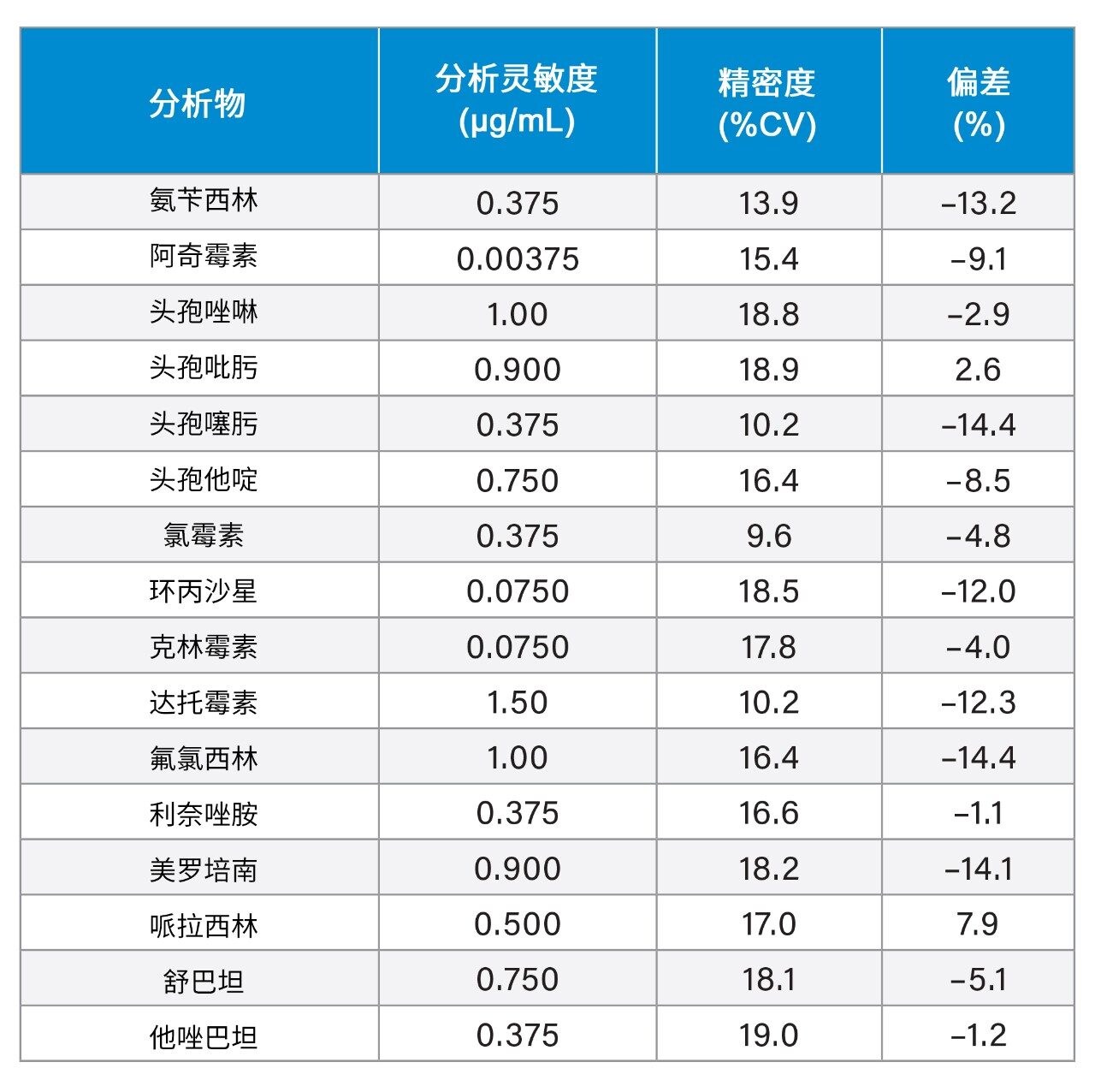
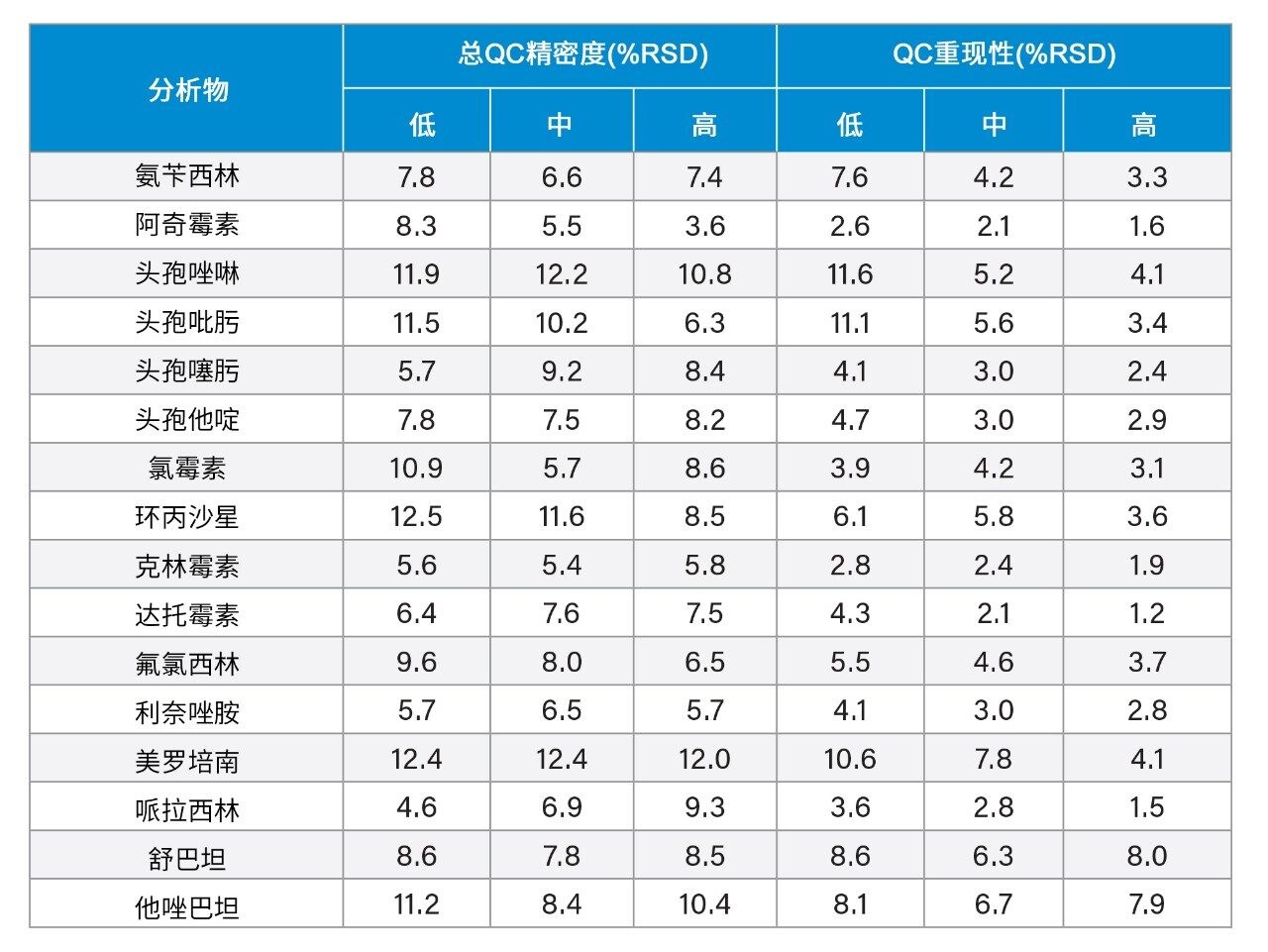
我们在五天内每天提取和定量分析三个浓度的血浆混合样品(每个浓度五个重复样,n = 25),以此确定该方法的总精密度。每个QC水平设置五个重复样,以评估方法的重现性。表6显示了这些实验的结果,测得三个浓度水平下的总精密度和重现性为RSD≤12.5%。
对于头孢吡肟、达托霉素、哌拉西林和舒巴坦,在表1所示的范围内将低浓度和高浓度混合血浆样品按已知比例混合后,方法在该范围内呈线性。氨苄西林、阿奇霉素、头孢唑啉、头孢噻肟、头孢他啶、氯霉素、环丙沙星、克林霉素、氟氯西林、利奈唑胺和美罗培南确定在表1所示的范围内进行了二次拟合。
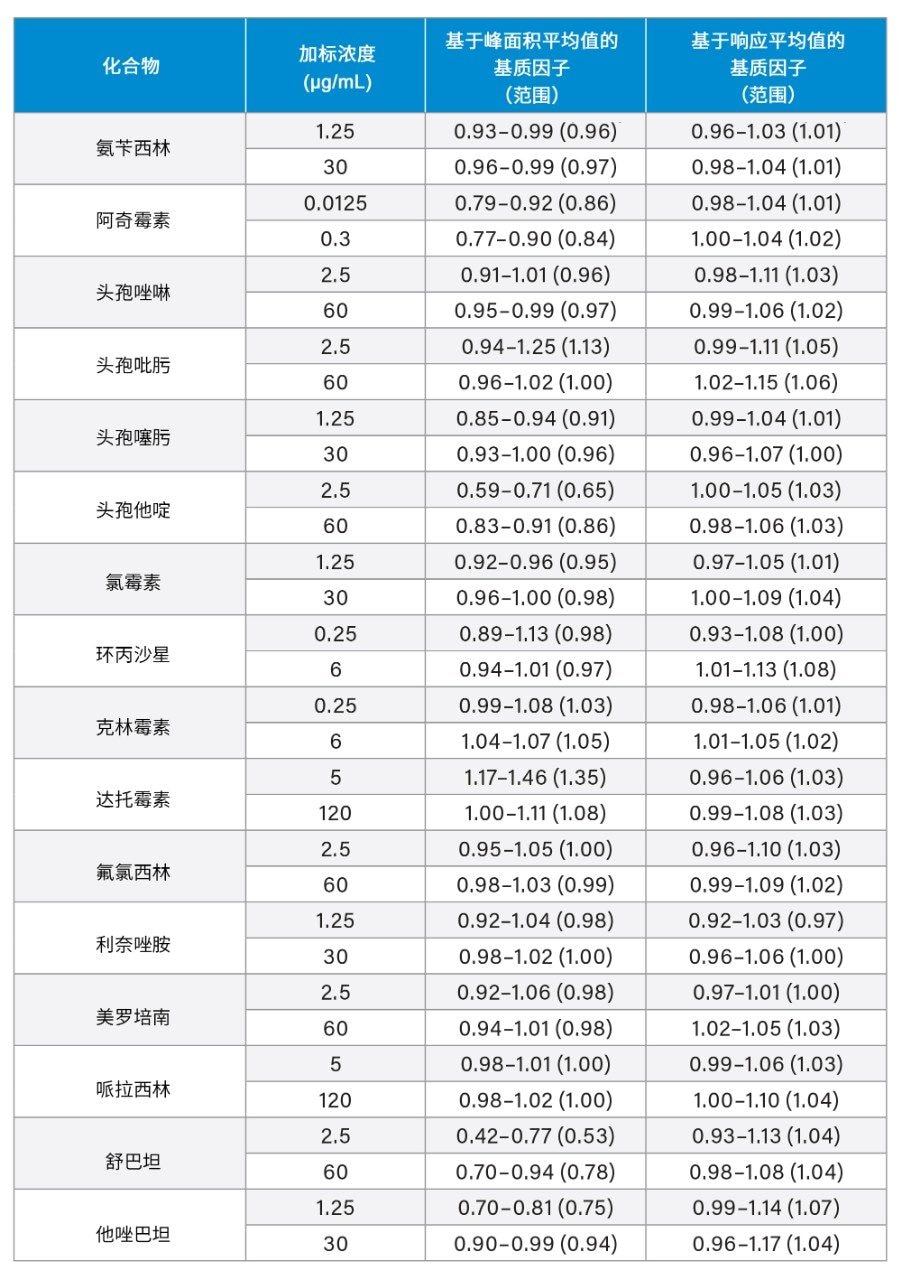
在低和高QC浓度(n = 6)血浆样品中评估基质效应,计算为等量加标浓度提取溶剂样品的百分比。计算基于分析物:内标响应比,以补偿内标造成的信号增强或抑制效应(表7)。
通过测定低浓度和高浓度混合血浆液样品(QC1和QC3浓度)的回收率(n = 3),评估高浓度加标内源性化合物(白蛋白、胆红素、胆固醇、肌酐、甘油三酯和尿酸)的潜在干扰。所得回收率范围为85.7~115.5%。
结论
使用一种样品前处理程序,分两次运行分析,所开发的临床研究方法证明该样品前处理程序和UPLC-MS/MS系统能够定量分析血浆中的16种抗生素。该方法在测试范围内未表现出系统残留,并且使用选定的稳定同位素标记的内标非常有效地补偿了各种分析物的基质效应。
720007388ZH,2021年10月