定量分析和鉴定测试是疫苗原料及成品批次放行的重要组成部分。传统方法可能缺乏选择性,开发耗时,且多重分析能力不佳。GARDASIL 9是一种九价疫苗,由九种不同的HPV L1蛋白质抗原组成,可预防多种导致宫颈癌和生殖器疣风险增加的HPV亚型。本研究利用完整的样品前处理工作流程(包括佐剂解吸、胰蛋白酶酶解和LC-MS/MS定量监测),通过特征性肽段分析方法测定GARDASIL 9组分。执行一次LC-MS/MS分析即可同时定量10~200 μg/mL浓度范围内所有九种HPV病毒株特异性L1蛋白,并获得出色的重现性。
GARDASIL 9是由HPV L1蛋白抗原组成的九价疫苗,这些蛋白抗原形成病毒样颗粒(VLPs),能够防御九种HPV病毒株,从而预防80~90%的宫颈癌和90%的生殖器疣1,2。 疫苗生产过程中的重要一步是疫苗原料及成品批次的质量控制。批次放行测试包括无菌性、效价、纯度、抗原定量和鉴定等内容。传统的定量分析和鉴定测试方法有总蛋白测定和酶联免疫吸附试验(ELISA)。这些分析方法存在局限性,例如没有专属性(或者专属性或交叉反应性不明)、开发耗时且多重分析能力不佳。因此,考虑使用质谱法作为抗原定量分析和鉴定测试的工具。质谱法可同时选择性测定和定量特定类型的L1蛋白。本研究开发出一套完整的样品前处理流程,包括从铝佐剂中解吸HPV L1蛋白以及蛋白质的胰蛋白酶酶解,从而通过特征性肽段分析方法定量GARDASIL 9 HPV L1抗原。此工作流程包括质谱分析,能够以高重现性定量10~200 μg/mL范围内的肽段,该范围完全涵盖GARDASIL 9疫苗产品中预期的HPV L1蛋白浓度范围(40~120 μg/mL)。
将各种HPV L1蛋白稀释至750 µg/mL (30 µg),用RapiGest SF表面活性剂(沃特世,部件号186001861)进行变性处理,然后用二巯基苏糖醇还原,再用碘乙酰胺烷基化。使用胰蛋白酶(Promega,部件号V5111)按照1:10胰蛋白酶:蛋白质(w/w)的比率酶解样品,并用甲酸淬灭。取10 µL样品注入与Xevo G2-XS QTof质谱仪联用的ACQUITY UPLC I-Class PLUS系统,使用LC-MSE方法进行肽图分析。
取2 µL空白样、标准品、质量控制样品或疫苗产品样品分别加入16 µL 100 µg/mL的牛血清白蛋白水溶液(Sigma,部件号05470)中。除空白样外,向所有其他样品中加入2 µL内标。向每个样品中加入20 µL用100 mM Tris HCl (pH 10.0)配制的0.1% (w/v) RapiGest SF表面活性剂(沃特世,部件号186001861)。将样品置于80 °C下温育10分钟,然后以2000 x g的离心力离心5分钟,使佐剂形成颗粒。从沉淀的佐剂中小心移取32 µL样品,并用1.2 µL 10%盐酸(v/v)中和至pH 8.0。用0.3 µg胰蛋白酶(Promega,部件号V5111)按照1:10胰蛋白酶:蛋白质(w/w)的比率在37 °C下过夜酶解样品。在37 °C下用2 µL 20%甲酸水溶液(v/v)处理15分钟,使酶解反应淬灭,并使RapiGest发生沉淀。将样品在10 °C下以1800 x g离心15分钟,使RapiGest形成颗粒。每个样品各取30 µL转移至QuanRecovery 96孔板中,并取5 µL注入与Xevo TQ-S micro质谱仪联用的ACQUITY UPLC I-Class PLUS系统,进行LC-MS/MS分析。
|
液相色谱系统: |
ACQUITY UPLC I-Class PLUS(固定定量环) |
|
质谱系统: |
Xevo G2-XS QTof质谱仪,ESI+ |
|
样品板: |
具有MaxPeak高性能表面的QuanRecovery样品瓶 |
|
色谱柱: |
ACQUITY UPLC PREMIER BEH C18肽分析专用柱, 300 Å, 1.7 µm, 2.1 × 100 mm |
|
柱温: |
60 oC |
|
样品温度: |
10 oC |
|
进样体积: |
10 µL |
|
流速: |
0.2 mL/min |
|
流动相A: |
0.1%甲酸的水溶液 |
|
流动相B: |
0.1%甲酸的乙腈溶液 |
|
梯度: |
流动相B在50分钟内由1%增加至35%,流速0.2 mL/min,然后进行色谱柱清洗和平衡 |
|
电离模式: |
ESI+ |
|
毛细管电压: |
1.2 kV |
|
锥孔电压: |
40 V |
|
离子源温度: |
150 oC |
|
脱溶剂气温度: |
350 oC |
|
锥孔气流速: |
20 L/h |
|
脱溶剂气流速: |
600 L/h |
|
用于数据采集和处理的信息学软件系统 |
UNIFI (v.1.9.4) |
|
液相色谱系统: |
ACQUITY UPLC I-Class PLUS(固定定量环) |
|
质谱系统: |
Waters Xevo TQ-S micro质谱仪,ESI+ |
|
样品板: |
具有MaxPeak高性能表面的QuanRecovery 96孔板 |
|
色谱柱: |
ACQUITY UPLC PREMIER BEH C18肽分析专用柱, 300 Å, 1.7 µm, 2.1 × 100 mm |
|
柱温: |
60 oC |
|
样品温度: |
10 oC |
|
进样体积: |
5 µL |
|
流速: |
0.4 mL/min |
|
流动相A: |
0.1%甲酸的水溶液 |
|
流动相B: |
0.1%甲酸的乙腈溶液 |
|
梯度: |
流动相B在1分钟内由10%增加至15%,随后在3分钟内由15%增加至30%,然后进行色谱柱清洗和平衡。运行时间7分钟。 |
|
电离模式: |
ESI+ |
|
毛细管电压: |
1.2 kV |
|
锥孔电压: |
20 V |
|
离子源温度: |
150 oC |
|
脱溶剂气温度: |
600 oC |
|
锥孔气流速: |
100 L/h |
|
脱溶剂气流速: |
1000 L/h |
|
MS数据采集: |
MassLynx 4.2版 |
|
用于数据处理的信息学软件: |
TargetLynx XS v4.2 |
利用肽图分析方法表征HPV L1蛋白有助于选择合适的候选肽段进行定量,还可以鉴定出是否存在蛋白质骨架修饰(例如脱酰胺和氧化)。之前已在应用纪要720006969EN中介绍了用于分析和定量含Fc片段的蛋白质的完整工作流程,本研究将该工作流程略作调整后加以使用3。针对GARDASIL 9中存在的所有九种HPV L1蛋白进行肽图分析实验。如图1所示,优异的碎片离子数据确认了HPV 18型肽段FSLDLDQYPLGR的存在。由于这种肽段具有较高的信号强度、较低的修饰可能性和良好的定量重现性,因此选作HPV 18的特征性肽段。通过MassLynx-Skyline Interface工作流程鉴定并优化各种特征性肽段的MRM通道4。
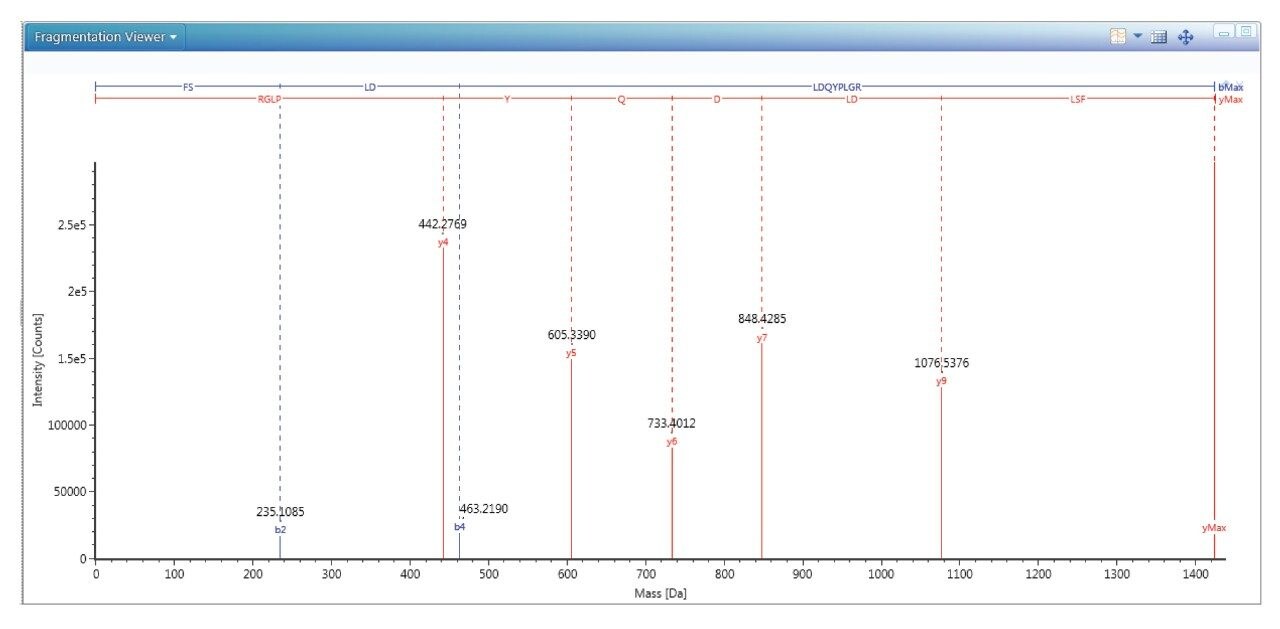
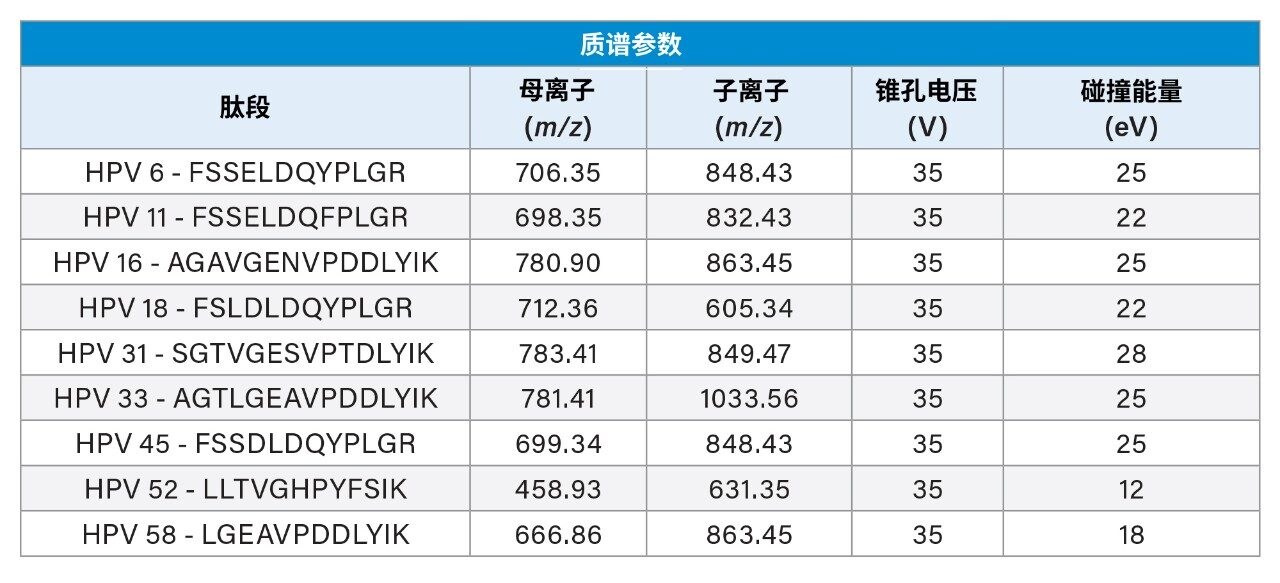
简而言之,在通过肽图分析实验鉴定出特征性肽段后,使用优化的色谱方法,通过监测每种肽段的母离子质量数鉴定这些肽段的保留时间。对每种肽段母离子选择强度最高的电荷态,全面检查所选肽段的所有b子离子和y子离子,以鉴定强度最高的MRM通道。进一步优化该最强MRM通道的碰撞能量,并使用这些优化参数得到最终的MS方法。用于定量分析的MRM通道可参见表1。
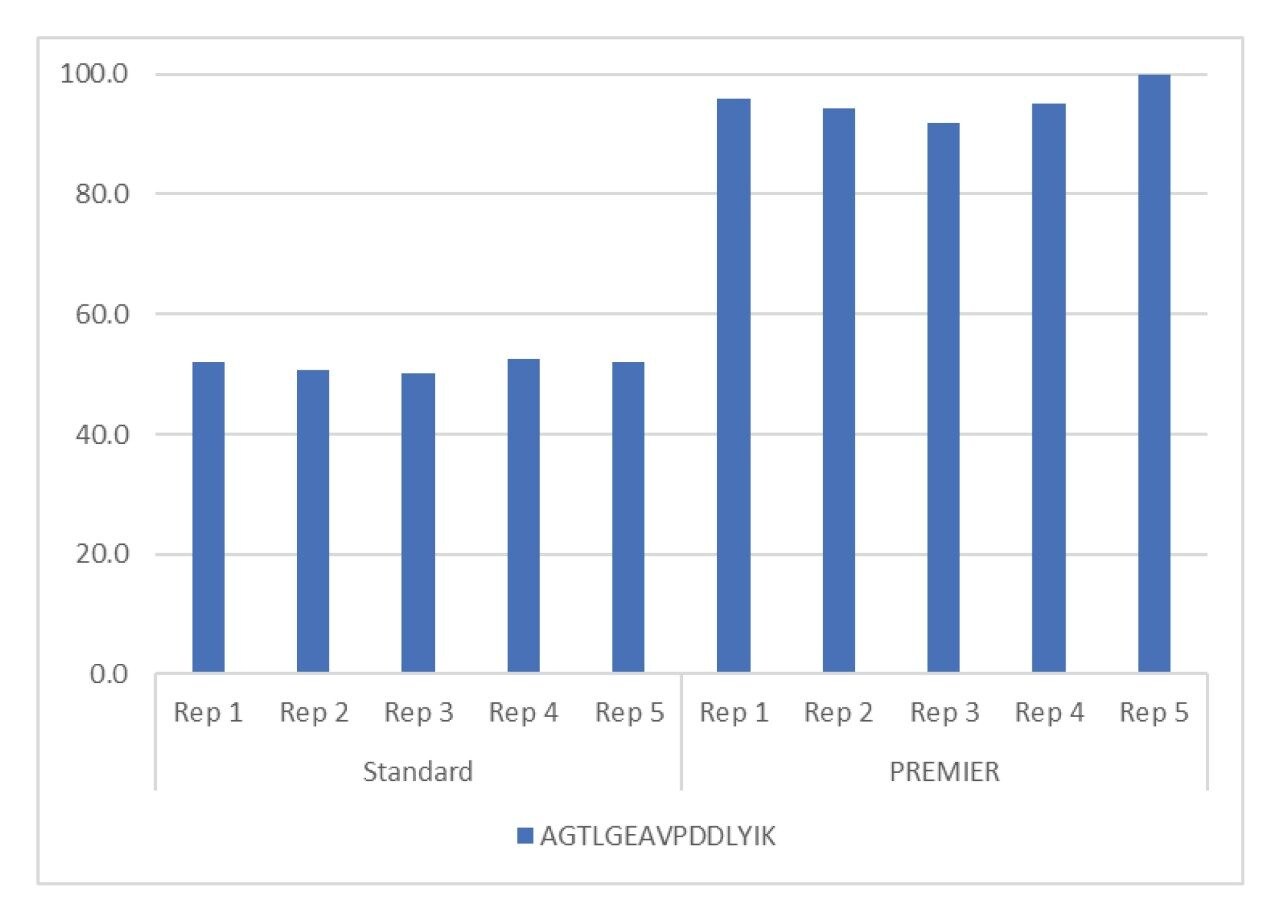
选择合适的色谱柱是液相色谱方法开发过程的重要组成部分。研究发现,采用HPS(高性能表面)技术的ACQUITY PREMIER BEH C18 300 Å肽分析专用柱是定量HPV L1蛋白的理想选择。图2展示了标准色谱柱与PREMIER色谱柱的比较结果5。两种色谱柱均通过进样10次用于钝化的高浓度样品进行钝化,然后将分析物进样分析5次。采用MaxPeak HPS技术的PREMIER色谱柱能够缩短色谱柱钝化时间,得到的峰面积是标准色谱柱的2倍。峰面积增加可实现更低的定量限,并提高肽段测量的重现性。
高效佐剂解吸是成功定量佐剂疫苗产品中抗原浓度的关键所在。蛋白质可通过静电力、疏水相互作用、氢交换(由范德华力推动)以及配体交换与铝佐剂结合6。 配体交换会产生最紧密的蛋白质结合,这是佐剂的表面羟基与蛋白质抗原磷酸基团之间相互作用的结果。GARDASIL 9采用的佐剂为专有的无定形羟基磷酸铝硫酸盐(AAHS),具有表面羟基和磷酸基团7。该疫苗在大约pH 7.0下配制,AAHS在此pH下具有零电荷点8。抗原HPV L1蛋白VLPs的等电点范围为8.1~8.6,因此在配制的疫苗产品中带正电9,10。
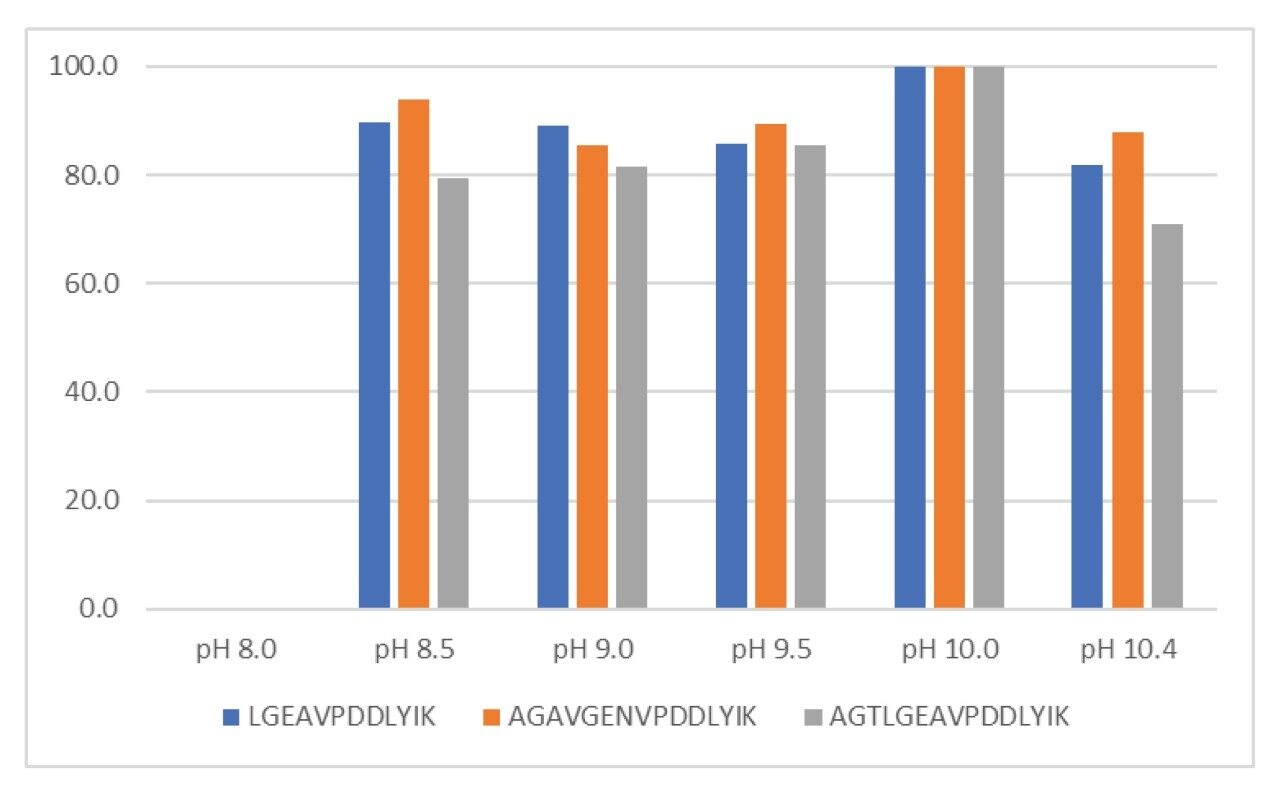
我们已经通过实验确定,要破坏这种吸附作用,需要采用表面活性剂和高pH条件,使蛋白质从AAHS佐剂中完全解吸,并使VLPs自身开始解离11。 我们使用兼容MS系统的表面活性剂RapiGest对HPV L1蛋白进行变性处理,这是实现完全解吸的必要步骤。该佐剂解吸方案还利用高pH条件,将HPV L1蛋白的电荷从正电荷完全转换为负电荷。如图3所示,在pH 10.0的条件下,佐剂中的蛋白质解吸达到最高水平。需要注意的是,在pH 8.0下仅有非常少的蛋白质解吸,预期蛋白质在该pH下带正电。该结果表明,需要借助静电排斥作用充分破坏结合,使蛋白质解吸。
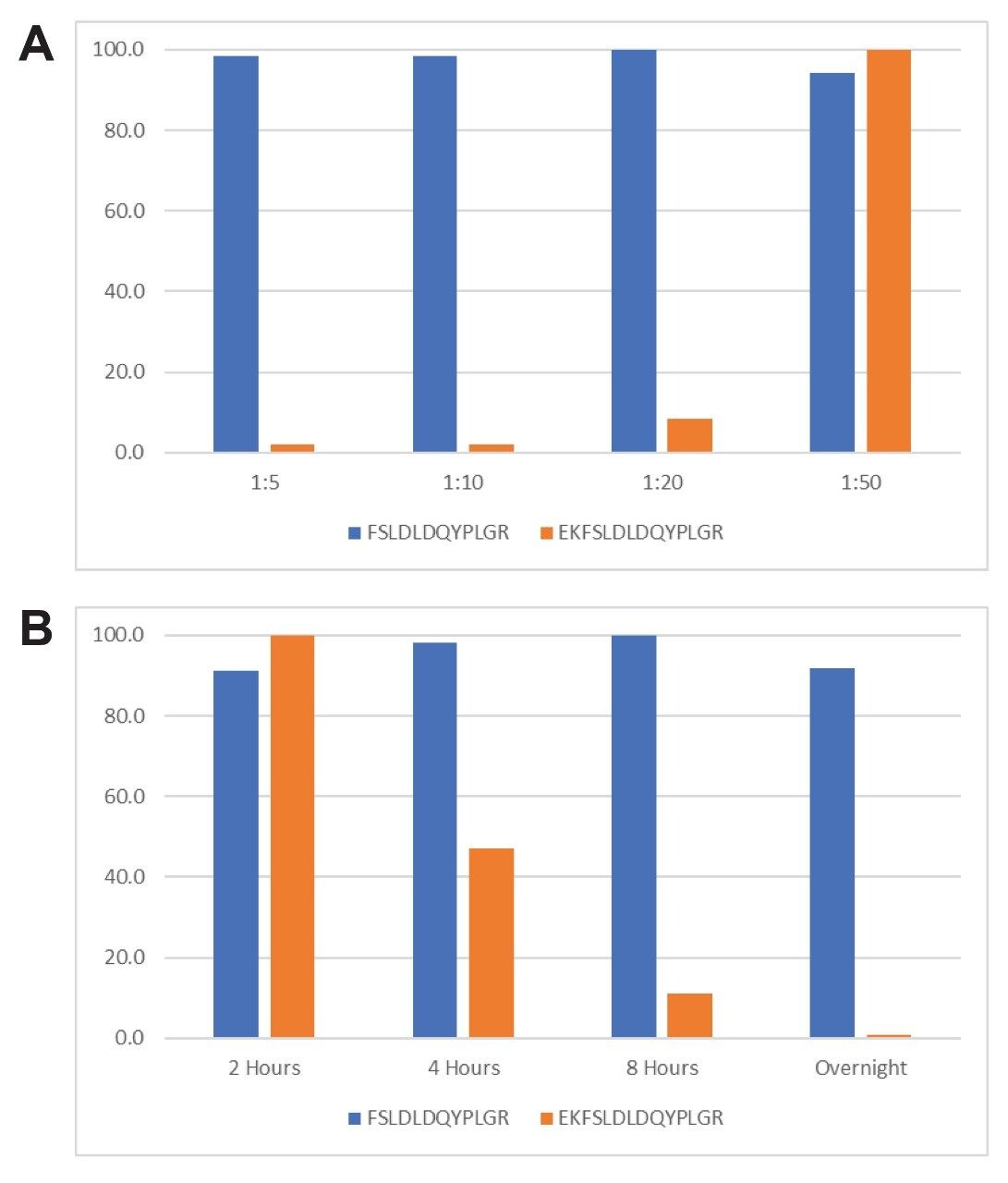
蛋白质的完全酶解对于通过特征性肽段分析方法实现准确、灵敏、可重现的定量至关重要。为确保完全酶解,必须检查并优化酶:底物比和酶解时间等酶解参数。为测量酶解的完全性,对包含一个漏切位点的肽段FSLDLDQYPLGR和EKFSLDLDQYPLGR进行监测与定量。
胰蛋白酶与蛋白质的比率基于在不同酶:底物比率下过夜酶解的结果进行优化。实验结果见图4中的A图。在胰蛋白酶:蛋白质比率为1:10和1:5的情况下,获得了最高强度的肽段FSLDLDQYPLGR和最低强度的肽段EKFSLDLDQYPLGR,表明HPV L1蛋白实现了比较完全的酶解。其余实验由于需要高浓度,因此选择1:10的比率以减少胰蛋白酶的自溶。如图4中的B图所示,对酶解时间进行了评估。8小时至过夜的酶解时间使HPV L1蛋白的酶解非常完全。考虑到酶解完全性和工作日便利性,选择过夜酶解。
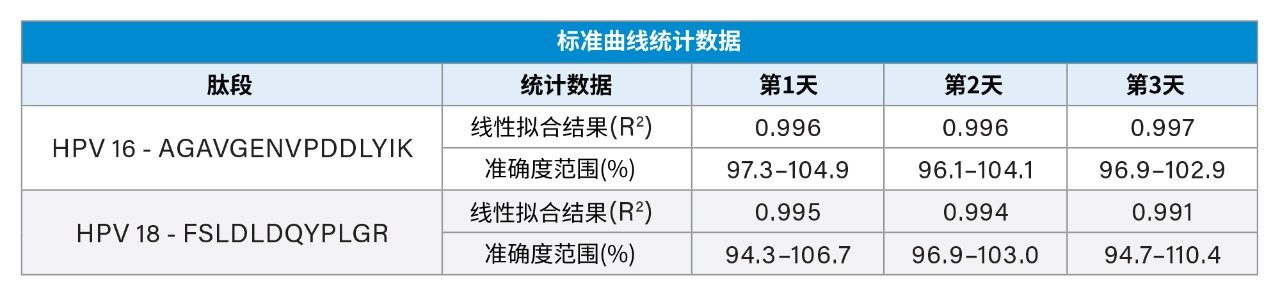
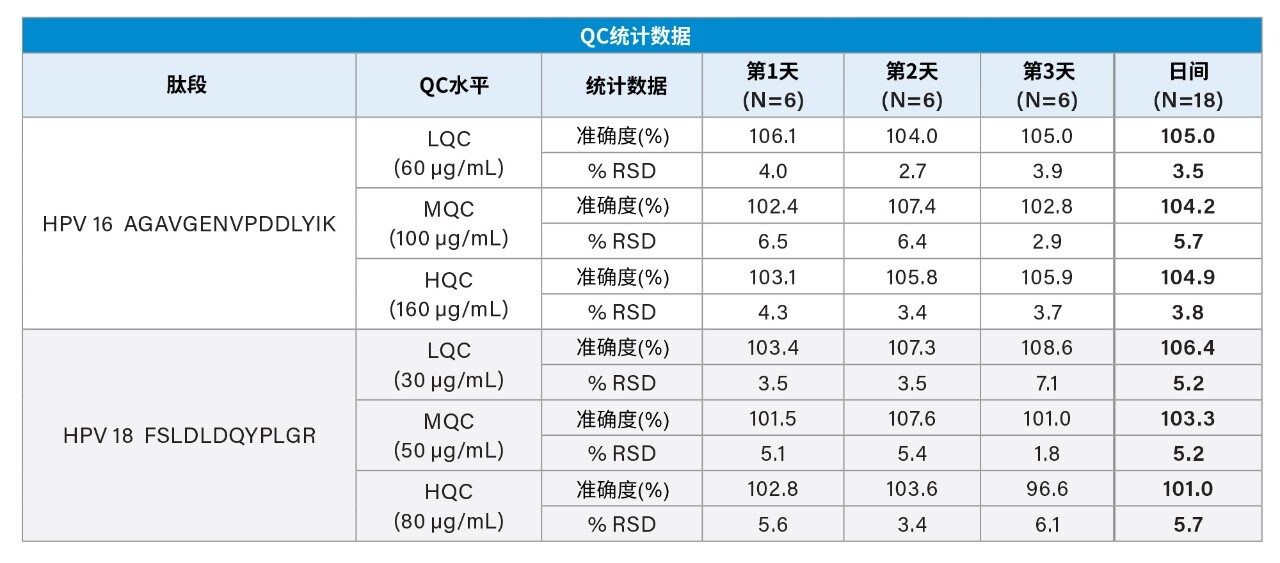
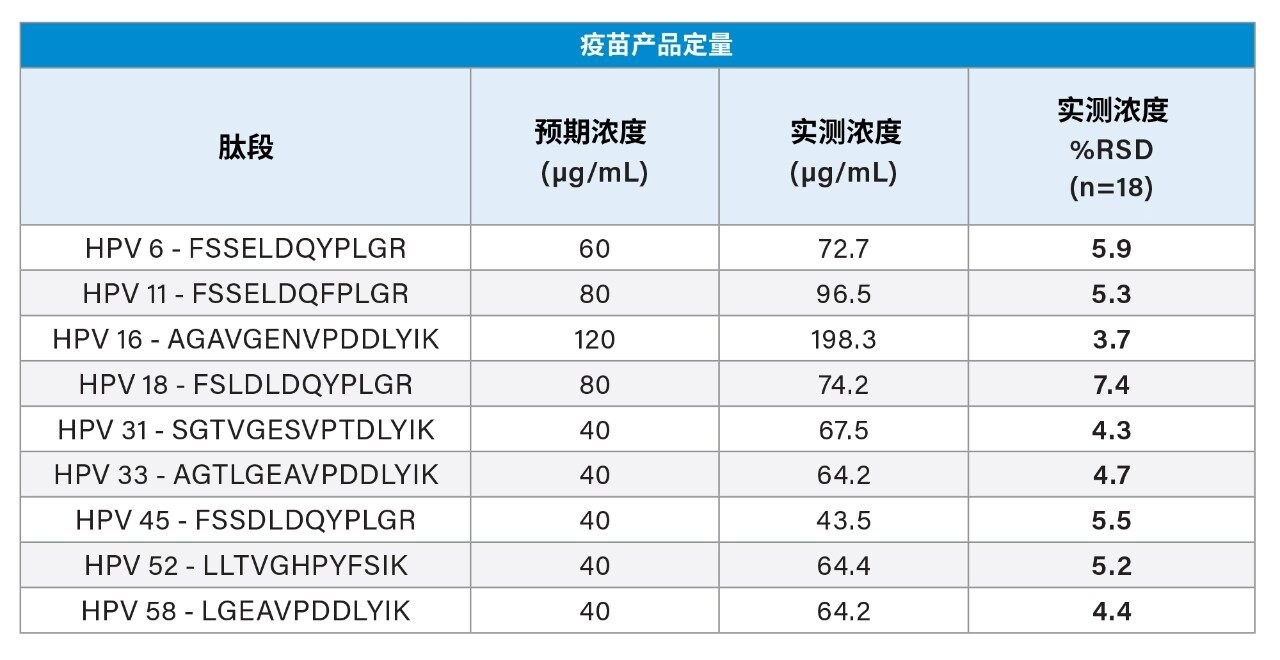
在三天内制备标准曲线标样、QC样品和疫苗产品样品,验证日间及日内分析精密度和准确度。HPV 16的标准曲线在20~200 µg/mL的范围内呈线性。其余HPV蛋白在10~100 µg/mL的范围内呈线性(表2)。制备低、中、高浓度QC样品,QC样品分析的准确度和精密度CV小于8%(表3)。如表4所示,三种制剂中所有九种HPV L1蛋白的测量具有高重现性,三天测量结果的CV小于8%。在大多数情况下,本研究中的LC-MS/MS实测值与标示值大体一致(尽管某些值偏高)。这些结果表明,该分析方法适用于定量GARDASIL 9中的HPV L1蛋白。
本研究开发出一种同时定量GARDASIL 9中多种HPV L1蛋白抗原的质谱分析方法。将LC-MS/MS与优化的样品前处理方案相结合,实现了高准确度和高精密度的蛋白质定量。
720007103ZH,2020年12月