
本应用纪要强调开发一种简单、灵敏且稳定的LC-MS/MS方法同时定量多种治疗性肽。
为确保药品安全性,药品生产商必须谨慎控制生产工艺,包括监测活性药物成分(API)、杂质及任何其他潜在污染物,这些污染物通常是之前的生产工艺交叉污染的结果。为尽量减少潜在的交叉污染,需要在生产工艺后全面采用设备清洁程序。
实际上,清洁和清洁验证是两项活动,旨在确保每个批次生产后不会发生交叉污染,从而尽可能预防患者风险。清洁验证是一种书面证据,在极大程度上确保人员始终如一地将系统或设备清洁至预定的可接受限值或确定的可接受残留水平(ARL)1,2。 清洁不足可能导致产品中掺入污染物,这些污染物可能由之前的产品批次、清洁剂或其他异物造成。因此,验证清洁过程的主要目的是确保药品的安全性、有效性或质量,同时遵守现行药品生产质量管理规范(CGMP)法规、其他联邦法规及其他标准法规3,4。
在法规审查过程中,药品生产商重点关注反应室和多用途纯化系统的清洁和清洁验证。尽可能确保安全性是药品生产的首要任务,同时,尽量缩短生产停机时间对于保持效率并避免因设备闲置而造成的负面经济影响也很重要。这为快速开发分析清洁方法带来了更大的压力,这些方法在检测药品或其他疑似污染物的ARL时必须快速、灵敏、稳定且具有较高的选择性。虽然与紫外(UV)检测联用的高效液相色谱(HPLC)是测定ARL的常用分析工具,但还需要检测灵敏度和选择性更高的分析方法5-8。
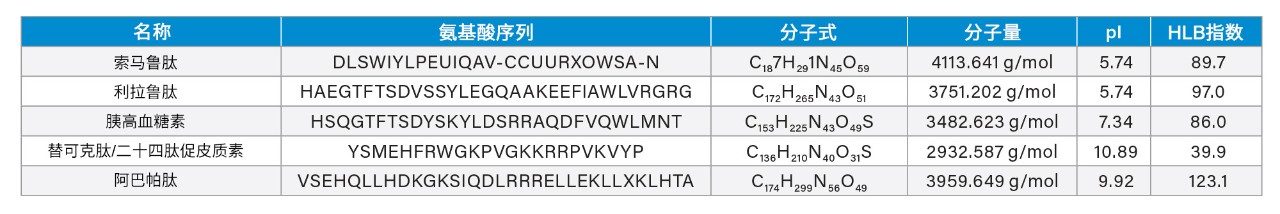
实际上,由于生物治疗药物(例如肽)在较低剂量水平下具有高效价,这类药物的生产日益增加,因此通常需要能够实现低至ng/mL级检测的清洁验证方法。液相色谱-质谱联用(LC-MS) ARL定量方法凭借其方法开发时间更短、选择性多重反应监测(MRM)碎片实现高特异性的优势,在生物治疗药物方面的应用日益增加。但是,与小分子相比,生物治疗药物的分析仍具有许多挑战:分子尺寸大、分析灵敏度低、MS/MS碎裂效果不佳、容易发生大量吸附损失(主要由非特异性结合(NSB)导致),并且存在残留问题。这些挑战导致方法开发时间长、定量限低于理想水平,且分析稳定性低下。本文所述研究使用样品前处理策略来保持肽溶解度,并结合采用高性能表面的LC-MS型样品储存瓶来减轻由NSB导致的肽损失。此外,该方法强调使用低扩散UHPLC和反相BEH苯基柱进行色谱分离,并与灵敏的串联四极杆质谱仪联用,可同时、灵敏且准确地定量分析五种不同的肽:索马鲁肽、利拉鲁肽、胰高血糖素、替可克肽和阿巴帕肽。表1列出了这些肽的理化性质,包括氨基酸序列、分子式、分子量、等电点(pI)和HLB指数。上述方法的定量下限(LLOQ)为1 ng/mL,通过进样分析5 µL制得的样品得到。
用100%甲醇制备五种肽(表1)单独的储备液(1000 µg/mL)。将1000 µg/mL各种肽溶液的等分试样混合,用含2%甲酸的50:50水:乙腈溶液稀释,制备中间混合储备液(10 µg/mL)。使用上述相同的稀释剂通过连续稀释来制备样品(1~1000 ng/mL)。所有校准曲线标样和空白(未加标)样品均制备两份。利用MS级二氟乙酸(DFA)和甲酸(FA)作为流动相添加剂。
|
LC-MS软件: |
MassLynx 4.2版 |
|
定量软件: |
TargetLynx |
在方法开发过程中优化样品前处理、LC和MS方法的所有步骤,解决溶解度差、NSB、峰拖尾和残留问题。
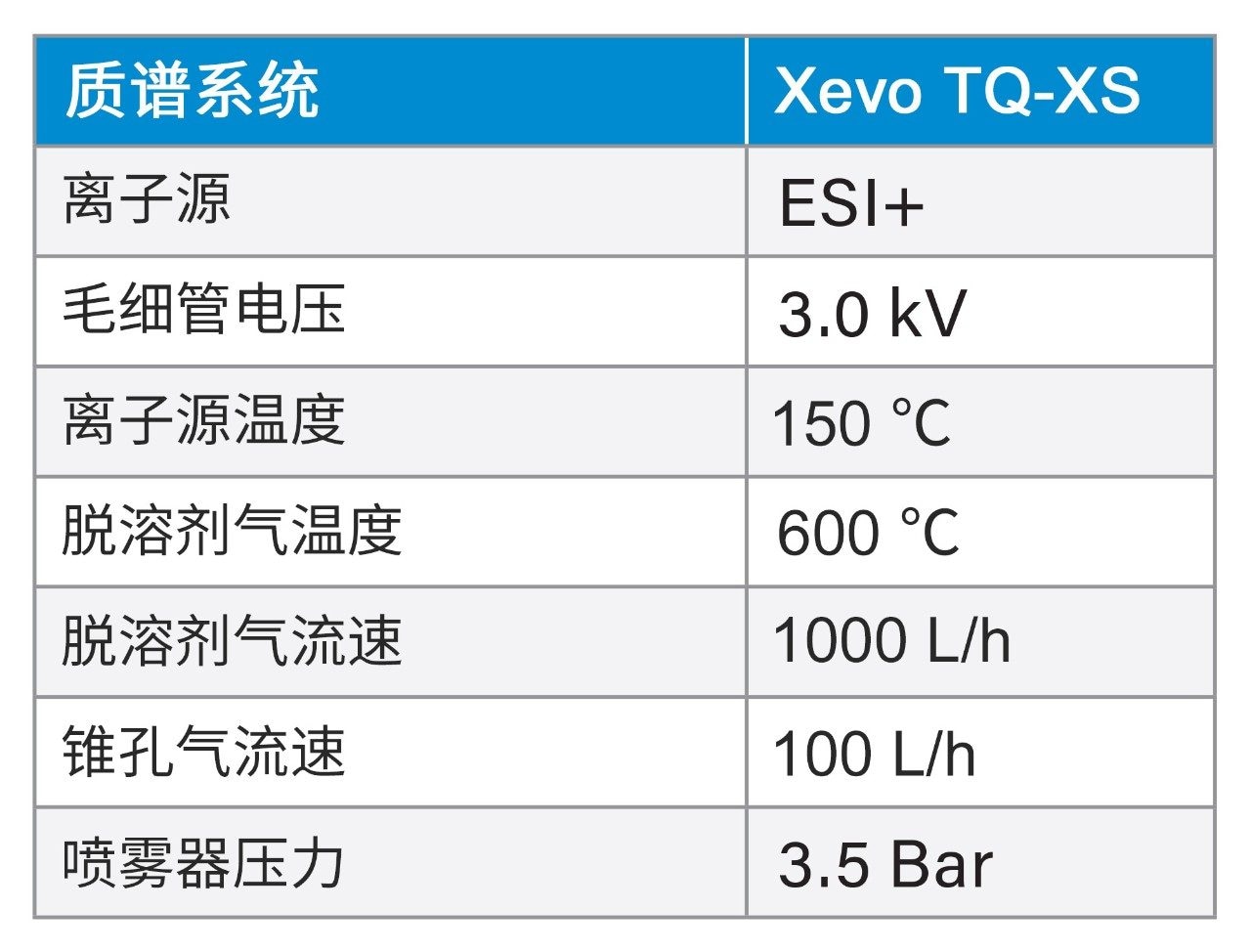
使用Xevo TQ-XS串联四极杆质谱仪(ESI+)进行LC-MS/MS定量分析。在方法开发过程中观察到各种肽的若干多电荷母离子。对每种肽选择强度最高的母离子电荷态进行MRM分析。索马鲁肽、利拉鲁肽、胰高血糖素、替可克肽和阿巴帕肽选择的电荷态分别为4+、4+、5+、6+和7+。此外,使用高特异性b/y离子碎片显著提高特异性。优化后的MS条件见实验部分,MRM通道设置见表3。
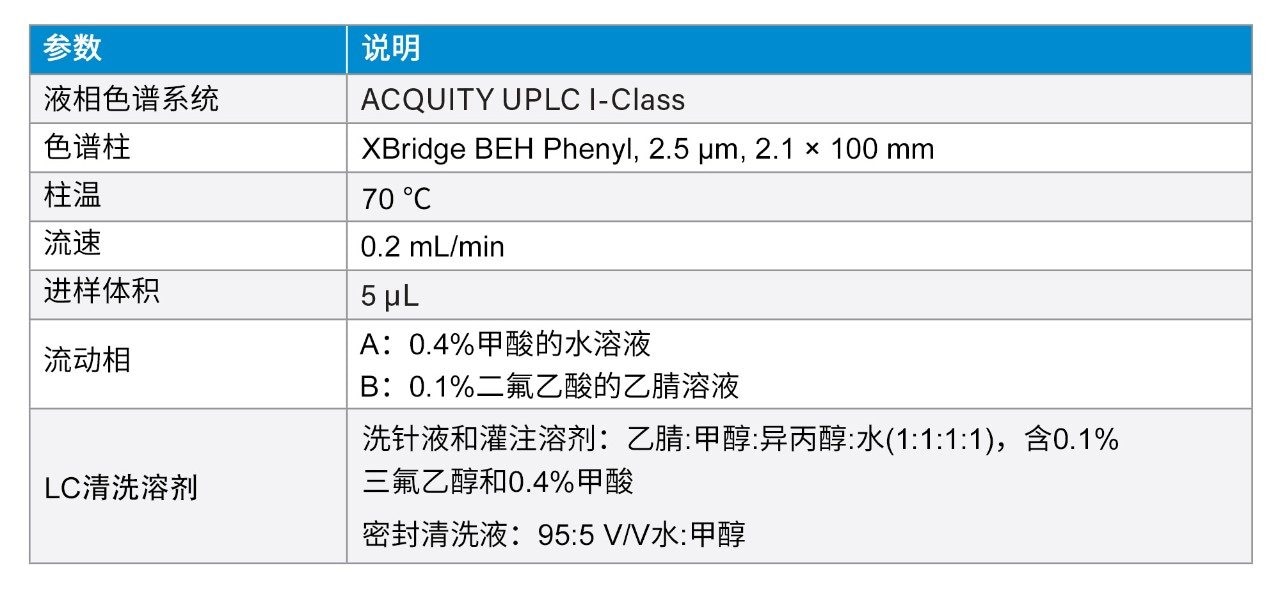
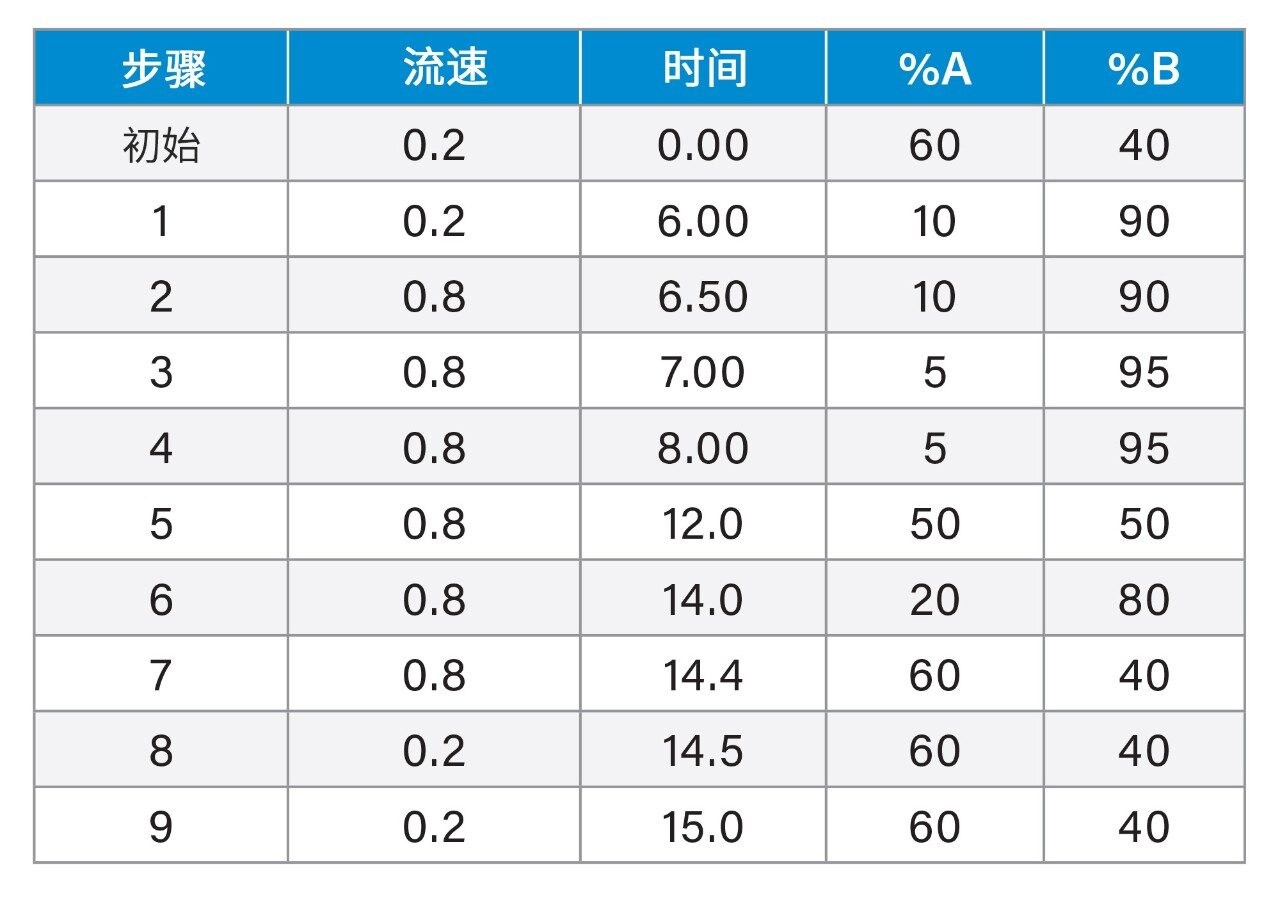
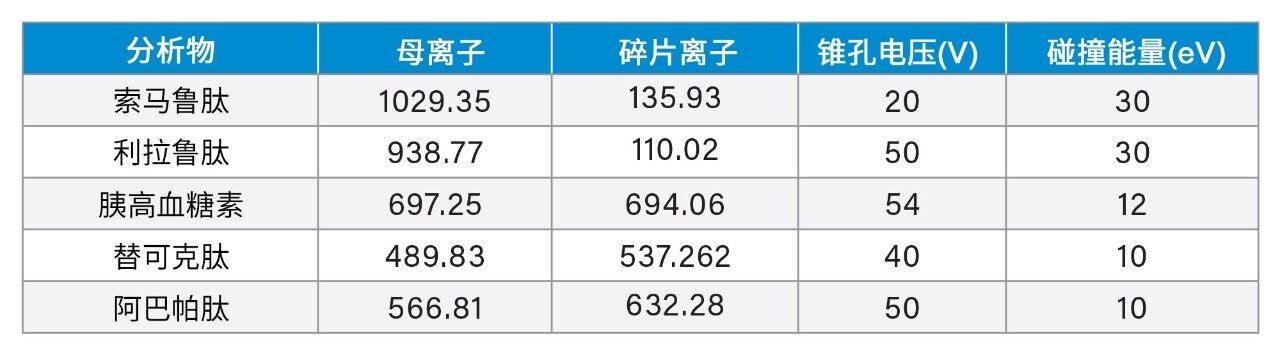
色谱分离采用XBridge BEH苯基柱(2.5 µm, 2.1 × 100 mm)。流动相为含有0.4%甲酸的水和含有0.1%二氟乙酸的乙腈。分析采用6 min的梯度。为减少棘手肽(利拉鲁肽)的柱上肽残留,完成肽分离后改变流动相组成,同时提高流速。使用反相苯基柱和二氟乙酸流动相提升了分析灵敏度,为该分析中的多样化肽提供了优异的峰形和色谱分离度。LLOQ (1 ng/mL)样品相比于空白样品的色谱性能如图1所示。所有肽在LLOQ下的信噪比(S/N)均≥10。
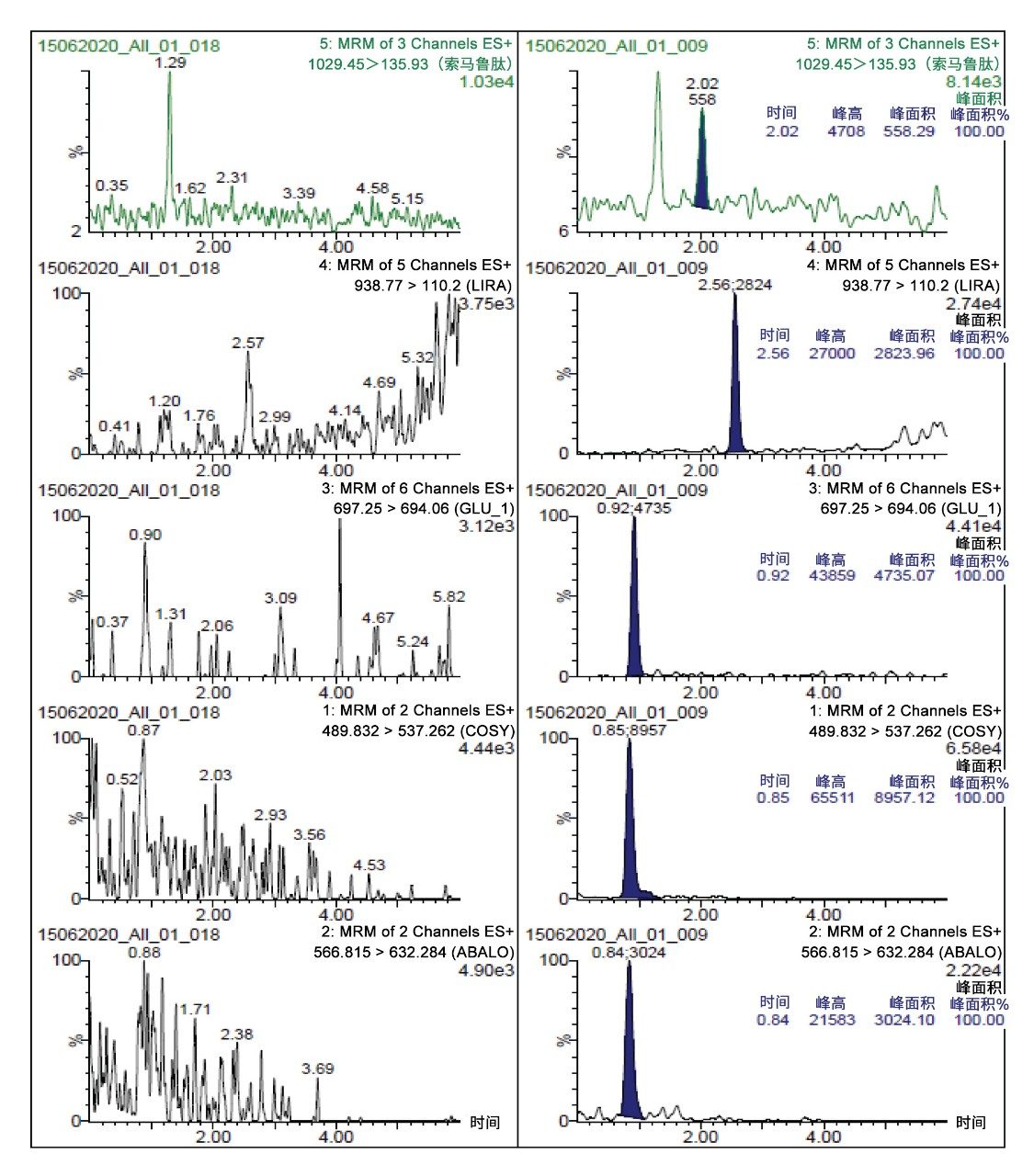
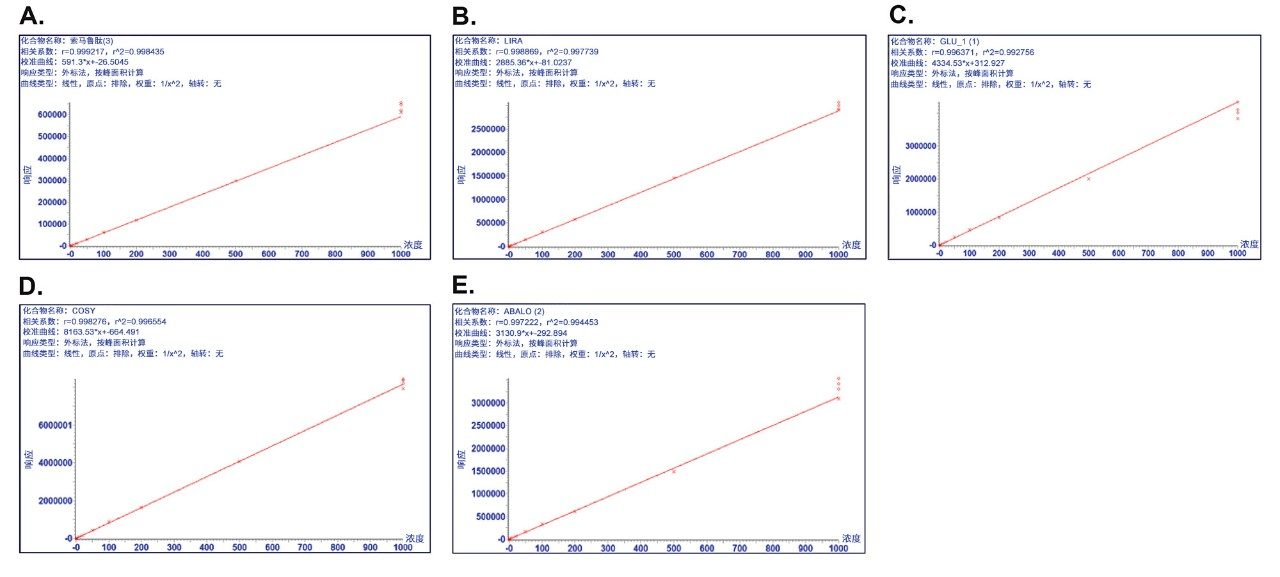
通过所述LC-MS方法仅使用5 µL样品即得到1 ng/mL的肽定量限。校准曲线的动态范围为1~1000 ng/mL,R2值>0.99(1/x2加权回归)。所有校准点的准确度在88~112%之间,满足推荐的性能(85~115%)。相关性能数据突出显示于表4和图2中。
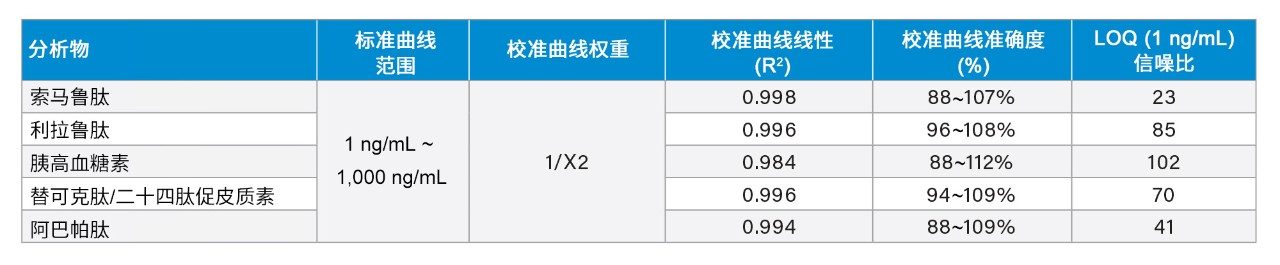
本应用纪要强调开发一种简单、灵敏且稳定的LC-MS/MS方法同时定量多种治疗性肽:索马鲁肽、利拉鲁肽、胰高血糖素、替可克肽和阿巴帕肽。该方法被证明适用于支持药品生产过程中所需的清洁验证活动。所开发的方法使所有五种肽的LLOQ均达到1 ng/mL,线性动态范围为1~1000 ng/mL。该方法的高灵敏度和定量性能可归因于仔细的样品前处理步骤和LC-MS方法优化。使用精心选择的样品稀释剂来保持肽的溶解度,并结合采用MaxPeak技术的QuanRecovery样品瓶减少由NSB引起的肽损失,使所有肽均实现了高回收率。借助ACQUITY UPLC I-Class系统和XBridge BEH苯基柱的低扩散、高分离度UPLC色谱分离优势,并与Xevo TQ-XS串联四极杆质谱仪联用,确保获得良好峰形,峰宽<10 s,用标准品轻松实现了1 ng/mL的检测限。结果证明,所开发的方法能够用于支持药物研究和生产。
720007035ZH,2020年10月